Аннотация
Обоснование. Функциональное состояние щитовидной железы вносит вклад в течение ожирения и ассоциированных с ним состояний. Наибольшую эффективность в лечении ожирения доказали методы бариатрической хирургии.
Цель. Оценить динамику массы тела, тиреоидного статуса, уровня лептина и показателей инсулинорезистентности у пациентов с ожирением после выполнения бариатрических вмешательств.
Методы. 74 пациента с ожирением II и III степени наблюдались после выполнения бариатрических вмешательств (рукавная гастропластика – 42 пациента, гастрошунтирование – 32 пациента); исходно оценивали индекс массы тела (ИМТ), уровень тиреотропного гормона (ТТГ), свободного Т4, уровни лептина, инсулина и глюкозы плазмы натощак; рассчитывался индекс инсулинорезистентности НОМА-IR. Динамика массы тела оценивалась по ИМТ и проценту потери избыточного ИМТ (%EBMIL). Через 3 года у 48 пациентов производили повторное измерение показателей.
Результаты. Субклинический гипотиреоз (СГ) был выявлен у 36,5% пациентов с высокими степенями ожирения. Была выявлена корреляционная зависимость между ИМТ и уровнем ТТГ (R=0,5; p=0,01). НОМА-IR был повышен у большинства пациентов с ожирением II и III степени (в среднем – 4,8±1,9 нг/мл). В группе СГ уровень лептина был значимо выше, чем в группе с нормальным уровнем ТТГ 43,0±7,3 нг/мл и 33,2±4,6 нг/мл соответственно (р=0,004). Среди пациентов с исходным СГ у 45% к 3 году после БО произошло спонтанное восстановление уровня ТТГ.
Заключение. В послеоперационном периоде снижение ИМТ было ассоциировано с уменьшением уровня ТТГ, лептина и HOMA-IR. Полученные данные могут отражать влияние жировой ткани на функциональное состояние щитовидной железы у пациентов с высокими степенями ожирения после бариатрических вмешательств. Это представляется крайне важным для поддержания достигнутой массы тела.
ОБОСНОВАНИЕ
Ожирение является одним из наиболее распространенных заболеваний. Ассоциированные с ожирением состояния, в том числе инсулинорезистентность и нарушения углеводного обмена, снижают продолжительность жизни и повышают риск развития сердечно-сосудистых катастроф. На сегодняшний день наибольшую эффективность в лечении морбидного ожирения доказали методы бариатрической хирургии [1].
Существенный вклад в клиническую картину ожирения вносит функциональное состояние щитовидной железы. Как манифестный, так и субклинический гипотиреоз (СГ) приводит к некоторому повышению массы тела за счет снижения основного обмена на 35–45%, уменьшения расхода энергетических субстратов и термогенеза, замедления гломерулярной фильтрации, тубулярной реабсорбции и секреции, что приводит к задержке жидкости [2].
Активно изучается вклад СГ (уровень тиреотропного гормона (ТТГ) – 4,0–9,99 мМЕ/л) в патогенез ожирения и инсулинорезистентности. Известно, что тиреоидные гормоны опосредуют процессы периферической утилизации глюкозы за счет транслокации GLUT геномным и негеномным путем, поэтому гипотиреоз, как правило, ассоциирован с формированием процессов инсулинорезистентности. В большинстве исследований выявляется положительная корреляционная взаимосвязь между повышением уровня ТТГ и индекса массы тела (ИМТ). Даже у пациентов с высоконормальными значениями тиреотропного гормона (2,5–3,99 мМЕ/л) инсулинорезистентность и другие компоненты метаболического синдрома встречаются значимо чаще [3, 4]. Было установлено, что при СГ по мере нарастания уровня ТТГ ИМТ и степень инсулинорезистентности. Помимо этого, было выявлено, что уровень адипоцитокинов также коррелирует с уровнем ТТГ: в частности, уровень лептина повышен при гипотиреозе и снижен при гипертиреозе [5].
Лечебная тактика при СГ у пациентов с ожирением четко не определена, литературные данные крайне противоречивы. В связи с этим представляется актуальным изучение взаимосвязи функционального состояния щитовидной железы и метаболизма жировой ткани у пациентов с ожирением.
ЦЕЛЬ
Изучить уровень ТТГ у пациентов с ожирением без тиреоидной патологии; оценить взаимосвязь между уровнями ТТГ, лептина и индексом инсулинорезистентности НОМА-IR у больных с ожирением, перенесших бариатрическую операцию.
МЕТОДЫ
Дизайн исследования
Проведено наблюдательное одноцентровое проспективное выборочное исследование.
Критерии соответствия
Критерии включения: пациенты с ожирением не менее II степени (ИМТ 35 и более) после рукавной гастропластики (РГ) и гастрошунтирования (ГШ); возраст от 18 до 75 лет; информированное согласие на участие в исследовании.
Критерии невключения: наличие декомпенсированной хронической патологии; пациенты с любыми серьезными или неконтролируемыми физическими или психическими заболеваниями; выявление положительных антител к тиреопероксидазе; терапия препаратами левотироксина.
Критерии исключения: прием пациентом препаратов для лечения ожирения в послеоперационном периоде; наступление беременности; отказ пациента участвовать в исследовании.
Условия проведения
Исследование проводилось на базе кафедры факультетской хирургии и кафедры факультетской терапии ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет имени академика И.П. Павлова».
Продолжительность исследования
Набор пациентов и формирование групп осуществляли с мая 2014 г. по июнь 2016 г. Время послеоперационного наблюдения составило от 3,1 до 4,1 года, в среднем – 3,6 года.
Описание медицинского вмешательства
Проводились сбор анамнеза, определение ИМТ исходно и через 6, 12, 18, 24, 30, 36 мес после выполнения бариатрического вмешательства. Исходно и через 3 года после выполнения бариатрического вмешательства осуществлялся забор крови из локтевой вены в утреннее время натощак для анализа на уровни ТТГ, Т4св., лептина, инсулина и глюкозы.
Основной исход исследования
Функциональное состояние щитовидной железы на основании уровня ТТГ, а также динамика показателей индекса инсулинорезистентности (НОМА-IR) и лептина до и после выполнения бариатрической операции.
Дополнительные исходы исследования
Успешность бариатрической операции устанавливалась на основании оценки динамики массы тела в послеоперационном периоде с использованием параметров, рекомендованных Международной Федерацией Хирургии Ожирения (IFSO) в 2015 г.: ИМТ, кг/м2; процент потери избыточного ИМТ (Percent excess BMI loss (%EBMIL)) [6]. Помимо этого, для каждого пациента ретроспективно оценивалось наступление точки надир (минимальной послеоперационной массы тела) и время ее достижения [7].
Анализ в подгруппах
Пациенты были разделены на подгруппы по степени ожирения на основании ИМТ в соответствии с классификацией ВОЗ (II и III степени), типу бариатрической операции (РГ и ГШ). По уровню ТТГ пациенты были разделены на 3 группы: с нормальным уровнем ТТГ (0,5–2,49 мМЕ/л); с высоконормальным уровнем ТТГ (2,5–3,99 мМЕ/л); с СГ (ТТГ более 4 мМЕ/л).
Методы регистрации исходов
Уровни ТТГ и Т4св. определяли при помощи иммуноферментного анализа (ИФА) на анализаторе фирмы Beckman Coulter 4300 (США) с использованием тест-систем: Access HYPERsensitive hTSH Reagent Pack (референсный диапазон ТТГ 0,4–4 мМЕ/л); Access Free T4 Reagent Pack (референсный диапазон Т4св. 7,8–14,3 пмоль/л). СГ считали уровень ТТГ более 4,0 мМЕ/л при сохранных уровнях Т4св., высоконормальным считали ТТГ от 2,5 до 3,99 мМЕ/л, нормальным считали ТТГ от 0,5 до 2,49 мМЕ/л.
Уровень глюкозы определялся в венозной крови глюкозооксидазным методом реактивами фирмы Beckman (США) на приборе Synchron CX9ALX (Beckman, США), единицы измерения – ммоль/л. Содержание иммунореактивного инсулина определяли на анализаторе фирмы Beckman Coulter (США) с использованием тест-системы Ассess Ultrasensitive Insulin.
ИМТ, кг/м2 определялся как масса тела (кг)/рост (м)2; процент потери избыточного ИМТ (%EBMIL) рассчитывался по следующей формуле: EBMIL (%) = 100 × (ИМТ исходный – ИМТ текущий/(ИМТ исходный – 25), где 25 – идеальный ИМТ для пациента с ожирением [7].
Бариатрическая операция (БО) считалась успешной при достижении 50% потери избыточного ИМТ. Массой тела в точке надир считалась минимальная масса тела, достигнутая в послеоперационном периоде [7].
Уровень лептина оценивали методом ИФА с использованием наборов DRG для на анализаторе Multiscan Labsystems (Финляндия).
Индекс инсулинорезистентности (НОМА-IR) рассчитывался по формуле: НОМА-IR = (глюкоза, ммоль/л × инсулин, мкЕд/мл)/22,5. Критерием инсулинорезистентности считался НОМА-IR более 2,7.
Этическая экспертиза
Проведение исследования было одобрено локальным научным этическим комитетом ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет имени академика И.П. Павлова» (протокол заседания локального этического комитета №161 от 21 апреля 2014 года). Каждый пациент получал подробную информацию о проводимом исследовании и давал письменное информированное согласие на участие.
Статистический анализ
Принципы расчета размера выборки. Размер выборки предварительно не рассчитывался.
Методы статистического анализа данных. Статистическая обработка результатов исследования проведена с использованием программной системы STATISTICA for Windows (версия 10). При проведении статистической обработки данных использовали методы описательной, а также непараметрической статистики: достоверность различий средних значений определялась с помощью критерия Манна–Уитни, значимыми считались различия групп при р<0,05. Данные представлены в виде средних значений и стандартного отклонения. Проводился корреляционный анализ для оценки взаимосвязи лабораторных показателей и ИМТ. Методом непараметрического корреляционного анализа (коэффициент корреляции Спирмена) оценивались ассоциации изучаемых показателей. Критический уровень значимости (p) для проверки статистических гипотез при сравнении статистических показателей принимался менее 0,05.
РЕЗУЛЬТАТЫ
Объекты (участники) исследования
В исследование включены 74 пациента, наблюдавшихся эндокринологом в клиниках ПСПбГМУ им. акад. И.П. Павлова по поводу ожирения II и III степени, у которых предшествовавшие попытки снижения массы тела (диета, физическая активность, медикаментозная терапия) не оказали стойкого эффекта. Среди пациентов, вошедших в исследование, было 50 женщин (67,6%) и 24 мужчины (32,4%). Средний возраст пациентов составил 43,9±9,6 года, значимых различий по возрасту между мужчинами и женщинами выявлено не было (р>0,05).
У 25% пациентов было диагностировано ожирение II степени, у 75% – III степени. Исходный ИМТ был значимо выше у мужчин, чем у женщин: 50,5±9,7 кг/м2 и 42,9±7,8 кг/м2 соответственно (р=0,014). Исходный ИМТ в группах РГ и ГШ значимо не различался и составлял в среднем 44,5±9,6 кг/м2 и 46,9±10,3 кг/м2 соответственно (р>0,05).
Основные результаты исследования
Исходный уровень ТТГ находился в диапазоне от 0,94 до 9,56 мМЕ/л и в среднем составил 3,5±1,9 мМЕ/л. По уровню ТТГ пациенты были разделены на 3 группы: с нормальным уровнем ТТГ (0,5–2,49 мМЕ/л) – группа 1; с высоконормальным уровнем ТТГ (2,5–3,99 мМЕ/л) – группа 2; с СГ (ТТГ более 4 мМЕ/л) – группа 3.
Значимых различий по возрасту между группами выявлено не было (р>0,05 для всех групп). ИМТ в группе СГ составил в среднем 50,8±10,8 кг/м2, что было значимо выше ИМТ в группе с нормальным уровнем ТТГ – 40,8±4,9 кг/м2 (р=0,009). Была выявлена корреляционная зависимость между ИМТ и уровнем ТТГ (R=0,512; p=0,01).
Уровень лептина был повышен у всех пациентов, включенных в исследование, – в среднем 39,2±7,3 нг/мл. Значимых различий по уровню лептина между пациентами с ожирением II и III степени выявлено не было (р>0,05). Уровень лептина между группами РГ и ГШ также значимо не различался (р>0,05). В группе с высоконормальным уровнем ТТГ и группе СГ он был значимо выше – 40,3±5,2 нг/мл и 43,0±7,3 нг/мл соответственно, чем в группе пациентов с нормальным уровнем ТТГ – 33,2±4,6 нг/мл (р=0,01; р=0,004) (табл. 1).
Таблица 1. Клинико-лабораторные показатели пациентов с ожирением II и III степени перед выполнением бариатрической операции
| Показатель | Группа 1
(ТТГ 0,5–2,49 мМЕ/л) |
Группа 2
(ТТГ 2,5–3,99 мМЕ/л) |
Группа 3
(ТТГ >4 мМЕ/л) |
р* |
| Количество
пациентов, % |
29 (39,2%) | 18 (24,3%) | 27 (36,5%) | |
| ТТГ, мМЕ/л | 1,7±0,5 | 3,4±0,4 | 5,4±1,4 | 0,0003/1, 2/1, 3/2 |
| Возраст, лет | 41,6±8,8 | 44,0±9,9 | 48,7±8,2 | >0,05 |
| ИМТ, кг/м2 | 40,8±4,9 | 46,1±8,2 | 50,8±10,8 | 0,0093/1 |
| Лептин, нг/мл | 33,2±4,6 | 40,3±5,2 | 43,0±7,3 | 0,012/1; 0,0043/1 |
| НОМА-IR | 3,8±1,3 | 5,1±1,6 | 5,8±2,1 | 0,017 3/1 |
Примечание. ТТГ – тиреотропный гормон. ИМТ – индекс массы тела. НОМА-IR – индекс инсулинорезистентности.
*Данные представлены в виде среднего и стандартного отклонения, значимыми считались различия при p<0,05. Статистически значимые различия выделены.
НОМА-IR был повышен у большинства пациентов с ожирением II и III степени (в среднем – 4,8±1,9 нг/мл). У части пациентов c ожирением II степени (24%) не было выявлено признаков инсулинорезистентности. НОМА-IR в группе СГ был значимо выше – 5,8±2,1, чем в группе с нормальным уровнем ТТГ – 3,8±1,3 (р=0,017).
Таким образом, по результатам исследования у больных с ожирением II и III степени СГ выявляется чаще, чем в общей популяции; повышение уровня ТТГ ассоциировано с формированием процессов инсулинорезистентности (значимое повышение НОМА-IR, р=0,017). Возможно, влияние жировой ткани на функциональное состояние щитовидной железы у больных ожирением высоких степеней в определенной степени опосредовано лептином.
Через 3 года после бариатрической операции 48 пациентов прошли повторное обследование. Значимых различий ИМТ между группами РГ (n=31) и ГШ (n=17) выявлено не было: 34,0±7,3 кг/м2 и 35,3±5,6 кг/м2 соответственно (р>0,05).
По уровню ТТГ через 3 года после оперативного вмешательства отмечалось следующее распределение пациентов: в группе с нормальным уровнем ТТГ – 24 пациента (50,0%), с высоконормальным уровнем ТТГ – 13 пациентов (27,1%), с СГ – 11 пациентов (22,9%). Среди пациентов с исходным СГ, завершивших исследование (n=20), у 9 пациентов (45%) к 3 году после БО произошло спонтанное восстановление уровня ТТГ (рис. 1).
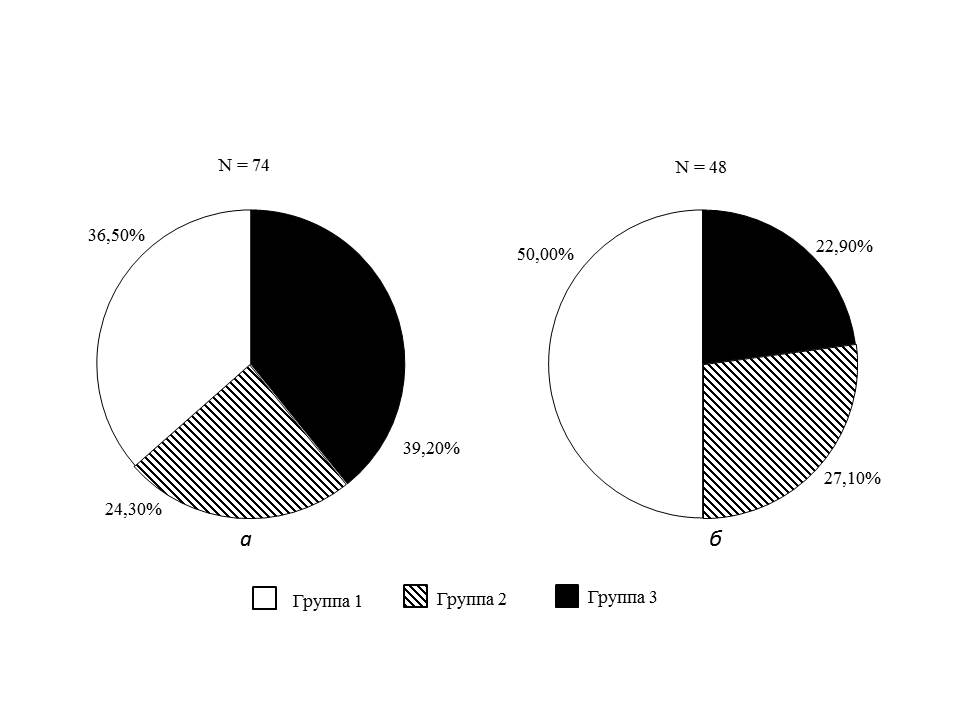
Рисунок 1. Функциональное состояние щитовидной железы у пациентов с ожирением высоких степеней исходно и через 3 года после выполнения бариатрической операции: а – до бариатрической операции; б – через 3 года после выполнения бариатрической операции.
Примечание.
Группа 1 – пациенты с нормальным уровнем ТТГ (0,5–2,49 мМЕ/л)
Группа 2 – пациенты с высоконормальным уровнем ТТГ (2,5–3,99 мМЕ/л)
Группа 3 – пациенты с субклиническим гипотиреозом (ТТГ 4,0 мМЕ/л и более)
Через 3 года после БО уровень лептина значимо снизился в группах ГШ и РГ, значимых различий между группами РГ и ГШ выявлено не было (р>0,05), средний уровень составил 26,4±8,3. Корреляции между уровнями ТТГ и лептина через 3 года после выполнения БО выявлено не было (табл. 2).
Таблица 2. Клинико-лабораторные показатели пациентов с ожирением II и III степени исходно и через 3 года после выполнения бариатрической операции.
| Показатель | Исходно | Через 3 года после БО | p* |
| ИМТ, кг/м2 | 45,3±9,7 | 34,8±6,4 | 0,000 |
| Лептин, нг/мл | 39,2±7,3 | 26,4±8,3 | 0,03 |
| НОМА-IR | 4,8±1,9 | 3,4±1,1 | 0,02 |
| СГ, % | 39,2% | 22,9% |
Примечание. ИМТ – индекс массы тела. СГ – субклинический гипотиреоз.
*Данные представлены в виде среднего и стандартного отклонения, значимыми считались различия при p<0,05. Статистически значимые различия выделены.
Через 3 года после выполнения оперативного вмешательства НОМА-IR у пациентов с исходной инсулинорезистентностью значимо снизился и составил 3,4±1,1 (р=0,02).
Таким образом, у больных после БО снижение ИМТ было ассоциировано с уменьшением уровня ТТГ, что, возможно, отражает влияние жировой ткани на функциональное состояние щитовидной железы у пациентов с высокими степенями ожирения. Также на фоне снижения ИМТ было выявлено значимое снижение уровня лептина, что может объясняться некоторым уменьшением резистентности к анорексигенному потенциалу лептина. Это представляется крайне важным для поддержания достигнутой массы тела. Снижение ИМТ после бариатрической операции также было ассоциировано со снижением HOMA-IR.
Дополнительные результаты исследования
Ретроспективно для каждого пациента оценивалось наступление точки надир (минимальной послеоперационной массы тела) и время ее достижения. В группах РГ и ГШ в точке надир была достигнута сравнимая эффективность (80,9% и 78,1% пациентов с %EBMIL >50%), что позволило объединить пациентов с различными видами оперативного вмешательства.
Нежелательные явления
Не были выявлены.
ОБСУЖДЕНИЕ
Резюме основного результата исследования
У больных с высокими степенями ожирения в 36,5% случаев был выявлен субклинический гипотиреоз. Повышение уровня ТТГ было ассоциировано с повышением ИМТ, уровня лептина и НОМА-IR. Среди пациентов с ожирением II степени у 24% не было выявлено инсулинорезистентности. Через 3 года после БО у 45% пациентов с исходным СГ произошло спонтанное восстановление уровня ТТГ. У всех пациентов через 3 года после БО наблюдалось значимое уменьшение уровня лептина. У пациентов с исходной инсулинорезистентностью наблюдалось значимое снижение НОМА-IR.
Обсуждение основного результата исследования
В работе представлена группа пациентов с высокими степенями ожирения, подвергшихся различным видам БО и наблюдавшихся в течение 3 лет послеоперационного периода (60% – РГ, 40% – ГШ). Исходно у 30% пациентов был выявлен СГ, что несколько выше литературных данных [8]. Возможно, это объясняется тем, что в исследование были включены пациенты с высокими степенями ожирения.
По данным популяционных исследований показано, что повышение уровня ТТГ, как правило, ассоциировано с женским полом и старшим возрастом [7]. В исследуемой группе пациентов 70% составили женщины, однако среди обследованных пациентов в группе СГ количество мужчин и женщин было сопоставимым. Вероятно, СГ у пациентов с ожирением объясняется не аутоиммунными механизмами формирования СГ (пациенты с повышенным титром антител к тиреопероксидазе исключались из исследования), а влиянием самой жировой ткани: происходит нарушение активности дейодиназы 2 типа и, соответственно, снижение супрессии ТТГ в гипофизе; формирование резистентности к ТТГ в тканях.
Известно, что гипотиреоз способствует некоторому увеличению массы тела за счет снижения скорости основного обмена, скорости клубочковой фильтрации и задержки жидкости. Существуют тесные биохимические взаимосвязи между жировой тканью и гипоталамо-гипофизарно-тиреоидной осью. Лептин, вырабатывающийся периферической жировой тканью, напрямую стимулирует экспрессию тиреотропин-рилизинг-гормона в паравентрикулярных ядрах гипоталамуса. Помимо этого, лептин стимулирует выработку проопиомеланокортина, что также влияет на секрецию тиреотропин-рилизинг-гормона [9]. Изучение послеоперационной динамики уровня лептина в связи с функциональным состоянием щитовидной железы представляется крайне актуальным. В приведенном исследовании уровень лептина исходно был повышен у всех пациентов, однако в группе пациентов с СГ уровень лептина был значимо выше, чем у пациентов с нормальными значениями ТТГ. Возможно, ТТГ оказывает самостоятельный эффект на жировую ткань, стимулируя секрецию лептина.
В представленной работе у пациентов с ожирением и СГ как ИМТ, так и НОМА-IR были значимо выше, что согласуется с литературными данными. В проведенном исследовании у части пациентов c ожирением II степени (24%) не было выявлено признаков инсулинорезистентности (так называемый фенотип метаболически здорового ожирения). На сегодняшний день обсуждается стабильность метаболически здорового ожирения: по данным проведенных исследований, метаболически здоровое ожирение может являться временным этапом перед развитием инсулинорезистентности [10, 11]. Эта точка зрения подтверждается тем, что в группе пациентов с ожирением III степени все пациенты имели инсулинорезистентность по HOMA-IR.
Ограничения исследования
Проведенное исследование ограничено объемом выборки. Для подтверждения полученных в исследовании результатов требуются дальнейшие проспективные контролируемые исследования.
ЗАКЛЮЧЕНИЕ
Полученные данные представляются чрезвычайно важными для расширения представлений о патогенезе формирования дисфункции щитовидной железы у больных с ожирением. Вероятно, при ожирении происходит формирование СГ не за счет аутоиммунной патологии, а по другим причинам.
Лечебная тактика у пациентов с СГ на фоне ожирения четко не определена, исследований по влиянию терапии тиреоидными гормонами на исходы лечения ожирения на настоящий момент крайне мало, данные противоречивы. С учетом спонтанного восстановления уровня ТТГ у больных с ожирением на фоне снижения массы тела назначение терапии тироксином представляется нецелесообразным.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ.
Источник финансирования. Проведение исследования и подготовка статьи осуществлены на личные средства авторского коллектива.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Участие авторов. Все авторы внесли значимый вклад в проведение исследования и подготовку статьи, прочли и одобрили финальную версию статьи перед публикацией.
Список литературы
↑1. Angrisani L, Santonicola A, Iovino P, et al. Bariatric surgery worldwide 2013. Obes Surg. 2015;25(10):1822-1832. https://doi.org/10.1007/s11695-015-1657-z
↑2. Захарова С.М., Савельева Л.В., Фадеева М.И. Ожирение и гипотиреоз // Ожирение и метаболизм. – 2013. – Т. 10. – № 2. – С. 54-58. [Zakharova SM, Savelieva LV, Fadeeva MI. Obesity and hypothyroidism. Obesity and metabolism. 2013;10(2):54-58. (In Russ.)] https://doi.org/10.14341/2071-8713-4826
↑3. Oh JY, Sung YA, Lee HJ. Elevated thyroid stimulating hormone levels are associated with metabolic syndrome in euthyroid young women. Korean J Intern Med. 2013;28(2):180-186. https://doi.org/10.3904/kjim.2013.28.2.180
↑4. Ren R, Ma Y, Deng F, et al. Association between serum TSH levels and metabolic components in euthyroid subjects: a nationwide population-based study. Diabetes Metab Syndr Obes. 2019;12:1563-1569. https://doi.org/10.2147/DMSO.S202769
↑5. Oge A, Bayraktar F, Saygili F, et al. TSH influences serum leptin levels independent of thyroid hormones in hypothyroid and hyperthyroid patients. Endocr J. 2005;52(2):213-217. https://doi.org/10.1507/endocrj.52.213
↑6. Higa K, Ho T, Tercero F, et al. Laparoscopic Roux-en-Y gastric bypass: 10-year follow-up. Surg Obes Relat Dis. 2011;7(4):516-525. https://doi.org/10.1016/j.soard.2010.10.019.
↑7. Brethauer SA, Kim J, El Chaar M, et al. Standardized outcomes reporting in metabolic and bariatric surgery. Obes Surg. 2015;25(4):587-606. https://doi.org/10.1007/s11695-015-1645-3
↑8. Sheehan MT. Biochemical Testing of the Thyroid: TSH is the Best and, Oftentimes, Only Test Needed – A Review for Primary Care. Clin Med Res. 2016;14(2):83-92. https://doi.org/10.3121/cmr.2016.1309
↑9. Mullur R, Liu YY, Brent GA. Thyroid hormone regulation of metabolism. Physiol Rev. 2014;94(2):355-382. https://doi.org/10.1152/physrev.00030.2013
↑10. Романцова Т.И., Островская Е.В. Метаболически здоровое ожирение: дефиниции, протективные факторы, клиническая значимость // Альманах клинической медицины. – 2015;1(1):75-86. [Romantsova TI, Ostrovskaya EV. Metabolically healthy obesity: definitions, protective factors, clinical relevance. Almanac of clinical medicine. 2015;1(1):75-86. (In Russ.)] https://doi.org/10.18786/2072-0505-2015-1-75-86
↑11. Roberson LL, Aneni EC, Maziak W. Beyond BMI: The “Metabolically healthy obese” phenotype & its association with clinical/subclinical cardiovascular disease and all-cause mortality – a systematic review. BMC Public Health. 2014;14:14. https://doi.org/10.1186/1471-2458-14-14
