А.С. Луценко*, Е.В. Нагаева, Ж.Е. Белая,
О.С. Чухачева, Т.С. Зенкова, Г.А. Мельниченко
Национальный медицинский исследовательский
центр эндокринологии
 Введение
Введение
Дети с установленным дефицитом гормона роста получают заместительную терапию рекомбинатным гормоном роста до совершеннолетия и достижения генетически прогнозируемого конечного роста.
Несмотря на то, что основной спектр физиологических эффектов соматотропный гормон (СТГ) оказывает на организм в детском возрасте, а в последующем его выработка снижается, СТГ играет важную роль в нормальном функционировании органов и систем взрослого человека. В настоящее время в России разработана система оказания медицинской помощи детям с дефицитом гормона роста [1, 2], однако отсутствуют клинические рекомендации, посвященные диагностике и заместительной терапии СТГ-дефицита взрослых.
Первые исследования, посвященные лечению СТГ-дефицита у взрослых пациентов с гипопитуитаризмом, были опубликованы в 1989 г. [3, 4]. В Российской Федерации первый опыт применения человеческого гормона роста у взрослых пациентов с СТГ-дефицитом был опубликован в 2004 г. [5]. Клинические проявления заболевания у взрослых пациентов неспецифичны и в случаях приобретенного СТГ-дефицита часто маскируются проявлениями недостаточностей других тропных гормонов гипофиза, что затрудняет диагностику.
Целью данного обзора является обобщение современных данных по диагностике, лечению и системному влиянию заместительной терапии соматропином у взрослых пациентов с СТГ-дефицитом.
Клинические проявления
Дефицит СТГ у взрослых характеризуется системными изменениями метаболизма при неспецифичных клинических проявлениях [6].
- Состав тела. Увеличение массы жировой ткани, преимущественно за счет висцерального жира, уменьшение тощей массы [7–9], снижение объема внеклеточной жидкости и общей концентрации натрия [10].
- Физическая активность. Снижение толерантности к физическим нагрузкам, уменьшение мышечной силы на фоне уменьшения количества мышечной ткани [11]. Нарушение терморегуляции [12].
- Сердечно-сосудистая система, липидный обмен и система свертывания крови. Увеличение сердечно-сосудистого риска за счет дислипидемии, нарушений углеводного обмена и ускоренного развития атеросклероза. Уменьшение массы миокарда, нарушение проводимости, сократимости и ударного объема, снижение нагнетательной функции и фракции выброса, диастолическая дисфункция [13]. Дислипидемия вследствие повышения концентрации общего холестерина, холестерина ЛПНП и триглицеридов [14]. Повышение активности фибриногена и ингибитора активаторов плазминогена 1-го типа (PAI-1) [15].
- Углеводный обмен. Нарушение толерантности к глюкозе, инсулинорезистентность [16].
- Костная система. Уменьшение костной массы и минеральной плотности кости (МПК), повышение риска переломов [17–19].
- Качество жизни и когнитивные функции. Снижение качества жизни: дезадаптация, сниженная самооценка, тревожность, апатия, депрессия, социальная изоляция [20].
Диагностика
Диагностика СТГ-дефицита взрослых сложна по ряду причин. Клинические проявления данного заболевания неспецифичны и потому имеют невысокую диагностическую ценность [21]. В физиологических условиях секреция СТГ имеет импульсный характер, на нее влияют возраст, пол и индекс массы тела, в связи с чем определение базальной концентрации СТГ не имеет диагностического значения [22].
Нормальные показатели ИРФ-1 сыворотки крови не исключают диагноз СТГ-дефицита. ИРФ-1, ИРФ-связывающий белок 3 (ИРФСБ-3) имеют ориентировочное значение для диагностики, поскольку показатели у пациентов с СТГ-дефицитом и здоровых людей могут частично совпадать [23].
В настоящее время общепринятым методом диагностики СТГ-дефицита взрослых являются стимуляционные пробы [22, 24], протоколы которых представлены в табл. 1.

Зарубежные клинические руководства рекомендуют проводить пробы только тем пациентам, у козаместительная гормональная терапия соматотропином будет способствовать улучшению метаболических параметров и качества жизни. Проведения провокационных проб не требуется при наличии одного из двух условий:
1. Наличие трех из четырех составляющих:
– значительный дефицит роста (<-3 SDS);
– как минимум одна дополнительная тропная недостаточность;
– низкая концентрация ИФР-1 в крови;
– врожденный дефект гипоталамо-гипофизарной области по данным МРТ: «триада» (гипоплазия аденогипофиза, эктопия нейрогипофиза, аплазия/гипоплазия ножки гипофиза);
или
– оперативное лечение опухоли гипоталамо-гипофизарной области в анамнезе;
или
– облучение области «голова–шея» в анамнезе.
2. Мутации генов, ассоциированных с развитием гипопитуитаризма: GH1, GHRHR, HESX1, LHX3, PROP1, POU1F1 [PIT1] и др. [22, 24, 25].
В табл. 2 представлены используемые в мире пороговые значения диагностических проб для диагностики СТГ дефицита у взрослых.
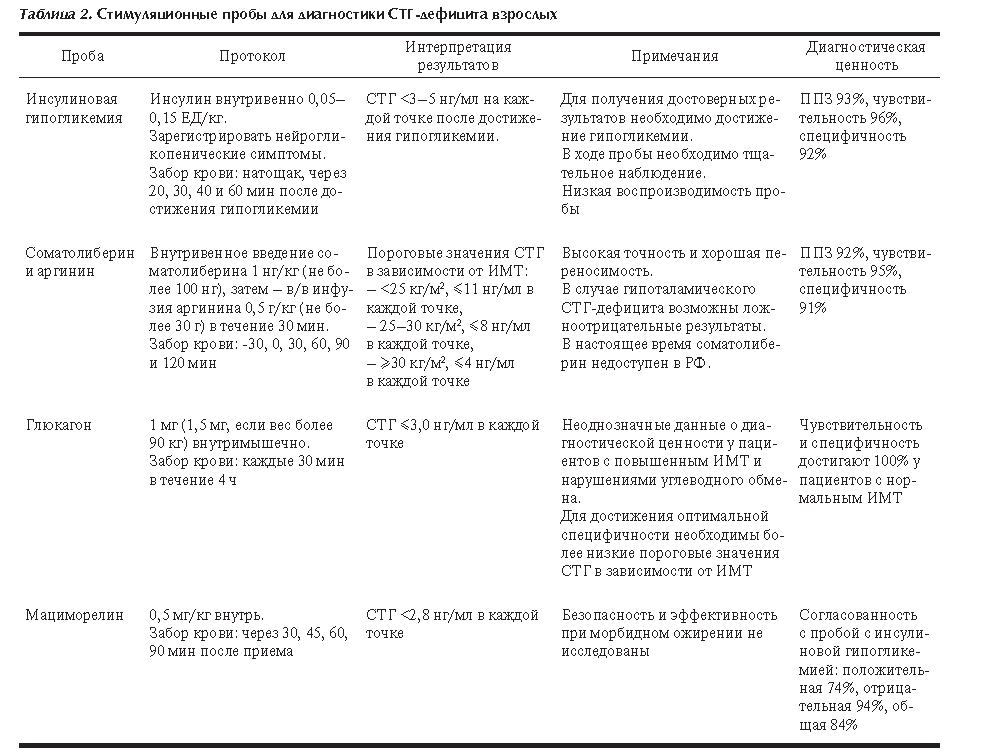
Проба с инсулиновой гипогликемией Стимуляция секреции СТГ при гипогликемии была впервые описана в 1963 г. [26]. Данная проба считается «золотым стандартом» в диагностике СТГ-дефицита взрослых [22, 24], однако у нее имеется ряд недостатков. Требуется тщательное медицинское наблюдение для мониторинга потенциальных нежелательных явлений (судорожных приступов или потери сознания вследствие гипогликемии). Кроме того, в связи с наличием инсулинорезистентности у пациентов с ожирением, у данной категории может понадобиться использование более высоких доз инсулина (0,15–0,20 ЕД/кг массы тела), что увеличивает риск отсроченной гипогликемии [27]. Проба с инсулиновой гипогликемией противопоказана пожилым пациентам, лицам с высоким сердечно-сосудистым риском и эпилепсией. И хотя чувствительность пробы высока, отмечаются ограничения в ее воспроизводимости. Кроме того, вариабельность пиков секреции СТГ отмечалась у здоровых добровольцев в зависимости от времени проведения и в разные фазы менструального цикла [22].
В настоящее время в качестве диагностического значения стимулированной секреции СТГ при гипогликемии используется диапазон 3,0–5,0 нг/мл [22, 24].
Согласно зарубежным рекомендациям, при противопоказаниях к пробе с инсулиновой гипогликемией возможно проведение комбинированной пробы со стимуляцией соматолиберином и аргинином, однако, применение аргинина для диагностики СТГ-дефицита в РФ не зарегистрировано.
Проба с соматолиберином и аргинином
Проба с соматолиберином и аргинином, как и проба с инсулиновой гипогликемией, считается достаточно чувствительной и специфичной для диагностики СТГ-дефицита [28, 29], однако в настоящее время на фармацевтическом рынке отсутствует препарат соматолиберина.
Точность данной пробы определяется совместным применением двух стимулирующих веществ: соматолиберин стимулирует синтез и высвобождение СТГ гипофизом [30], а аргинин усиливает этот эффект путем подавления высвобождения соматостатина [31]. Концентрация СТГ на фоне стимуляции не зависит от пола и возраста, однако, результат зависит от ИМТ, в связи с чем используются три пороговых значения (табл. 3).
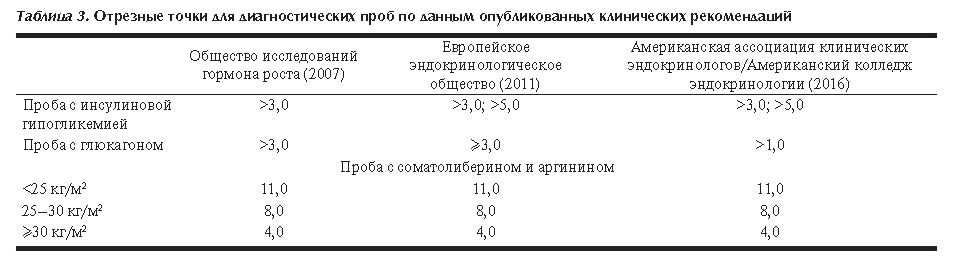
В связи с тем, что в ходе данной пробы стимулируется и гипофиз, и гипоталамус, при гипоталамическом генезе заболевания (например, после лучевой терапии) возможны ложноположительные результаты [32].
Проба с глюкагоном
В связи с тем, что основная альтернативная проба для диагностики недоступна, активно изучается возможность применения пробы с глюкагоном при противопоказаниях к пробе с инсулиновой гипогликемией.
Глюкагон – сильный стимулятор секреции СТГ, однако, механизм стимуляции остается неясным.
Стимулирующий эффект более выражен при внутримышечном или подкожном введении по сравнению с внутривенным [33].
Достоинства пробы с глюкагоном – воспроизводимость и безопасность, на ее результаты не влияет пол и гипоталамический генез СТГ-дефицита. Недостатки – длительность пробы (3–4 ч) и необходимость внутримышечного введения глюкагона. Побочные эффекты пробы более выражены у пожилых пациентов: гипотония, гипогликемии и приступы эпилепсии [34]. Кроме того, имеется риск отсроченных гипогликемий, в связи с чем данная проба не вошла в рутинную клиническую практику.
В двух исследованиях сравнивались диагностические возможности пробы с глюкагоном и пробы с инсулиновой гипогликемией, группы пациентов и контроль были сопоставлены по полу и возрасту [35, 36]. В исследовании J. Gómez и соавт. группы пациентов были также сопоставлены по ИМТ, в данном исследовании выявлена обратная корреляция возраста и ИМТ с пиковыми концентрациями СТГ у здоровых добровольцев.
Изначально пороговым значением концентрации СТГ принималось 3,0 нг/мл. В дальнейших исследованиях выявлено, что использование такого значения приводит к гипердиагностике СТГ-дефицита [37]. Принимая это во внимание, рекомендации Американской ассоциации эндокринологов предлагают использовать пороговое значение 1,0 нг/мл для пациентов с ИМТ более 25 кг/м2. Авторы также отмечают, что для уточнения диагностической точности сниженного порогового значения необходимо проведение больших проспективных исследований среди пациентов с различным ИМТ и нарушениями углеводного обмена [22].
Секретагоги гормона роста
К данному классу относятся молекулы, проявляющие сильный дозозависимый и специфичный стимуляционный эффект на соматотрофы [38]. Они связываются с рецептором СТГ секретагога-1а (growth hormone secretagogue receptor 1a, GHS-R1a) в гипоталамусе и гипофизе. Естественным лигандом данного рецептора является грелин [39]. Другие агонисты его рецептора являются аналогами грелина: GHRP-2 (GH-releasing peptide-2, СТГ-рилизинг пептид-2), GHRP-6, гексарелин, все данные вещества вводятся парентерально. Также существуют аналоги грелина для перорального введения.
Достоинство секретагогов СТГ – возможность перорального приема [40]. Они устойчивы к протеолизу, так как многие представители являются небелковыми молекулами либо содержат D-изомеры аминокислот [41]. Недостаток – возможность получения ложноположительных результатов при гипоталамическом генезе СТГ-дефицита [42].
Проводились исследования, оценивающие диагностическую ценность проб с GHRP-6, GHRP-2 и комбинаций соматолиберина с гексарелином, пиридостигмином, аципимоксом, GHRP-6 в сравнении с пробой с инсулиновой гипогликемией [43–48].
В исследованиях теста с соматолиберином и GHRP-6 для диагностики СТГ-дефицита взрослых отмечена хорошая переносимость пробы (единственный побочный эффект – «приливы»), высокая чувствительность и воспроизводимость. GHRP-6 назначается внутривенно, пик ответа СТГ развивается на 15–30-й минуте – значительно раньше, чем при использовании других фармакологических стимуляторов. Пороговое значение для нормального ответа 20 нг/мл, для СТГ-дефицита 10 нг/мл [49, 50]. На результаты данного теста не влияют возраст, пол или избыточная масса тела, за исключением случаев, когда ИМТ превышает 35 кг/м2, – пороговое значение снижается до 5 нг/мл [51].
Пробу с GHRP-2 с 2006 г. используют в Японии, так как она безопасна и удобна, в качестве порогового значения используется концентрация СТГ 9 нг/мл.
Пиковой концентрации СТГ после стимуляции достигает на 60-й минуте [52].
В исследовании, где в качестве стимулирующего агента использовался ацетилированный грелин, наиболее диагностически значимыми значениями концентрации СТГ для диагностики были 7,3 нг/мл при нормальной массе тела, 2,9 нг/мл при избыточной массе тела и 0,6 нг/мл при ожирении, диагностическая точность составила 89,3, 94,1 и 62,5% соответственно. Авторы делают вывод, что ожирение значительно снижает ответ СТГ на стимуляцию грелином, однако данная проба является надежным инструментом в диагностике у пациентов с нормальной и избыточной массой тела [53].
В настоящее время применение вышеуказанных методов в Российской Федерации невозможно, так как на рынке отсутствуют препараты соматолиберина и секретагогов СТГ.
Пероральный секретагог СТГ
В 2017 г. Food and Drugs Administration (FDA) одобрило применение мациморелина для диагностики СТГ-дефицита у взрослых [54].
Мациморелин – агонист GHS-R1a с высокой стабильностью, которая позволяет назначать его перорально. В исследовании I фазы у 36 здоровых добровольцев при пероральном приеме мациморелина отмечалось быстрое дозозависимое повышение концентрации препарата в плазме, пик концентрации достигался на 50–75-й минуте после приема. Дозозависимая стимуляция секреции СТГ соотносилась по времени с максимальной концентрацией препарата в плазме, повышение концентрации СТГ длилось около 120 мин после перорального приема или интрадуоденального введения. Препарат хорошо переносился, нежелательных явлений не выявлено [55].
В многоцентровом открытом исследовании сравнивали диагностическую ценность и безопасность мациморелина в сравнении с пробой соматолиберин + аргинин, среди взрослых пациентов с СТГ-дефицитом и здоровых добровольцев. Согласно ROC-анализу, оптимальная пороговая концентрация СТГ составила 2,7 нг/мл: чувствительность 82%, специфичность 92%, доля ошибок в распознавании 13%. Среди пациентов, которым назначали оба диагностических теста, диагностическая ценность методов была сопоставима.
Пиковые концентрации СТГ обратно коррелировали с ИМТ в контрольной группе. При единственном заборе крови через 45 мин после приема мациморелина, при использовании пороговых значений, согласно ИМТ (6,8 нг/мл при ИМТ <30 кг/м2, 2,7 нг/мл при ИМТ ≥30 кг/м2) чувствительность пробы составила 90%, специфичность – 85%, доля ошибок в распознавании – 12,2% [56].
В 2018 г. опубликованы результаты многоцентрового, открытого, рандомизированного, двойного перекрестного исследования, целью которого было установить эффективность и безопасность применения однократного приема мациморелина в дозе 0,5 мг/кг для диагностики СТГ-дефицита взрослых, по сравнению с пробой с инсулиновой гипогликемией.
Пациенты были поделены на три группы согласно вероятности наличия заболевания: высокой (n=38), средней (n=37) и низкой (n=39), также подобрана группа здоровых добровольцев (n=25).
При использовании в качестве «точки отсечения» значения концентрации СТГ 2,8 нг/мл для мациморелина и 5,1 нг/мл для пробы с инсулиновой гипогликемией, отрицательная согласованность составила 95,38% (95% ДИ 87–99%), положительная согласованность – 74,32% (95% ДИ 63–84%), чувствительность 87%, специфичность 96%. Воспроизводимость пробы с мациморелином составила 97% (n=33). В ходе вторичного анализа выявлено, что использование отрезной точки 5,1 нг/мл позволяет достигнуть отрицательной согласованности 94% (95% ДИ 85–98%), положительной согласованности 82% (95% ДИ 72–90%), чувствительности 92% и специфичности 96% [57].
В настоящее время не опубликовано результатов по безопасности и диагностической ценности данного теста у пациентов с морбидным ожирением. К наиболее частым побочным эффектам относятся искаляемость и нарушения работы желудочно-кишечного тракта (тошнота, голод и диарея). Следует избегать назначения совместно с препаратами, удлиняющими интервал QT, так как это может привести к развитию желудочковой тахикардии. CYP3A4 – основной фермент, метаболизирующий мациморелин, поэтому при применении совместно с препаратами, активирующими его, возможно получение ложноположительных результатов [54].
Стандартизация наборов для определения СТГ Результаты стимулирующих проб трактуются согласно пороговым значениям концентраций, в связи с чем точность лабораторного определения СТГ крайне важна.
Циркулирующий СТГ представлен различными изоформами и изомерами: в наибольшей доле присутствует вариант массой 22 кДа, также присутствуют молекулы меньшей массы. Моноклональные антитела способны специфично связываться с изоформами массой 22 кДа, но будут пропускать другие изоформы. Молекулы сходного с СТГ строения (плацентарный СТГ, пролактин), а также СТГ-связывающий белок (с которым связано около 50% циркулирующего СТГ) могут вступать в перекрестные реакции и влиять на точность измерения. Также существуют различия и несогласованность в калибровках, что ограничивает возможности сравнения пороговых значений в разных исследованиях. Кроме того, лаборатории могут использовать разные единицы измерения концентрации либо активности СТГ [58].
Для борьбы с данными ограничениями в настоящее время предложен единый калибровочный стандарт для СТГ – 98/574. Все производители наборов должны уточнять определяемые изоформы, специфичность используемых антител и наличие перекрестных реакций с СТГ-связывающим белком [59].
Протеомные биомаркеры СТГ-дефицита
На момент подачи статьи публикации по протеомным биомаркерам СТГ-дефицита взрослых отсутствовали. В 2018 г. опубликованы результаты исследования, в котором методом протеомного анализа нового поколения SWATH-MS исследовались циркулирующие белки у детей с СТГ-дефицитом в сравнении со здоровыми добровольцами. Обнаружено три белка, которые могут являться биомаркерами для неинвазивной диагностики СТГ-дефицита у детей: аполипопротеин A-IV, CFHR4 (complement factor H-related protein 4) и PBP (platelet basic protein) [60]. Вопрос исследования данных белков при СТГ-дефиците у взрослых остается открытым.
Полиморфизмы рецептора гормона роста У человека ген рецептора гормона роста (r-СТГ) расположен на 5-й хромосоме. Ген состоит из девяти экзонов, кодирующих рецептор, и нескольких дополнительных экзонов в 5’ нетранслируемой области. Известны две основные изоформы r-СТГ, отличающиеся наличием (fl-GHR, full-length), либо отсутствием экзона 3 (d3-GHR, exon 3-deficient). Отсутствие экзона 3 приводит к потере 22 аминокислот во внеклеточном домене рецептора [61]. В настоящее время считается, что связывающая способность обеих изоформ одинакова. Изоформа d3 доминирует над fl, около 50% европейцев гетероили гомозиготны по d3 [62]. Носительство d3 ассоциировано с высоким ростом, более высокой чувствительностью к СТГ и является фактором долгожительства у мужчин [63].
У пациентов с генотипом fl/fl отмечался более выраженный ответ на введение соматропина после лечения в течение 1 нед, по сравнению с пациентами с аллелями d3 [64]. В другом исследовании с длительностью лечения 12 мес, повышение ИРФ-1 в ответ на терапию было достоверно большим в группе d3/d3. Различий по концентрации ИРФ-1 между группами fl/d3 и fl/fl не выявлено [65]. По данным S. Meyer и соавт., не выявлено достоверных различий концентрации ИРФ-1 на фоне терапии между носителями одного или двух аллелей d3 и генотипа fl/fl [66]. У взрослых пациентов с СТГ-дефицитом с аллелями d3 снижен риск переломов позвонков независимо от получения заместительной терапии СТГ [67].
Также опубликованы исследования, в которых между генотипами не обнаруживалось различий по клиническим проявлениям и нежелательным явлениям, качеству жизни, концентрациям ИРФ-1, составу тела и жировой массе [68–71].
Проведено два исследования, в которых оценивали влияние полиморфизмов r-СТГ на различные показатели на фоне заместительной терапии СТГ спустя 1 год и после 5 лет лечения. В исследовании Van der А. Klaauw и соавт. после первого года лечения в группе носителей d3 отмечалось более выраженное повышение ИФР-1 при одинаковых средних дозах соматотропина в группах. Среди носителей d3 общий холестерин снижался менее выраженно, а концентрация холестерина ЛПВП достигала более высоких значений по сравнению с fl/fl. Однако, через 5 лет данных различий между группами обнаружено не было [72]. По данным С. Giavoli и соавт., лечение соматропином нормализует концентрацию ИРФ-1 и снижает процентную долю жировой массы после 1 года и после 5 лет лечения, независимо от присутствия аллеля d3. После одного года лечения в группах носителей d3 отмечалось повышение концентрации холестерина ЛПВП, после пяти лет – снижение концентрации общего холестерина и холестерина ЛПНП.
При исходно одинаковой распространенности нарушений углеводного обмена через 5 лет после лечения в группе fl/fl она снизилась, а в группах носителей d3 двукратно увеличилась [73].
В настоящее время данные по влиянию полиморфизма r-СТГ на клиническую картину СТГ-дефицита взрослых малочисленны, а имеющиеся публикации по взаимоотношениям носительства аллели d3 и ответа на заместительную терапию противоречивы.
