Врожденный иммунитет
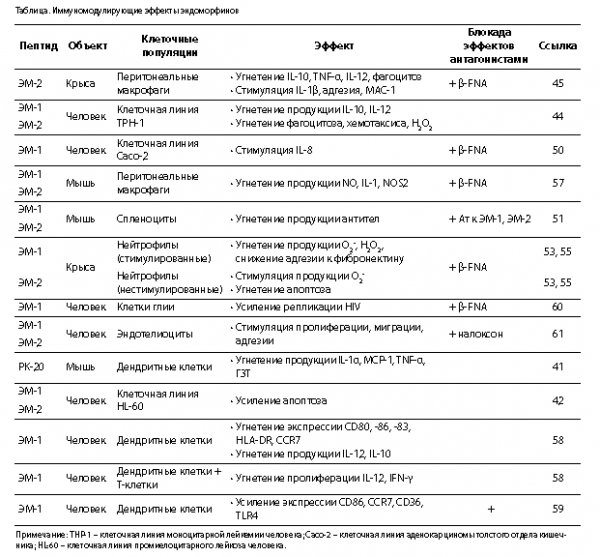
Исследователями из японского Департамента фармакологии было показано, что оба тетрапептида в фармакологических концентрациях 10-6–10-8 М угнетают индуцированную липополисахаридом (ЛПС) продукцию IL-10 и IL-12 макрофагальной клеточной линией THP-1 [44], а также перитонеальными макрофагами крыс в ответ на ЛПС и форболмиристатацетат (ФМА) [45]. Помимо этого, было установлено, что ЭМ-2 у крыс оказывал разнонаправленные эффекты на секрецию основных противовоспалительных цитокинов, ингибируя продукцию TNF-a, но стимулируя секрецию IL-1β [44]. В настоящее время существуют работы, объясняющие этот феномен тем, что регуляция экспрессии IL-1β в ЛПС-стимулированных культурах происходит на транскрипционном уровне, в то время как в отношении TNF-α – экспрессия регулируется посттранскрипционно [46, 47]. По данным других авторов, ЭМ-1 и ЭМ-2 снижают продукцию и TNF-α, и IL-1β нестимулированными перитонеальными макрофагами крыс спустя 12 и 24 ч воздействия в диапазоне концентраций 10-6–10-9 М, при этом более выраженный эффект был зарегистрирован у ЭМ-1 [48].
Есть данные о том, что совместное культивирование макрофагов с ЭМ-1 значимо снижает содержание TNF-α и, напротив, увеличивает содержание IFN-γ в клеточных супернатантах, по сравнению с контрольными культурами, а также налоксон-зависимо снижает экспрессию CD36 на макрофагах, оказывая таким образом противовоспалительный и антиатерогенный эффекты [49].
Помимо этого, показано, что ЭМ-1 угнетает продукцию IL-8 клеточной линией аденокарциномы толстого отдела кишечника Сaco-2, стимулированной IL-1β [50].
В ряде работ показана способность эндоморфинов модулировать фагоцитарную активность эффекторов врожденного иммунитета. Группой японских исследователей получены данные о способности ЭМ-2 усиливать экспрессию CR-3 (Мас-1) на поверхности перитонеальных макрофагов крыс, повышать адгезию макрофагов к фибронектину, угнетать хемотаксис макрофагов и подавлять спонтанную продукцию супероксиданионов. В то же время, несмотря на усиление экспрессии Мас-1, под воздействием ЭМ-2 наблюдалось угнетение фагоцитоза опсонизированной E. coli [44]. Аналогичные эффекты ЭМ-2 на фагоцитарную активность и хемотаксис были получены в культурах человеческих моноцитов [51] и при культивировании THP-1 клеточной линии [44]. С представленными выше результатами согласуются и данные о влиянии ЭМ-1 и ЭМ-2 на фагоцитарную активность и бактерицидность в культурах перитонеальных макрофагов крыс [48].
Эндоморфины также модулируют функции нейтрофильных гранулоцитов. Так, показано, что в ответ на ЭМ-1 и ЭМ-2 (10-6–10-18М) в стимулированных фитогемагглютинином (ФГА) нейтрофилах крыс снижается продукция супероксиданиона, а в нестимулированных культурах наблюдается обратная картина, при этом подтверждено участие μОР в исследуемых процессах [52]. Кроме этого, под воздействием эндоморфинов наблюдалась стимуляция хемотаксиса, но фагоцитарная активность нейтрофилов при этом не изменялась [53]. Выше упоминалось, что
антиноцицептивные эффекты ЭМ-2 при введении пептида в ЦНС не возникают при блокаде κ-опиатных рецепторов, этот феномен авторы объясняют тем, что при интрацеребровентрикулярном [54] введении ЭМ-2 активация его рецепторов приводит к мобилизации эндогенного динорфина А, который, возможно, и обеспечивает антиноцицептивный эффект этого пептида. Было показано, что угнетение образования активных форм кислорода нейтрофилами in vitro под воздействием эндоморфинов не возникало после воздействия β-фуналтрексамином (β-FNA), но не антагонистом κ-опиатных рецепторов [55].
Показано, что эндоморфины участвуют в регуляции NO – короткоживущего радикала, вовлеченного в процессы воспаления, передачи нервных импульсов, апоптоза и регуляцию сосудистого тонуса. В статье Saric A. и соавт. показано, что только ЭМ-1 стимулирует выделение NO спустя 30 мин после активации индуцибельной NO-синтазы (NOS 2), этот эффект был опосредован через μОР. При длительной инкубации (48 ч) эффект тетрапептидов отсутствовал. Авторы объясняют это тем, что в данном случае эффект скорее был опосредованным и определялся цитокинами, нежели прямым взаимодействием эндоморфинов с рецепторами [56]. В 2010 г. еще один авторский коллектив подтвердил супрессивный эффект эндоморфинов на выброс NO мышиными перитонеальными макрофагами in vivo, данный эффект полностью блокировался введением β-FNA. Однако in vitro при добавлении ЭМ-1 и ЭМ-2 в культуры перитонеальных макрофагов не было зарегистрировано никаких модулирующих эффектов в отношении радикалов NO [57].
При анализе влияния ЭМ-1 на созревание и функциональную активность дендритных клеток было установлено, что ЭМ-1 снижает экспрессию CD80, CD86, CD83, HLA-DR и CCR7 на активированных дендритных клетках и угнетает секрецию ими IL-12 и IL-10. При совместном культивировании Т-лимфоцитов и дендритных клеток с обработкой ЭM-1 пролиферация Т-клеток нарушалась, и в культуральном супернатанте определялись меньшие количества IL-12 и IFN-γ [58]. В то же время ЭМ-1 налоксонзависимо усиливает экспрессию поверхностных молекул дендритных клеток периферической крови CD86, CCR7 и CD36, индуцированных гипергликемией, но замедляет созревание дендритных клеток на фоне гипергликемии. Помимо этого, ЭМ-1 ингибирует индуцированную гипергликемией экспрессию молекулы TLR4 на поверхности дендритных клеток [59].
Есть данные, что ЭМ-1 (10-10–10-16М), но не ЭМ-2 in vitro усиливает репликацию ВИЧ в клетках микроглии человека. Интересно, что данный эффект блокируется β-FNA или токсином коклюша, однако классические лиганды DAMGO и морфин не оказывали подобного действия [60].
Некоторые иммуномодулирующие свойства эндоморфинов освещены в серии работ, посвященных изучению атеросклероза. Ключевыми клетками в развитии этого процесса выступают макрофаги, а ключевой молекулой принято считать молекулу CD36, экспрессирующуюся на их поверхности, так как через нее опосредуется поступление в клетку окисленных форм липопротеинов низкой плотности (ЛПНП) и формирование так называемых пенистых клеток (макрофагов, нагруженных ЛПНП).
В некоторых статьях есть данные о провоспалительной активности опиоидных пептидов, в частности ЭМ-1, при атеросклерозе. Так, с помощью методов флуоресцентной и конфокальной микроскопии показано, что пептид снижает концентрацию липидных включений в макрофагах линии TH1 в концентрациях 10-6–10-8 М. Методом проточной цитометрии зарегистрировано статистически значимое снижение экспрессии СD36 TH1 макрофагами в культурах с ЭМ-1 [49].
На эндотелиоцитах пуповинной вены (HUVEC) показано, что в физиологических концентрациях (от 100 nM до 10 μМ) эндоморфины оказывали стимулирующее влияние на пролиферацию, миграцию и адгезивные свойства эндотелиоцитов, а в высоких концентрациях (50, 100 μМ) был зарегистрирован токсический эффект пептидов на клеточную линию HUVEC. При этом эффект блокировался налоксоном, что говорит о реализации действия эндоморфинов через опиатные рецепторы [61].
Необходимо отметить, что в ряде работ представлены данные, свидетельствующие об отсутствии у эндоморфинов иммуномодулирующей активности. Так, в статье Carrigan и соавт. (2000) подтвержден обезболивающий эффект ЭМ-1 на крысах, но при этом не обнаружена какая-либо иммуномодулирующая активность. Авторы оценивали активность NK-клеток селезенки, продукцию IFN-γ, пролиферативный ответ лимфоцитов после стимуляции конканавалином А (Кон A), ЛПС и микробным суперантигеном TSST (токсин синдрома токсического шока). Было показано, что интрацеребровентрикулярная инъекция ЭМ-1 в левый латеральный желудочек приводила к существенной антиноцицепции, отменяемой налтрексоном, но не влияла на изучаемые иммуннологические параметры. Авторы предположили, что ЭМ-1 при данной схеме введения мог не диффундировать в области мозга, ответственные за иммуномодуляцию [62, 63]. Другим объяснением возможного отсутствия у ЭМ-1 иммунномодулирующих эффектов может быть несоответствие доз, необходимых для анальгезии и иммуномодуляции (табл.).
Обсуждение
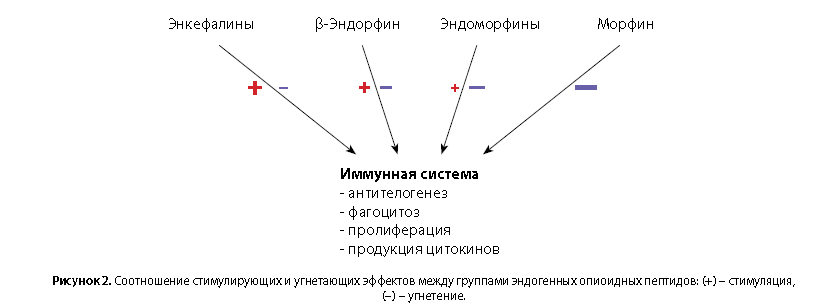
Таким образом, эндоморфины модулируют функции клеток врожденного и адаптивного иммунитета, оказывая эффекты как угнетающей, так и стимулирующей направленности. Так, реакции адаптивного иммунитета эндоморфинами подавляются, в то время как реакции врожденного иммунитета могут как угнетаться, так и стимулироваться. Направленность эффектов сильно зависит от объекта исследования, исследуемых доз и концентраций, условий активации клеток и используемой модели эксперимента. Этим эндоморфины отличаются от своего низкомолекулярного аналога – морфина, который оказывает выраженное угнетающее действие на функции клеток врожденного и адаптивного иммунитета, подавляя фагоцитоз, пролиферацию, продукцию цитокинов, усиливая апоптоз и смещая поляризацию Т-хелперов в сторону Th2-клеток [64]. Проявляя модулирующее действие, эндоморфины, скорее, более близки к β-эндорфину, который, несмотря на смешанный спектр связывания (μ,δ), является преимущественно μ-агонистом и, в зависимости от условий, может оказывать как стимулирующее, так и угнетающее действие на широкий спектр иммунных реакций in vivo и in vitro. Эффекты β-эндорфина (особенно in vitro) налоксоном не устраняются, а могут даже потенцироваться [65].
Аналогичную картину мы можем наблюдать и у эндоморфинов, когда не все их эффекты отменяются антагонистами, а наиболее выраженный антагонистический эффект оказывает β-FNA, но не налоксон, хорошо известный как антагонист морфина. Из всех групп опиоидных пептидов, способных связываться с μ-OP, пожалуй, только у энкефалинов стимулирующие эффекты преобладают над супрессорными [66].
Соотношение иммуномодулирующих эффектов по направленности между группами эндогенных опиоидных пептидов можно отобразить следующим образом (рис. 2).
На наш взгляд, подобные феномены могут зависеть от двух основных причин. Первая заключается в структуре μ-OP, лиганд-связывающий карман которого большой и глубокий, очень похожий на CXCR4 (хемокиновый рецептор), однако намного глубже. Помимо этого, в отличие от мускаринового рецептора лиганд-связывающий карман μ-OP ничем не защищен, что создает структурную основу для очень быстрой кинетики диссоциации агонистов и антагонистов. Также рецептор способен связывать агонисты, выраженно отличающиеся по физико-химическим свойствам, низкомолекулярные (морфин, его производные, налоксон, β-FNA и т.д.) и значительно более крупные агонисты пептидной природы [67]. Другой причиной может являться способность короткоцепочечных пептидов проникать внутрь клетки через мембрану путем транслокации или эндоцитоза, без связывания со специфическим рецептором [68], что, в свою очередь, приводит к активации различных цепочек внутриклеточных мессенджеров и, соответственно, различному эффекту [69]. Хотя эндоморфины обладают низкой способностью к эндоцитозу [19], вероятность такого механизма нельзя исключить вследствие их короткоцепочечной структуры. Значительно усиливается способность эндоморфинов к эндоцитозу после химической модификации – путем метилирования, гликозилирования или липидирования, что может иметь важное клиническое значение [70].
Заключение
Подводя итог, можно сказать, что на сегодняшний день эндоморфины являются перспективными агентами, способными эффективно регулировать ноцицептивные сигналы, в том числе при воспалительных процессах различной этиологии, а также модулировать функциональную активность клеток иммунной системы. Эксперименты по химической модификации эндоморфинов дают возможность в перспективе получить мощные фармакологические агенты, действующие через опиоидные рецепторы без формирования побочных эффектов опиатов, таких как толерантность и зависимость. Возможность разделить анальгетические эффекты эндоморфинов и их способность модулировать иммунный ответ является перспективным направлением дальнейших исследований.
