С.В. Гейн1,2*, Т.А. Баева1
1Институт экологии и генетики микроорганизмов
– филиал ФГБУН Пермский федеральный исследовательский центр
Уральского отделения Российской академии наук
2Пермский государственный национальный
исследовательский университет
Введение
Лиганды, способные связываться с опиоидными рецепторами, можно условно разделить на две основные группы: первая представлена широким спектром низкомолекулярных соединений, в первую очередь морфином и его производными, которые используются в практической медицине в качестве анальгетиков, вторая группа – это эндогенные опиоидные пептиды, выполняющие в организме, помимо антиноцицептивной, еще ряд важных функций, в том числе иммунорегуляторную. Наиболее полно описано иммуномодулирующее действие трех основных семейств опиоидных пептидов: эндорфинов, энкефалинов и динорфинов, имеющих общую N-концевую последовательность и образующихся при расщеплении крупных молекул-предшественников [1].
Однако в конце XX в. были идентифицированы еще два пептида, взаимодействующих с опиоидными рецепторами, – эндоморфин 1 (ЭМ-1) и эндоморфин 2 (ЭМ-2) [2]. Несмотря на то что основным местом локализации соединений с опиоидной активностью является центральная нервная система (ЦНС), где они в первую очередь ответственны за антиноцицепцию, опиоидные пептиды также широко распространены в центральных и периферических органах иммунной системы, продуцируются клетками в ответ на контакт с антигеном либо в присутствии высоких концентраций провоспалительных цитокинов, обусловливая широкий спектр иммунорегуляторных эффектов, реализуемых по пара- и аутокринному механизму [3]. В настоящем обзоре мы попытались суммировать и систематизировать современные представления о структуре эндоморфинов и их иммуномодулирующих эффектах.
Структура и локализация эндоморфинов
ЭМ-1 и ЭМ-2 были впервые идентифицированы в мозге быка и коре головного мозга человека в 1997 г. [2, 4].
Они представляют собой два тетрапептида, отличающихся по одному аминокислотному остатку. Структура эндоморфинов отличается от структуры эндорфинов, энкефалинов и динорфинов, которые содержат одинаковую N-концевую последовательность Tyr-Gly-Gly-Phe.
Эндоморфины не имеют общей N-концевой последовательности, а эндогенный предшественник эндоморфинов до сих пор не идентифицирован [5]. Химическая структура эндоморфинов представлена на рис. 1.
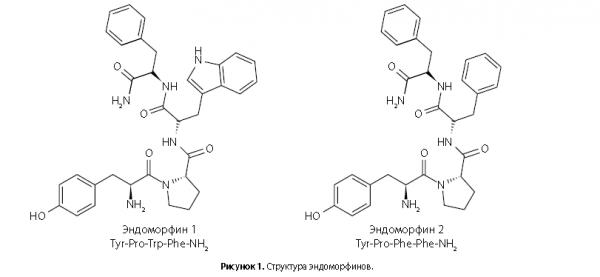
Последовательность эндоморфинов содержит спейсер Pro2, который соединяет между собой два фармакофорных остатка. Спейсер Pro2 обеспечивает необходимую стереохимическую конфигурацию ЭM-1 для связывания с рецептором. Биологически активной конформацией ЭМ-1 является структура, в которой боковые цепочки Tyr1 и Trp3 имеют противоположную ориентацию по отношению к Pro2 [6].
В центральной нервной системе эндоморфины распределены всюду. Этими пептидами изобилуют промежуточный мозг, средний мозг, структуры продолговатого и заднего мозга. ЭМ-1 доминирует в головном мозге, в то время как ЭМ-2 более распространен в спинном мозге [6, 7] и его распределение совпадает с зонами, богатыми β-эндорфином [8]. В органах иммунной системы эндоморфины обнаружены в клетках периферической крови, тимусе и селезенке [9], также в цитоплазме иммунокомпетентных клеток очага воспаления, и практически отсутствовали в невоспаленной ткани [10]. По данным Seale J.V. с соавт., области селезенки крыс с высоким содержанием ЭМ-1 и ЭМ-2 совпадали преимущественно с зонами преобладания макрофагов и В-лимфоцитов, минимальные количества пептидов присутствовали в зонах с преобладанием популяций Т-лимфоцитов [11]. В условиях хронического воспаления в модели адъювантного артрита ЭМ-1 и ЭМ-2 обнаружены в макрофагах/моноцитах медуллярной зоны подколенных лимфатических узлов крыс [12].
У человека ЭМ-1 и ЭМ-2 обнаружены в экстрактах лимфоцитов периферической крови, а в клетках селезенки – только ЭМ-2 [9]. Стабильность эндоморфинов довольно низкая, но в ЦНС период полураспада значительно выше (88 мин для ЭМ-1 и 105 мин для ЭМ-2), чем в плазме крови (4 мин для ЭМ-1 и 7 мин для ЭМ-2) [13]. В общем, эндоморфины относительно более стабильны, чем энкефалины, эндорфины и динорфины, благодаря наличию пролинового остатка во второй позиции [14, 15]. Показано, что внедрение жирных кислот и сахаров в структуру некоторых пептидов значительно улучшает их фармакологические свойства [16–18]: увеличиваются биодоступность, стабильность молекулы к ферментативному расщеплению, а также проницаемость через биологические барьеры методом пассивной диффузии (эндоцитоз) [19].
Продолжение следует…
