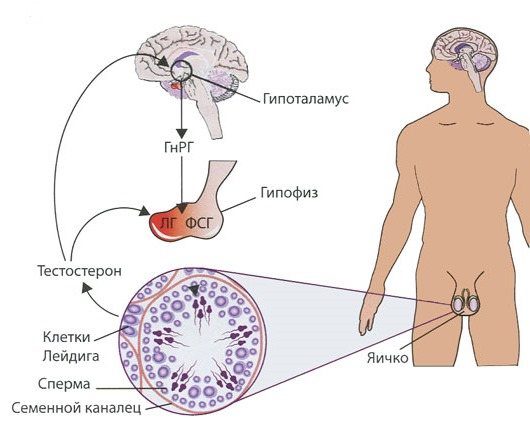
 При гипогонадотропном гипогонадизме (ГГ) отсутствие полового развития у мальчиков является следствием дефицита гонадотропных гормонов при неповрежденных тестикулах [1, 2]. Различают врожденные и приобретенные формы данного заболевания. К врожденным формам относят генетические варианты, приводящие к нарушению закладки нейронов, секретирующих гонадотропин-рилизинг-гормон; приобретенный ГГ развивается у детей с объемными образованиями хиазмально-селлярной области (ХСО) — краниофарингиомы, глиомы, аденомы гипофиза [2, 3].
При гипогонадотропном гипогонадизме (ГГ) отсутствие полового развития у мальчиков является следствием дефицита гонадотропных гормонов при неповрежденных тестикулах [1, 2]. Различают врожденные и приобретенные формы данного заболевания. К врожденным формам относят генетические варианты, приводящие к нарушению закладки нейронов, секретирующих гонадотропин-рилизинг-гормон; приобретенный ГГ развивается у детей с объемными образованиями хиазмально-селлярной области (ХСО) — краниофарингиомы, глиомы, аденомы гипофиза [2, 3].
В связи с внедрением новых методик вспомогательных репродуктивных технологий во всем мире встал вопрос о повышении репродуктивного потенциала у мужчин с врожденным и приобретенным ГГ [4–7].
Традиционно для лечения всех форм гипогонадизма у лиц мужского пола используют препараты тестостерона, которые позволяют добиться удовлетворительных конечного роста и стадии полового развития. Однако объем гонад остается допубертатным, и созревание сперматогенного эпителия в таких условиях невозможно [4–7]. Как следствие, пациенты остаются бесплодными, испытывают психосоциальную неудовлетворенность [8, 9].
По данным литературы, использование препаратов гонадотропинов — хорионического гонадотропина (ХГЧ) и рекомбинантного фолликулостимулирующего гормона (рФСГ) — у взрослых пациентов с ГГ позволяет не только увеличить объем гонад, но и, в ряде случаев, добиться сперматогенеза [4–7]. Однако терапия, начатая во взрослом состоянии, далеко не всегда позволяет получить удовлетворительные результаты спермограммы [4]. Полагают, что инициировать применение препаратов гонадотропинов у пациентов с ГГ необходимо в пубертатном возрасте [4, 7, 10]. Это приведет к созреванию сперматогенного эпителия (что повысит вероятность фертильности в будущем), улучшит качество жизни, а также поможет существенно снизить стоимость лечения бесплодия у взрослых [4–7, 9].
Тем не менее, при лечении ГГ у подростка, родители которого желают сохранить фертильность, врач сталкивается с рядом вопросов, касающихся сроков начала терапии, выбора препаратов и последовательности их введения, режима дозирования. Так, актуальный Приказ Министерства здравоохранения № 847н от 9 ноября 2012 г. «Об утверждении стандарта специализированной медицинской помощи детям при гипогонадизме» предусматривает применение препаратов тестостерона и лишь в четверти случаев — ХГЧ. При этом препараты рекомендуют использовать «в соответствии с инструкцией по применению [11], в индивидуальном режиме дозирования в зависимости от показаний и схемы лечения». [12]. Федеральные клинические рекомендации (протоколы) по диагностике и лечению гипогонадизма у детей (2014 г.) также рекомендуют терапию препаратами эфиров тестостерона в большинстве случаев. Указывая на возможность восстановления фертильности у пациентов с ГГ путем введения гонадотропинов, авторы подчеркивают, что «тактика лечения определяется актуальностью вопроса фертильности для пациента в настоящее время» и предлагают три схемы лечения [3].
В публикациях зарубежных авторов также можно найти результаты исследований различных вариантов терапии гонадотропинами. Например, Julia Rohayem и соавт. начинают с ХГЧ, в индивидуальных и постепенно возрастающих дозах, до достижения уровня тестостерона, соответствующего стадии полового развития пациента. При этом стартовая и полная терапевтическая дозы ХГЧ, а также целевой уровень тестостерона зависят от наличия/отсутствия предшествующей терапии препаратами половых гормонов. Далее к терапии добавляют препараты рФСГ (фоллитропин альфа) в дозе 75/150 МЕ [6]. Naoko Sato и соавт. предлагают одновременное введение препаратов ХГЧ и рФСГ в минимальных дозах с постепенным (раз в 6 месяцев) их увеличением до полных заместительных — 3000 ЕД и 150 ЕД соответственно, 1 раз в неделю [5].
Между тем накопленные литературные данные свидетельствуют о первоочередной роли ФСГ в создании условий для будущего сперматогенеза в пубертатном возрасте [4, 13]. У подростков так называемая «вторая волна» пролиферации клеток Сертоли («первой» называют пролиферацию незрелых клеток Сертоли в периоде «мини-пубертата» под действием гонадотропных гормонов) и увеличение объема тестикул связаны с повышением секреции ФСГ клетками гипофиза, стимулированными гонадолиберином [13, 14]. Далее лютенизирующий гормон (ЛГ) способствует повышению уровня тестостерона, что ведет, благодаря экспрессии соответствующих рецепторов на поверхности клеток Сертоли в пубертатном периоде [15], к их конечной дифференцировке [7, 13]. Количество клеток Сертоли находит отражение в качестве спермограммы [7, 16].
В результате многие исследователи полагают, что начинать следует с препаратов рФСГ, со временем переходя на комбинированную терапию гонадотропинами [4, 7]. Продолжительность периода монотерапии препаратами рФСГ, по данным литературы, варьирует от нескольких месяцев до 2 лет, находится в обратной зависимости от возраста пациентов и определяется уровнем ингибина В [4, 7]. Так, A. Dwyer и соавт. показали, что концентрация ингибина В претерпевает значимые изменения в первые 2–3 месяца введения препаратов рФСГ, после чего приобретает вид «плато» [4], подобно физиологическим изменениям в пубертатном возрасте [17].
Описание протокола лечения
Мы придерживаемся мнения, что проводить лечение гонадотропинами следует всем пациентам с диагностированным ГГ [2, 3], достигшим возраста 14 лет, когда синдром задержки пубертата является клинически значимым, снижает качество жизни подростка и, следовательно, требует лечения. От подобной терапии стоит воздержаться, если имеется хотя бы одно из нижеперечисленных состояний:
1) наличие опухоли гипофиза или гипоталамуса, лечение которой не проводилось, либо проводилась неадекватная терапия;
2) неконтролируемые нарушения со стороны щитовидной железы, надпочечников и гипофиза, с нестабильной заместительной терапией (дозы препаратов не были стабильными в течение по крайней мере 3 месяцев);
3) операция или лучевая терапия опухолей ХСО в течение 12 месяцев до начала лечения;
4) наличие в анамнезе химиотерапии по поводу онкологического заболевания;
5) клинически значимое заболевание печени, включая активный вирусный гепатит или цирроз;
6) аллергия/гиперчувствительность к гонадотропинам или их вспомогательным компонентам;
7) клинически значимое состояние или ситуация, при которой, по мнению лечащего врача, терапия может быть небезопасна.
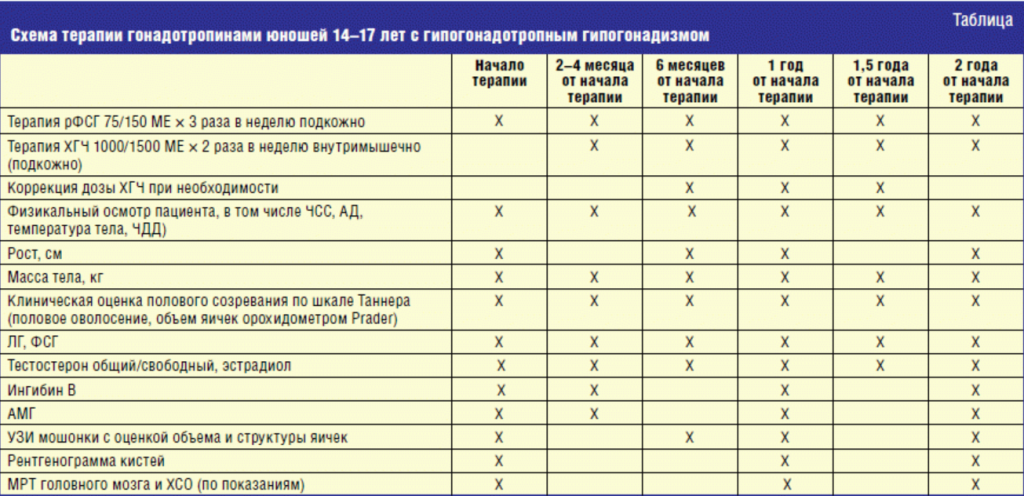
Наиболее обоснованным представляется начало лечения с введения препаратов рФСГ. Режим дозирования (рФСГ 75 МЕ/150 МЕ в зависимости от веса и/или возраста, подкожно, 3 раза в неделю) согласуется с мнением большинства авторов [2, 3, 6]. В частности, результаты исследований по применению рФСГ в дозе 150 МЕ 3 раза свидетельствовали об увеличении объема яичек вдвое, индукции сперматогенеза у мужчин с ГГ и нормализации уровня иммунореактивного ФСГ [4, 6].
Переходить на комбинированную терапию целесообразно через 2–4 месяца от начала введения препаратов рФСГ. Возраст пациентов не позволяет длительно откладывать индукцию пубертата, а значимые изменения уровня ингибина В, как указывалось выше, происходят в первые 2–3 месяца лечения [4]. Так, через 2–4 месяца от начала введения препартов рФСГ пациент начинает получать дополнительно ХГЧ, внутримышечно (подкожно), в стандартном режиме дозирования — 1000/1500 МЕ в зависимости от веса и/или возраста, 2 раза в неделю с последующей титрацией дозы по уровню тестостерона, с целью поддержания его в пределах нормальных значений для стадии пубертата. При появлении признаков гинекомастии и/или повышении концентрации эстрадиола дозу ХГЧ можно снизить [18].
Продолжать этап комбинированной терапии, вслед за T. S. Han и P. M. G. Bouloux, мы рекомендуем в течение 1,5–2 лет [19].
Судить об эффективности терапии в подростковом возрасте можно на основании оценки полового развития по шкале Таннер (с измерением объема яичек с помощью орхидометра Prader), антропометрии (с определением костного возраста по рентгенограмме левой кисти с помощью атласа Greulich) [2, 3]. Важнейшими лабораторно-инструментальными методами контроля являются: измерение объема яичек методом ультрасонографии, определение в крови уровня тестостерона, который отражает функциональную активность клеток Лейдига, концентраций ингибина В и антимюллерова гормона (АМГ), которые отражают функцию клеток Сертоли. Увеличение объема яичек, достижение пубертатных уровней тестостерона и ингибина В, повышение и затем снижение уровня АМГ свидетельствуют об эффективности терапии гонадотропинами [2–7]. Заметим, что данные о ценности сывороточного АМГ и/или его отношения к тестостерону в плане фертильности противоречивы [20, 21]. С одной стороны, Massimo Alfano и соавт. называют уровень АМГ менее 4,62 нг/мл и/или соотношение АМГ к общему тестостерону менее 1,02 высокочувствительным маркером фертильности, доказанной методом тестикулярной микродиссекции [20], а с другой, L. Aksglaede и соавт. не обнаруживают взаимосвязи между концентрацией АМГ и качеством спермограммы [21]. О приверженности пациента к терапии, а таrже адекватности дозы препарата рФСГ можно судить по уровню иммунореактивного ФСГ 1–7 ЕД/л [6].
Учитывая вероятность задержки полового развития у пациента с ГГ, мы считаем важным проводить измерение уровня ЛГ на протяжении всего лечения. Предполагается, что у пациентов с ГГ эндогенный уровень ЛГ будет по-прежнему низкий. У юношей с задержкой полового созревания во время терапии препаратами с ФСГ-активностью и ХГЧ возможно созревание гипофиза, что приведет к повышению уровня ЛГ [22].
Схема терапии гонадотропинами, а также параметры ее эффективности представлены в таблице.
В качестве заключения, или Что после протокола
Главным способом оценки фертильности мужчины является спермограмма [23], однако провести подобное исследование у пациентов в возрасте младше 18 лет не всегда возможно по физиологическим и этическим соображениям. Тем не менее, многие авторы указывают на целесообразность данного исследования после двух-трех лет от начала лечения, так как это может позволить составить план дальнейшего наблюдения [19].
Терапия гонадотропинами на сегодняшний день является дорогостоящей, а лечение пациентам с ГГ требуется длительное. В связи с этим возникает вопрос о том, что делать после достижения половой зрелости и становления сперматогенеза.
Некоторые авторы предлагают переводить пациентов с ГГ на традиционную заместительную терапию препаратами тестостерона, с возобновлением лечения гонадотропинами при появлении желания восстановить фертильность [4]. Такой подход, по их мнению, должен существенно снизить стоимость и продолжительность лечения бесплодия у взрослых пациентов с ГГ. T. S. Han и P. M. G. Bouloux указывают на возможность поддержания сперматогенеза, достигнутого при помощи комбинированной терапии гонадотропинами, одним лишь ХГЧ [19], что поможет избежать возможных негативных последствий терапии препаратами тестостерона [8, 23]. Наконец, при получении удовлетворительных результатов спермограммы, можно рассмотреть вопрос криоконсервации, для обращения в центры вспомогательных репродуктивных технологий в будущем.?
Литература
- Boehm U., Bouloux P.-M., Dattani M. T., de Roux N., Dodé C., Dunkel L., Dwyer A. A., Giacobini P., Hardelin J.-P., Juul A., Maghnie M., Pitteloud N., Prevot V., Raivio T., Tena-Sempere M., Quinton R., Young J. Expert consensus document: European Consensus Statement on congenital hypogonadotropic hypogonadism — pathogenesis, diagnosis and treatment // Nature Reviews Endocrinology. 2015; 11: 47–564. DOI: 10.1038/nrendo.2015.112.
- Лисс В. Л., Скородок Ю. Л., Плотникова Е. В., Нагорная И. И., Николаева Л. В., Пальчик А. Б., Шабалов Н. П. Диагностика и лечение эндокринных заболеваний у детей и подростков. СПб, 2017.
- Андрианова Е. А., Безлепкина О. Б., Васюкова О. В., Волеводз Н. Н., Емельянов А. О., Зильберман Л. И., Калинченко Н. Ю., Карева М. А., Кураева Т. Л., Меликян М. А., Нагаева Е. В., Орлова Е. М., Панкратова М. С., Петряйкина Е. Е., Стребкова Н. А., Чикулаева О. А. Федеральные клинические рекомендации (протоколы) по ведению детей с эндокринными заболеваниями. М., 2014.
- Dwyer A. A., Sykiotis G. P., Hayes F. J., Boepple P. A., Lee H., Loughlin K. R. et al. Trial of recombinant follicle-stimulating hormone pretreatment for GnRH-induced fertility in patients with congenital hypogonadotropic hypogonadism // J Clin Endocrinol Metab. 2013; 98: E1790–1795.
- Sato N., Hasegawa T., Hasegawa Y., Arisaka O., Ozono K., Amemiya S., Kikuchi T., Tanaka H., Harada S., Miyata I., Tanaka T. Treatment situation of male hypogonadotropic hypogonadism in pediatrics and proposal of testosterone and gonadotropins replacement therapy protocols // Clin Pediatr Endocrinol. 2015; 24 (2): 37–49.
- Rohayem J., Hauffa B. P., Zacharin M., Kliesch S., Zitzmann M. Testicular growth and spermatogenesis: new goals for pubertal hormone replacement in boys with hypogonadotropic hypogonadism? -a multicentre prospective study of hCG/rFSH treatment outcomes during adolescence // Clinical Endocrinology. 2017; 86 (1): 75–87. DOI: org/10.1111/cen.13164.
- Raivio T., Wikstrom A. M., Dunkel L. Treatment of gonadotropin-deficient boys with recombinant human FSH: long-term observation and outcome // Eur J Endocrinol. 2007; 156: 105–111.
- Majzoub A., Sabanegh E., Jr. Testosterone replacement in the infertile man // Transl Androl Urol. 2016; 5 (6): 859–865.
- Aydogan U., Aydogdu A., Akbulut H., Sonmez A., Yuksel S., Basaran Y. et al. Increased frequency of anxiety, depression, quality of life and sexual life in young hypogonadotropic hypogonadal males and impacts of testosterone replacement therapy on these conditions // Endocr J. 2012; 59: 1099–1105.
- Drobac S., Rubin K., Rogol A. D., Rosenfield R. L. A workshop on pubertal hormone replacement options in the United States. 2006; 19: 55–64.
- Приказ Минздрава России от 09.11.2012 № 847н «Об утверждении стандарта первичной медико-санитарной помощи детям при гипогонадизме» (Зарегистрировано в Минюсте России 27.02.2013 № 27354).
- Толмачева Е. А. Справочник Видаль 2018. Видаль Рус, 2018.
- Pitteloud N., Hayes F. J., Boepple P. A., DeCruz S., Seminara S. B., MacLaughlin D. T., Crowley W. F. Jr. The role of prior pubertal development, biochemical markers of testicular maturation, and genetics in elucidating the phenotypic heterogeneity of idiopathic hypogonadotropic hypogonadism // J Clin Endocrinol Metab. 2002; 87 (1): 152–160.
- Cortes D., Muller J., Skakkebaek N. E. Proliferation of Sertoli Cells during development of the human testis assessed by stereological methods // Int J Androl. 1987, 10: 589–596.
- Regadera J., MartÍnez-GarcÍa F., Go0nzález-Peramato P., Serrano A., Nistal M., & Suárez-Quian C. Androgen Receptor Expression in Sertoli Cells as a Function of Seminiferous Tubule Maturation in the Human Cryptorchid Testis1 // J Clin Endocr Metab. 2001; 86 (1), 413–421. DOI: 10.1210/jcem.86.1.7109.
- Johnson L., Zane R. S., Petty C. S., Neaves W. B. Qualification of the human Sertoli cell population ^ its distrubtion, relation to germ cell numbers, and age-related decline // Biology of Reproduction. 1984; 31: 785–795.
- Руководство по детской эндокринологии / Под ред. Ч. Г. Д. Брука, Р. С. Браун. Пер. с англ. под ред. В. А. Петерковой. М.: ГЭОТАР-Медиа, 2009. 352 с.
- Скородок Ю. Л., Иоффе И. Ю., Нагорная И. И., Никитина И. Л. Применение рекомбинантного ФСГ в комбинированной терапии у юноши с идиопатическим гипогонадотропным гипогонадизмом // Медицинский Совет. 2018; 17: 260–264.
- Han T. S., Bouloux P. M. What is the optimal therapy for young males with hypogonadotropic hypogonadism? // Clin Endocrinol. 2010; 72: 731–737.
- Alfano M., Ventimiglia E., Locatelli I., Capogrosso P., Cazzaniga W., Pederzoli F., Frego N., Matloob R., Saccà A., Pagliardini L., Viganò P., Zerbi P., Nebuloni M., Pontillo M., Montorsi F., Salonia A. Anti-Mullerian Hormone-to-Testosterone Ratio is Predictive of Positive Sperm Retrieval in Men with Idiopathic Non-Obstructive Azoospermia // Scientific Reports. 2017; 7: 17638. DOI: 10.1038/s41598–017–17420-z.
- Aksglaede L., Olesen I. A., Carlsen E., Petersen J. H., Juul A., Jørgensen N. Serum concentration of anti-Müllerian hormone is not associated with semen quality // Andrology. 2018; 6 (2): 286–292. DOI: 10.1111/andr.12456.
- Sidhoum V. F., Chan Y. M., Lippincott M. F., Balasubramanian R., Quinton R., Plummer L., Dwyer A., Pitteloud N., Hayes F. J., Hall J. E., Martin K. A., Boepple P. A., Seminara S. B. Reversal and relapse of hypogonadotropic hypogonadism: resilience and fragility of the reproductive neuroendocrine system // J Clin Endocrinol Metab. 2014; 99 (3): 861–870. DOI: 10.1210/jc.2013–2809.
- Bassil N., Alkaade S., Morley J. E. The benefits and risks of testosterone replacement therapy: a review // Ther Clin Risk Manag. 2009; 5: 427–448.
Ю. Л. Скородок*, кандидат медицинских наук
И. Ю. Иоффе*
И. Л. Никитина**, 1, доктор медицинских наук
Л. А. Желенина*, доктор медицинских наук, профессор
* ФГБОУ ВО СПбГПМУ МЗ РФ, Санкт-Петербург
** ФГБУ НМИЦ им. В. А. Алмазова МЗ РФ, Санкт-Петербург
1 Контактная информация: nikitina0901@gmail.com
Гонадотропины при гипогонадотропном гипогонадизме у юношей: перспективы лечения/ Ю. Л. Скородок, И. Ю. Иоффе, И. Л. Никитина, Л. А. Желенина
Для цитирования: Лечащий врач № 12/2018; Номера страниц в выпуске: 44-46
Теги: половое развитие, нарушение, индукция пубертата, фертильность
