Митохондриальные заболевания, ассоциированные с гипопаратиреозом. Поступали сообщения о развитии гипопаратиреоза при трех заболеваниях, ассоциированных с митохондриальной дисфункцией: синдроме Кернса — Сейра, синдроме митохондриальной энцефаломиопатии с лактатацидозом и инсультоподобными эпизодами (MELAS), а также при синдроме дефицита митохондриального трифункционального белка (mitochondrial trifunctional protein, МТР) (рис. 2, табл. 1) [51–53]. Синдром Кернса — Сейра характеризуется прогрессирующей периферической офтальмоплегией (паралич глазных мышц) и пигментной ретинопатией, которые развиваются в возрасте менее 20 лет [52]. Делеции, дупликации и миссенс-мутации в митохондриальной ДНК приводят к развитию синдрома Кернса — Сейра и MELAS-синдрома [19, 30, 51], тогда как синдром дефицита МТР развивается в результате нарушения окисления жирных кислот в митохондриях. Синдром дефицита MTP ассоциирован с кардиомиопатией, периферической нейропатией, пигментной ретинопатией и дисфункцией печени и вызван мутациями в гене НADHB, который кодирует β-субъединицу трифункционального фермента [53]. Остается непонятным механизм (или механизмы), который приводит к гипопаратиреозу при этих митохондриальных заболеваниях.
Наследственные костные дисплазии, ассоциированные с гипопаратиреозом. Гипопаратиреоз встречается более чем у 50 % пациентов с синдромом Кенни — Кэффи [19], который также характеризуется низким ростом и остеосклеротической дисплазией костей. Синдром Кенни — Кэффи может наследоваться как аутосомно-рецессивное (тип I) или доминантное (тип II) заболевание [19]. Синдром Санджад — Сакати, который также известен как синдром гипопаратиреоза, задержки развития и дисморфизма, распространен в популяциях на Ближнем Востоке и имеет фенотип, схожий с синдромом Кенни — Кэффи [54]. Синдром Санджад — Сакати и синдром Кенни — Кэффи I типа вызваны мутациями в гене тубулин-специфичного шаперона Е (ТВСЕ) [55], который кодирует белок шаперона, необходимый для правильного фолдинга субъединиц α-тубулина [55] и играет главную роль в миграции паращитовидной железы [56]. Синдром Кенни — Кэффи II типа развивается в результате гетерозиготной миссенс-мутации в гене А семейства со сходством последовательностей, равным 111 (FAM111A), который кодирует белок, участвующий в репликации ДНК и созревании хроматина, а также может принимать участие в эмбриональном развитии [57, 58]. Было продемонстрировано, что мутация гена FAM111A Ser342del вызывает ассоциированную с гипопаратиреозом скелетную дисплазию, характеризующуюся хрупкостью костей (остеокраниостеноз) и приводящую к гибели в перинатальном периоде (рис. 2, табл. 1) [58].
Аутосомно-доминантная гипокальциемия. Аутосомно-доминантные гипокальциемии I и II типов представляют собой генетически отличающиеся заболевания, которые, как оказалось, связаны с герминативными мутациями белков CaSR и G11α соответственно (рис. 2, табл. 1) [15, 59, 60]. Для I типа, который является наиболее распространенным типом аутосомно-доминантной гипокальциемии, характерна гипокальциемия, изменения уровней ПТГ от неопределяемого до нормального и повышение экскреции кальция, которое может привести к выраженной гиперкальциурии даже при низких сывороточных концентрациях кальция [15, 60–62]. Эктопические кальцификаты в почках или базальных ганглиях образуются примерно у 35 % пациентов с аутосомно-доминантной гипокальциемией I типа [15, 60, 63]. У некоторых пациентов с гипокальциемией I типа, которая связана с мутациями CaSR, может также развиваться Барттер-подобный синдром (синдром Барттера V типа), который характеризуется гипокальциемическим алкалозом, ренальной потерей солей и гиперренинемическим гиперальдостеронизмом вместе с гипокальциемией и гипопаратиреозом [15, 64]. Аутосомно-доминантная гипокальциемия II типа имеет сходный с I типом биохимический фенотип сыворотки крови [59, 65, 66], но, как правило, менее выраженные клинические проявления со стороны почек — значительно меньшую экскрецию кальция с мочой [67]. Кроме того, у некоторых пациентов отмечается низкорослость, которая вызвана задержкой роста в постнатальном периоде [67, 68].
Аутосомные формы гипопаратиреоза. Гомолог отсутствия глиальных клеток 2 (GCM2) — паратиреоид-специфический фактор транскрипции (рис. 2), который играет решающую роль во внеклеточном гомеостазе кальция, способствуя развитию паращитовидных желез [47, 48, 69] и взаимодействуя с факторами транскрипции GATA3 и MAFB, которые повышают экспрессию ПТГ (рис. 3) [49, 50] . Герминативные мутации GCM2 (табл. 1) часто ассоциированы с тяжелой гипокальциемией и сывороточными концентрациями ПТГ от низких до неопределяемых [70]. Гомозиготные мутации GCM2 вызывают аутосомно-рецессивную форму изолированного гипопаратиреоза, нарушая локализацию в ядре, связывание с ДНК и/или трансактивационные свойства фактора транскрипции GCM2 [70], тогда как гетерозиготные мутации GCM2 приводят к развитию аутосомно-доминантного гипопаратиреоза, оказывая доминантно-негативный эффект на трансактивационные свойства GCM2 [71, 72].
Герминативные аномалии гена PTH — редкая причина аутосомно-доминантных и рецессивных форм изолированного гипопаратиреоза (табл. 1). Эти аномалии, к которым относятся нонсенс- и миссенс-мутации или мутации в сайтах сплайсинга, в основном воздействуют на экзон 2 (кодирует область сигнального пептида — препроПТГ(1–115) пептида) и предположительно нарушают биосинтез и секрецию ПТГ (рис. 2) [19, 73–75]. Недавно в семье со случаями аутосомно-рецессивной формой гипокальциемии была идентифицирована мутация, воздействующая на зрелый пептид ПТГ(1–84), и было показано, что в результате нарушалась связь ПТГ с рецептором PTH1R75 [75]. В зависимости от типа используемого анализа ПТГ, у больных членов семьи были определены высокие или низкие уровни ПТГ в плазме крови. Затем была обнаружена мутация (Arg25Cys), которая препятствовала проведению некоторых иммунохимических анализов, где использовались антитела к ПТГ(1–34) и к фрагментам ПТГ(13–34). Это объясняет, почему некоторые тест-системы не могли обнаружить мутантный пептид ПТГ [75].
Х-сцепленный рецессивный гипопаратиреоз. Х-сцепленный рецессивный гипопаратиреоз развивается только у мужчин и ассоциирован с развитием гипокальциемических судорог у младенцев [76]. Были определены молекулярные делеции и инсерции, затрагивающие хромосомы 2p25 и Xq27, также эти структурные изменения могут изменить экспрессию близлежащего гена SOX3 (табл. 1) [77, 78]. SOX3 кодирует высокомобильный групповой фактор транскрипции, который экспрессируется паращитовидными железами во время эмбриогенеза и может играть некоторую роль в развитии паращитовидных желез из глоточных карманов (рис. 3) [77].
Другие причины гипопаратиреоза
В некоторых случаях изолированного гипопаратиреоза, когда другие причины не удается установить, также предполагается аутоиммунная этиология разрушения паращитовидных желез. Не существует формальных диагностических критериев и утвержденных лабораторных тестов, которые могли бы быть использованы для постановки этого диагноза. К функциональному гипопаратиреозу также может привести тяжелая и длительная гипомагниемия [79, 80]. Редко причиной гипопаратиреоза могут стать такие инфильтративные заболевания как гемохроматоз, болезнь Вильсона и опухолевые метастазы [2]. Считается, что в этом случае механизм связан с ингибированием функции клеток паращитовидных желез железом (первичный избыток железа при гемохроматозе и вторичный при переливаниях крови больным талассемией [группа наследственных болезней крови в основе которых лежит продукция аномального гемоглобина]), медью (болезнь Вильсона — Коновалова) и замещением функциональной ткани паращитовидных желез опухолевыми клетками. Несмотря на то, что были описаны случаи гипопаратиреоза, индуцированного облучением, эта этиология очень редка [2].
Диагностика, скрининг и профилактика
Клинические проявления
Клинические проявления гипопаратиреоза крайне разнообразны и могут возникать со стороны различных органов и систем (рис. 4). Классические симптомы гипопаратиреоза — это повышение нервно-мышечной проводимости вследствие гипокальциемии. Другие проявления могут быть вызваны эпизодами гиперкальциемии и гиперфосфатемии (например, внескелетные кальцификаты), но происхождение некоторых симптомов (например, психических) пока недостаточно понятно [2].
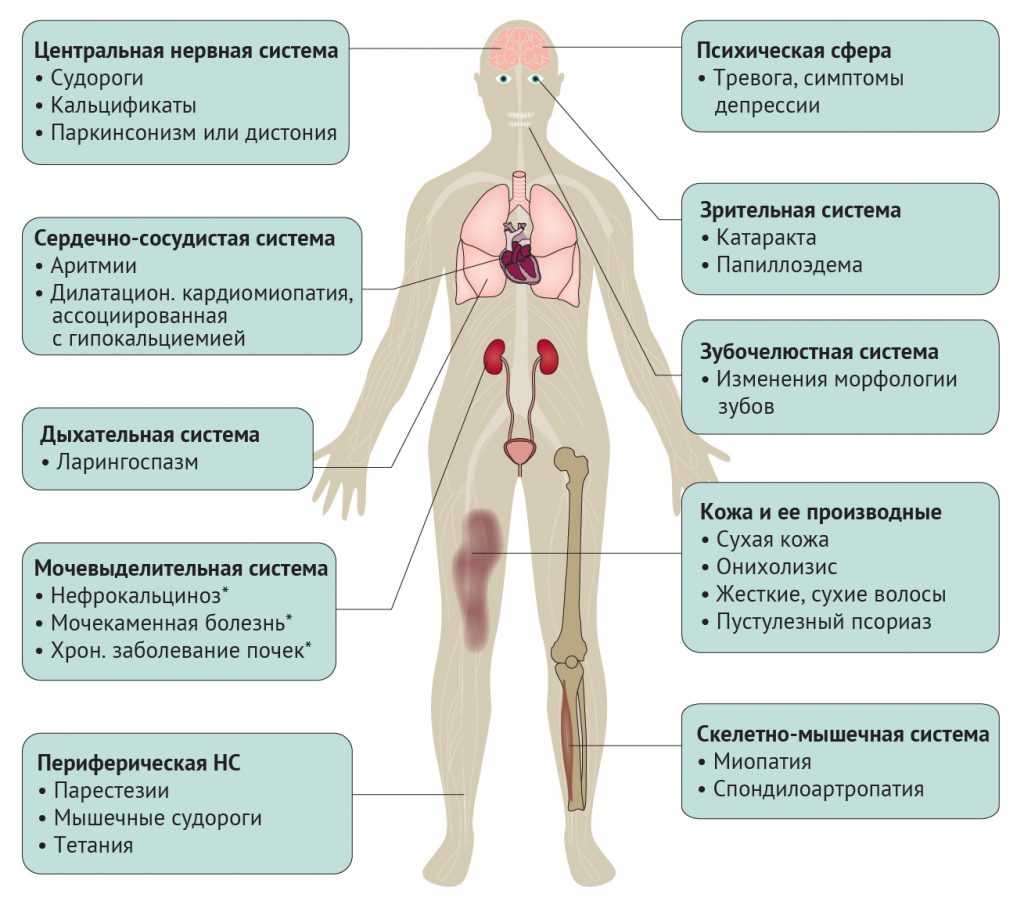
Рисунок 4 | Клинические признаки гипопаратиреоза Продемонстрированы частые и редкие клинические признаки. *В основном эти проявления развиваются в ходе лечения препаратами кальция и активными формами витамина D.
Периферическая нервная система. Гипокальциемия индуцирует частичную деполяризацию покоящейся мембраны нейрона, тем самым повышая вероятность запуска потенциала действия [81]. Это приводит к повышению нервно-мышечной проводимости — ключевого симптома гипокальциемии любой этиологии. Повышение чувствительности сенсорного нейрона проявляется как парестезия в конечностях и периоральной и оральной областях. Повышение проводимости в двигательных нейронах может проявляться развитием мышечных спазмов или тетании, варьируя от классического карпопедального спазма (спазм мышц предплечья, кисти, нижней конечности и/или стопы) до жизнеугрожающего ларингоспазма [82, 83]. Повышение нервно-мышечной проводимости можно распознать с помощью симптомов Хвостека (ипсилатеральное подергивание мышц лица при нажатии в области точек выхода лицевого нерва) и Труссо (сокращение мышц руки при раздувании манжеты тонометра до значений, превышающих систолическое давление на 3 минуты и более) [84].
Центральная нервная система. При тяжелой гипокальциемии возможно развитие фокальных или генерализованных (тонико-клонического типа) судорожных приступов. Хотя ранее у пациентов с гипопаратиреозом часто развивались судороги, в двух недавних исследованиях они отмечаются лишь у 4–8 % пациентов [13, 85]. Возможными объяснениями могут быть как систематическая ошибка отбора в ранних исследованиях, так и лучших контроль уровней сывороточного кальция в последующих исследованиях.
Кальцификаты в центральной нервной системе (рис. 5a, b) — обычная находка у пациентов с гипопаратиреозом, распространенность которой в двух когортах средней величины в США и Индии составила 52–74 % [85, 86]. Кальцификаты чаще всего встречаются в базальных ганглиях, но могут возникать и в сером, и в белом веществе, в паренхиме мозжечка, в таламусе и зубчатых ядрах. Хотя точная причина возникновения кальцификатов не ясна, их прогрессия была независимо ассоциирована с уменьшением соотношения кальция и фосфата в сыворотке крови, что позволяет предположить, что изменения метаболизма фосфата могут играть ключевую роль в образовании эктопических кальцификатов [86]. Примечательно, что два гена (натрий-зависимый фосфатного транспортера 2 [PIT2, также известный как SLC20А2] и ксенотропного и политропного ретровирусного рецептора 1 [XPR1]) оказались ассоциированы с семейной идиопатической кальцификацией базальных ганглиев (также известной как синдром Фара), кодируя белки, участвующие в транспорте фосфатов, что поддерживает гипотезу о роли аномального гомеостаза фосфатов в развитии эктопической кальцификации при хроническом гипопаратиреозе [87, 88]. Клиническая значимость кальцификатов центральной нервной системы, наблюдаемых у пациентов с длительным течением гипопаратиреоза, остается не ясной. К симптомам относятся паркинсонизм (неврологическое двигательное расстройство, которое характеризуется тремором, брадикинезией, ригидностью и постуральной нестабильностью) и дистония (неврологическое двигательное расстройство, ассоциированное с выгибаниями или аномальными фиксированными позами), отмечаемые при гипопаратиреозе, но встречающиеся гораздо реже, чем кальцификация базальных ганглиев [85, 86, 89]. Кроме того, противоречива связь между масштабом и локализацией кальцификатов и неврологической симптоматикой [90, 91].
Сердечно-сосудистая система. При гипопаратиреозе редко развиваются аритмии. У некоторых пациентов с хронической гипокальциемией, ассоциированной с гипопаратиреозом, отмечалось удлинение скорректированного интервала QT на ЭКГ наряду с заметными аномалиями зубцов U и Т [92]. Однако большинство из этих симптомов быстро исчезает после устранения гипокальциемии. Дилатационная кардиомиопатия, ассоциированная с хронической тяжелой гипокальциемией, обычно также исчезает после лечения [93]. Тем не менее, в недавнем обзоре клинического случая тяжелой гипокальциемии у младенца, предполагался необратимый компонент дилатационной кардиомиопатии, ассоциированной с гипокальциемий [94]. Несмотря на многочисленные сообщения о случаях, распространенность кардиомиопатии в когортах пациентов с гипотиреозом очень низка, что свидетельствует о наличии подгруппы уязвимых пациентов, факторы риска для которых пока не определены [13, 85].
Почки. Как правило, гипопаратиреоз обычно не ассоциирован с почечной недостаточностью даже среди пациентов с функциональными мутациями CASR, для которых при отсутствии лечения характерно развитие гиперкальциурии [63, 95]. Однако традиционная терапия гипопаратиреоза препаратами кальция и активными метаболитами витамина D обычно приводит к повышению экскреции кальция с мочой, поскольку угнетает его ПТГ-опосредованную реабсорбцию в дистальных канальцах нефрона. Развивающаяся в результате гиперкальциурия может стать причиной нефрокальциноза и камней в почках (рис. 5с). По имеющимся данным, частота нефрокальциноза у пациентов с гипопаратиреозом, находящихся на лечении препаратами кальция или витамином D, составляет 12–57 % [63, 96, 97]. В крупном датском исследовании типа «случай-контроль» соотношение рисков образования камней в почках составило 4,82 (95 %; ДИ 2,00–11,64) для пациентов с послеоперационным гипопаратиреозом [13]. При традиционном лечении гипопаратиреоза у пациентов повышается риск хронической болезни почек. В когорте из США [85] у 41 % пациентов скорость клубочковой фильтрации (СКФ) составила < 60 мл/мин/1,73 м² (при норме СКФ ≥ 90 мл/мин/1,73 м²), что в 2–17 раз превышало нормальные значения. В двух датских исследованиях типа «случай-контроль» [8, 13] соотношение рисков для диагностированной почечной недостаточности составляло 3,1 (95 % ДИ: 1,73–5,55) и 6,01 (95 % ДИ: 2,45–14,75) для пациентов с послеоперационным и нехирургическим гипопаратиреозом соответственно, в сравнении с контрольной группой того же возраста.
Скелетно-мышечная и зубочелюстная системы. Гипопаратиреоз ассоциирован с ослаблением ремоделирования кости (активный процесс, объединяющий образование кости и ее резорбцию), которое сочетается с нормальной или повышенной минеральной плотностью кости и деформацией микроархитектуры кости [98, 99]. Уменьшение процессов формирования кости подтверждается выраженным снижением числа тетрациклиновых меток в костных биоптатах в сравнении с контролем [100–102]. Частота активации (показывает, сколько раз в год на определенном участке кости происходит остеогенез) снижается на 50–80 % у пациентов с гипопаратиреозом в сравнении с контрольной группой. В дополнение к общему ослаблению ремоделирования кости, снижается глубина и количество резорбционных углублений, что говорит об ослаблении резорбции кости. Скорость остеогенеза, поверхность и ширина остеоида (неминерализованного костного матрикса) постепенно и значительно уменьшаются. Снижение скорости костеобразования отражается в снижении уровней минерализации поверхности и аппозиции минералов. При гипопаратиреозе ослабление ремоделирования костной ткани приводит к ситуации, когда после завершения каждого цикла ремоделирования костная ткань в большей степени осаждается, а не удаляется [99]. Это наблюдение объясняет увеличение минеральной плотности кости и толщины коркового слоя, о которых сообщалось в некоторых исследованиях. Данные скелетные аномалии обнаруживаются в трабекулярной и кортикальной костной ткани, а изменения подтверждаются в ходе микроКТ костных биоптатов [103, 104]. У пациентов с гипопаратиреозом нехирургической этиологии может поражаться зубочелюстная система, что сопровождается укорочением корней, гипоплазией эмали и гипоплазией или полным отсутствием зубов [105, 106].
Остается неясной связь ассоциированных с гипопаратиреозом скелетных аномалий и остеопороза. В датском исследовании типа «случай-контроль» [8, 13] в сравнении с общей популяцией не было обнаружено различий в частоте переломов. Анализ конкретных типов переломов показал, что у пациентов с нехирургическим гипопаратиреозом повышен риск переломов верхних конечностей в сравнении с контрольной группой (1,94; 95 % ДИ 1,31–2,85), а также что у пациентов с послеоперационным гипопаратиреозом риск подобных переломов ниже (0,69; ДИ 0,49–0,97) [9]. В некоторых сообщениях о случаях заболевания гипопаратиреоз также ассоциировался со спондилоартропатией, для которой характерна оссификация связок и образование синдесмофитов [107]. В одной небольшой серии случаев сообщалось о наличии клинически очевидной спондилоартропатии у 3 из 40 пациентов с гипопаратиреозом, причем радиологические изменения были идентифицированы у 14 из 40 [108].
Для миопатии скелетных мышц характерны высокие уровни креатинфосфокиназы и гистологические аномалии в биоптатах мышц; миопатия также наблюдается при гипопаратиреозе и, видимо, опосредована тяжелой гипокальциемией [109, 110]. У пациентов с гипопаратиреозом в сравнении с контрольной группой, схожей с ними по возрасту и полу, значительно снижается мышечная сила и максимальное мышечное усилие, а также им требуется больше времени для выполнения тестов на физические функции [111].
Зрительная система. Гипопаратиреоз ассоциирован с высоким риском катаракты, распространенность которой составляет 27–55 % [112–114]. В датском исследовании типа «случай-контроль» нехирургический гипопаратиреоз был ассоциирован с повышенным риском (95 % ДИ 2,13–8,34) в сравнении с контрольной группой, но риск катаракты у пациентов с послеоперационным гипопаратиреозом не отличался существенным образом от риска в общей популяции. Это свидетельствует о том, что возраст начала заболевания и/или длительность течения гипопаратиреоза являются важными факторами [8, 13]. В недавнем исследовании типа «случай-контроль» пациентов с катарактой, лица с гипопаратиреозом были значительно младше обычных пациентов с этим заболеванием, а также имели признаки более тяжелого поражения задней капсулы хрусталика (мембраны, которая окружает хрусталик) и большую скорость поражения передней капсулы [114]. Кроме того, преимущественно гипопаратиреоз ассоциирован с кортикальной катарактой (постепенное помутнение, начинающееся с периферии хрусталика), тогда как «возрастные» катаракты преимущественно являются ядерными (постепенное помутнение центральной части хрусталика) [113]. Этиология катаракты неизвестна, но доклинические исследования показывают, что она может быть следствием хронической гипокальциемии [115]. Папиллоэдема (отек соска диска зрительного нерва из-за повышенного внутричерепного давления) также может наблюдаться у пациентов с гипопаратиреозом и обычно улучшается после коррекции гипокальциемии [116].
Кожа и ее производные. Гипопаратиреоз воздействует на кожу и ее производные. Обычно отмечается сухость, шелушение кожи, а ногти зачастую становятся ломкими, происходит онихолизис (отделение ногтя от ногтевого ложа) [117]. Волосы на волосистой части головы, в подмышечной области и на лобке могут быть волнистыми и тонкими [117]. В многочисленных клинических случаях описан редкий и тяжелый тип псориаза (генерализованный пустулезный псориаз, ассоциированный с пузырьковыми высыпаниями). Во всех случаях пустулезный псориаз был ассоциирован с тяжелой гипокальциемией, а его симптомы уменьшались после лечения гипокальциемии [118, 119].
Психическая сфера. Гипопаратиреоз ассоциирован с высоким риском психических заболеваний [120]. В датской когорте риск госпитализации по поводу психических расстройств, таких как депрессия или биполярное аффективное расстройство, был значительно выше у пациентов с послеоперационным (коэффициент рисков: 2,01; 95 % ДИ 1,16–3,50) и нехирургическим гипопаратиреозом (коэффициент рисков: 2,45; 95 % ДИ: 1,78–3,35) в сравнении с контрольной группой, сходной по возрасту и полу [9].
