Аннотация
Гипопаратиреоз — это заболевание, характеризующееся низкими циркулирующими концентрациями паратиреоидного гормона (ПТГ), недостаток которого приводит к снижению концентрации кальция и повышению концентрации фосфора в крови. Вызванное гипокальциемией повышение нервно-мышечной проводимости обуславливает симптомы гипопаратиреоза, включающие ощущение покалывания, мышечные спазмы и судороги. Самая распространенная причина этого заболевания — случайное повреждение или удаление паращитовидных желез в ходе операций на шее, реже оно вызывается генетическими, идиопатическими или аутоиммунными причинами. Традиционная схема лечения включает активные метаболиты витамина D и/или препараты кальция, но при подобной терапии не происходит полного замещения всех функций ПТГ, что может вызывать осложнения как в ранние сроки (например, гипокальциемия, гиперкальциемия, повышение почечной экскреции кальция), так и в долгосрочной перспективе (например, нефрокальциноз, мочекаменная болезнь и формирование кальцификатов в головном мозге). Новым вариантом лечения стала заместительная терапия ПТГ. В ходе клинических испытаний с максимальной продолжительностью исследований до 6 лет было показано, что лечение препаратами человеческого ПТГ(1–34) и ПТГ(1–84) безопасно и эффективно. Рекомбинантный человеческий ПТГ(1–84) был одобрен для лечения гипопаратиреоза в США и Европе, однако его влияние на развитие осложнений в долгосрочной перспективе все еще оценивается. В опубликованных клинических руководствах специалистами единогласно признается необходимость продолжения исследований для оптимизации лечения. В этой статье обобщаются имеющиеся знания о распространенности, патофизиологии, клинической картине гипопаратиреоза и ведении пациентов с данным заболеванием.
Гипопаратиреоз — это заболевание, которое характеризуется полным отсутствием или неадекватным снижением концентрации циркулирующего паратиреоидного гормона (ПТГ), что приводит к гипокальциемии, гиперфосфатемии и повышению выделения кальция с мочой [1, 2]. Наиболее частой причиной заболевания является удаление или повреждение паращитовидных желез в ходе операций на области шеи, например, при тотальной тиреоидэктомии или радикальной диссекции шеи при злокачественных новообразованиях головы и шеи. Другими этиологическими факторами являются аутоиммунные, генетические и очень редко — инфильтративные заболевания (такие как гемохроматоз, болезнь Вильсона — Коновалова и метастазирование) [3, 4]. Открытие множества генетических дефектов, ответственных за развитие гипопаратиреоза, позволило понять физиологию паращитовидных желез. К этим дефектам относятся мутации приобретения функций, которые влияют на внеклеточный кальций-чувствительный рецептор (CaSR) или на гуанин-нуклеотид-связывающий белок 11α (G11α), и мутации потери функций, воздействующие на основные факторы транскрипции или непосредственно на ПТГ [2].
Клинические проявления варьируют от легкой формы заболевания с парестезией (чувство жжения или покалывания) и мышечными судорогами до тяжелых симптомов, таких как ларингоспазм (спазм голосовых связок) и судорожные приступы [2]. Несмотря на то, что на сегодняшний день стандартом лечения является традиционная схема терапии активными метаболитами витамина D и пероральными препаратами кальция, они замещают функции ПТГ не полностью и их прием приводит к отдаленным осложнениям, таким как внескелетная кальцификация. Особое беспокойство вызывает происходящая при отсутствии ПТГ потеря кальция с мочой, которая в перспективе провоцирует развитие нефрокальциноза (кальцификации почечной паренхимы) и нарушения функции почек. Кроме того, результаты ряда клинических исследований показали снижение качества жизни пациентов с гипопаратиреозом. Все это указывает на необходимость появления новых методов лечения. До недавнего времени гипопаратиреоз оставался одним из немногих классических эндокринных дефицитных состояний, для которых не существовало заместительной терапии соответствующим гормоном. Однако клинические испытания продемонстрировали эффективность ПТГ при лечении гипопаратиреоза, что позволило зарегистрировать рекомбинантный человеческий паратиреоидный гормон (рчПТГ(1–84)) как препарат для терапии гипопаратиреоза в США и Евросоюзе и способствовало исследованию новых методов лечения и ранее неизвестных аналогов ПТГ [5, 6]. По мере все более широкого применения современной терапии, решающее значение будут иметь оценка эффективности контроля над заболеванием, появление отдаленных осложнений и качество жизни пациентов.
Эпидемиология
По имеющимся оценкам, распространенность гипопаратиреоза в США, Дании и Италии относительно схожа и составляет 23–37 случаев на 100 000 населения [3], однако в некоторых других странах отмечается более низкая распространенность [7]. Различия между странами могут объясняться различиями в хирургических подходах, поскольку в большинстве случаев заболевание развивается после операции. Необходимы дальнейшие исследования, которые позволили бы оценить распространенность и заболеваемость гипопаратиреозом не только в США и Европе, поскольку данных о проведении таких исследований из Южной Америки, Азии, Африки и Австралии не поступало. Хотя распространенность наследственных форм гипопаратиреоза у женщин и мужчин примерно одинакова [8], послеоперационный гипопаратиреоз чаще встречается у женщин [9], поскольку женщины более склонны к заболеваниям щитовидной железы и, как следствие, чаще подвергаются тиреоидэктомии [10].
Северная Америка
Наилучшая оценка распространенности гипопаратиреоза в Северной Америке основывается на анализе большой базы данных медицинского страхования США за период 12 месяцев 2007–2008 годов [11]. Распространенность гипопаратиреоза в популяции оценивается в 59 000 взрослых, имеющих медицинскую страховку, и всего в 77 000 взрослых в США. Альтернативный подход, основанный на частоте оперативных вмешательств на области шеи и распространенности хронического гипопаратиреоза как хирургического осложнения с использованием той же базы данных, позволил сформулировать аналогичные выводы [11]. Еще одна оценка распространенности гипопаратиреоза, представлена в кратком изложении и основана на результатах лонгитюдного популяционного Ротчестерского эпидемиологического проекта. Средства медицинской статистики использовались для идентификации всех лиц, проживающих в округе Олмстед, Миннесота, США в 2009 году (средний возраст и стандартное отклонение = 58 ± 20 лет; 71 % женщин), у которых был диагностирован гипопаратиреоз любой этиологии в период с 1945 года по настоящее время [12]. Было выявлено 54 случая гипопаратиреоза, что позволило подсчитать распространенность, составившую 37 на 100 000 населения. Подобная распространенность прогнозирует наличие в США примерно 115 000 лиц больных гипопаратиреозом любой этиологии. В изученной базе данных гипопаратиреоз, развившийся после операций на области шеи составлял 78 % случаев, по другим вторичным причинам — 9 %, как наследственное заболевание был выявлен в 7 % случаев и в 6 % был идиопатическим.
Европа
Для оценки распространенности гипопаратиреоза в Дании использовался Датский национальный реестр пациентов [8, 9, 13]. В этих исследованиях также оценивали смертность и коморбидность, сопоставляя схожих по возрасту и полу пациентов с гипопаратиреозом и контрольную группу. Было выявлено 1849 лиц с послеоперационным гипопаратиреозом и 180 с гипопаратиреозом нехирургической этиологии. Предполагаемая распространенность послеоперационного гипопаратиреоза составила 22 на 100 000 населения, а нехирургического — 2,3 на 100 000 населения. Заболеваемость послеоперационным гипопаратиреозом составила 0,8 на 100 000 человеко-лет [13]. В послеоперационных случаях операции были выполнены по следующим показаниям: злокачественное новообразование (чаще всего рак щитовидной железы) в 30 %, нетоксический зоб (нормальная активность, неонкогенная гипертрофия щитовидной железы) в 37 %; токсический зоб (гиперфункция щитовидной железы) в 25 % и первичный гиперпаратиреоз в 8 % [13]. Распространенность гипопаратиреоза в Норвегии приблизительно в два раза ниже, чем в Дании, и составляет 10,2 на 100 000 населения [5]. Средняя частота госпитализаций по поводу гипопаратиреоза в Италии составила 5,9 на 100 000 человек за год [14].
Механизмы/патофизиология
Для гипопаратиреоза характерно отсутствие или крайне низкие уровни ПТГ, ключевого гормона минерального гомеостаза, в крови. Наиболее распространенной причиной является удаление или повреждение паращитовидных желез в ходе операции. Другими причинами являются аутоиммунные заболевания или генетические нарушения, влияющие на формирование железы или биосинтез и высвобождение ПТГ.
ПТГ и минеральный гомеостаз
Паращитовидные железы контролируют гомеостаз внеклеточного кальция путем секреции ПТГ (рис. 1). В клетках паращитовидных желез ПТГ синтезируется как 115-аминокислотный пептид-предшественник (препроПТГ(1–115)), который позднее модифицируется в полноценный ПТГ, состоящий из 84 аминокислот (ПТГ(1–84)). ПТГ запасается в секреторных гранулах и выбрасывается из паращитовидных желез при уменьшении концентрации ионизированного кальция в циркулирующей крови. Эти изменения улавливаются CaSR — рецептором, связанным с G-белком, который в больших количествах экспрессируется на поверхности клеток паращитовидных желез [15]. Снижение уровней внеклеточного кальция уменьшает передачу сигнала от CaSR посредством G11α и Gqα, что индуцирует заметное повышение высвобождения ПТГ из паращитовидных желез. Секретируемый ПТГ в циркулирующей крови воздействует на связанный с G-белком рецептор ПТГ1 (PTH1R, ПТГ1Р) [16] в костях и почках, повышая плазменные уровни кальция, что приводит к ингибированию секреции ПТГ паращитовидными железами по типу обратной связи [15].
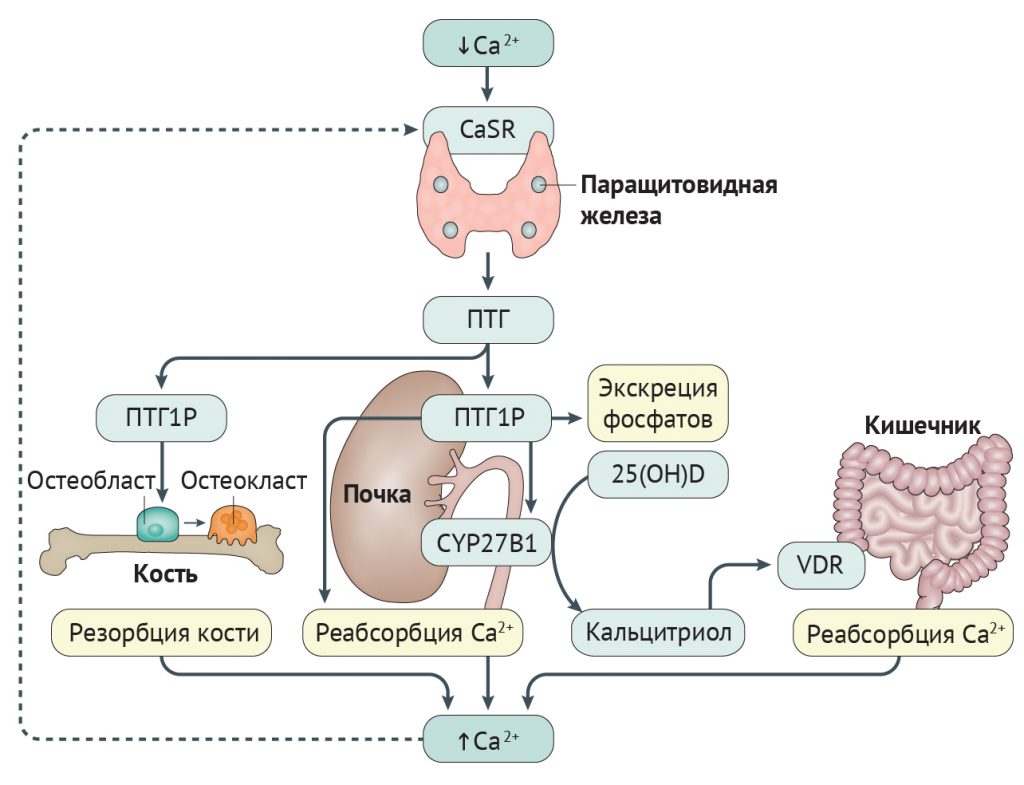
Рисунок 1 | Регуляция внеклеточного обмена кальция Ослабление активации внеклеточного кальций-чувствительного к рецептора (CaSR) из-за снижения уровней кальция внутри клетки приводит к быстрому повышению секреции паратиреоидного гормона (ПТГ). ПТГ воздействует на рецептор ПТГ1 (ПТГ1Р) в почках и костях. В костях ПТГ1Р активирует остеобласты (клетки, формирующие кость) и остеоциты (дифференцированные остеобласты, которые проникают в костный матрикс и принимают участие в регуляции активности остеобластов и остеокластов [клетки, обеспечивающие резорбцию кости] и обмене фосфатов). Это приводит к высвобождению цитокинов, которые стимулируют активность остеокластов, усиливающих резорбцию кости, что, в свою очередь, приводит к высвобождению кальция из скелета [16]. В почках ПТГ усиливает канальцевую реабсорбцию кальция, экскрецию фосфатов и активирует фермент 25-гидроксивитамин-D-1-α‑гидроксилазу (CYP27B1), который способствует превращению предшественника 25(ОН)D в активный метаболит 1,25-дигидроксивитамин D (также известный как кальцитриол). Кальцитриол воздействует на кишечник через рецептор к витамину D (белок VDR), увеличивая абсорбцию кальция из продуктов питания [19]. Опосредуемое ПТГ повышение уровней кальция и кальцитриола воздействует на паращитовидные железы, ингибируя секрецию ПТГ посредством обратной связи (обозначено пунктиром) [15].
При развитии гипопаратиреоза отсутствие или низкий уровень ПТГ приводят к гипокальциемии, поскольку нарушается активность остеокластов, что уменьшает высвобождение кальция из кости, усиливается экскреция кальция с мочой и происходит ингибирование синтеза кальцитриола в почках, из-за чего ухудшается абсорбция кальция в кишечнике [19]. В результате дефицита ПТГ увеличивается реабсорбции фосфатов канальцевым аппаратом почек, ведущая к гиперфосфатемии. У пациентов с гиперпаратиреозом была выявлена связь между повышением уровня FGF23 в сыворотке крови и хронической гиперфосфатемией [20].
ПТГ также принимает участие в гомеостазе магния. ПТГ усиливает реабсорбцию магния в почках [21], в то время как тяжелая и продолжительная гипомагнезиемия приводит к развитию гипокальциемии вследствии ингибирования секреции ПТГ и развития резистентности к ПТГ в органах-мишенях [22, 23]. Гипермагнезиемия также может приводить к ингибированию высвобождения ПТГ через активацию CaSR, что способствует развитию гипокальциемии [24, 25].
Послеоперационный гипопаратиреоз
Операции в области шеи — наиболее распространенная причина приобретенного гипопаратиреоза, которая составляет около 75 % от всех случаев гипопаратиреоза [3]. К хирургическим вмешательствам, ассоциированным с развитием гипопаратиреоза, относятся тотальная тиреоидэктомия или радикальная диссекция шеи при злокачественных опухолях головы и шеи. Также причинами гипопаратиреоза могут быть случайное удаление железы, интраоперационная травматизация паращитовидных желез или деваскуляризация железы. К гипопаратиреозу может приводить и паратиреоидэктомия, направленная на удаление, например, одной или нескольких опухолей паращитовидных желез [1, 3, 26].
Транзиторным послеоперационным гипопаратиреозом называют состояние, сопровождающееся полным отсутствием или снижением уровня ПТГ продолжительностью менее шести месяцев, которое развивается у 25–30 % пациентов, перенесших тотальную тиреоидэктомию, тогда как постоянный послеоперационный гипопаратиреоз (длительностью более шести месяцев) развивается лишь у 3 % пациентов [27]. К независимым прогностическим факторам транзиторного гипопаратиреоза после тиреоидэктомии относятся: низкие предоперационные уровни ПТГ, сывороточного кальция и 25-гидроксивитамина D (25(OH)D), аутотрансплантация (реимплантация паращитовидной железы в ткани шеи или предплечья после операций на области шеи) одной или нескольких паращитовидных желез и длительная операция [28]. К факторам риска постоянного гипопаратиреоза после операции на щитовидной железе относятся: степень хирургического вмешательства; диагностированная перед операцией болезнь Грейвса (аутоиммунное заболевание, которое сопровождается гиперфункцией щитовидной железы); невозможность идентифицировать ≥ 2 паращитовидных желез в ходе операции; уровень сывороточного кальция ≥ 1,88 ммоль/л (7,5 мг/дл [норма: 2,12–2,62 ммоль/л или 8,5–10,5 мг/дл]) в течение 24 часов после операции; повторное вмешательство по поводу кровотечения [28]. В редких случаях послеоперационный гипопаратиреоз может дать о себе знать спустя годы после операции в области шеи [29]. Механизм, лежащий в основе этого явления, до конца не выяснен, но причиной могут быть опосредованные возрастом эффекты измененной васкуляризации небольшого количества оставшейся после операции ткани паращитовидных желез [1].
Генетические причины гипопаратиреоза
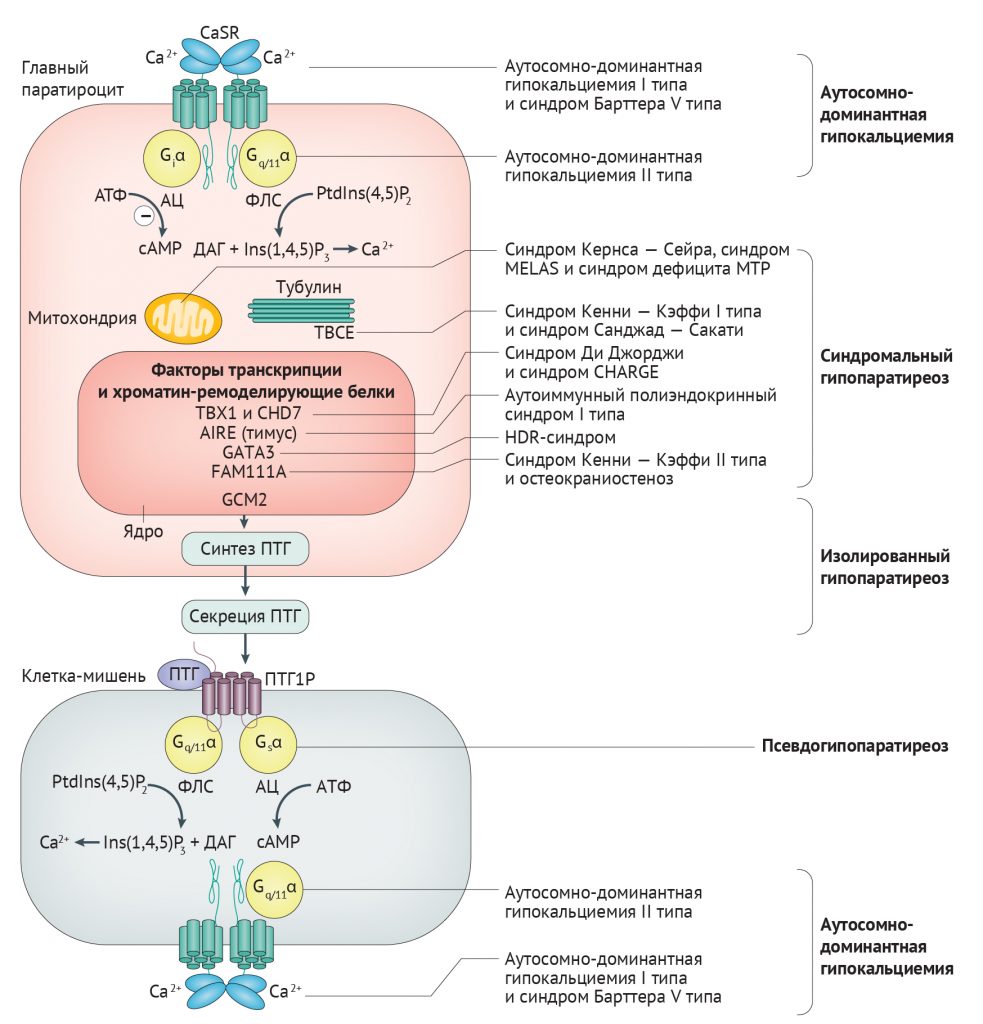
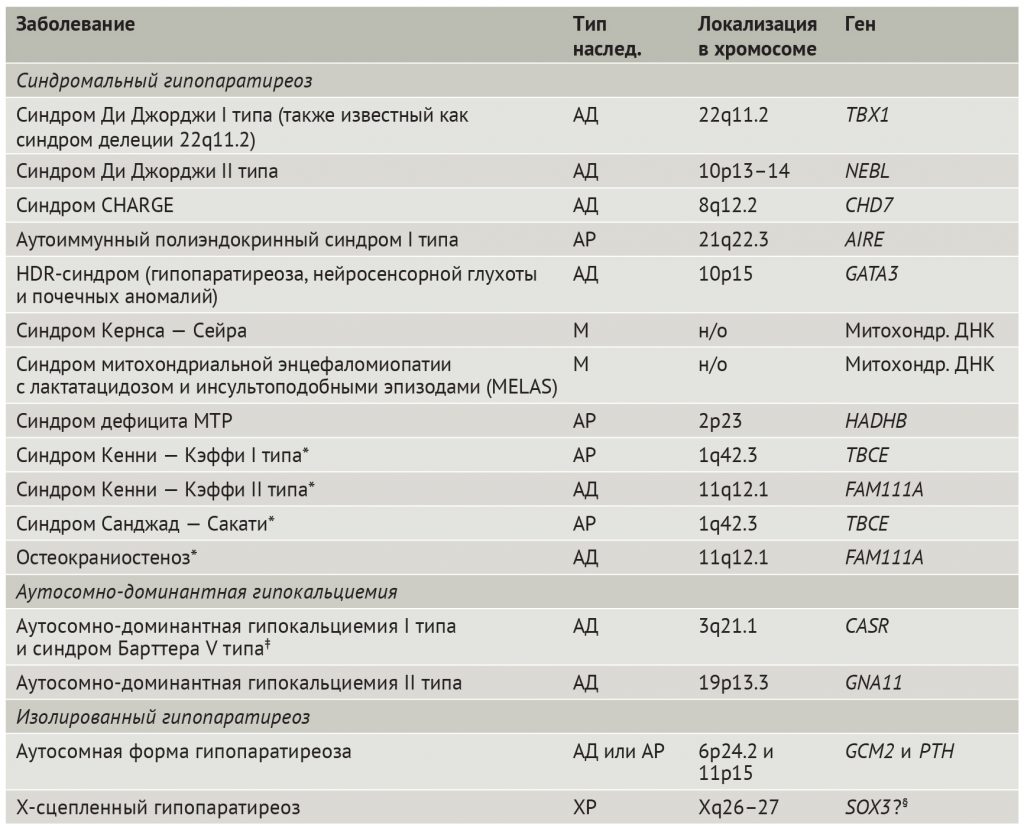
Гипопаратиреоз имеет генетическую этиологию менее чем в 10 % случаев [3]. Однако хромосомные микроделеции и моногенные аномалии являются наиболее частыми причинами гипопаратиреоза у детей [30]. Генетические формы гипопаратиреоза встречаются в виде компонентов синдромальных расстройств, одиночной эндокринопатии (изолированный гипопаратиреоз) или в виде аутосомно-доминантной гипокальциемии, которая может считаться отдельным типом гипопаратиреоза (табл. 1). Генетические формы резистентности к ПТГ (модуль 1) — отдельной группы состояний, называемых псевдогипопаратиреозом — не рассматриваются в этой статье.
Модуль 1 | Псевдогипопаратиреоз
Псевдогипопаратиреоз — это нарушение, связанное с резистентностью к паратиреоидному гормону (ПТГ). Хотя оно также приводит к гиперкальциемии и гиперфосфатемии, концентрации ПТГ в циркулирующей крови повышаются, что отличает это состояние от гипопаратиреоза. Основными причинами псевдогипопаратиреоза являются генетические или эпигенетические мутации в GNAS — импритинговом гене, кодирующем α‑субъединицу (Gsα) гуанин-нуклеотид-связывающего стимулирующего белка (Gs), и варианты его сплайсинга (рис. 2) [167]. Gsα кодируется 1–13 экзонами GNAS и биаллельно экспрессируется в большинстве тканей, но в некоторых тканях, к которым относятся проксимальные почечные канальцы и щитовидная железа, экспрессия материнской аллели снижается или совсем отсутствует. Гетерозиготные инактивирующие мутации на материнской аллели GNAS приводят к развитию псевдогипопаратиреоза Iа типа. В дополнение к резистентности к ПТГ, у пациентов с гипопаратиреозом Iа типа отмечаются признаки наследственной остеодистрофии Олбрайта (НОО), в том числе низкий рост, ожирение, округлое лицо, подкожные кальцификаты и брахидактилия (укорочение пальцев рук или ног) [167]. Может развиться резистентность к другим гормонам, воздействующим через Gs, например к тиреотропному гормону (ТТГ) и соматотропному-рилизинг гормону. Напротив, мутации GNAS, унаследованные от отца, вызывают псевдопсевдогипопаратиреоз, который характеризуется фенотипом НОО, но без ожирения, нейрокогнитивных аномалий и резистентности к гормонам. Для псевдогипопаратиреоза Ib типа характерны дефекты метилирования GNAS, которые приводят к резистентности к ПТГ, а иногда и к ТТГ [167–169]. Аутосомно-доминантный псевдогипопаратиреоз Ib типа может быть вызван материнскими делециями экзонов AS3–4 GNAS и/или NESP (который кодирует нейроэндокринный секреторный протеин 55 [NESP55; часть общего локуса GNAS]) или близлежащего гена синтаксина 16 (STX16), но молекулярный дефект наиболее распространенной спорадической формы заболевания до сих пор неизвестен. Аномалии кодирующей области GNAS также приводят к развитию псевдогипопаратиреоза Iс типа, который клинически схож с Iа типом, хотя активность Gs и не изменяется in vitro [170]. В отличие от пациентов с псевдогипопаратиреозом Iа и IIb типов, у которых ответ цАМФ на ПТГ притупляется, у пациентов с псевдогипопаратиреозом II типа отмечается обычный ответ. Псевдогипопаратиреоз II типа в некоторых случаях может развиваться при дефиците витамина D [171]. Поскольку в дистальном почечном канальце Gs экспрессируется обоими аллелями, реабсорбция кальция в дистальных трубочках нормальная, и у пациентов с псевдогипопаратиреозом отсутствует риск нефрокальциноза. Лечение резистентности к ПТГ при псевдогипопаратиреозе состоит из активных форм витамина D и препаратов кальция, но цели отличаются от таковых при гипопаратиреозе. В данном случае это нормализация уровня кальция в крови и поддержание уровня ПТГ в нормальном или в незначительно превышающем норму диапазоне. Необходим регулярный контроль показателей крови и периодическое исследование экскреции кальция с мочой.
Рисунок 2 | Обзор регуляции синтеза, секреции и активности ПТГ и ассоциированных генетических нарушений Изменение концентрации внеклеточного кальция распознается кальций-чувствительным рецептором (CaSR), который экспрессируют клетки паращитовидных желез, почек и костей. CaSR воздействует через гуанин-нуклеотид-связывающий протеин q/11α (Gq/11α), стимулирующий фосфолипазу С (ФЛС), которая катализирует гидролиз фосфотидилинозитол-4,5-бисфосфата (PtdIns(4,5)P2) в инозитол-1,4,5-трифосфат (Ins(1,4,5)P3), тем самым повышая уровень кальция внутри клетки. CaSR также воздействует через Giα протеин, который ингибирует аденилатциклазу (АЦ), что приводит к уменьшению образования цАМФ из АТФ. В клетках паращитовидной железы эти проксимальные сигналы модулируют нисходящие пути, которые изменяют синтез и секрецию паратиреоидного гормона (ПТГ). Секретируемый ПТГ воздействует на рецептор ПТГ1 (ПТГ1Р) в чувствительных тканях, которые обладают Gs и Gq/11α белками. У пациентов с генетическими формами гипопаратиреоза были выявлены аномалии в некоторых генах и кодируемых ими белках в путях, связанных с чувствительностью к кальцию и функцией G-белка, активностью митохондрий и образованием тубулина, а также с транскрипцией генов и ремоделированием хроматина [19]. AIRE — аутоиммунный регулятор; CHD7 — хромодомен ДНК-связывающей геликазы 7; DAG — диацилглицерол; GATA3 — GATA-связывающий фактор 3; GCM2 — гомолог отсутствия глиальных клеток 2; HDR — гипопаратиреоз, нейросенсорная глухота и аномалии почек; MELAS — митохондриальная энцефаломиопатия с лактатацидозом и инсультоподобными эпизодами; MTP — митохондриальный трифункциональный белок; TBCE — тубулин-специфический шаперон E; TBX1 — фактор транскрипции T-box, brain 1
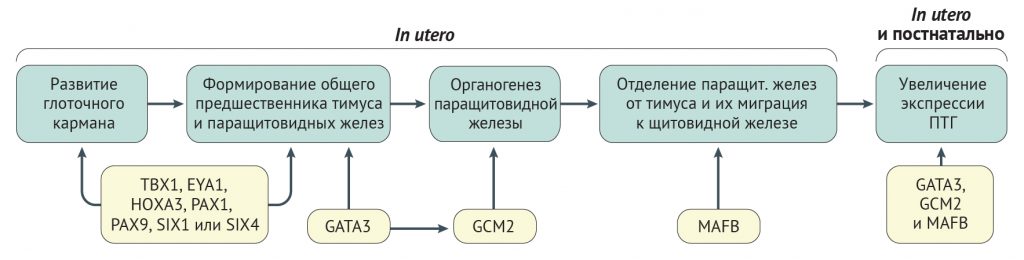
Синдром Ди Джорджи. Синдром Ди Джорджи встречается примерно у 60 % детей с проявлениями гипопаратиреоза [30]. Синдром включает гипопаратиреоз, пороки развития выходных отделов сердца, дисморфизм лица, психические заболевания, дисфункцию неба и гипоплазию тимуса [31]. Синдром Ди Джорджи чаще всего развивается в результате гетерозиготной микроделеции 3 миллионов пар оснований в хромосоме 22q11.2 [31], обозначается как I тип синдрома Ди Джорди (также известен как синдром делеции 22q11.2) (табл. 1). Область делеции захватывает ген TBX1, кодирующий фактор транскрипции T-box, brain 1 (белок TBR1), участвующий в развитии паращитовидных желез и тимуса из эмбриональной глоточной области (рис. 2, 3) [32]. Аномалии в функционировании ТВХ1 объясняют все основные фенотипические черты синдрома Ди Джорджи I типа [33].
Таблица 1 | Наследственные формы гипопаратиреоза
АД — аутосомно-доминантный; АР — аутосомно-рецессивный; М — по материнской линии; н/о — не определено; ПТГ — паратиреоидный гормон; ХР — Х-сцепленный рецессивный.
*Дисплазия костей и низкий рост.
‡ Синдром Барттера V типа — это разновидность аутосомно-доминантной гипокальциемии I типа.
§ Роль гена SOX3 в развитии Х-сцепленного гипопаратиреоза неизвестна.У некоторых пациентов встречается делеция короткого плеча хромосомы 10, обозначенная как синдром Ди Джорджи II типа [19]. Вероятно, за это расстройство ответственна делеция гена, кодирующего актин-связывающий белок небулин (NEBL) (табл. 1) [34], но как дефицит NEBL сказывается на развитии гипопаратиреоза, пока неясно.
Также у некоторых пациентов с синдромом Ди Джорджи встречаются признаки, характерные для синдрома CHARGE: колобома (расщепление одной или нескольких структур глаза), аномалии развития сердца, атрезия хоан (врожденная аномалия носового дыхания), замедление роста и аномалии мочеполовой системы и/или слуха [35]. CHARGE-синдром развивается в результате гетерозиготных мутаций в хромодомене ДНК-связывающей хеликазы 7 (CHD7) (табл. 1) [35], которая экспрессируется клетками глоточной эктодермы [36] и, возможно, играет роль в развитии глоточной области.
Аутоиммунный полиэндокринный синдром I типа. Аутоиммунный полиэндокринный синдром I типа, который также называют синдромом аутоиммунной полиэндокринопатии, кандидоза и эктодермальной дистрофии, представляет собой аутосомно-рецессивное заболевание, которое характеризуется иммунодефицитом и аутоиммунной деструкцией таких эндокринных органов, как паращитовидные железы, кора надпочечников и яичников (рис. 2, табл. 1) [37]. Аутоиммунный полиэндокринный синдром I типа вызывают мутации в аутоиммунном регуляторе (AIRE). Белок AIRE экспрессируется эпителиальными клетками мозгового вещества тимуса [38] и способствует развитию иммунологической толерантности к собственным антигенам путем удаления клонов аутореактивных Т-клеток в тимусе [39]. Клинически аутоиммунный полиэндокринный синдром I типа определяется наличием как минимум двух компонентов триады, которая включает кандидоз кожи и слизистых (инфицирование Candida spp. кожи, слизистых оболочек или ногтей), гипопаратиреоз и недостаточность коры надпочечников [40]. Однако заболевание также может быть ассоциировано с разнообразными аутоиммунными нарушениями, такими как гонадная недостаточность, алопеция, пернициозная анемия, витилиго и сахарный диабет I типа, а может проявляться лишь изолированным гипопаратиреозом [41]. У пациентов могут быть такие признаки эктодермальной дистрофии, как гипоплазия зубной эмали [42], а также повышенный риск развития рака полости рта [43].
Синдром гипопаратиреоза, нейросенсорной глухоты и почечных аномалий. Синдром гипопаратиреоза, нейросенсорной глухоты и почечных аномалий (HDR-синдром) — это аутосомно-доминантное заболевание, при котором у пациентов часто развивается гипокальциемия при неопределяемой, низкой или необъяснимо нормальной концентрации ПТГ в сыворотке крови [44, 45]. Кроме этого, HDR-синдром ассоциирован с билатеральной симметричной нейросенсорной глухотой и почечными аномалиями, которые в основном представлены кистами, сдавливающими клубочки и канальцы, что приводит к развитию почечной недостаточности [45]. Причиной развития HDR-синдрома являются гетерозиготные мутации в GATA-связывающем факторе 3 (GATA3) [46] у зародыша (табл. 1). Этот транскрипционный фактор, имеющий два домена типа «цинковые пальцы», опосредует экспрессию ПТГ (рис. 2) и участвует в эмбриональном развитии общих зачатков паращитовидных желез и тимуса (рис. 3) [47–50].
Рисунок 3 | Факторы транскрипции, участвующие в развитии и функционировании паращитовидных желез У людей паращитовидные железы развиваются из энтодермы третьего и четвертого глоточных карманов [48], тогда как у мышей они развиваются вместе с тимусом из энтодермы третьего глоточного кармана [48, 50]. Исследования на мышиных моделях показали, что группа факторов транскрипции опосредует развитие третьего глоточного кармана и формирование общего зачатка паращитовидных желез и тимуса [48, 50]. Эти факторы транскрипции действуют согласованно в пространстве и времени. Например, для развития третьего глоточного кармана необходим белок T-box 1 (TBX1), который экспрессируется клетками глоточной энтодермы [32], тогда как GATA-связывающий фактор 3 (GATA3), который экспрессируется клетками общих зачатков паращитовидных желез и тимуса позднее, чем TBX1, способствует дифференцировке и сохранению клеток-предшественниц паращитовидных желез и тимуса [47, 48]. Более того, GATA3 регулирует экспрессию гомолога отсутствия глиальных клеток 2 (GCM2), который экспрессируется паращитовидным доменом общего зачатка и опосредует начальные стадии органогенеза паращитовидных желез [47, 48]. Паратиреоидным доменом также экспрессируется фактор транскрипции MAFB, который облегчает отделение паращитовидных желез от тимуса и миграцию паращитовидных желез к щитовидной железе. GATA3, GCM2 и MAFB действуют синергично, что усиливает экспрессию паратиреоидного гормона (ПТГ) [49]. Поскольку экспрессия GATA3, GCM2 и MAFB сохраняется и у взрослых, вероятно, эти факторы транскрипции играют роль в постнатальной экспрессии ПТГ [49]. EYA1 — гомолог отсутствия глаз 1; HOXA3 — гомеобокс A3; PAX — белок, содержащий парный домен; SIX (Sine oculis homeobox homologue) — гомолог Sine oculis (so) Drosophila melanogaster c гомеобоксом.