Терапия путем направленного взаимодействия с PR: эффекты класса препаратов, клиническое применение, механизмы действия лигандов PR (SPRM)
В настоящее время существует большой клинический интерес к селективным модуляторам рецепторов прогестерона (selective progesterone receptor modulator, SPRM), группе соединений, воздействующих на PR. Эти соединения обладают терапевтическим потенциалом в отношении ряда нерешенных проблем доброкачественных новообразований в гинекологии [245]. Одним из наиболее значимых клинических эффектов SPRM является способность быстро вызывать аменорею (отсутствие кровотечения) с помощью механизмов, которые в основном остаются неизвестными (рис. 9А). Эндометрий является основной тканью-мишенью для SPRM. Существует целый ряд потенциальных действий этих препаратов: от чистого агонистического эффекта прогестерона и синтетических прогестинов до чистого антагонизма с синтетическими фармацевтическими препаратами, такими как онапристон. Некоторые соединения, включая азоприснил и мифепристон, демонстрируют смешанный частичный агонистический и антагонистический эффект (рис. 9B).
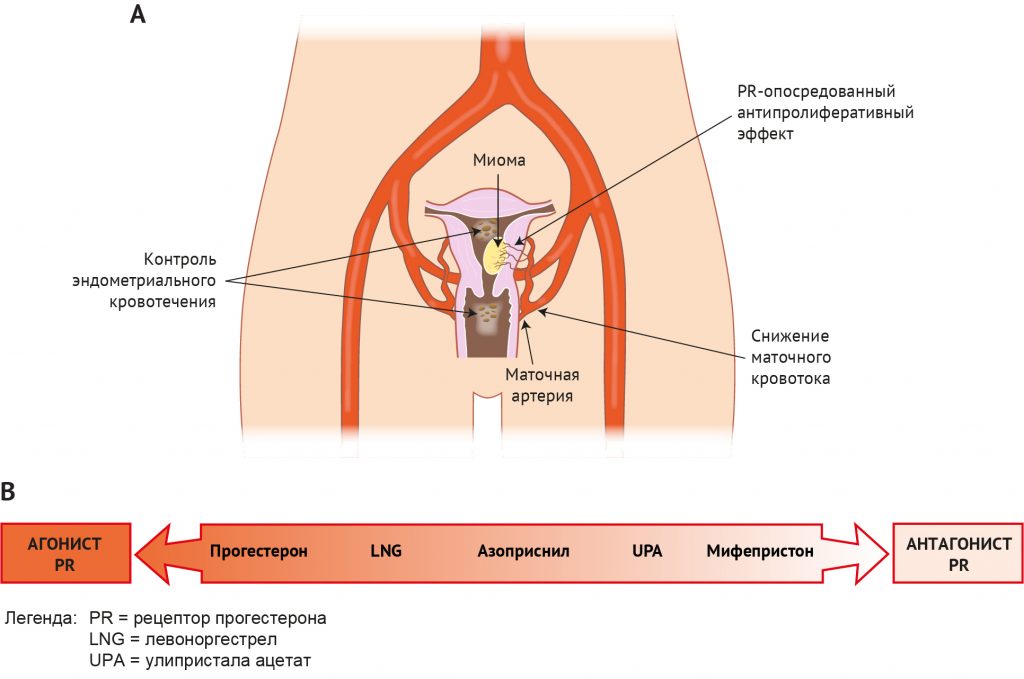
Physiological Reviews 2020.100:1149-1179 Рисунок 9 | Механизмы действия лигандов рецепторов прогестерона (селективных модуляторов рецепторов прогестерона; SPRM), которые влияют на эндометриальное кровотечение. А: контроль эндометриального кровотечения с помощью SPRM может быть осуществлен посредством 1) антипролиферативного действия SPRM на эндометрий; 2) ослабления кровотока в матке / эндометрии; и 3) нарушения комплексного взаимодействия между стромальными клетками эндометрия, клетками врожденного иммунитета и спиральными артериолами эндометрия (250). В: спектр модуляторов рецепторов прогестерона от агонистов до антагонистов. SPRM — это класс синтетических лигандов рецепторов прогестерона, оказывающих агонистическое, антагонистическое или смешанное воздействие на ткани-мишени прогестерона, например, на эндометрий.
Первым клинически разработанным SPRM стал мифепристон, применение которого, помимо медицинского прерывания беременности [236], возможно для экстренной контрацепции [99]; в качестве ежедневной пероральной контрацепции, не содержащей эстрогены [134]; в противозачаточных средствах длительного высвобождения [106]; а также при лечении миомы матки [215], эндометриоза и аденомиоза. Клиническая разработка зависела не только от демонстрации эффективности, но и от профиля безопасности: высказывалась озабоченность по поводу долгосрочных эффектов воздействия мифепристона на эндометрий, что, по сути, в настоящее время относится ко всем SPRM.
Влияние мифепристона на эндометрий зависит от дозы и продолжительности приема. При дозировке 10 мг/сут и более развитие фолликулов тормозится путем подавления гонадотропинов, а секреция эстрадиола в яичниках минимальна. В низких дозах (2 мг/сут или менее) мифепристон подавляет или задерживает овуляцию, не препятствуя развитию фолликулов, а уровень циркулирующих эстрогенов, как правило, находится в диапазоне, соответствующем середине фолликулярной фазы [14]. Таким образом, эндометрий подвергается воздействию свободного эстрогена, и в ранних исследованиях было высказано предположение, что это может привести к гиперплазии или карциноме эндометрия. Действительно, в ряде заключений у женщин были описаны эффекты [приема препарата], соответствующие гиперплазии эндометрия, с широко распространенным кистозным расширением желез и общим утолщением эндометрия [74, 171]. При очень высоких дозах (400 мг в сутки в течение 6 мес.) отмечалась массивная простая гиперплазия эндометрия, которая регрессировала при прекращении приема препарата [177].
Однако стало очевидно, что на самом деле ситуация была более сложной и что мифепристон и другие SPRM оказывают парадоксальное антипролиферативное действие именно на эндометрий. Первоначально это было изучено в экспериментах на приматах, и антипролиферативный эффект оказался специфичным для эндометрия [111, 253]. Клинические исследования показали, что в эндометрии женщин, принимавших SPRM, железистый эпителий выглядел как покоящийся или неактивный со сниженной митотической активностью, а кистозные железы больше походили на состояние постменопаузальной кистозной атрофии, чем гиперплазии [38, 61]. В клеточных линиях эндометрия также был описан антипролиферативный эффект [172, 208].
Митотическая активность в эндометрии запускается эстрогеном, а прогестерон оказывает ингибирующее действие, поэтому несколько парадоксально, что антипрогестины оказывают антипролиферативное действие на эндометрий. Даже при высоких концентрациях эстрогена SPRM способны подавлять пролиферацию эндометрия у самок приматов [219, 253] и у женщин [38]. Механизм этого действия неизвестен, и предлагаются такие объяснения, как подавление ER или ингибирование эстроген-индуцируемых протоонкогенов. Данные экспериментов на приматах позволяют предположить, что важную роль в этих эффектах могут играть рецепторы андрогенов (AR) в эндометрии. Эндометрий у самок приматов и женщин реагирует на терапию SPRM активацией экспрессии AR, и важно отметить, что у приматов антипролиферативное воздействие на эндометрий можно предотвратить путем введения антиандрогена флутамида [26].
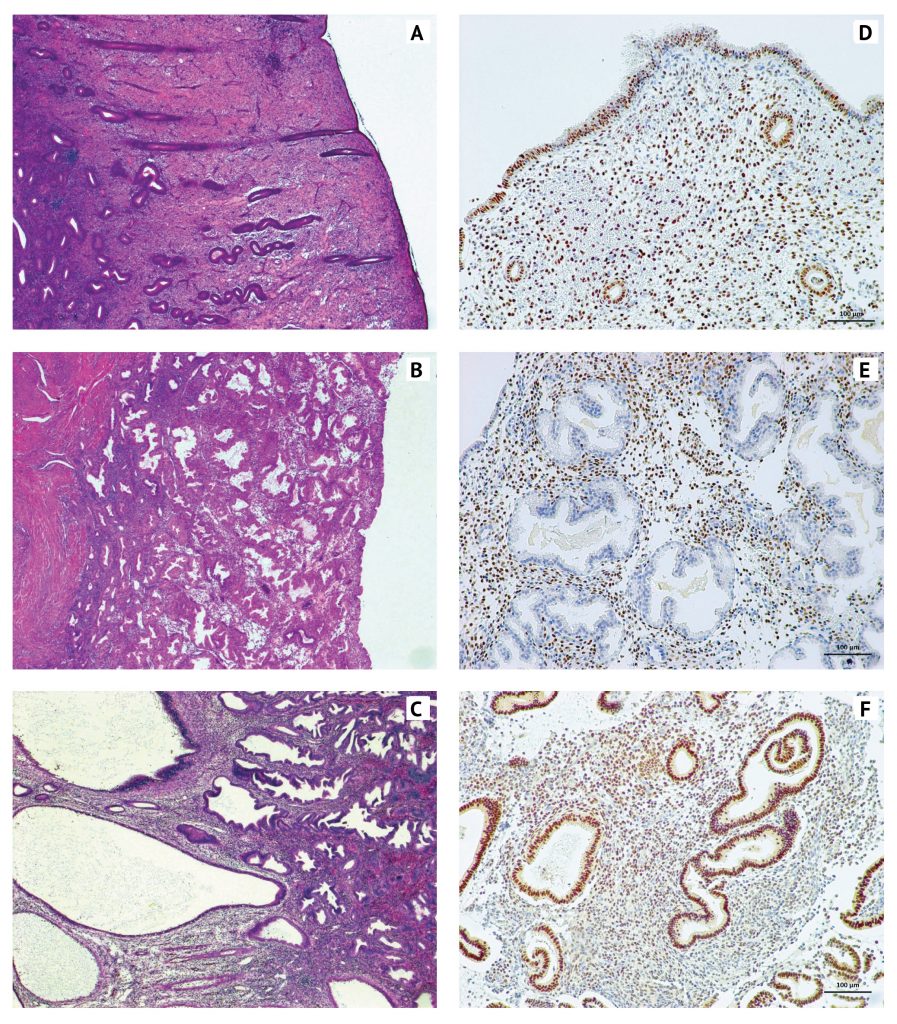
Стало ясно, что на лечение различными SPRM эндометрий реагирует примерно одинаковым образом, с незначительными особенностями для каждого препарата, которые, как полагают, зависят от степени агонистического / антагонистического воздействия на PR (рис. 9B). Морфологические изменения варьируют в зависимости от продолжительности лечения, однако удивительно схожи при лечении различными препаратами, назначаемыми на срок до 3 месяцев. Основным эффектом для желез эндометрия является их кистозное расширение, связанное с нарушением архитектуры желез. Для желез наблюдается нефизиологический секреторный эффект, который включает развитие выпячиваний апокринного типа в просвет матки и незавершенную вакуолизацию цитоплазмы. Характерно, что железистый эпителий выглядит спокойным, снижено число клеток с ядрами на разном уровне, клетки в митозе немногочисленны, что отражает антипролиферативный эффект. Строма эндометрия компактна, без изменений, предшествующих стадии децидуализации (рис. 10, A–C). Эти изменения в настоящее время признаны эффектом всего класса SPRM — спектром морфологических изменений, из которых ни одно не является специфическим, но сочетание которых не наблюдается ни в какой другой ситуации или при действии любого другого препарата. Эти изменения получили название названы «изменения эндометрия, связанные с модуляторами рецепторов прогестерона» (progesterone receptor modulator associated endometrial changes или PAEC) [112, 173]. Характерные гистологические изменения были описаны при применении мифепристона [84], азоприснила [252], онапристона [37], лонапризана [106], телапристона ацетата [173] и улипристала ацетата [251].
Естественная динамика развития и последствия PAEC в эндометрии имеют большое клиническое значение, так как многие потенциальные клинические показания в идеале требуют постоянного длительного применения препарата. Непрерывное применение SPRM в течение 6 месяцев и более приводит к утолщению эндометрия, степень которого коррелирует со степенью кистозного расширения желез эндометрия [13, 227]. Несмотря на то что с увеличением продолжительности непрерывного лечения железистый эпителий морфологически принимает все более спокойный или атрофический вид, увеличение толщины эндометрия часто приводит к клиническим проблемам, которые требуют инвазивных методов исследования и лечения. Поэтому современные схемы лечения используют прерывистый график приема SPRM, при котором препарат применяют в течение 12 недель, а затем отменяют, чтобы произошло отторжение эндометрия. Данные клинических испытаний улипристала ацетата показывают, что у подавляющего большинства женщин эндометрий возвращается к нормальной физиологической картине даже после восьми прерванных курсов [80]. Некоторые проблемы безопасности по-прежнему связаны с последствиями долгосрочного воздействия SPRM на эндометрий, однако основной проблемой безопасности, находящейся сейчас в центре внимания, является потенциальная гепатотоксичность, поскольку применение некоторых препаратов, в том числе, как недавно показано, улипристала ацетата, было связано с тяжелым повреждением печени у очень малого числа женщин [166].
Еще многое предстоит узнать о механизмах воздействия SPRM на эндометрий, в частности о механизмах антипролиферативного действия и аменореи. Вполне вероятно, что в опосредовании этих эффектов важную роль играет измененная экспрессия рецепторов половых стероидов (рис. 10, D–F) и прогестерон-регулируемых генов. Имеются доказательства не только изменения общего уровня экспрессии рецепторов половых стероидов в эндометрии, но и значительных изменений в характере экспрессии между железами эндометрия и стромой. Например, было показано увеличение общей концентрации мРНК AR, PR, PRB и ESRI (ERa) в эндометрии под воздействием улипристала ацетата по сравнению с секреторной фазой до начала терапии [249]. Иммуногистохимическое исследование распределения PR и PRB выявило их интенсивную экспрессию в ядрах клеток желез, с минимальной экспрессией в стромальных клетках, в отличие от пролиферативной фазы эндометрия до начала терапии, где наблюдалось интенсивное окрашивание ядер как в железах, так и в строме. При окрашивании на AR в секреторной фазе до начала терапии наблюдалось интенсивное окрашивание ядер в железах, но не в строме; иммуноэкспрессия ERα показала менее значительные различия, хотя были описаны изменения интенсивности.
Интересные наблюдения за эндометрием человека после терапии SPRM (азоприснилом) подтверждают роль пути IL-15 в сложном взаимодействии между стромальными клетками эндометрия, клетками врожденного иммунитета (NK-клетками матки) и спиральными артериями эндометрия, влияющими как на морфологию артериол, так и на менструальные кровотечения [250]. Наблюдаются ли такие нарушения нормальной функции эндометрия, как только что описано, при терапии другими препаратами класса SPRM, еще предстоит определить. Тем не менее SPRM являются бесценным инструментом для управления взаимодействием между прогестероном и рецепторами прогестерона и тем самым улучшают наше понимание физиологии эндометрия и, в частности, загадочной области регуляции менструального кровотечения.
Заключительные комментарии и будущие направления работы
Первые исследования физиологии эндометрия и его регуляции с помощью стероидов, результаты которых до сих пор лежат в основе многих наших знаний о процессе менструации, были проведены почти 80 лет назад. Значительный прогресс в нашем понимании патофизиологии эндометрия был достигнут благодаря современным инструментам исследования клеток и молекул, а также моделям имитируемых менструаций на животных. Однако и сегодня, спустя почти четыре десятилетия, остается актуальной цитата 1982 года: «несмотря на интерес, возобновившийся в течение последних нескольких лет, механизм менструального кровотечения все еще остается загадкой» [4]. Наше понимание биологии эндометрия продвинулось вперед, но многие вопросы, связанные с этой замечательной физиологической моделью повторного повреждения и восстановления, столь важной для продолжения существования нашего вида, остаются нерешенными.
Тема менструации у человека до сих пор остается табуированной, и многие вопросы, касающиеся физиологии менструации, по сей день остаются без ответа. К сожалению, сохраняется негативное отношение к менструации, особенно там, где женщины имеют более низкий социальный статус и где отсутствует просвещение в области репродуктивного здоровья. Это, наряду с ранее запутанной классификацией и терминологией, связанной с менструацией, препятствовало прогрессу в этой области. По мере внедрения системы классификации FIGO для АМК несоответствия будут уменьшаться, а полезность исследований в этой области будет возрастать. Это неизбежно положительно скажется на женщинах, страдающих от изнурительных аномальных маточных кровотечений.
Эндометрий представляет собой физиологическую ткань с повторяющимися эпизодами «травмы и восстановления» (менструации), которые регулируются преобладающей эндокринной средой и последовательным воздействием стероидов. Следовательно, он может также служить моделью повреждения / восстановления поверхности слизистой оболочки без образования рубцов, что может дать информацию о биологии других тканей организма [152]. После менструации «поврежденный» эндометрий быстро восстанавливает строение и функционирование тканей в процессе подготовки к следующему менструальному циклу. Для восстановления функционального эндометрия, готового к имплантации, необходимо устранить воспаление эндометрия и обеспечить клеточную пролиферацию и ангиогенез. Поэтому решение оставшихся без ответа вопросов в этой области может не только улучшить жизнь многих женщин, но и оказать значительное влияние на процессы в других тканях.
Остается интересным и все еще необъясненным, почему менструация происходит только у тех биологических видов, у которых эндометрий спонтанно децидуализируется перед [возможной] имплантацией. Напротив, у тех видов, у которых эндометрий не децидуализируется до установления контакта эмбриона с эндометрием, резкое снижение уровня прогестерона не влияет на разрушение эндометрия или кровотечение. Также неизвестно, влияет ли на менструацию «предварительная подготовка» эндометрия в предшествующем цикле. Существенно ли влияют на кровотечение во время менструации нарушения процессов децидуализации, ремоделирования сосудов и/или иммунного ответа? Механизмы прекращения менструации остаются неопределенными. Что влияет сильнее: факторы гемостаза или сужение сосудов? Или же для прекращения кровотечения требуется заново сформировать эпителий просвета матки? Влияет ли способность клеток менструальной жидкости к миграции на реэпителизацию просвета матки? Что регулирует эти локальные механизмы? Почему в физиологических условиях в эндометрии не образуются рубцы и почему происходит его рубцевание при таких состояниях, как синдром Ашермана [приобретенное состояние, когда в полости матки образуется рубцовая ткань (спайки)]?
Помимо множества вопросов, связанных с физиологией эндометрия, многое не изучено в отношении патологии эндометрия. Мы пока не знаем, каково влияние лейомиом (миом) или аденомиоза на эндометрий, а также каковы механизмы, с помощью которых они приводят к АМК. Кроме того, мы еще не до конца понимаем механизмы действия многих из наших современных методов лечения, например, SPRM.
Без этих знаний мы не сможем предоставить эффективное лечение многим женщинам, страдающим в настоящее время от АМК. Разгадка физиологии и патологии нарушений эндометрия приведет к созданию персонализированных терапевтических стратегий, которые будут способствовать сохранению фертильности и ограничат побочные эффекты, улучшая жизнь миллионов женщин во всем мире.
