Местные механизмы, которые ограничивают нормальное менструальное кровотечение: сужение сосудов, роль гипоксии, восстановление сосудов и эпителия и гемостаз
Как уже подчеркивалось, резкое снижение уровня прогестерона является причиной многих классических признаков воспаления в эндометрии. Приток клеток врожденного иммунитета и высвобождение MMP приводит к отторжению функционального слоя при менструации. Такое повреждение эндометрия должно быть строго отрегулировано и быстро остановлено, чтобы ограничить менструальную кровопотерю. Таким образом, для сокращения эндометриального кровотечения (менструации) требуется своевременное разрешение воспаления, сужение специализированных спиральных артериол эндометрия, эффективный гемостатический ответ, включающий восстановление поврежденной сосудистой сети, реэпителизацию остатков оголенного базального эндометрия (поврежденной поверхности слизистой оболочки), обращенного в просвет матки, и увеличение объема стромы [151, 152, 202]. Уникальный, не оставляющий шрамов процесс восстановления после менструации имеет важное значение для поддержания потенциала фертильности и ограничения менструального кровотечения. Однако механизмы и регуляция восстановления эндометрия по-прежнему плохо изучены [157].
Около 80 лет назад физиологическая роль гипоксии и снижения уровня половых стероидов изучалась в классических экспериментах — на моделях на нечеловекообразных приматах [145]. Аутологичные трансплантаты эндометрия макаки-резуса в переднюю камеру глаза позволили визуализировать процесс менструации непосредственно с помощью офтальмоскопа с щелевой лампой. За 4-24 ч до менструации, после отмены стероидов (прогестерона), наблюдалась интенсивная транзиторная вазоконстрикция спиральных артериол и очаговое кровотечение. Позже, более 30 лет назад, эти наблюдения пересмотрели Baird с соавт. [4], которые трансплантировали эндометрий в щечный мешок хомяка — иммуно-привилегированный участок, позволяющий непосредственно наблюдать влияние введения и отмены стероидов на сужение и расширение кровеносных сосудов.
После выхода этих публикаций решающая роль гипоксии в эндометрии продолжала оставаться предметом дискуссий. Литературные данные в этой области противоречивы и получены на различных моделях in vitro, ex vivo и in vivo. Поскольку радиус кровеносного сосуда является основным фактором, определяющим сопротивление потоку, даже небольшое увеличение радиуса сосуда будет оказывать существенное влияние на поток, например, двукратное увеличение радиуса сосуда приведет к 16-кратному уменьшению сопротивления потоку [153] (рис. 7А). Эффективное сужение артериол эндометрия необходимо для ограничения менструальной кровопотери.
А. Медиаторы вазоконстрикции эндометрия
Ослабление сужения сосудов при менструации может быть связано с нарушением продукции сосудосуживающих факторов после резкого снижения уровня прогестерона. PGF2α и эндотелин-1 (ET-1) являются двумя эндометриальными факторами с известными сосудосуживающими свойствами [15, 147]. Показано, что у женщин с обильной менструальной кровопотерей значительно снижается соотношение PGF2α / PGE2 [223], а также уменьшается экспрессия рецептора простагландина F [222]. Чрезмерная продукция PGE2 за счет PGF2α может привести к ослаблению сужения спиральных артериол перед менструацией. Также показано, что в эндометрии женщин с ОМК уменьшена экспрессия мощного вазоконстриктора ET-1 и усилена экспрессия его метаболизирующего фермента, нейральной эндопептидазы [147] (рис. 7В).
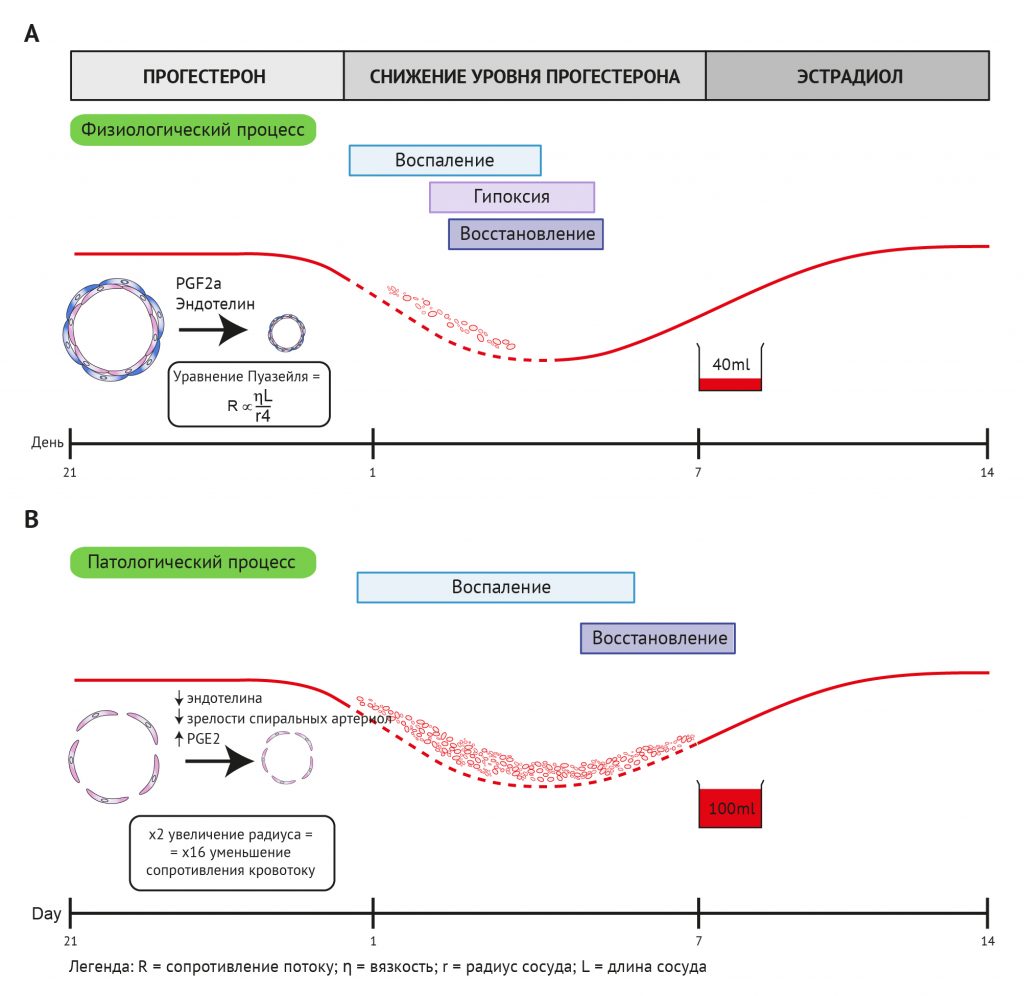
Рисунок 7 | Процессы в эндометрии во время его разрушения при менструации и последующего восстановления. A: физиологические процессы. После снижения уровня прогестерона зрелые, специализированные спиральные артериолы эндометрия сокращаются из-за повышения уровня вазоактивных факторов (например, эндотелина и простагландина PGF2a). Это сужение сосудов необходимо для ограничения менструальной кровопотери, что показывает уравнение Пуазейля, где сопротивление сосуда (R) прямо пропорционально длине сосуда (L) и вязкости крови (η) и обратно пропорционально радиусу сосуда в четвертой степени (r4). Местная среда эндометрия подвергается воспалению и гипоксии и восстанавливается без потери функции. B: происходят патологические процессы, вызывающие аномальную кровопотерю. Незрелость сосудов эндометрия и снижение уровня сосудосуживающих факторов приводят к увеличению радиуса сосуда во время менструации, что значительно усиливает менструальную кровопотерю. Кроме того, это может препятствовать физиологическому ответу — гипоксии, необходимой для нормального восстановления эндометрия после менструации.
Кроме того, ослабление вазоконстрикции при менструации может быть связано с аберрантным созреванием спиральных артериол в ходе всего предшествующего менструального цикла. Было отмечено, что окружность сосудов и участки нарушения целостности сосудов эндометрия у женщин с ОМК больше, чем в норме [163]. У женщин с тяжелым кровотечением наблюдалось значительное снижение пролиферации гладкомышечных клеток сосудов в спиральных артериолах в середине и конце секреторной фазы по сравнению с контрольной группой с нормальной менструальной кровопотерей [2]. Кроме того, показано, что уровень тяжелой цепи миозина гладких мышц (сократительного белка) — маркера созревания гладкомышечных клеток сосудов — также значительно снижается в спиральных артериолах женщин с ОМК [1]. Дополнительные данные в этом контексте получены из исследования количества и стадии дифференцировки гладкомышечных клеток сосудов (ГМКС) в кровеносных сосудах эндометрия у женщин с нормальным и подтвержденным обильным менструальным кровотечением [21]. При этом у женщин с ОМК в сосудах эндометрия наблюдалось нарушение регуляции экспрессии маркеров дифференцировки ГМКС, смутелина (smoothelin) и кальпонина. Смутелин и кальпонин являются регуляторами тонуса и сократимости сосудов [21]. Артериогенез эндометрия требует скоординированного созревания ГМКС, нижележащих клеток эндотелия (КЭ) и окружающего ВКМ. Также у женщин с ОМК отмечались пространственные и временные различия в уровнях белков-маркеров КЭ и компонентов ВКМ в сосудах эндометрия и поверхностном миометрии [22]. Такие сосудистые нарушения могут привести к неоптимальному сужению сосудов при менструации и значительно увеличить менструальную кровопотерю (рис. 7B).
Таким образом, ослабление вазоконстрикции специализированных спиральных артериол эндометрия не только влияет на объем менструальной кровопотери, но и может увеличить продолжительность кровотечения из-за задержки восстановления эндометрия. Действительно, показано, что у женщин с ОМК кровотечение длится на 2 дня дольше [157]. Ниже рассматриваются процессы, связанные с восстановлением сосудов и эпителия.
B. Гипоксия эндометрия
Помимо воздействия на кровоток, сужение сосудов при менструации может способствовать индукции гипоксии в менструальном эндометрии. Исследования Markee, в которых эндометрий трансплантировали в переднюю камеру глаза макак-резусов, показали, что наблюдаемое сужение сосудов согласуется с гипоксией в менструальном эндометрии [145]. Это привело к гипотезе, что гипоксия необходима для начала менструации. Однако последующие исследования in vitro и ex vivo показали, что менструальное отторжение эндометрия может происходить и при отсутствии гипоксии [86, 256].
Фактор, индуцируемый гипоксией (Hypoxia inducible factor, HIF), является основным регулятором клеточного ответа на гипоксию; хорошо описана его роль в митогенезе, ангиогенезе, апоптозе, воспалении и метаболизме в других тканях организма [210, 211]. Он состоит из двух субъединиц: α-субъединицы, быстро распадающейся при избытке кислорода, и конститутивно экспрессируемой β-субъединицы [210]. При гипоксии происходит αβ-димеризация, и HIF транслоцируется в ядро, где индуцирует транскрипцию генов, которые содержат элемент, определяющий реакцию на гипоксию (hypoxia responsive element, HRE), включая гены, участвующие в ангиогенезе, энергетическом метаболизме и ремоделировании тканей. Все эти процессы лежат в основе менструации.
В присутствии избытка кислорода α-субъединица HIF, она же HIF-1α, гидроксилируется ферментами пролил-гидроксилазами (prolyl hydroxylase, PHD). Эти ферменты инициируют быстрое разрушение HIF-1α протеасомой. В условиях гипоксии кислород-зависимые ферменты PHD неактивны, а белок HIF-1α остается стабильным. Следовательно, HIF-1α способен связываться с β-субъединицей HIF, HIF-1β. Происходит транскрипция генов-мишеней HIF, которая обеспечивает адаптацию к гипоксической среде. Альтернативным партнером для связывания с HIF-1β является субъединица HIF-2α, и в этом случае гены-мишени будут частично различаться, хотя некоторые из них останутся прежними [195].
HIF-1α был обнаружен в эндометрии человека, но его присутствие ограничено перименструальной фазой [59, 217]. У женщин с объективно измеренным ОМК в эндометрии во время менструации наблюдалось значительное уменьшение белка HIF-1α и его мишеней по сравнению с женщинами с нормальной кровопотерей, что согласуется с недостаточной реакцией на гипоксию. Это состояние было смоделировано на мышах [157] путем фармакологического и генетического снижения уровня HIF-1 при менструации и привело к значительному замедлению восстановления эндометрия (суррогатный маркер менструации в этой модели на мышах).
Существовала значительная неопределенность относительно наличия и роли гипоксии при менструации. Модель менструации на мышах (подробно описанная в разделе V) позволила пролить свет на эту проблему. Модель имитируемых менструаций на мышах позволила использовать пимонидазол — маркер парциального давления кислорода <10 мм рт. ст. Интенсивное окрашивание пимонидазолом было обнаружено в самом верхнем слое эндометрия после отмены прогестерона [52, 79, 157]. Во время разрушения ткани возникала транзиторная гипоксия, которая не выявлялась после восстановления оголенной поверхности эндометрия. Это убедительно свидетельствовало о наличии физиологической гипоксии в менструальном эндометрии в модели имитируемых менструаций на мышах. Для определения ее роли гипоксию при менструации предотвращали путем содержания мышей в гипероксической камере в период отмены прогестерона. Такие меры замедляли восстановление эндометрия после отторжения, указывая на то, что гипоксия необходима для нормального восстановления при менструации [157].
Это исследование особо подчеркивает ключевую роль гипоксии/ HIF в процессе менструации. Фармакологическая стабилизация HIF-1α с помощью диметилоксалилглицина (dimethyloxalylglycine, DMOG) нормализовала замедленное восстановление эндометрия, наблюдаемое у мышей, перенесших негипоксическую менструацию. DMOG является ингибитором пролилгидроксилазы и стабилизирует HIF-1α даже при нормоксии [110]. Это исследование подтверждает роль HIF-1 в эндометрии [157]. Кроме того, было предложено потенциальное применение ингибиторов PHD (стабилизаторов HIF-1α) в качестве кратковременного негормонального лечения для женщин с ОМК.
C. Восстановление сосудов и эпителия эндометрия
В ткани эндометрия человека во время менструации повышается уровень матричной РНК и белка ангиогенного фактора VEGF. В данном контексте следует отметить, что HIF-1α необходим для индуцированного гипоксией увеличения VEGF в эпителиальных клетках эндометрия человека [155]. Дополнительное исследование, в котором ангиогенный фактор VEGF был на молекулярном уровне заблокирован у нечеловекообразных приматов (макаки-резусы), и в альтернативной модели имитируемой менструации на мышах (псевдобеременность с последующей индукцией децидуализации и удалением яичников для запуска менструации) выявило подавление развития новых кровеносных сосудов и замедление восстановления (реэпителизации) оголенной поверхности эндометрия во время менструации [79]. Дополнительные доказательства, подтверждающие роль HIF в физиологическом процессе восстановления эндометрия во время менструации, получены в модели на мышах, где HIF-1α напрямую связывался с промотором VEGF во время менструации [44]. Эти экспериментальные наблюдения дают хорошие доказательства того, что гипоксия регулирует HIF-1α in vivo, координируя своевременное восстановление поврежденной поверхности слизистой оболочки эндометрия во время менструации.
D. Гемостаз в эндометрии
В других тканях повреждение кровеносных сосудов при травме приводит к прилипанию тромбоцитов к коллагену на поврежденной базальной мембране. Агрегация тромбоцитов стимулирует каскад коагуляции и образование фибринового сгустка. Однакоучастие тромбоцитов в восстановлении сосудов эндометрия относительно невелико. Сужение сосудов и активация каскада свертывания крови более важны для гемостаза в постменструальном периоде [94]. Каскад коагуляции активируется двумя путями: внешним и внутренним. Каждый из них завершается превращением фактора X в Ха (активированный фактор Х, — прим. пер.), который катализирует превращение протромбина в тромбин, что в конечном итоге приводит к образованию фибринового сгустка. Заболевания, нарушающие системный гемостаз, существенно влияют на уровень менструальной кровопотери (см. обзор 66). Среди таких расстройств чаще всего встречается болезнь фон Виллебранда, которая выявляется у 13 % женщин с жалобами на ОМК [213].
Деградация фибринового сгустка опосредована работой фибринолитической системы. Фибринолиз включает превращение плазминогена в активный плазмин, способствующий расщеплению отложений фибрина. Тканевой активатор плазминогена (tissue plasminogen activator, t-PA) и урокиназный активатор плазминогена (urokinase plasminogen activator, u-PA) стимулируют выработку плазмина. Ингибитор активатора плазминогена (plasminogen activator inhibitor, PAI), напротив, ингибирует фибринолитическую активность. Эндометрий человека содержит t-PA и u-PA, а также PAI и рецепторы u-PA [100, 180]. У женщин, страдающих от ОМК, уровень активности t-PA на второй день кровотечения повышен по сравнению с женщинами с нормальной менструальной кровопотерей [100], что согласуется с гиперактивностью фибринолитической системы. Еще одним доказательством такой чрезмерной активации фибринолитической системы является эффективность транексамовой кислоты как негормонального препарата для лечения ОМК при назначении в первые дни обильных менструаций. Это антифибринолитическое средство снижает уровень t-PA и PAI у женщин с ОМК и приводит к снижению кровопотери на 58 % [101].
Формирование и ремоделирование тканей — ключевые процессы заживления раны. Восстановление эндометрия после менструации обычно не оставляет рубцов и происходит быстро, в течение 3-5 дней [78, 157]. Было проведено интересное исследование менструальной жидкости (МЖ), при котором на 2-й день цикла у женщин с нормальной продолжительностью кровотечения 3-5 дней с помощью менструальной чаши были собраны менструальные выделения. Показано, что МЖ усиливает заживление ран как in vivo, в моделях на свиньях, так и in vitro, а также определено влияние МЖ на миграцию клеток — важный процесс в авторских моделях заживления ран [78].
Исследование менструального эндометрия с помощью сканирующей электронной микроскопии показало, что в первую очередь происходит восстановление эпителия, за которым следует увеличение объема стромы [142]. В этом исследовании было высказано предположение, что эпителиальные клетки растут из шейки желез эндометрия и распространяются навстречу клеткам, мигрирующим из других желез, образуя новую поверхность просвета матки. Исследование с окраской на бромдезоксиуридин и ядерный антиген пролиферирующих клеток, проведенное в модели имитируемой менструации на мышах, показало, что источником реэпителизации поверхности матки выступают клетки-предшественники, находящиеся среди эпителиальных клеток желез эндометрия [124]. Исследование эндометрия человека с использованием методов динамической гистероскопии и микроскопии показало, что отторжение и восстановление эндометрия происходят фрагментарно и одновременно в различных областях матки [91]. Это исследование выявило, что источником реэпителизации выступают оголенные клетки стромы, а не клетки желез. Все это доказывает, что наше понимание процесса восстановления эндометрия все еще находится в зачаточном состоянии. Учитывая способность эндометрия многократно восстанавливаться без образования рубцов или потери функции, стратегически важно определить эти процессы и их регуляцию.
Влияние и классификация аномальных маточных кровотечений
Аномальные маточные кровотечения (АМК) [169, 170], включая ОМК, связаны с изнуряющими симптомами и железодефицитной анемией (ЖДА). АМК тяжелым бременем ложатся на клинику. Двадцать процентов из 1,2 миллиона обращений к гинекологам в Великобритании приходятся на женщин с ОМК [179, 197]. В исследовании, проведенном в Соединенных Штатах Америки, подсчитано, что ОМК приводят к финансовым потерям в размере более 2000 долларов на пациента в год из-за отсутствия больной женщины на работе и расходов на ведение домашнего хозяйства [85]. Благодаря доступной контрацепции у женщин в странах с высоким уровнем дохода теперь ожидается не менее 400 менструаций в течение жизни. Ранее у женщин происходило около 40 менструальных кровотечений в течение жизни из-за многократных беременностей и длительной лактационной аменореи [216]. Таким образом, из-за большего числа менструаций повышается как вероятность развития менструальных нарушений у женщины, так и общее число жалоб, связанных с нарушениями менструального цикла, в том числе с аномальными менструальными кровотечениями.
Для АМК доступно медикаментозное лечение, но оно часто прекращается из-за побочных эффектов или отсутствия эффективности, что указывает на необходимость персонализированного негормонального лечения ОМК. Все методы, основанные только на прогестинах, связаны с нерегулярными и часто непредсказуемыми мажущими выделениями или кровотечениями [3]. Незапланированное маточное кровотечение является одной из наиболее распространенных причин прекращения применения методов лечения, основанных только на прогестинах. Такие методы включают внутриматочную систему, высвобождающую левоноргестрел [199]. По данным национального 4-летнего мониторинга ОМК, 43 % женщин потребовалось хирургическое вмешательство в течение года после первого обращения к врачу [196, 197]. В Англии и Уэльсе наибольший процентный рост коэффициента фертильности в последнее время был отмечен среди женщин в возрасте 40 лет и старше, и с 1981 года этот показатель увеличился более чем в три раза. В 2015 году коэффициент фертильности для женщин в возрасте 40 лет и старше превысил показатель для женщин в возрасте до 20 лет [182, 196, 197], и это означает, что операции, ведущие к потере репродуктивной функции, не всегда являются приемлемым вариантом для женщин, испытывающих проблемы с менструацией. Кроме того, операция создает риск повреждения кишечника / мочевого пузыря / мочеточника, кровоизлияния и инфекции. Проблемы, связанные с менструацией, представляют собой клиническую область, требующую серьезных решений и персонализированных, эффективных методов лечения, которые позволят женщинам сохранить свою фертильность / матку. Определение фундаментальной физиологии инициации и прекращения менструального цикла, а также аномалий эндометрия, присутствующих у женщин с АМК, поможет выявить новые стратегии диагностики и лечения таких расстройств.
Тактика ведения пациента при жалобах на это распространенное состояние, ухудшающее качество жизни, не улучшится без соответствующей диагностики основного заболевания. Обилие потенциальных причин АМК и отсутствие их общепринятой номенклатуры ранее препятствовали прогрессу в этой клинически важной области. Однако в 2011 году для АМК была опубликована система классификации FIGO (The International Federation of Gynecology and Obstetrics, Международная федерация гинекологии и акушерства), разработанная в несколько этапов при участии международной группы врачей-исследователей из более чем 17 стран на 6 континентах [168]. Эта группа рекомендовала исключить непоследовательные, сбивающие с толку термины, такие как «дисфункциональное маточное кровотечение» и «меноррагия», заменив их более упрощенными терминами, такими как «обильное менструальное кровотечение» или «нерегулярное обильное менструальное кровотечение». Кроме того, была введена система классификации PALM-COEIN [169, 170] (в данной классификации AUB (abnormal uterine bleeding) = АМК — прим. пер.) (рис. 8). PALM обозначает структурные нарушения: полипы (AUB-P), аденомиоз (AUB-A), лейомиомы (AUB-L) и злокачественные / предраковые состояния (AUB-M). COEIN обозначает неструктурные причины, такие как коагулопатия (AUB-C), дисфункция овуляции (AUB-O), дисфункция эндометрия (AUB-E), ятрогенные причины, например, связанные с терапией прогестином и другими гормонами (AUB-I), и причины, не классифицированные иначе (AUB-N). Эндометриоз включен в категорию AUB-N, так как он может иногда вызывать АМК. Фенотип эндометрия при эндометриозе является областью активных исследований и предметом недавних обзоров [89, 146], поэтому далее обсуждаться не будет.
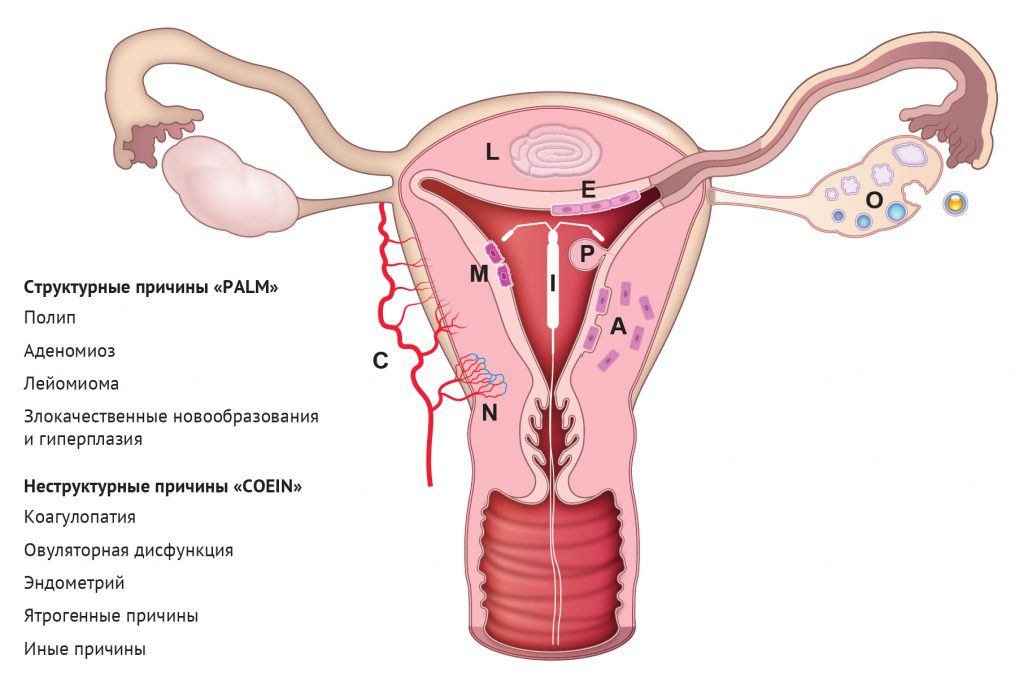
Рисунок 8 | Система классификации PALM COEIN для аномальных маточных кровотечений (АМК). P — полипы (polyps); A — аденомиоз (adenomyosis); L — лейомиомы (leiomyoma); M — злокачественные образования (malignancy); С — коагулопатии (coagulopathy); O — овуляторная дисфункция (ovulatory dysfunction); E — дисфункции эндометрия (endometrial); I — ятрогенные причины (iatrogenic); N — иные причины (not otherwise classified). См. 169 и 170.
A. Структурные причины АМК («PALM») (см. рис. 8)
Полипы эндометрия или шейки матки, как правило, возникают в результате доброкачественной пролиферации эпителия и стромы и содержат различные сосудистые, железистые, фиброзно-мышечные и соединительнотканные компоненты. Обычно полипы проявляются нерегулярными маточными кровотечениями, однако плохо изучены причины их возникновения и то, как полипы вызывают АМК. Они могут представлять собой локализованные очаги неотслаивающегося эндометрия, которые разрастаются в течение нескольких циклов. Полипы поддаются хирургическому удалению, а появление устройств для изъятия тканей позволило эффективно проводить гистероскопическое удаление полипов в амбулаторных условиях.
Аденомиоз (AUB-A по классификации FIGO) [170] определяется наличием эктопических эндометриальных желез и стромы в пределах миометрия. Его распространенность колеблется от 7 до 27 %, при этом значительные различия частоты встречаемости обусловлены сложностями постановки диагноза [150, 174]. У женщин с аденомиозом эктопические участки эндометрия, как и нормально расположенный эндометрий, претерпевают циклическое отторжение, что приводит к выраженным болям. Влияние аденомиоза на эндометрий и механизмы, вызывающие АМК, изучены недостаточно. Аденомиоз является особенно сложной задачей, поскольку он часто устойчив к медикаментозному лечению, а варианты хирургического вмешательства (абляция или гистерэктомия) неприемлемы для тех, кто хочет сохранить репродуктивную функцию. Определение механизмов, путем которых эндометрий вовлечен в развитие аденомиоза, может выявить новые терапевтические стратегии для больных женщин. Имеются некоторые данные, свидетельствующие о снижении уровня рецепторов прогестерона в эндометрии у женщин с аденомиозом [18, 19], что может привести к снижению чувствительности эндометрия к прогестерону. Также в эндометрии у женщин с аденомиозом была выявлена повышенная экспрессия такого подтипа ER, как ER-B, при сниженной экспрессии PR [108]. Прогестерон подавляет пролиферацию и противодействует воздействию эстрогена во время пролиферативной фазы менструального цикла, следовательно, такие нарушения могут частично способствовать развитию ОМК у женщин с аденомиозом.
Лейомиомы (миомы, фибромы матки; AUB-L) являются наиболее распространенными доброкачественными опухолями у женщин репродуктивного возраста, а совокупный риск их возникновения в течение жизни достигает 80 % [12]. Симптомы этого состояния, которые наблюдаются в ~50 % случаев [12], могут включать нарушения свертываемости крови (ОМК или нерегулярные кровотечения), симптомы давления (на мочевой пузырь и кишечник), боли в области таза и нарушения репродуктивной функции. Лейомиомы образуются вследствие пролиферации гладкомышечных клеток матки и связанного с ними коллагенового матрикса, они чрезвычайно неоднородны по размеру и расположению. Новые данные, полученные в результате полногеномных исследований ассоциаций, позволили выявить подгруппы генов, приводящие к образованию миомы (см. обзор 226). Их воздействие на функцию эндометрия привлекло внимание благодаря связи с нарушениями репродуктивной функции и АМК. Подслизистая миома связана с ослабленным ответом на децидуализацию и повреждением генов, регулируемых прогестероном, таких как HOXA10 [69, 192]. Помимо негативного влияния на имплантацию, нарушение «менструальной предварительной подготовки» секреторного эндометрия может существенно повлиять на функцию эндометрия во время менструации и увеличить кровопотерю. Также у женщин с миомой может быть нарушено сокращение сосудов во время менструации, при этом экспрессия рецепторов эндотелина и PGF2α в фиброзной ткани отличается от нормы [164, 189]. Как уже говорилось выше, даже небольшое ослабление вазоконстрикции значительно усиливает ток крови при менструации [153]. Дальнейшее изучение влияния миомы на эндометрий позволит разработать стратегии терапии с сохранением репродуктивной функции при лейомиомах.
B. Неструктурные причины АМК («COEIN») (см. рис. 8)
Эти расстройства не всегда легко выявляются с помощью визуализации органов малого таза и требуют квалифицированного сбора анамнеза и осмотра пациента для проведения соответствующего обследования и постановки диагноза. К классификационной категории AUB-C относят наследственные коагулопатии и нарушения гемостаза. Местная регуляция гемостаза эндометрия была рассмотрена выше, это состояние требует участия гематолога для надлежащего лечения [100, 121, 132]. Кровотечение из-за овуляторной дисфункции (AUB-O) может быть следствием крайних значений репродуктивного возраста или индекса массы тела, а также из-за фоновых заболеваний, таких как синдром поликистозных яичников. Поскольку нарушение происходит на уровне яичников, часто эффективна гормональная терапия. Категория AUB-E включает нарушения локальной коагуляции, сосудистой функции и/или воспаления в эндометрии, которые рассмотрены выше (см. Разделы VIII и XI). Детальное понимание регуляторных факторов, участвующих в ключевом репродуктивном событии — менструации — и нарушений, возникших у пациентов с АМК, будет способствовать специфической коррекции и более точному, персонализированному лечению. Только понимание физиологии и патологии менструации позволит повысить эффективность и приемлемость медицинских стратегий лечения АМК и ослабить зависимость от неспецифических хирургических вмешательств, приводящих к утрате репродуктивной функции.
