Возрождающийся подобно фениксу эндометрий является физиологическим примером поврежденной или «раневой» поверхности, которой каждый месяц требуется быстрое восстановление. Ежемесячно эндометрий человека подвергается воздействию последовательно изменяющихся концентраций циркулирующих половых стероидов, вырабатываемых яичниками: эстрадиол (E2) и прогестерон (P4). Падение уровня прогестерона служит фактором, запускающим менструацию. Вероятно, ключевую роль в процессах репарации эндометрия играет гипоксия. При менструации может наблюдаться нормальный уровень кровопотери (НМК), однако у четверти женщин репродуктивного возраста происходят обильные менструальные кровотечения (ОМК). Аномальное маточное кровотечение (АМК, включая симптом ОМК) — достаточно распространенное и изнуряющее состояние. С АМК могут быть связаны такие структурные особенности матки, как лейомиома/миома (Л) и/или аденомиоз (A). В данном обзоре авторы кратко рассматривают физиологию менструации (эндокринную, воспалительную и гематологическую регуляцию отторжения и восстановления эндометрия), очерчивают причины АМК и определяют актуальные области исследований, позволяющие усовершенствовать лечение нарушений менструального цикла и облегчить тяжесть АМК.
Физиологическими функциями эндометрия (слизистой оболочки) матки являются подготовка к имплантации, поддержание беременности в случае имплантации и менструация при отсутствии беременности. Таким образом, эндометрий играет ключевую роль в размножении и продолжении нашего вида. Менструация — это событие, регулируемое стероидами, и для подготовленного прогестероном эндометрия существуют лишь одна ей альтернатива — беременность. Падение уровня прогестерона служит фактором, запускающим менструацию. Эндометрий при менструации является физиологическим примером поврежденной или «раневой» поверхности, которой каждый месяц требуется быстрое восстановление. Физиологические события менструации и восстановления эндометрия обеспечивают доступную in vivo на человеке модель воспаления и восстановления тканей. Развитию нашего понимания патофизиологии эндометрия способствовали современные инструменты клеточных и молекулярных исследований, а также модели имитируемых менструаций на животных. АМК, включая ОМК, тяжелым бременем ложится на общество, затрагивая каждую четвертую женщину репродуктивного возраста. Понимание структурных и неструктурных причин, лежащих в основе АМК, необходимо для оптимизации и обеспечения точности тактики ведения пациентов. Этому способствует тщательная классификация факторов возникновения кровотечений. Авторы подчеркивают острую необходимость понимания механизмов, лежащих в основе менструации и ее нарушений. Эндометрий является основной тканью-мишенью для селективных модуляторов рецепторов прогестерона (selective progesterone receptor modulators, SPRM). Этот класс соединений обладает терапевтическим потенциалом для решения клинических проблем ОМК. Механизмы, благодаря которым SPRM ослабляют менструальное кровотечение, в настоящее время мало изучены. Менструация у человека остается табуированной темой, и многие вопросы физиологии эндометрия, которые касаются менструальных кровотечений, до сих пор не получили ответа.
Введение
Функции эндометрия матки заключаются в подготовке к имплантации, поддержании беременности, если имплантация произошла, и менструации при отсутствии беременности. Таким образом, эндометрий (слизистая оболочка матки) играет ключевую роль в размножении и поддержании нашего вида. Эти важнейшие процессы регулируются стероидами, и для подготовленного прогестероном эндометрия существуют лишь две альтернативы: беременность или менструация. Эндометрий представляет собой сложную многокомпонентную ткань, мишень стероидных гормонов, которая при отсутствии беременности ежемесячно отторгается (происходит менструация), а затем быстро восстанавливается без остаточных рубцов или потери функции. Восстановление эндометрия после его разрушения и отторжения включает устранение воспаления, ангиогенез, ремоделирование и формирование новой ткани. В состав эндометрия входят такие типы клеток, как стромальные, эпителиальные, сосудистые и иммунные клетки. Динамичный межклеточный диалог с участием эндокринной и иммунной систем необходим для обеспечения эффективного отторжения эндометрия и последующей реэпителизации (восстановления поврежденной поверхности слизистой оболочки) в случае, если беременность не наступила. Эндометрий человека и физиологические события менструации и восстановления эндометрия обеспечивают доступную in vivo на человеке модель воспаления и восстановления тканей. Следовательно, эндометрий при менструации можно считать прекрасным физиологическим примером поврежденной или «раневой» поверхности, которая должна быстро восстанавливаться каждый месяц.
Стадия менструального цикла определяется преобладающим эндокринным окружением, оказывающим значительное влияние на строение и функцию эндометрия
Во время менструального цикла человека эндометрий ежемесячно подвергается воздействию последовательно изменяющихся концентраций циркулирующих половых стероидов, вырабатываемых яичниками, что имеет решающее значение для регуляции его роста и дифференцировки. Главными участниками такой подготовки к беременности являются вырабатываемые яичниками 17-эстрадиол (E2) и прегн-4-ен-3,20-дион (прогестерон; P4). Колебания концентраций этих гормонов на протяжении всего менструального цикла хорошо описаны (рис. 1A).
В эндокринной среде эндометрия изначально преобладает эстрадиол — на ранней, «пролиферативной», фазе менструального цикла происходит интенсивная пролиферация тканей сосудов и собственно эндометрия. Пролиферативная фаза эндометриального цикла соответствует «фолликулярной» фазе яичников; а после овуляции и образования желтого тела происходит секреция прогестерона [49, 181].
Во время «секреторной» фазы эндометриального цикла (соответствующей «лютеиновой» фазе яичников) преобладает прогестерон, выработка которого необходима для обеспечения имплантации эмбриона в подготовленный эстрадиолом эндометрий и для поддержания беременности [49, 62, 181].
События, охватывающие время от регрессии желтого тела в поздней секреторной фазе (время падения уровня прогестерона) и менструации до постменструального восстановления эндометрия в последующей пролиферативной фазе, отражают эндокринный «лютеофолликулярный» переходный период и могут быть названы «перименструальным окном» (рис. 1B).
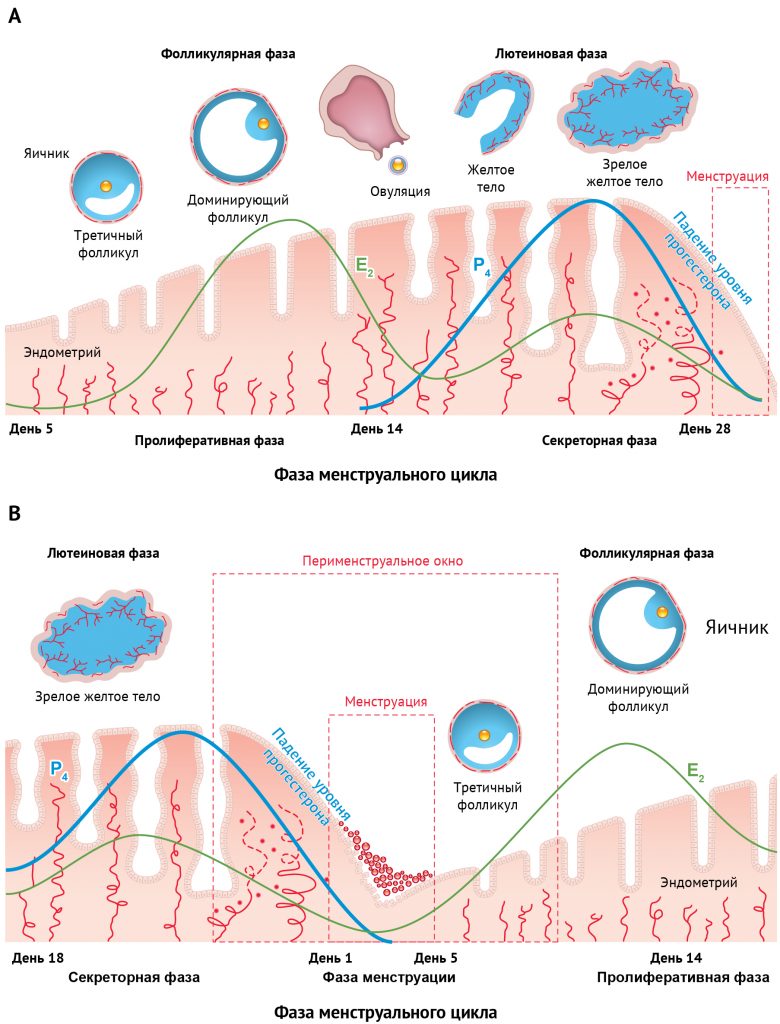
Рисунок 1 | Менструальный цикл человека A: Эстрадиол — гормон, воздействие которого на эндометрий доминирует в пролиферативной фазе (эквивалентна фолликулярной фазе яичников). Секреторная фаза наступает после овуляции, когда желтое тело секретирует прогестерон (эквивалентна лютеиновой фазе яичников). В: перименструальное окно (лютео-фолликулярный переход): смещение традиционной иллюстрации менструального цикла с целью фокусировки на значительных изменениях гормонального фона и эндометрия, которые происходят при его разрушении и восстановлении.
Гистологически эндометрий состоит из простого цилиндрического эпителия и лежащей под ним многоклеточной стромы. Строма содержит клеточные компоненты соединительной ткани с фибробластоподобными стромальными клетками, а также трубчатые железы, открывающиеся в просвет матки, спиральные артерии и варьирующийся поток привлекаемых клеток врожденного иммунитета [181]. Имеются также существенные доказательства наличия популяции стволовых клеток эндометрия [89]. Эти клетки-предшественники способны дифференцироваться в стромальные и эпителиальные клетки и способствовать эффективному обновлению и поддержанию эндометрия, что необходимо для восстановления его целостности при менструации. У человека эти стволовые клетки-предшественники находятся в базальном слое эндометрия [205].
Стромальные клетки эндометрия (СКЭ) являются мишенью для прогестерона. Процесс, называемый децидуализацией эндометрия, указывает на превращение СКЭ в специализированные секреторные децидуальные клетки, которые создают питательное и восприимчивое клеточное микроокружение, необходимое для имплантации эмбриона и дальнейшего развития плаценты [95]. Децидуализация — это процесс, включающий трансформацию СКЭ удлиненной формы в округлые клетки, сопровождающийся индукцией экспрессии в СКЭ прогестерон-зависимых белков, включая пролактин, тканевой фактор, белок IGFBP1 и транскрипционный фактор FOXO1, а также гликоген [31, 32, 72, 138, 139, 207]. Реакция децидуализации эндометрия запускается внутриклеточно путем продукции цАМФ [32], возникающей первоначально в периваскулярных клетках стромы эндометрия, еще до того, как децидуализация охватит всю строму. Также децидуализация распространяется под эпителием, обращенным в просвет матки, и таким образом наблюдается в тех участках эндометрия, куда может имплантироваться эмбрион. У человека децидуализация не зависит от контакта эмбриона с эндометрием (имплантации) и происходит спонтанно под воздействием прогестерона. Также спонтанная децидуализация была описана у недавно обнаруженного менструирующего грызуна — иглистой мыши [16] (описание имитируемых менструаций в модели на мышах см. в разделе V).
Эти функционально разные фазы менструального цикла имеют решающее значение для синхронизации эндометрия с созреванием ооцитов, оплодотворением и имплантацией эмбриона в середине секреторной фазы, когда имплантационная восприимчивость эндометрия, скорее всего, будет оптимальной [229]. Интересно, что эндометрий человека проявляет наиболее обширную реакцию децидуализации среди всех изученных на сегодняшний день менструирующих видов [194]. Эта особенность, в свою очередь, может играть важную роль в обширной инвазии трофобласта, которая происходит у человека во время имплантации [82, 113]. Важно отметить, что недостаточность или нарушение инвазии трофобласта на ранних сроках беременности может привести к выкидышу, а на поздних сроках повлечь за собой такие проблемы, как задержка роста плода и преэклампсия [40, 117, 140].
Все больше фактов свидетельствует о том, что нарушения децидуализации лежат в основе отклонений на ранних, средних и поздних сроках беременности. Изменение функции децидуальных клеток в начале первого триместра может быть связано с последующим развитием преэклампсии. Например, аберрантная экспрессия хемокинов/цитокинов децидуальными клетками может влиять на миграцию, адгезию и выживаемость иммунных клеток эндометрия (NK-клетки матки, моноциты/макрофаги, Т-лимфоциты).
Это может привести к аномальным взаимодействиям с эпителиальными и/или эндотелиальными клетками эндометрия, в результате чего нарушаются их функции (количество, активация) и влияние на инвазию трофобласта с последующим риском развития преэклампсии [113]. Также было высказано предположение, что «менструальная предварительная подготовка» [33] защищает от развития преэклампсии. Существуют хорошие подтверждения того, что и менструация, и беременность являются воспалительными состояниями, связанными с физиологическим повреждением тканей процессами ишемии-реперфузии. Последнее особенно заметно во время беременности. Так, Бросенс с соавт. [33] предположили, что циклическая менструация защищает ткани матки от избыточного воспаления и окислительного стресса, который проявляется при глубокой плацентации, описав это термином «менструальная предварительная подготовка».
Более глубокое рассмотрение этого аспекта функции матки/эндометрия выходит за рамки данного обзора.
Концентрация циркулирующего эстрадиола снижается в течение поздней секреторной фазы, частично вследствие действия прогестерона. Прогестерон способствует превращению эстрадиола в менее биологически активную форму (эстрон; Е1) путем индукции метаболизирующих стероиды ферментов 17-гидроксистероиддегидрогеназ (HSD) [115, 133, 190, 237, 239], тем самым регулируя доступность эстрогенных лигандов. Сообщается, что прогестерон также снижает экспрессию рецепторов эстрогена (ER) [238] и тем самым дополнительно ингибирует действие эстрадиола. Таким образом, 17-HSD позволяют каждой клетке точно контролировать внутриклеточную концентрацию каждого полового стероида в соответствии с локальными потребностями тканей [133]. Децидуализация, по-видимому, является необходимым условием для менструации и происходит спонтанно у женщин и самок приматов Старого Света. У других же видов, напротив, децидуализация наблюдается только при имплантации, а менструации не возникают.
Отсутствие беременности приводит к регрессу желтого тела (формированию в яичнике рубцеподобной структуры, известной как беловатое тело, corpus albicans) и к последующему резкому снижению концентрации циркулирующего прогестерона и эстрадиола [63]. Снижение уровня эстрадиола и особенно прогестерона запускает наступление менструации (рис. 1 и 2), при которой верхний, функциональный слой эндометрия разрушается, отторгается, а затем восстанавливается.
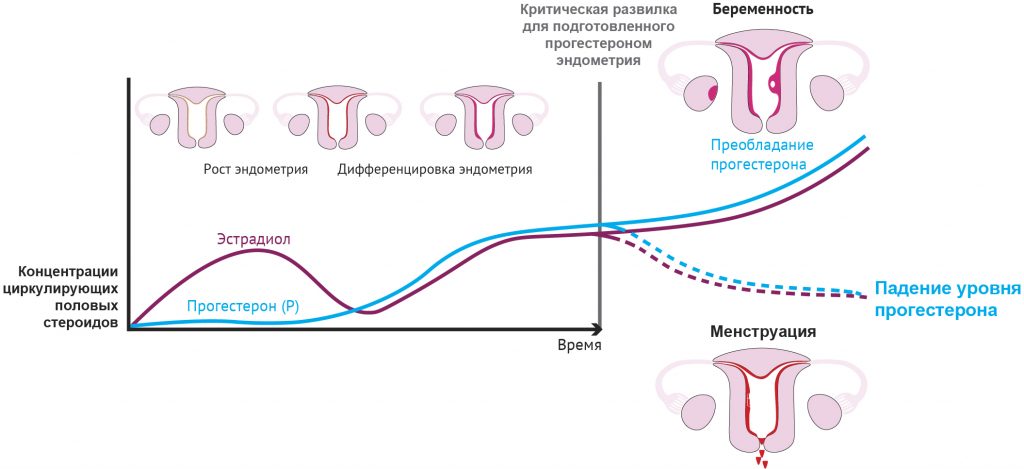
Рисунок 2 | Падение уровня прогестерона: триггер для менструации Менструация — это событие, регулируемое стероидами. Существуют лишь две альтернативы для подготовленного прогестероном эндометрия: беременность или менструация. Падение уровня прогестерона как следствие регрессии желтого тела при отсутствии беременности является триггером для менструации. Падение уровня прогестерона связано с притоком клеток врожденного иммунитета, усилением экспрессии медиаторов воспаления, включая простагландины, повышением проницаемости сосудов и разрушением тканей. Это воспалительное событие проявляется в виде менструального кровотечения. [Адаптировано из Jabbour et al.(116)]
Морфологические изменения в эндометрии сопровождаются важными молекулярными и клеточными процессами, среди которых — очаговая активация матриксных металлопротеиназ (MMP) в зонах менструального лизиса [87, 144, 241] и усиление в эндометрии локальной экспрессии медиаторов воспаления, например, циклооксигеназы-2 (ЦОГ-2) [57, 119], цитокинов/хемокинов (например, интерлейкина-8 (IL-8), CCL-2) [57], а также повышение уровня локального синтеза простагландина [222, 228]. Сигнальный путь ядерного фактора NF-κB и рецепторов простагландинов типа Е, а также связанные с ними другие сигнальные пути реагируют на снижение концентрации прогестерона и вовлечены в регуляцию менструации (см. раздел VII). Имеются данные о нарушениях некоторых из этих путей у женщин с отклонениями менструального цикла, чаще всего с ОМК [222].
Регуляция эндометрия половыми стероидами и роль местных глюкокортикоидов
Имеются данные о том, что наряду с эстрадиолом и прогестероном, которые синтезируются в яичниках и регулируют состояние и функцию эндометрия, важную роль в функционировании эндометрия играют местные стероиды, в том числе другие эстрогены [96], андрогены [97] и глюкокортикоиды [159, 193].
Клетками-мишенями для андрогенов являются стромальные клетки эндометрия. Клетки функционального слоя экспрессируют рецепторы к андрогенам (androgen receptor, AR) во время пролиферативной фазы, а клетки базального слоя — на протяжении всего менструального цикла [97, 148]. Во время секреторной фазы экспрессия AR на поверхности клеток функционального слоя ослабляется, а в эпителиальных клетках эндометрия — усиливается, поскольку при регрессии желтого тела (т. е. при отсутствии беременности) падает концентрация циркулирующего прогестерона.
Локально синтезируемые глюкокортикоиды ограничивают воспаление в других участках ткани. Эти эффекты опосредованы связыванием кортизола с рецепторами глюкокортикоидов в ядре (glucocorticoid receptor, GR) [42]. В эндометрии GR находятся в стромальных и эндотелиальных клетках, а также NK-клетках матки [107]. Фермент 11β-гидроксистероиддегидрогеназа 1-го типа (11β-HSD1) синтезирует кортизол путем ферментативного восстановления кортизона, а 11β-гидроксистероид-дегидрогеназа 2-го типа (11β-HSD2) катализирует обратную реакцию [73].
Показано, что глюкокортикоиды ингибируют ангиогенез [141, 221]. В исследованиях описана экспрессия 11β-HSD1 в эндометрии, которая усиливается при менструации и совпадает с максимальными концентрациями мРНК GR в гомогенатах тканей эндометрия [159]. Интересно, что в эндометрии женщин с ОМК наблюдается повышенная локальная инактивация кортизола ферментом 11β-HSD2 [193]. В этом исследовании уровень мРНК HSD11B2 у женщин с ОМК был в 2,5 раза выше, чем у женщин с объективно измеренной нормальной менструальной кровопотерей. Это привело к гипотезе о более низкой локальной концентрации кортизола в эндометрии у женщин с более обильными менструальными кровотечениями. Таким образом, инактивация кортизола с помощью 11β-HSD2 может вызвать местный дефицит глюкокортикоидов в эндометрии и, следовательно, усиление ангиогенеза и нарушение сужения сосудов. Впоследствии на основе этого наблюдения было проведено двойное слепое плацебо-контролируемое исследование с адаптивным дизайном на основе ответа параллельных групп [248]. В ходе исследования изучалось влияние краткосрочного перорального приема синтетического глюкокортикоида дексаметазона, относительно устойчивого к инактивации ферментом 11β-HSD2, на «спасение» эндометрия от дефицита глюкокортикоидов в лютеиновой фазе и уменьшение менструальной кровопотери (ClinicalTrials.gov NCT01769820; EudractCT 2012–003405–98).
Рецепторы эстрогена (изоформа ERα) присутствуют в ядрах эпителиальных и стромальных клеток эндометрия на протяжении всей пролиферативной фазы, во время которой доминирует эстроген. В течение секреторной фазы менструального цикла с преобладанием прогестерона уровень ERα в эпителиальных и стромальных клетках эндометрия падает, в то время как уровень рецепторов прогестерона в строме эндометрия сохраняется, но снижается в железистом эпителии [58, 60, 136, 224].
Рецепторы прогестерона (progesterone receptor, PR) находятся в ядрах эпителиальных и стромальных клеток во время пролиферативной фазы. Существует, по крайней мере, две изоформы PR — PRA и PRB, которые действуют как транскрипционные регуляторы прогестерон-чувствительных генов [102, 103]. Хорошо описаны временные и пространственные паттерны экспрессии PR [136, 224]. Во время секреторной фазы PR сохраняются в строме функционального слоя, особенно в периваскулярной области.
Экспрессия PR согласуется с функциональной ролью прогестерона в данной фазе, т. е. с дифференцировкой и децидуализацией стромальных клеток при подготовке к беременности. Иммуногистохимический анализ эндометрия человека показал, что изоформа PRA преобладает в секреторной фазе, в то время как для изоформы PRB показано снижение во второй половине менструального цикла как в клетках стромы, так и в железистом эпителии [32, 167, 246]. Таким образом, стромальные клетки эндометрия остаются чувствительными к прогестерону во время секреторной фазы. Клетки базального слоя эндометрия, напротив, стойко экспрессируют PR на протяжении всего менструального цикла [136, 224].
Проведенные на микрочипах генетические исследования эндометрия человека и мыши рассмотрены в работе Дей с соавт. [67]. Изучение эндометрия в середине секреторной фазы, обработанного in vitro децидуализированными стромальными клетками, эндометрия, обработанного ex vivo прогестероном и антагонистом PR, и тканей матки, полученных от PR-дефицитных мышей, выявило множество прогестерон-чувствительных генов, способных сохранять экспрессию PR и демонстрировать максимальную реакцию на прогестерон. В контексте регрессии желтого тела и подготовки к менструации это заставляет эндометрий реагировать на падение уровня прогестерона. Доступны подробные обзоры, рассматривающие молекулярную биологию ER и PR, их роль в функционировании женской половой системы и репродукции, особенно в контексте имплантации [20, 48, 188].
Гетерогенность клеток эндометрия
Существует тонко скоординированное взаимодействие между циркулирующими стероидными гормонами яичников и соответствующими рецепторами во множестве типов клеток [143, 152], составляющих эндометрий. Следствием этого взаимодействия являются функциональные особенности эндометрия, которые жестко регулируются «во времени и пространстве». Нарушение взаимосвязи гормонов и клеток-мишеней нередко имеет клинические последствия, такие как расстройства менструального цикла или проблемы с имплантацией.
Таким образом, учитывая гетерогенную природу эндометрия с его многочисленными клеточными компонентами, важно понимать, что каждый компонент, т. е. клетки эпителия, стромы, сосудов и иммунные клетки, обладает уникальным профилем экспрессии генов. Поэтому при проведении «-омиксных» исследований (омиксные технологии — комплекс современных технологий, включающий геномику, транскриптомику, протеомику и метаболомику — прим. пер.) с использованием образцов цельных тканей необходимо тщательно учитывать клеточный состав образцов эндометрия. Данные, касающиеся, например, профилей экспрессии генов, ассоциированных с имплантационной восприимчивостью эндометрия, продолжают уточняться, особенно по мере развития технологий и использования диагностических платформ [68]. Показано, что классические гистологические характеристики эндометрия [181] в конкретный момент взятия проб / исследования эндометрия влияют на профили экспрессии генов в тканях [7, 36, 232]. Более поздние данные описывают важные изменения в эпителиальном и стромальном компонентах между пререцептивной и рецептивной фазами эндометрия [229]. Следовательно, анализ экспрессии генов эндометрия в настоящее время является предпочтительным золотым стандартом для прогнозирования окна имплантации [7, 229]. Однако следует отметить, что на данные о профилях экспрессии генов, полученные в результате исследований цельной ткани, могут влиять пропорции клеток различных типов в биоптате эндометрия, что, в свою очередь, будет отражать изменение соотношений клеточных компонентов в течение всего менструального цикла [229]. Новая эра транскриптомики единичных клеток предвещает захватывающие открытия в отношении функции эндометрия во время менструации и имплантации [242].
Моделирование менструации на мышах
Менструация — это явление, в природе встречающееся лишь у нескольких видов млекопитающих: человека, приматов Старого Света, крыланов, иглистой мыши и слоновой землеройки. Изучение образцов эндометрия человека позволяет получить важные данные, касающиеся процесса менструации и его регуляции. Однако вариабельность состояния пациенток и нарушение нормальной архитектуры эндометрия во время взятия образцов могут ограничить результаты исследования. Для точного определения причинно-следственной связи требуется моделирование на животных. Модели на приматах Старого Света внесли значительный вклад в наши знания о функции эндометрия (см. ниже), но они дороги и требуют большого числа животных для уменьшения межиндивидуальной вариабельности [176]. Кроме того, дизайн исследования и условия содержания нечеловекообразных приматов должны соответствовать современным рекомендациям, что приводит к дополнительным издержкам. Моделирование на мышах привлекательно благодаря генетической однородности, доступности реагентов для исследований и относительно низкой стоимости. В настоящее время в распоряжении исследователей имеются три обширные категории моделей менструации на мышах.
Уже упоминавшаяся мышиная модель имитируемой менструации была первоначально разработана Финном и Поупом в 1980-х годах [83], но лишь спустя 20 лет была создана модель с более точной воспроизводимостью. В первоначальной модели [83] мышам с удаленными яичниками путем инъекций последовательно вводили эстрадиол и прогестерон для подготовки эндометрия к искусственной децидуализации. Последний этап включал внутриматочное введение арахисового масла для стимуляции децидуализации эндометрия. Модель Финна и Поупа (1984) оказалась весьма успешной, поскольку обычно в конце протокола только у одной мыши из шести не происходила децидуализация. Тем не менее, из-за вариабельности ответной реакции и плохой воспроизводимости времени децидуализации потребовалось два десятилетия, чтобы широко внедрить эту модель и вызвать к ней интерес. В 2003 г. Брастед с соавт. [24] вместо инъекций прогестерона применили подкожные силиконовые помпы, высвобождающие прогестерон (авторы разработки — Коэн и Миллиган, 1993 [46]). Использование силиконовых имплантатов для контроля выделения прогестерона обеспечило методику быстрого снижения концентрации прогестерона в матке при хирургическом удалении гормональной помпы. Этот шаг улучшил воспроизводимость времени имитированных менструальных событий, которые в этой модели следуют за снижением уровня прогестерона. В результате отмены прогестерона в эндометрии и окружающей его среде происходит множество гистологических и молекулярных изменений, аналогичных тем, которые на морфологическом уровне наблюдаются в эндометрии человека во время месячных. Происходит отторжение децидуализированного эндометрия, рекрутирование лейкоцитов [160] и видимое менструальноподобное кровотечение [54, 201]. Впоследствии вся ткань эндометрия восстанавливается, ремоделируется и регенерирует (рис. 3).
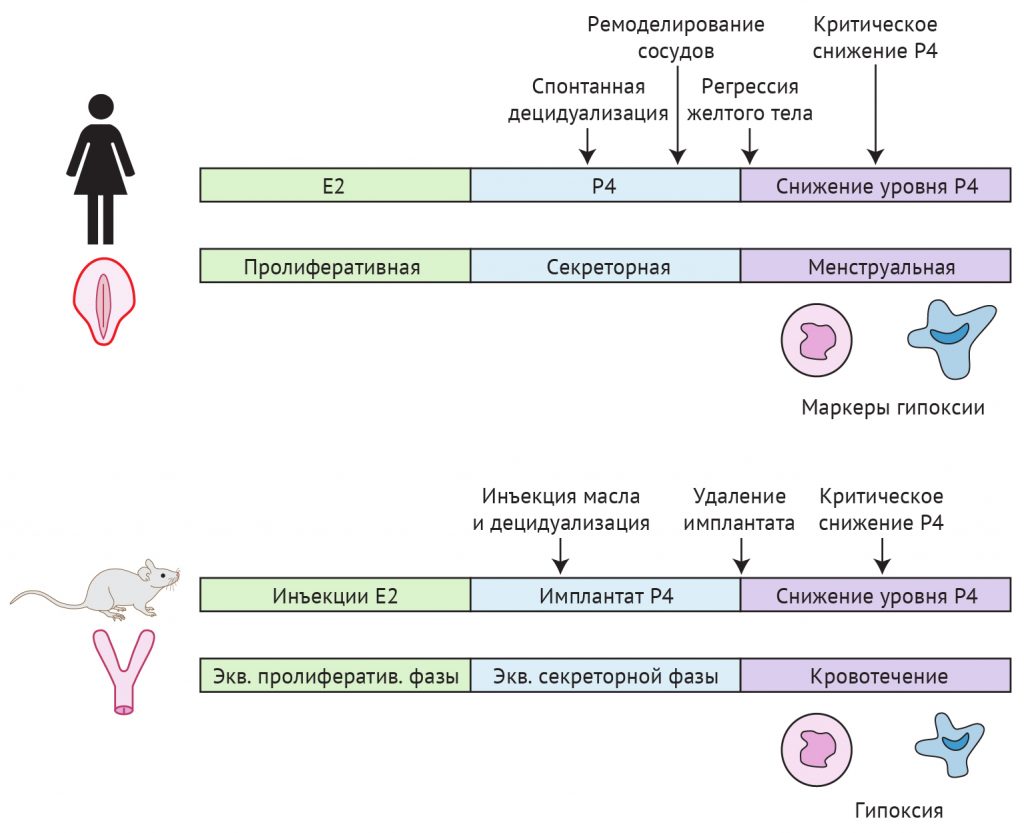
Рисунок 3 | Сравнение менструального цикла человека и модели имитируемого разрушения и восстановления эндометрия на мышах. Матка мыши двурогая, в отличие от «грушевидной» матки человека. Эндометрий человека подвергается спонтанной децидуализации, в то время как для запуска децидуализации в подготовленной матке мыши необходима трансцервикальная инъекция масла. Интенсивное сосудистое ремоделирование, происходящее у человека во время поздней секреторной фазы, в модели на мышах не наблюдается. Тем не менее в обоих случаях сопоставимы процессы кровотечения, отторжения и восстановления, а приток нейтрофилов и макрофагов выявлен в эндометрии как человека, так и мыши. Также в менструальном эндометрии человека и мыши обнаружены маркеры гипоксии. Кроме того, во время менструации у человека и в данной модели на мышах наблюдается критический период снижения Р4. Е2 — эстрадиол; Р4 — прогестерон; Экв. — эквивалент
В ходе разработки модели имитируемой менструации на мышах была установлена необходимость «этапа децидуализации», поскольку было показано, что одного лишь быстрого снижения концентрации прогестерона недостаточно для индукции эндометриального кровотечения [24, 54, 83, 160, 201]. Инъекция арахисового масла в просвет матки обеспечила индуцированное повреждение в условиях эндокринного окружения с высоким уровнем системного прогестерона и привела к преимплантационной децидуализации эндометрия мыши. Это искусственно созданное событие было аналогично естественным явлениям в середине секреторной фазы как у нечеловекообразных приматов (макаки-резусы), так и у людей. Модель имитируемой менструации на мышах подтвердила важность этапа децидуализации, происходящего перед снижением уровня прогестерона, в физиологии менструации.
В дальнейшем Брастед с соавт. (2003) усовершенствовали модель имитируемой менструации на мышах, что дало возможность изучить важные особенности менструации у человека. Эти особенности включают экспрессию медиаторов воспаления, факторы, влияющие на эндометриальное/менструальное кровотечение, а также восстановление эндометрия [45, 54, 122, 123, 125, 160, 201, 254].
Эта модель была использована для управления воспалительным ответом [122] и гормональным контролем [123] при менструации, а также для фармакологического и генетического изменения участвующих в ней ключевых факторов [157]. Данные эксперименты подтвердили и расширили результаты исследований на тканях человека, обеспечив понимание механизмов регуляции менструации и восстановления эндометрия. Параллельные наблюдения процессов в «перименструальном» эндометрии человека и эндометрии мыши при отмене прогестерона в «модели имитируемых менструаций» (рис. 3) подтверждают, что мышиная модель способна воспроизводить события менструации у человека [11].
Ксенотрансплантатная модель менструации также позволяет исследовать процесс менструации in vivo [51, 105]. В этой модели фрагменты функционального слоя эндометрия человека трансплантируются иммунодефицитным мышам с удаленными яичниками. Введение таким мышам эстрадиола и прогестерона с последующим удалением стероидов яичников приводило к разрушению ксенотрансплантированного эндометрия человека, что аналогично процессу при менструации. Явным преимуществом этой модели является возможность стандартизации гормональных изменений, которым подвергается эндометрий человека, а также возможность введения препаратов и проведения манипуляций на эндометрии таким способом, который был бы неэтичен в случае человека. Также модель позволяет исследовать местный лейкоцитарный ответ в сравнении с системным ответом путем анализа распределения лейкоцитов человека и мыши. Однако трансплантация эндометрия человека нарушает нормальную архитектуру мышиного эндометрия и может изменить сосудистые и иммунологические реакции при менструации. Кроме того, для трансплантации необходимы иммунодефицитные мыши, что еще больше изменяет местную среду эндометрия.
Совсем недавно в качестве нового модельного объекта для изучения менструации была предложена обыкновенная, или египетская, иглистая мышь [17]. У иглистой мыши обнаружена спонтанная децидуализация и циклическая менструация продолжительностью в среднем 3 дня каждые 6–10 дней. Перед менструацией наблюдалась эндометриальная трансформация стромы, соответствующая спонтанной децидуализации. Поскольку этот грызун подвержен ожирению и сахарному диабету и ранее использовался при моделировании данных состояний, для исследований на иглистых мышах уже доступны некоторые методики и реагенты. Потенциальное преимущество этой мыши по сравнению с моделями на стандартных лабораторных мышах заключается в том, что иглистая мышь позволит изучать множественные/последовательные менструальные циклы и любые подготавливающие эффекты, которые менструальные циклы будут оказывать на физиологию эндометрия. Кроме того, у иглистой мыши, как и у человека, основным циркулирующим глюкокортикоидом является кортизол, а не кортикостерон, как у обычных лабораторных мышей. Кроме того, у иглистой мыши также наблюдается ремоделирование спиральных артерий в децидуализированном эндометрии [16], и это позволяет предположить, что данный вид можно использовать в качестве модельного объекта для изучения сосудистых нарушений беременности, таких как преэклампсия. К недостаткам модели можно отнести вариабельность естественных циклов, что также затрудняет изучение человека и приматов, и невозможность на данный момент проводить генетические манипуляции над иглистой мышью, что ограничивает доказательные исследования.
Моделирование менструации на нечеловекообразных приматах
Нечеловекообразные приматы относятся к тем видам животных, у которых происходит менструация и спонтанная децидуализация эндометрия. Несколько исследований надежно доказали, что макака-резус является подходящим объектом для моделирования менструации человека. Эндометрий макак-резусов и женщин схожи в молекулярном и гистологическом аспекте в период перименструального окна (лютео-фолликулярный переход) и во время менструации. У обоих видов во время менструации наблюдается строго скоординированное, регулируемое в пространстве и времени повышение уровня экспрессии MMP [27, 200] и VEGF (фактора роста эндотелия сосудов) [175], которым предшествует резкое снижение уровня прогестерона [28–30, 60, 175, 218, 220]
Хотя сходство между человеком и макаками благоприятствует исследованиям на нечеловекообразных приматах с целью изучения механизмов, лежащих в основе менструации, новых терапевтических подходов к лечению нарушений менструального цикла и стратегий контрацепции, существуют этические соображения относительно использования приматов в экспериментах, а финансовые расходы, связанные с содержанием макак, ограничивают их полезность в качестве модели для рассматриваемого аспекта женского здоровья.
Это послужило основанием для рассмотрения альтернативных моделей, и вышеописанные модели менструации на мышах оказались привлекательными вариантами для моделирования менструации и экспериментального манипулирования процессами, лежащими в ее основе.
Резкое снижение уровня прогестерона: триггер для менструации
Эндометрий человека представляет собой ткань с физиологически повторяющимися эпизодами «повреждения и восстановления» (менструации). Падение концентрации циркулирующего прогестерона у женщин, вызванное регрессией желтого тела, является триггером менструации. Важнейшую роль резкого снижения уровня прогестерона в физиологии менструации подтверждают клинические исследования, в которых введение женщинам антагонистов PR в секреторную фазу приводило к менструальноподобному кровотечению. Введение PR-антагониста мифепристона в середине секреторной фазы повышало концентрацию медиаторов воспаления в эндометрии, включая COX-2, NF-κB и IL-8 (CXCL8) [56, 57].
Дальнейшее подтверждение роли резкого снижения уровня прогестерона в индукции менструации предоставили современные исследования на нечеловекообразных приматах (макаках-резусах) [158, 175]. В этих исследованиях менструальный цикл и менструальное кровотечение у приматов были вызваны удалением обоих яичников, 14-дневным введением эстрогена и последующей установкой прогестерон-выделяющего имплантата для имитации секреторной фазы эндометрия. Поддержание уровня эстрадиола в период отмены прогестерона (удаления прогестерон-выделяющего имплантата) показало, что при индукции менструации эффект снижения концентрации прогестерона преобладает над эффектом снижения уровня эстрадиола.
Считается, что локальные процессы в эндометрии, которые следуют за падением уровня прогестерона у женщин, происходят в две фазы [128] (рис. 4). Первая фаза после понижения концентрации прогестерона связана с усиленным локальным воздействием на эндометрий цитокинов и простагландинов (PG) и зависит от эффективной реакции децидуализированных периваскулярных стромальных клеток на падение уровня прогестерона, который является противовоспалительным гормоном [39, 77]. Хемокины — специфические цитокины-хемоаттрактанты — отвечают за передвижение лейкоцитов в эндометрии (рекрутирование, миграцию и активацию). Хемокины делят на четыре подкласса исходя из структуры их N-концевых остатков цистеина: C, CC, CXC и CX3C. Опубликованные данные исследований децидуализированных стромальных клеток эндометрия человека in vitro описывают происходящую после снижения уровня прогестерона индукцию медиаторов воспаления, включая IL-6, хемокины CCL11, CCL2, CXCL10 и CXCL8 и гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF). Этот клеточный ответ на снижение концентрации прогестерона in vitro и индукцию медиаторов воспаления управляется действием транскрипционного фактора NF-κB [127, 130; рассмотрено в работе Эванс и Саламонсен — 77]
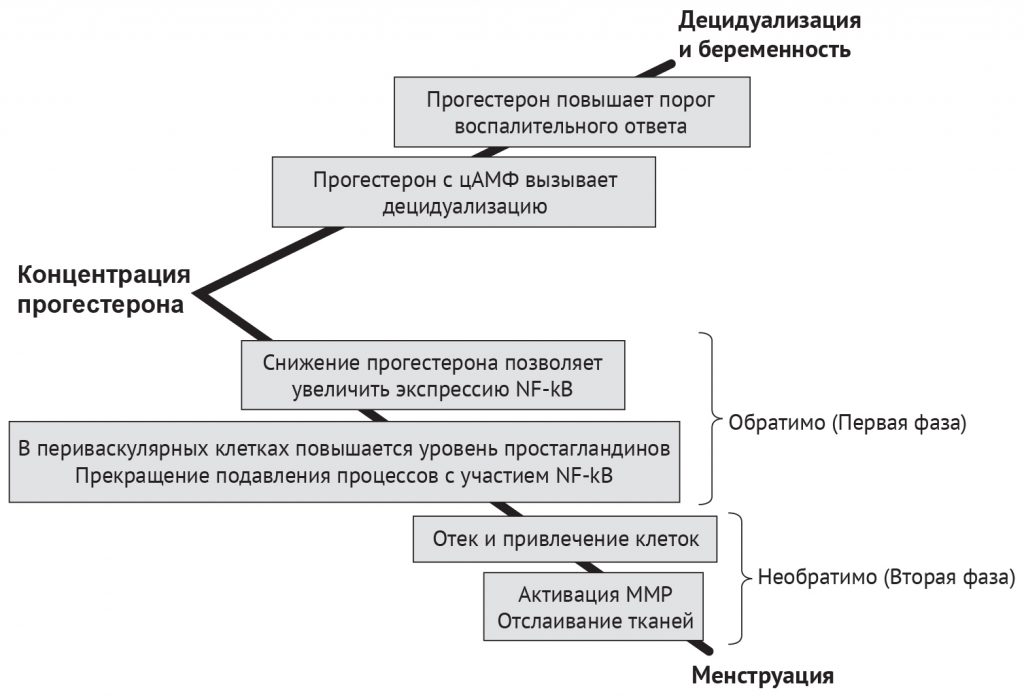
Physiological Reviews 2020.100:1149-1179 Рисунок 4 | Критический период снижения концентрации прогестерона. Обратимая первая фаза связана с усиленным локальным воздействием цитокинов и простагландинов на эндометрий и зависит от эффективной реакции децидуализированных периваскулярных стромальных клеток на снижение уровня прогестерона, противовоспалительного гормона. Необратимая вторая фаза локальных процессов в эндометрии после снижения концентрации прогестерона является следствием повышенной продукции цитокинов и притока клеток врожденного иммунитета в локальную среду эндометрия, что сопровождается активацией и высвобождением матричных металлопротеиназ (ММР) с разрушением внеклеточного матрикса. Считается, что эта фаза не зависит от взаимодействия с рецепторами прогестерона. NF-kB — ядерный фактор каппа-B [Адаптировано из Kelly с соавт. (128)]
В контексте менструации и функции эндометрия прогестерон оказывает ингибирующее действие на путь NF-κB [128, 130], увеличивая концентрацию IκB или конкурируя за сайты распознавания NF-κB на генах. Снижение уровня прогестерона после регрессии желтого тела ослабляет ингибирование и приводит к повышению активности NF-κB и, как следствие, к выработке в эндометрии цитокинов и хемокинов. Также показано, что транскрипционный фактор NF-κB важен для контроля продукции ММР-1, ММР-3 и ММР-9 [43], обеспечивая тем самым путь, посредством которого снижение концентрации прогестерона способствует повышению активности ММР эндометрия.
Вторая фаза локальных процессов в эндометрии после резкого снижения уровня прогестерона (рис. 4) является следствием увеличения выработки цитокинов и сопровождается притоком клеток врожденного иммунного ответа в локальную среду эндометрия, а также активацией и высвобождением MMP с разрушением внеклеточного матрикса (ВКМ). Считается, что эта вторая фаза не зависит от воздействия на рецепторы прогестерона (рис. 4); данная гипотеза подтверждена в исследованиях нечеловекообразных приматов (макаки-резусы) с удаленными яичниками и в модели на мышах. У нечеловекообразных приматов прогестероновые имплантаты удаляли в конце моделируемого менструального цикла и затем вводили новые в различных временных точках от 12 до 72 ч после первоначального удаления имплантата [218]. Исследование на макаках показало, что замена прогестеронового имплантата в течение 24 ч предотвращала как менструацию, так и ожидаемое повышение содержания MMP-1, -2 и -3 в эндометрии. В противоположность, замена прогестеронового имплантата спустя 36 ч после удаления не влияла на менструальное кровотечение и лишь частично блокировала выработку MMP, заметно уменьшая концентрацию MMP-2 в эндометрии. Также в мышиной модели имитируемой менструации воспроизводимо продемонстрирована возможность остановки локальных процессов в эндометрии, происходящих при резком снижении уровня прогестерона [247]. В том же исследовании на мышах показан и «временной порог отсутствия прогестерона» [247], при достижении которого менструальное кровотечение становится неизбежным.
Децидуализированные стромальные клетки, характерные для предменструального эндометрия, являются ключевым компонентом чувствительности эндометрия к циркулирующим гормонам. Отсюда можно предложить механизм, посредством которого прогестерон-зависимые децидуализированные стромальные клетки эндометрия (экспрессирующие PR) влияют на рекрутирование клеток врожденного иммунитета перед менструацией. Это подтверждает исследование, в котором Эванс и Саламонсен [77] имитировали лютеиновую фазу путем децидуализации клеток при 12-дневном воздействии эстрадиола и прогестина (медроксипрогестерона ацетат). При последующей отмене гормонов наблюдалось прогнозируемое увеличение уровня NF-κB наряду с ожидаемой выработкой воспалительных цитокинов и хемокинов. Усиленная продукция медиаторов воспаления прекратилась после введения ингибитора NF-κB.
Менструация как воспаление
Под воспалением понимается общий ответ иммунной системы на вредоносные внешние раздражители, направленный на устранение инфекции, регенерацию поврежденных тканей и восстановление физиологических функций. Воспалительные реакции разделяют на «острые» и «хронические». Острая реакция представляет собой кратковременный, первоначальный ответ на повреждающие стимулы, а хроническая реакция — длительный ответ, включающий поддержание уровня определенных иммунных клеток в месте воспаления наряду с опосредованным хозяином разрушением и/или фиброзом тканей, что в конечном итоге может привести к потере функции [34]. Для всего организма крайне важно эффективное разрешение воспаления после успешного удаления вредоносных раздражителей, чтобы ограничить повреждение тканей и восстановить их целостность и функцию. На клеточном уровне процесс острого воспаления включает быстрое рекрутирование нейтрофильных гранулоцитов, за которыми вскоре следуют воспалительные моноциты, дифференцирующиеся в макрофаги, пролиферирующие in situ и управляющие продолжающимся воспалительным ответом и его разрешением [98]. Молекулярные медиаторы острого воспаления, продуцируемые локально в тканях и рекрутируемыми лейкоцитами, включают простаноиды (простагландины и простациклины), липидные медиаторы, комплемент, цитокины и хемокины. Медиаторы воспаления, которые вырабатываются локально в эндометрии во время лютео-фолликулярного перехода, то есть во время индуцированного снижением прогестерона отторжения эндометрия (менструации), могут действовать по отдельности или совместно и обуславливать воспалительный ответ путем индукции вазодилатации, изменения экспрессии молекул клеточной адгезии и, в конечном итоге, привлечения лейкоцитов [50, 57, 88, 120, 162, 212].
Разрешение воспаления в эндометрии координируется не менее жестко, чем воспалительный ответ в других местах организма. Как и в прочих тканях, синтез провоспалительных медиаторов сокращается, а существующие медиаторы воспаления деградируют, ограничивая рекрутирование лейкоцитов и восстанавливая целостность сосудов. Простаноиды эндометрия подвергаются катаболизму посредством ряда реакций окисления и восстановления [8, 75], а устранение хемокинов осуществляется путем их захвата апоптотическими лейкоцитами через рецепторы хемокинов [10]. Местное разрешение воспаления также включает фагоцитоз апоптотических нейтрофилов. Распознавание апоптотических клеток макрофагами во время фагоцитоза модулирует фенотип макрофагов и способствует высвобождению противовоспалительных и способствующих разрешению воспаления цитокинов, таких как IL-10 и TGF-β [114], наряду с липидными медиаторами, например, липоксинами и резольвинами [34].
Полезность и надежность моделирования менструации человека на мышах описана в недавнем исследовании, где процессы апоптоза и воспаления в эндометрии человека в период перименструального окна были изучены как в эндометрии женщин в фазе менструации и при кровотечении, так и в эндометрии мышей после отмены прогестерона в модели имитируемой менструации [11]. Показано, что пространственно-временная регуляция апоптоза в нормальном эндометрии человека воспроизводится в эндометрии в модели имитируемой менструации на мышах, поскольку интенсивный апоптоз эндометрия (оцениваемый по экспрессии расщепленной каспазы 3) до начала разрушения, отторжения и кровотечения наблюдался как у людей, так и у мышей.
Кроме того, усиление транскрипции воспалительных хемокинов менструальной фазы (CXCL8, CCL2, Cxcl1) и транскрипции воспалительных цитокинов (TNF, IL-6, Tnf) наблюдалось как в хорошо изученном нормальном эндометрии человека, так и в эндометрии в модели менструации на мышах [11]. Такое усиление экспрессии хемо- и цитокинов в ответ на снижение уровня прогестерона у человека и мыши сопровождалось существенным увеличением количества нейтрофилов при наступлении менструации / симуляции менструации у мышей. Аналогичный ответ лейкоцитов и мононуклеарных фагоцитов в зонах активной репарации был описан и при моделировании менструации на мышах [53].
Менструация является физиологической моделью самоограничивающегося воспаления. В менструальном эндометрии наблюдается множество классических признаков воспаления, включая отек тканей и приток иммунных клеток. Воспалительный процесс, происходящий в эндометрии во время менструации, жестко регулируется, чтобы предотвратить потерю функции [55, 116].
Предположение о том, что менструация представляет собой воспалительный процесс [81], получило дополнительную поддержку за последние три десятилетия благодаря многим важным открытиям, касающимся молекулярных и клеточных изменений в эндометрии, которые сопровождают воспаление и включают в себя очаговую активацию MMP [87, 144, 241], повышенную экспрессию ЦОГ-2 [57, 119], увеличение концентрации простагландинов [228] и вовлечение локальной гипоксии тканей [52, 59, 93, 154, 157] (см. ниже).
Усиленная экспрессия местных воспалительных хемокинов и цитокинов эндометрия совпадает со снижением уровня прогестерона. Доказано усиление экспрессии CCL2 (MCP-1), CXCL8 (IL-8), IL-6, TNF и COX-2 в поздней секреторной и менструальной фазах менструального цикла [11, 57, 119, 162].
В эндометрии человека мРНК и белок CXCL8 [9, 154] в выявляемых концентрациях присутствуют в течение всего менструального цикла в стромальных [9, 154] и периваскулярных клетках, а экспрессия CXCL8 достигает максимума после снижения уровня прогестерона [162]. Максимальная транскрипция и экспрессия цитокина IL-6 в эндометрии отмечена в поздней секреторной фазе менструального цикла [243], при этом белок локализован в железах эндометрия и их секрете [244]. Вероятно, определенную роль в менструации играет TNF, обнаруженный в стромальных и эпителиальных клетках эндометрия человека [231]. Есть данные о повышенном уровне мРНК TNF в эндометрии во время поздней секреторной фазы [243]. Однако ни в одном из вышеуказанных исследований не были изучены образцы, взятые в менструальной фазе. Недавно Амстронг с соавт. [11] описали усиление транскрипции CCL2, CXCL8, IL6 и TNF в эндометрии во время менструальной фазы у женщин с объективно измеренной нормальной менструальной кровопотерей. Эти результаты были воспроизведены в модели имитируемой менструации на мышах: наблюдалось повышение уровня транскрипции Tnf (TNF) и хемокина нейтрофилов Cxcl1 (KC; GRO-α), который у мышей является гомологом CXCL8 человека (183, 225).
Хемокины, выработка которых максимальна при менструации, выполняют целый ряд функций, не только рекрутируя лейкоциты, но и способствуя местной пролиферации клеток и ангиогенезу. Например, CXCL8 (IL-8), наряду с хорошо описанной способностью вызывать хемотаксис лейкоцитов, активно участвует в местном ангиогенезе [131] и в индукции хемотаксиса и пролиферации гладкомышечных клеток сосудов [255].
Трафик лейкоцитов эндометрия
Лейкоциты эндометрия играют важнейшую роль в его функционировании, включая не только разрушение ткани эндометрия, но и его восстановление [204] и инвазию эмбриона [214]. Лейкоциты, рекрутированные во время перименструального окна, являются неотъемлемыми компонентами процесса восстановления эндометрия. Ключевую роль локальной популяции (популяций) иммунных клеток эндометрия продемонстрировало наблюдение, что истощение пула нейтрофильных гранулоцитов замедляет восстановление эндометрия в модели имитируемой менструации на мышах [122]. Также интересно, что в модели повреждения миокарда на мышах заживление ран нарушалось из-за истощения популяции макрофагов. Можно было бы обоснованно предположить аналогичную ситуацию, если бы во время менструации человека наблюдалось истощение популяции или недостаток макрофагов, но этот феномен еще предстоит продемонстрировать [240].
Возможно, что местная доступность биоактивных глюкокортикоидов также играет роль во взаимодействиях иммунных клеток с клетками сосудов в эндометрии во время восстановления тканей при менструации, и такое действие может быть прямым или косвенным — опосредованным функциями тканевых резидентных макрофагов [235]. Макрофаги эндометрия экспрессируют рецепторы глюкокортикоидов, но не рецепторы прогестерона [235]. Имеются данные, которые обращают внимание на важность местного кортизола в регуляции паракринного действия макрофагов в эндометрии человека. Исследования in vitro показали, что культура с супернатантом из обработанных кортизолом макрофагов, происходящих из моноцитов периферической крови, изменяет в эндотелиальных клетках эндометрия транскрипцию генов ангиогенеза, например, CXCL2, CXCL8, CTGF и VEGFC. Белки CXCL2 и CXCL8 также обнаружены в макрофагах эндометрия in situ [235]. Экспрессия этих факторов в эндометрии была максимальной во время фазы менструации, что согласуется с их ролью в восстановлении эндометрия в данный период.
Размер популяции лейкоцитов эндометрия варьирует в течение менструального цикла [152]. Первоначально популяцию лейкоцитов эндометрия в пролиферативной фазе, когда число лейкоцитов ниже всего, описывали как изменяющуюся между 8,2 % [35] и 10–15 % [126] от числа стромальных клеток эндометрия. Напротив, непосредственно перед началом менструации, когда число лейкоцитов наиболее велико, количество иммунных клеток варьирует от 20–25 % [126] до 40–45 % популяции стромальных клеток эндометрия [23, 203]. Однако количественная оценка популяций клеток иммунной системы эндометрия сопряжена с весьма серьезными проблемами, обусловленными значительным влиянием стадии эндокринного цикла яичников, а также большой неоднородностью распределения клеток в многоклеточном эндометрии. Сообщается о попытках решения проблемы количественной оценки конкретных типов иммунных клеток в эндометрии, например, NK-клеток матки, что имеет важное значение для клинической практики [135]. Такие измерения проводятся у женщин в контексте лечения бесплодия, но, насколько известно, они не имеют отношения к жалобам на нарушения менструального цикла или менструального кровотечения. Любой значимый клинический тест для подсчета NK-клеток матки, независимо от клинического контекста, потребует стандартизированного метода для установления границ нормы числа NK-клеток матки. Это будет непростой задачей из-за неоднородности распределения NK-клеток матки в эндометрии и, как отмечено выше, из-за изменения числа клеток в разные фазы менструального цикла.
Нейтрофильные гранулоциты в значительном количестве рекрутируются в эндометрий непосредственно перед менструацией [191], и такое привлечение лейкоцитов совпадает со снижением уровня прогестерона [11]. Нейтрофилы содержат высокие уровни MMP, а в эндометрии они могут активировать MMP in situ [88], тем самым способствуя разрушению эндометрия во время менструации.
Макрофаги присутствуют в эндометрии на протяжении всего менструального цикла, и с началом менструации их количество незначительно увеличивается [11, 152, 203, 234]. Фагоцитоз апоптотических клеток макрофагами необходим для разрешения воспаления в других тканях [206] и, следовательно, может иметь важное значение для разрешения связанного с менструацией воспаления в эндометрии. После менструации макрофаги вычищают продукты клеточного распада [92] и способствуют ремоделированию и восстановлению функционального слоя эндометрия [156].
Считается, что в популяцию макрофагов в эндометрии вносят вклад два различных источника: это пролиферация резидентных макрофагов in situ [64, 118, 161] и макрофаги, возникшие из привлеченных в ткань моноцитов [70, 209]. Известно, что макрофаги пролиферируют in situ и в других воспалительных условиях, например в присутствии IL-4 в ходе воспалительного ответа Th2-клеток [118]. Доказательства пролиферации in situ в менструальном эндометрии получены в результате экспериментов, в которых эндометрий человека был ксенотрансплантирован мышам с ослабленным иммунитетом [105]. Мышей подвергали воздействию гормональной среды, имитирующей человеческий менструальный цикл, и число макрофагов человека было наибольшим на 28-й день такого имитированного цикла. Резидентные макрофаги эндометрия человека экспрессируют β-изоформу ER [104], и всем макрофагам эндометрия свойственна положительная реакция при иммуноцитохимическом окрашивании на GR [235].
Среди хемотаксических стимулов, с помощью которых моноциты попадают в эндометрий, выделяют CCL2 (MCP-1), который интенсивно экспрессируется в эндометрии поздней секреторной фазы [119]. Сообщается, что популяции макрофагов эндометрия относительно стабильны в течение всего менструального цикла, причем их численность увеличивается только в поздней секреторной / менструальной фазе и в ранней пролиферативной фазе менструального цикла [25]. Следует отметить, что авторы данного исследования объединили образцы тканей поздней секреторной и менструальной фаз в одну группу. В более поздней работе [47] описано значительное увеличение численности макрофагов только во время менструальной фазы.
Амстронг с соавт. [11] охарактеризовали закономерности локализации макрофагов в период перименструального окна (лютео-фолликулярного перехода) и описали миграцию клеток врожденного иммунитета в направлении желез, подвергающихся апоптозу (рис. 5), с последующим передвижением наружу в строму (рис. 6).
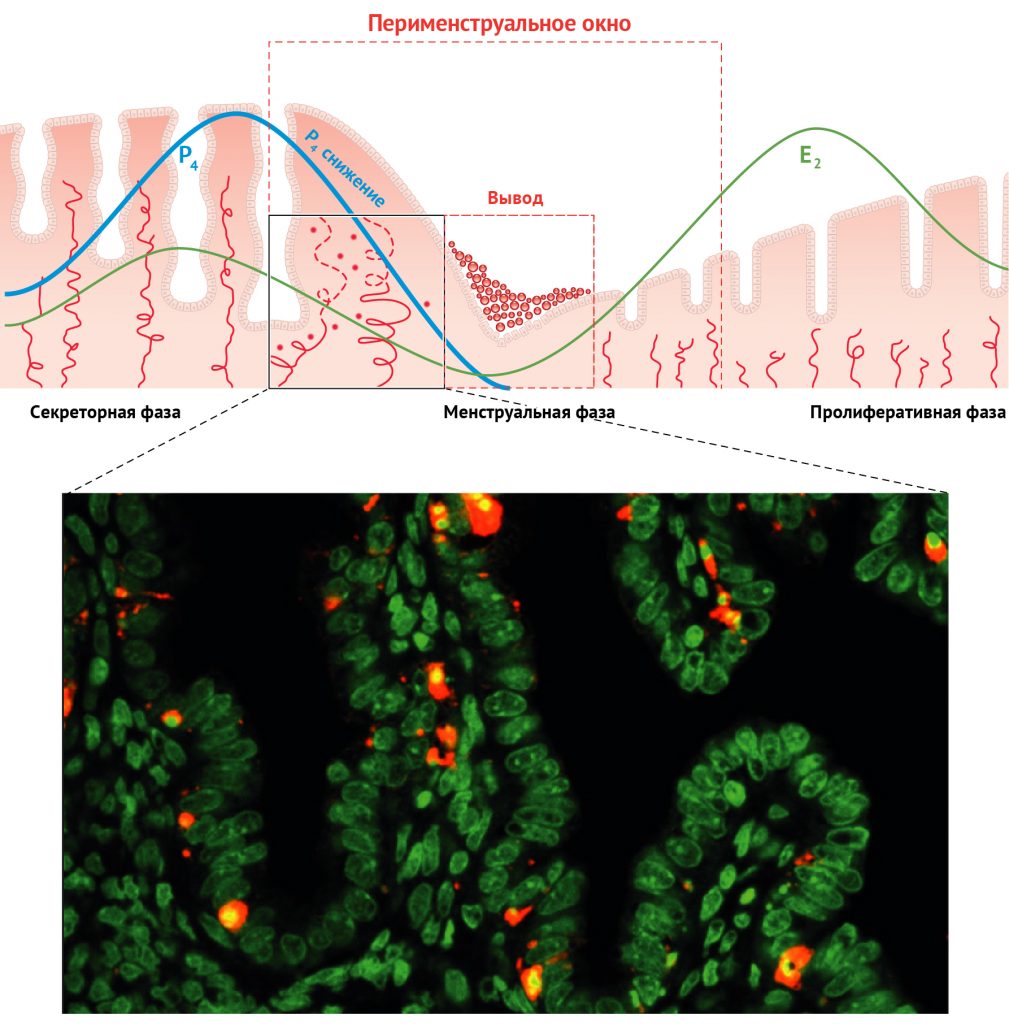
Рисунок 5 | Апоптоз в железах и строме эндометрия человека в поздней секреторной фазе предшествует отторжению эндометрия при менструации. Вверху: черный квадрат на диаграмме обозначает позднюю секреторную фазу. Внизу: репрезентативная иммунофлуоресцентная микрофотография расщепленной каспазы-3 (красный цвет — маркер апоптоза, положительная иммунореактивность расщепленной каспазы-3) эндометрия человека в поздней секреторной фазе (день менструального цикла 29). Контрастирующая окраска ядер: Sytox Green (зеленый; Molecular Probes Inc.)
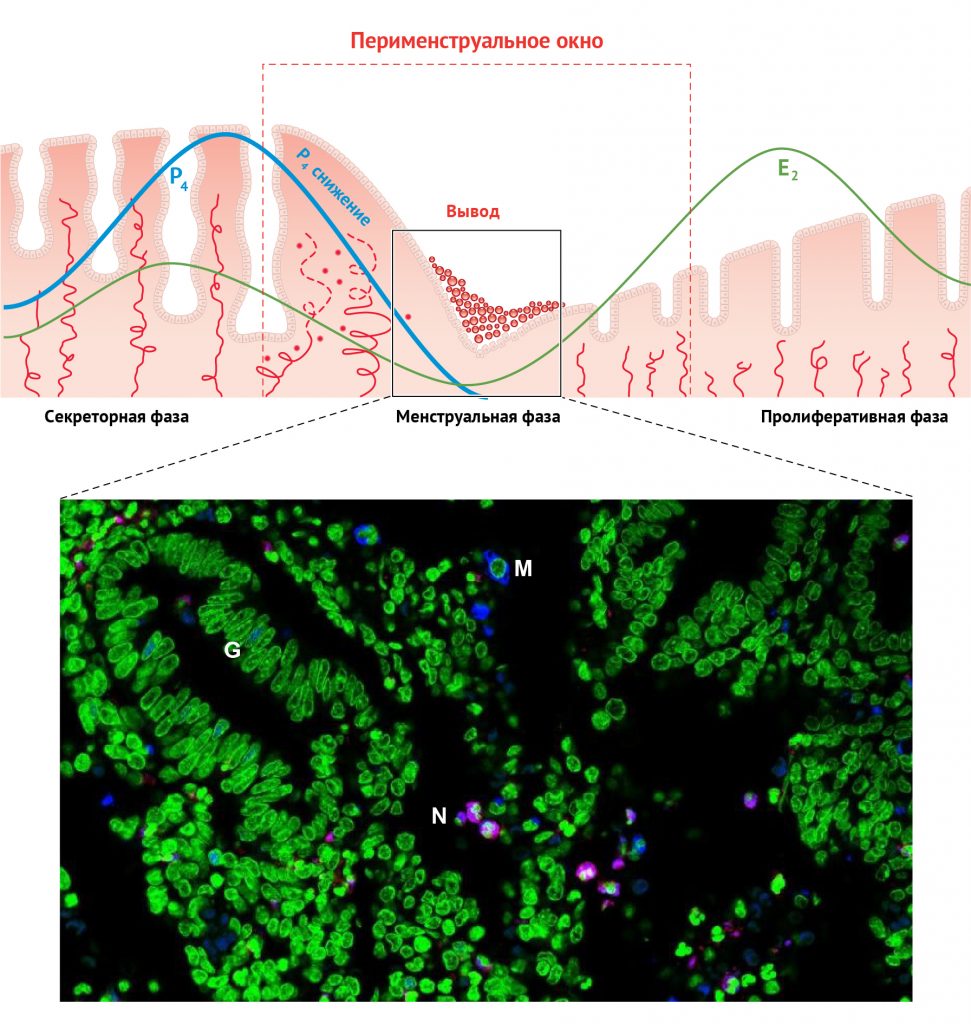
Рисунок 6 | Нейтрофилы и макрофаги в изобилии присутствуют в эндометрии человека во время менструальной фазы. Вверху: черный квадрат на диаграмме обозначает менструальную фазу. Внизу: репрезентативная иммунофлуоресцентная микрофотография CD68-клеток (синий; маркер макрофагов, CD68-положительная иммунореактивность) и эластазы (фиолетовый; маркер нейтрофилов, эластаза-положительная иммунореактивность) в менструальной фазе эндометрия человека (день менструального цикла 1). Обозначения: G — железы эндометрия, М — макрофаги, N — нейтрофилы. Контрастирующая окраска ядер: Sytox Green (зеленый; Molecular Probes Inc.)
Таким образом, резидентные и рекрутированные популяции лейкоцитов имеют решающее значение для разрушения эндометрия посредством экспрессии и активации MMP, а также для его восстановления путем модулирования локальной экспрессии ангиогенных факторов и очистки от продуктов клеточного распада. Число этих лейкоцитов, среди которых наиболее многочисленны нейтрофилы и макрофаги, выше всего перед менструацией и во время нее.
Мезенхимально-эпителиальный переход как критический фактор в определении функции эндометрия
Свойства повторного (физиологического) восстановления и ремоделирования эндометрия человека в последнее время были предметом внимания в контексте мезенхимально-эпителиального перехода (МЭП) и эпителиально-мезенхимального перехода (ЭМП). Важнейшее физиологическое событие — менструация — является прекрасным примером того, насколько для успешного функционирования эндометрия необходим переход между мезенхимальным и эпителиальным фенотипом клеток. В недавнем обзоре по этой теме подробно рассмотрена историческая перспектива исследований, связанных с переходом клеточных фенотипов в контексте репродукции [185], а также фундаментальные работы в области заживления ран. В конце концов, менструирующий эндометрий является физиологическим примером поврежденной «раненой» поверхности, которая должна быстро восстанавливаться каждый месяц.
Были охарактеризованы маркеры как мезенхимальных, так и эпителиальных клеток. Фенотипически мезенхимальная клетка имеет веретенообразную, многополярную форму и способна к инвазии и миграции. Эпителиальная клетка, напротив, представляет собой многоугольник с апико-базолатеральной поляризацией и способностью к межклеточной адгезии. Мезенхимальные маркеры включают виментин, фибронектин, Snail 1 и Snail 2, гладкомышечный актин [137, 185] и N-кадгерин; эпителиальные маркеры — цитокератины [8, 9, 18] и Е-кадгерин [137, 185]. В экспериментах in vitro показано, что в контексте регенерации эндометрия N-кадгерин является специфическим поверхностным маркером для клеток-предшественников эпителия в составе эндометрия. Кроме того, в том же исследовании изучение полнослойных (от просвета до соединения эндометрий/миометрий) гистерэктомических срезов показало, что N-кадгерин является маркером клеток-предшественников эпителия в железах в пределах базального слоя эндометрия [178].
При менструации верхний функциональный слой эндометрия отторгается. Как описано ранее, это событие запускается резким снижением уровня прогестерона и согласованной последовательностью провоспалительных событий [55, 152, 202, 204]. Вслед за этим следует регенерация эндометрия. Накапливаются доказательства существования популяций стволовых клеток или клеток-предшественников, расположенных как в верхнем функциональном слое, так и в нижнем базальном слое вблизи соединения эндометрий/миометрий [41, 90, 149, 186], а также в базальном и функциональном слоях в периваскулярных областях. Таким образом, для регенерации эндометрия требуется несколько типов стволовых клеток или клеток-предшественников, включая циркулирующие клетки костномозгового происхождения [5, 71, 233]. Также охарактеризована популяция стволовых клеток, полученная из менструальных выделений, и, как сообщается, эти клетки обладают ангиогенными и провоспалительными свойствами [6, 187]. В менструальных выделениях присутствуют и клетки функционального слоя эндометрия. Описан транскриптом единичных клеток, полученных с помощью лазера из функционального и базального слоя эндометрия [87]. В данном транскриптомном исследовании наряду с генными продуктами апоптоза были выявлены продукты генов, связанных с деградацией тканей (например, системы матриксных металлопротеиназ и плазмина). Клетки функционального слоя были обогащены продуктами генов, связанных с биосинтезом ВКМ (коллагенами и ферментами их созревания). Эти данные согласуются с гипотезой о том, что клеточные фрагменты функционального слоя способствуют регенерации эндометрия на позднем этапе менструации. Дальнейшее обсуждение стволовых клеток и клеток-предшественников эндометрия выходит за рамки данного обзора [65, 90].
Роль МЭП в процессе регенерации эндометрия изучалась в мышиной модели имитируемой менструации [54]. В этой модели процесс децидуализации индуцируется искусственно, а снижение концентрации прогестерона обеспечивается путем удаления имплантата. Обнаружено, что стромальные клетки эндометрия мыши, расположенные рядом с областями восстановления эпителия просвета, экспрессируют маркеры как эпителиальных, так и стромальных клеток. Кроме того, отмечено снижение числа мезенхимальных маркеров и увеличение количества маркеров эпителиальных клеток, что подтверждает идею об основополагающей роли МЭП в регенерации эндометрия [54].
