Шаронова Людмила Александровна
В настоящее время отмечается прогрессивный рост числа больных сахарным диабетом (СД). По прогнозам Международной диабетической ассоциации, к 2040 г. их количество во всем мире увеличится до 642 млн человек, преимущественно за счет больных СД типа 2 [1]. Также в настоящее время отмечается увеличение числа больных гипотиреозом. Распространенность манифестного гипотиреоза в популяции составляет 0,2-3% [2]. Эти заболевания ассоциированы с избыточной массой тела, гиперинсулинемией, дислипидемией, приводящим к тяжелому атеросклеротическому поражению сосудов и дисметаболическим изменениям миокарда [3].
Цель – оценить взаимосвязь адипокинов и эхокардиографических показателей у больных СД 2 типа и гипотиреозом.
Материал и методы
Были обследованы 20 мужчин в возрасте от 38 до 64 лет. В 1-ю группу вошли 10 мужчин с гипотиреозом, медиана возраста которых составила 54,00 (43,00; 60,25) года, индекс массы тела (ИМТ) – 32,11 (25,86; 38,63) кг/м2. 2-ю группу составили 10 мужчин с СД типа 2 с медианой возраста 57,00 (50,25; 62,00) лет, ИМТ – 30,30 (27,19; 33,80) кг/м2. Контролем служили результаты обследования 30 практически здоровых мужчин, которые были разделены на 2 группы. В 1-ю (младшую) контрольную группу вошли 20 мужчин, медиана возраста которых была 21,00 (20,00; 21,00) год и ИМТ – 22,92 (21,00; 24,85) кг/м2. 2-ю (старшую) контрольную группу составили 10 мужчин с медианой возраста 54,00 (51,00; 56,00) года и ИМТ – 26,10 (24,60; 29,70) кг/м2.
Диагноз “сахарный диабет типа 2” был поставлен на основании критериев Всемирной организации здравоохранения (ВОЗ) (2013) [4]. Диагноз “первичный гипотиреоз” устанавливался в соответствии с классификацией гипотиреоза, на основании данных клинико-лабораторного обследования [5]. Критериями исключения из исследования были: инсулинотерапия, выраженные нарушения функции печени и почек, тяжелые хронические заболевания легких, перенесенный инфаркт миокарда, пороки сердца.
В группе пациентов с гипотиреозом все мужчины получали лечение препаратами L-тироксина. Медиана дозы L-тироксина составила 150,0 (109,38; 190,62) мкг. У 7 (70,0%) мужчин причиной гипотиреоза был хронический аутоиммунный тиреоидит, у 3 (30,0%) – снижение функции щитовидной железы было послеоперационным. Все больные СД типа 2 на момент обследования находились на таблетированной сахароснижающей терапии (препаратами сульфонилмочевины, бигуанидами, ингибиторами ДПП-4). У 100% обследованных с СД типа 2 и 70% пациентов с гипотиреозом была диагностирована артериальная гипертензия I и II степени, в связи с чем данные пациенты получали гипотензивную терапию [ингибиторы ангиотензин-превращающего фермента (иАПФ), блокаторы кальциевых каналов, диуретики]. Диагноз “артериальная гипертензия” верифицировался в соответствии с рекомендациями Всероссийского научного общества кардиологов (ВНОК) по диагностике и лечению артериальной гипертензии (2010).
У всех обследованных определялись антропометрические показатели: рост, масса тела, окружность талии (ОТ), окружность бедер (ОБ), с дальнейшим расчетом соотношения ОТ/ОБ и ИМТ по формуле (ВОЗ, 1997):
ИМТ = масса тела (кг)/рост (м2).
Степень ожирения оценивалась по классификации ВОЗ (1997): при значении ИМТ 25-29,9 кг/м2 диагностировали избыточную массу тела, 30-34,9 кг/м2 – I степень ожирения, 35-39,9 кг/м2 – II степень ожирения, 40 кг/м2 и более – III степень ожирения. Тип ожирения определяли по соотношению ОТ/ОБ: глютеофеморальный тип диагностировали при ОТ/ОБ менее 0,95, абдоминальный – при ОТ/ОБ 0,95 и более.
У всех пациентов производился забор крови из локтевой вены утром натощак. Концентрация глюкозы в плазме определялась глюкозооксидазным методом на биохимическом анализаторе “Erba XL-200” (Erba Lachema, Чехия). Уровень иммунореактивного инсулина (ИРИ) исследовался методом иммуноферментного анализа на аппарате “Architect i1000SR” (Abbot, Германия). Инсулинорезистентность (ИР) оценивали по индексу HOMA-IR, который рассчитывался по формуле:
HOMA-IR = ИРИ х гликемия натощак / 22,5.
Уровень общего холестерина, холестерина липопротеинов низкой плотности (ЛПНП), триглицеридов, холестерина липопротеинов высокой плотности (ЛПВП) определялись спектрофотометрическим методом на биохимическом анализаторе “Screen Master Plus” (Hospitex diagnostic, Швейцария). На основании полученных результатов по формуле: КА = (ОХ – ЛПВП) / ЛПВП рассчитывался коэффициент атерогенности (КА). Уровень адипонектина, лептина и резистина в сыворотке крови исследовался методом иммуноферментного анализа на аппарате “Expert Plus” (Asys, Австрия).
Пациентам с гипотиреозом и СД типа 2 проводилось эхокардиографическое исследование на аппарате Logic7 в стандартных позициях. Количественная оценка показателей эхокардиографии осуществлялась согласно совместным рекомендациям Европейской эхокардиографической ассоциации и Американского эхокардиографического общества [6]. Контролем служили результаты обследования 20 здоровых мужчин, средний возраст которых составил 22,00 (21,00; 22,00) года. Морфометрические показатели левого желудочка (ЛЖ) оценивались по толщине межжелудочковой перегородки в диастолу и систолу (МЖПд, МЖПс), толщине задней стенки левого желудочка в диастолу и систолу (ЗСЛЖд и ЗСЛЖс), конечному диастолическому и конечному систолическому размерам ЛЖ (КДР и КСР), предсердно-желудочковому соотношению (ЛП/КДР). Объемно-функциональные показатели ЛЖ оценивались по массе миокарда левого желудочка (ММЛЖ), индексу ММЛЖ (ИММЛЖ), конечному диастолическ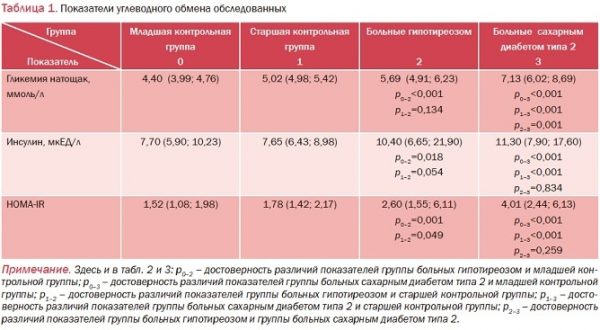 ому и систолическому объему (КДО, КСО), отношению КДО/ММЛЖ. Критерием гипертрофии миокарда ЛЖ было наличие 2 из 3 показателей: гипертрофия стенок ЛЖ (МЖПд и/или ЗСЛЖд), увеличение ММЛЖ и ИММЛЖ более 115 г/м2 для мужчин [6]. О сократительной способности миокарда ЛЖ судили по фракции выброса (ФВ), в норме ФВ >55%. Оценивались величины максимальных скоростей раннего (Е) и позднего (А) наполнения. Отношение скоростей Е/А менее 1,0 расценивалось как признак диастолической дисфункции ЛЖ.
ому и систолическому объему (КДО, КСО), отношению КДО/ММЛЖ. Критерием гипертрофии миокарда ЛЖ было наличие 2 из 3 показателей: гипертрофия стенок ЛЖ (МЖПд и/или ЗСЛЖд), увеличение ММЛЖ и ИММЛЖ более 115 г/м2 для мужчин [6]. О сократительной способности миокарда ЛЖ судили по фракции выброса (ФВ), в норме ФВ >55%. Оценивались величины максимальных скоростей раннего (Е) и позднего (А) наполнения. Отношение скоростей Е/А менее 1,0 расценивалось как признак диастолической дисфункции ЛЖ.
Статистическую обработку полученных данных выполняли на компьютере с помощью Microsoft Excel 2007 и пакета программ SPSS 11.5 (SPSS Inc., США). Оценивали нормальность распределения с использованием критерия Шапиро-Уилка. Полученные количественные признаки имели распределение, отличное от нормального, в связи с чем статистическую обработку данных осуществляли непараметрическими методами. При описании полученных результатов использовали медиану, 25-й и 75-й процентиль [Ме (25; 75)]. Достоверность различий между группами оценивали с помощью критерия Манна-Уитни. Для корреляционного анализа использовали критерий Спирмена. При проверке всех гипотез использовался уровень значимости р<0,05.
Результаты и обсуждение
По результатам антропометрического обследования установлено, что у мужчин с гипотиреозом и СД типа 2 ИМТ достоверно превышал контрольные значения (p<0,05) и соответствовал I степени ожирения [32,11 (25,86; 38,63) и 30,30 (27,19; 33,80) соответственно]. Также у пациентов этих 2 групп ОТ была более 94 см [105,00 (92,00; 121,00) и 106,00 (99,50; 115,25) соответственно], а отношения ОТ/ОБ больше 0,95 [0,97 (0,91; 1,00) и 1,00 (0,96; 1,03) соответственно], что по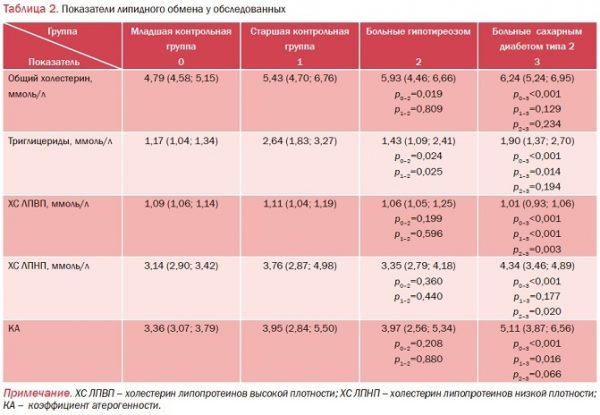 зволило диагностировать у них висцеральный тип ожирения.
зволило диагностировать у них висцеральный тип ожирения.
У пациентов с гипотиреозом уровень глюкозы плазмы достоверно превышал аналогичный показатель младшей контрольной группы (p<0,001), но при этом не выходил за пределы нормального диапазона (табл. 1). Также в этой группе пациентов выявлена гиперинсулинемия на фоне снижения чувствительности к инсулину. Уровень гликемии в группе пациентов с СД типа 2 достоверно превышал аналогичные показатели как обеих контрольных групп, так и группы больных гипотиреозом (p<0,001). У мужчин с СД типа 2 выявлена инсулинорезистентность, которая сопровождалась компенсаторной гиперинсулинемией.
При анализе показателей липидного обмена (табл. 2) обнаружено достоверное (p<0,05) повышение концентрации общего холестерина и триглицеридов у мужчин с гипотиреозом относительно младшей контрольной группы. У пациентов с СД типа 2 выявлено достоверное повышение общего холестерина и холестерина ЛПНП и снижение холестерина ЛПВП по сравнению с данными младшей контрольной группы (р<0,001). Сравнение со старшей контрольной группой позволило выявить у мужчин с гипотиреозом тенденцию к увеличению общего холестерина и холестерина ЛПНП и недостоверное снижение холестерина ЛПВП. У обследованных с СД типа 2 установлено недостоверное повышение общего холестерина и холестерина ЛПНП по сравнению с данными старшей контрольной группы, а также значительное (р<0,001) снижение холестерина ЛПВП и увеличение (р=0,016) коэффициента атерогенности.
При сравнении показателей липидного профиля у обследованных 2 групп установлено, что у мужчин с СД типа 2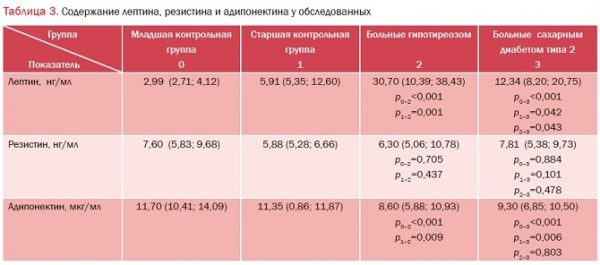 содержание холестерина ЛПВП значительно снижено, а холестерина ЛПНП – повышено (p<0,05) относительно мужчин с гипотиреозом.
содержание холестерина ЛПВП значительно снижено, а холестерина ЛПНП – повышено (p<0,05) относительно мужчин с гипотиреозом.
В группах пациентов с СД типа 2 и с гипотиреозом установлено достоверное (p<0,05) снижение концентрации адипонектина и повышение концентрации лептина относительно обеих контрольных групп (табл. 3). Аналогичные данные были получены также другими авторами [7-9].
Наиболее выраженные гипоадипонектинемия и гиперлептинемия были установлены в группе мужчин с гипотиреозом. Значимого изменения уровня резистина у обследованных пациентов в сравнении с группами контроля отмечено не было.
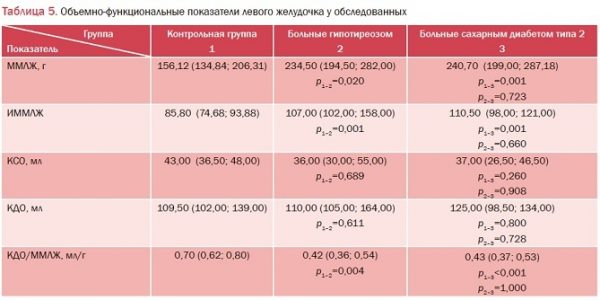
При анализе морфометрических показателей левого желудочка (табл. 4) было выявлено, что толщина МЖПс, МЖПд и ЗСЛЖд у пациентов с гипотиреозом и СД типа 2 была значимо больше по сравнению с аналогичными показателями контрольной группы (p<0,05). Значения КСР и КДР у обследованных пациентов относительно лиц группы контроля не отличались (p>0,05).
Анализ объемно-функциональных показателей ЛЖ представил статистически достоверное увеличение ММЛЖ и ИММЛЖ у пациентов 2 групп по сравнению с показателями контрольной группы (табл. 5). Наибольшего значения ММЛЖ достигла у пациентов с СД типа 2. Значения КДО и КСО у пациентов и с гипотиреозом, и с СД типа 2 достоверно не отличались от контрольных, а отношение КДО/ММЛЖ было достоверно ниже, чем в группе контроля. Эти данные могут 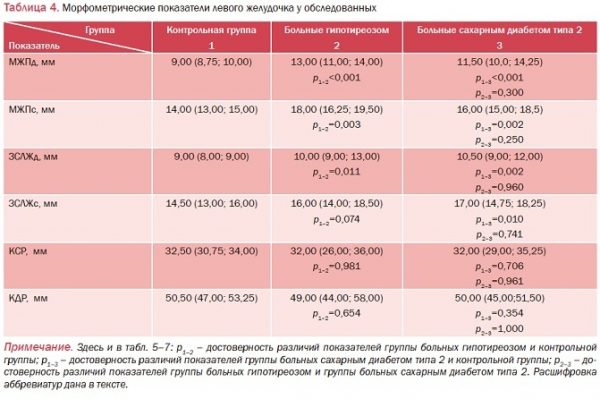 свидетельствовать о наличии гипертрофии миокарда ЛЖ без признаков его дилатации у пациентов данных групп. Это согласуется с данными других авторов [10-12].
свидетельствовать о наличии гипертрофии миокарда ЛЖ без признаков его дилатации у пациентов данных групп. Это согласуется с данными других авторов [10-12].
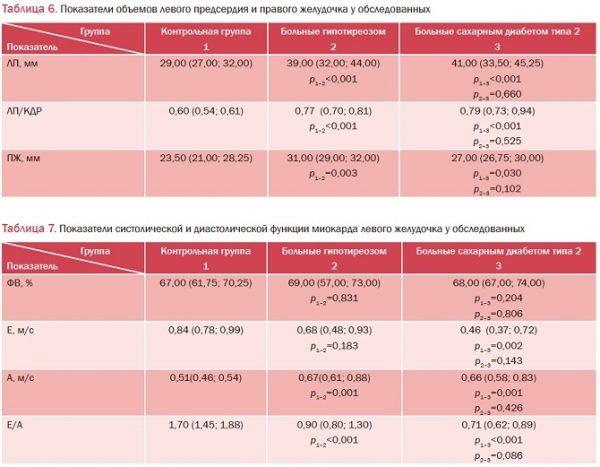
Изменение объемно-функциональных показателей ЛЖ способствует увеличению левого предсердия. Так, у всех обследованных пациентов выявлено значительное (p<0,001) увеличение размеров левого предсердия (ЛП) и повышение отношения ЛП/КДР относительно контрольной группы (табл. 6). Увеличение размеров ЛП приводит к повышению давления в легочной артерии, что, в свою очередь, способствует развитию гипертрофии правого желудочка (ПЖ). У всех обследованных пациентов размеры ПЖ были достоверно увеличены относительно контрольной группы (p<0,05).
В группе больных гипотиреозом выявлены прямые корреляции ИМТ с ИММЛЖ и ЗСЛЖд (r=0,857; p=0,014 и r=0,764; p=0,046 соответственно). У обследованных с СД типа 2 размер ПЖ положительно коррелировал с ИМТ (r=0,798; p=0,006). Эти данные свидетельствуют о влиянии ожирения на процесс ремоделирования миокарда у данных больных. Также у пациентов с СД типа 2 была выявлена положительная корреляция величин ЛП и ММЛЖ с концентраций лептина (r=0,754; p=0,012 и r=0,685; p=0,029 соответственно) и отрицательная – с адипонектином (r=-0,665; p=0,036 и r=-0,742; p=0,014 соответственно). Вероятно, гиперлептинемия и гипоадипонектинемия влияют на развитие гипертрофии миокарда при СД типа 2.
При анализе показателей систолической и диастолической функций миокарда ЛЖ (табл. 7) у больных гипотиреозом и СД типа 2 было выявлено статистически значимое снижение соотношения величин максимальных скоростей раннего (Е) и позднего (А) наполнения относительно контрольной группы. Наименьшее значение Е/А отмечено у пациентов с СД типа 2. Уменьшение соотношения Е/А ниже 1,0 свидетельствует о замедлении релаксации ЛЖ и нарушении диастолической функции у обследованных пациентов. ФВ у всех обследованных соответствовала норме (>55%), значимо не отличаясь от контрольных значений.
 В группе пациентов с СД типа 2 установлена обратная взаимосвязь отношения Е/А с ИМТ и отношением ОТ/ОБ (r=-0,806; p=0,005 и r=-0,640; p=0,046 соответственно).
В группе пациентов с СД типа 2 установлена обратная взаимосвязь отношения Е/А с ИМТ и отношением ОТ/ОБ (r=-0,806; p=0,005 и r=-0,640; p=0,046 соответственно).
Выводы
1. У обследованных мужчин с СД типа 2 на фоне висцерального ожирения выявлена инсулинорезистентность, которая сопровождалась компенсаторной гиперинсулинемией. В группе пациентов с гипотиреозом отмечены усиление инсулинорезистентности и гиперинсулинемия.
2. У мужчин с СД типа 2 и гипотиреозом выявлена атерогенная дислипидемия. Изменения показателей липидного обмена были более выражены в группе пациентов с СД типа 2.
3. У пациентов с СД типа 2 и гипотиреозом установлены гипоадипонектинемия и гиперлептинемия.
4. У мужчин с СД типа 2 и гипотиреозом выявлена гипертрофия миокарда левого желудочка и диастолическая дисфункция левого желудочка при сохранной его сократительной способности. Гиперлептинемия и гипоадипонектинемия, возможно, участвуют в процессе ремоделирования миокарда левого желудочка при СД типа 2 и гипотиреозе. Развитию гипертрофии миокарда левого желудочка у обследованных пациентов способствует ожирение.
 Литература
Литература
1. International Diabetes federation. Diabetes Atlas. 7th ed. International Diabetes Federation, 2015.
2. Аметов А.С. Избранные лекции по эндокринологии. М. : Медицинское информационное агентство, 2016. 720 с.
3. Крутиков Е.С., Цветков В.А., Глушко А.С. Структурно-функциональные нарушения щитовидной железы у больных сахарным диабетом 2-го типа // Таврический мед.-биол. вестн. 2013. Т. 16, № 3. С. 71-74.
4. Дедов И.И., Шестакова М.В., Майоров А.Ю. и др. Алгоритмы специализированной медицинской помощи больным сахарным диабетом. 8-й вып. / под ред. И.И. Дедова, М.В. Шестаковой, А.Ю. Майорова. М. : УП ПРИНТ, 2017. 112 с.
5. Петунина Н.А., Трухина Л.В. Болезни щитовидной железы. М. : ГЭОТАР-Медиа, 2011. 216 с.
6. Lang R.M., Bierig M., Devereux R.B., Flachskampf F.A. et al. Рекомендации по количественной оценке структуры и функции камер сердца (под ред. Ю.А. Васюка) // Рос. кардиол. журн. 2012. № 3 (95). Прил. 1. 28 с.
7. Kaushik Kar, Satwika Sinha. Variations of adipokines and insulin resistance in primary hypothyroidism // J. Clin. Diagn. Res. 2017. Vol. 11, N 8. P. BC07-BC09.
8. Вербовой А.Ф., Ворожцова Е.И. Особенности гормонального метаболизма у мужчин с сахарным диабетом типа 2 и ишемической болезнью сердца // Эндокринология: новости, мнения, обучение. 2013. № 3. С. 69-73.
9. Вербовой А.Ф., Цанава И.А., Вербовая Н.И. Адипокины и метаболические показатели у больных сахарным диабетом 2 типа в сочетании с подагрой // Ожирение и метаболизм. 2016. № 13 (1). С. 20-24.
10. Орлова М.М., Байтман Т.П., Грицаева Е.А., Сафронова А.О. и др. Изменения состояния сердечно-сосудистой системы у пациентов с первичным манифестным гипотиреозом // Всероссийский эндокринологический конгресс с международным участием “Инновационные технологии в эндокринологии” : сборник тезисов. М., 2017. С. 363.
11. Просяник В.И., Серебрякова О.В. Изменение эхокардиографических показателей у больных с дисфункцией щитовидной железы // Забайкальский мед. вестн. 2014. № 2. С. 31-37.
12. Барабанова Н.А. Содержание мозгового натрийуретического пептида и эхокардиографические показатели у мужчин с сахарным диабетом 2 типа // Терапевт. 2014. № 5. С. 47-52.
