Блинов Д.В.1,2,3, Акарачкова Е.С.4,5, Орлова А.С.5,
Крюков Е.В.6, Корабельников Д.И.2
1 Институт Превентивной и Социальной Медицины
2 АНО ДПО «Московский медико-социальный институт имени Ф.П. Гааза»
3 Клинический Госпиталь Лапино, ГК «Мать и Дитя»
4 Международное общество «Стресс под контролем»
5 ФГАОУ ВО Первый Московский государственный медицинский
университет имени И.М. Сеченова
6 ФГБУ «Главный военный клинический госпиталь имени Н.Н. Бурденко»
Введение
Объем накопленных медицинских знаний неуклонно увеличивается. Если раньше знаний, полученных в годы учебы, практикующему врачу хватало в течение всей его практики, то сейчас даже повышение квалификации каждые пять лет признано отстающим от современных реалий и вводится принцип непрерывного медицинского образования (НМО). Именно необходимость в систематизации и предоставлении практикующему специалисту актуальной информации по диагностике и лечению в «концентрированном» виде, удобном для усвоения и использования в повседневной практике, определила необходимость создания клинических рекомендаций как руководств к действию. Клинические рекомендации (КР) – сравнительно новый инструмент оценки и регуляции качества медицинской помощи.
КР стали все больше внедряться в практику параллельно с распространением принципов ведения пациента, основанных на доказательной медицине, то есть с использованием методов, эффективность и безопасность которых была доказана качественно спланированными и выполненными клиническими исследованиями.
Первые КР появились в 70-х годах прошлого века в странах Европы и Северной Америки. Они преимущественно были основаны на экспертном мнении. Соответственно, качество рекомендаций было сравнительно невысоким. Начиная с 80-х годов прошлого века постепенно формируются современные подходы к разработке КР, основанные на систематических обзорах научной литературы, сформулированы требования к методологии создания и оценке качества.
В России до недавнего времени не существовало четкого определения термина «клинические рекомендации» (руководства).
В ряде клинических рекомендаций или руководств разработчики не приводят их четкого определения [1-3]. В тех случаях, когда авторы приводят определение КР, наиболее часто они дают определения, близкие к следующему: «клинические рекомендации – систематически разработанные документы, описывающие алгоритмы действий врача по диагностике, лечению и профилактике заболеваний и помогающие ему принимать правильные клинические решения» [4].
Каждый исторический период характеризуется законодательными актами, которые регулируют отношения в сфере охраны здоровья граждан. В современной России таким законодательным актом является Федеральный закон № 323-ФЗ «Об основах охраны здоровья граждан Российской Федерации». Данный Федеральный закон (ФЗ) был утвержден 21.11.2011 г. и вступил в силу 01.01.2012 г. Этот ФЗ регулирует отношения, возникающие в сфере охраны здоровья граждан в Российской Федерации, и определяет: правовые, организационные и экономические основы охраны здоровья граждан; права и обязанности человека и гражданина, отдельных групп населения в сфере охраны здоровья, гарантии реализации этих прав; полномочия и ответственность органов государственной власти РФ и органов местного самоуправления в сфере охраны здоровья; права и обязанности медицинских организаций, иных организаций, индивидуальных предпринимателей при осуществлении деятельности в сфере охраны здоровья; права и обязанности медицинских работников и фармацевтических работников [5].
В ФЗ-323 изначально было закреплено, что медицинская помощь организуется и оказывается в соответствии с порядками оказания медицинской помощи, обязательными для исполнения на территории РФ всеми медицинскими организациями, а также на основе стандартов медицинской помощи.
При этом в законе не содержалось упоминаний о КР. В апреле 2018 г. председателем Правительства РФ Д. А. Медведевым подписано распоряжение о внесении в Госдуму РФ проекта поправок к ФЗ-323, в котором КР утверждаются в новом статусе, в частности, впервые в проекте закреплено определение клинических рекомендаций и то, что КР являются обязательными к исполнению. Принятие данных поправок прошло в довольно сжатые сроки. Так, в мае 2018 г., согласно распоряжению председателя Правительства, проект поправок был направлен Правительством РФ в Госдуму. Второе и третье
чтения в Госдуме законопроект прошел, соответственно, 18.12.2018 г. и 19.12.2018 г., а 21.12.2018 г. он получил одобрение и Совета Федерации. 25.12.2018 г. его подписал Президент РФ В. В. Путин.
Новый законодательный акт получил название «Федеральный закон от 25 декабря 2018 г. № 489-ФЗ «О внесении изменений в статью 40 Федерального закона «Об обязательном медицинском страховании в Российской Федерации» и Федеральный закон «Об основах охраны здоровья граждан в Российской Федерации» по вопросам клинических рекомендаций» (ФЗ-489) [6].
В ФЗ-489 дано определение клинических рекомендаций. Согласно ФЗ-489, «Клинические рекомендации – документы, содержащие основанную на научных доказательствах структурированную информацию по вопросам профилактики, диагностики, лечения и реабилитации, в т. ч. протоколы ведения (протоколы лечения) пациента, варианты медицинского вмешательства и описание последовательности действий медицинского работника с учетом течения заболевания, наличия осложнений и сопутствующих заболеваний, иных факторов, влияющих на результаты оказания медицинской помощи». КР должны в обязательном порядке учитываться при создании стандартов и критериев качества оказания медицинской помощи. КР разрабатываются медицинскими профессиональными некоммерческими организациями по отдельным заболеваниям или состояниям (группам заболеваний или состояний) с указанием медицинских услуг, предусмотренных номенклатурой.
Перечень таких заболеваний составляет Минздрав РФ. Также Минздравом РФ должен быть создан научно-практический совет с участием представителей научных организаций, вузов, медицинских учреждений, на который возложены обязанности рассматривать и одобрять подготовленные профессиональными организациями КР. Профессиональное сообщество и Минздрав РФ должны обновить и/или разработать клинические рекомендации по каждой нозологии к 2022 г. [6]. Это определяет цель данной работы.
Цель – на основании анализа нормативных актов и документов регуляторных органов определить подходы и методологию разработки клинических рекомендаций, соответствующим требованиям
законодательства РФ.
Материалы и методы
Проанализированы нормативные акты, закрепляющие понятие и статус КР, в частности, Федеральный Закон № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации» [5], «Федеральный закон № 489-ФЗ «О внесении изменений в статью 40 Федерального закона «Об обязательном медицинском страховании в Российской Федерации» и Федеральный закон «Об основах охраны здоровья граждан в Российской Федерации» по вопросам клинических рекомендаций» [6].
Также были исследованы подзаконные акты Минздрава РФ: Приказ от 28 февраля 2019 г. № 102н «Об утверждении Положения о научно-практическом совете» Министерства здравоохранения Российской Федерации [7] и Приказ от 28 февраля 2019 г. № 103н «Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности включаемой в клинические рекомендации информации» Министерства здравоохранения Российской Федерации [8].
Кроме этого, анализировались открытые источники регуляторных органов РФ, включая «Рубрикатор клинических рекомендаций» [9], методические материалы на сайте ФГБУ «Центр экспертизы и контроля качества медицинской помощи» (ЦЭККМП) Минздрава РФ [10]. Также были изучены экспертные мнения представителей медицинских профессиональных некоммерческих организаций и лидеров мнений, отобранные из различных открытых источников.
Результаты
До настоящего времени клинические рекомендации не имели какой-либо единой структуры документа. Профессиональные сообщества, занимающиеся подготовкой КР, использовали самостоятельно разработанную структуру, либо следовали «Требованиям к оформлению клинических рекомендаций для размещения в Рубрикаторе» [9,11]. После подписания ФЗ-489 Президентом РФ Минздрав РФ разработал и утвердил «Положение о научно-практическом совете Минздрава России» [7] и Приказ № 103н от 28.02.2019 г. «Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности включаемой в клинические рекомендации информации» [8]. Приказ 103н был зарегистрирован в Минюсте РФ 8 мая 2019 г. Положение о совете вступило в силу в середине апреля, а Приказ № 103н – 19.05.2019 г.
Место КР в системе организации оказания и управления качеством медицинской помощи приведено на рисунке 1.
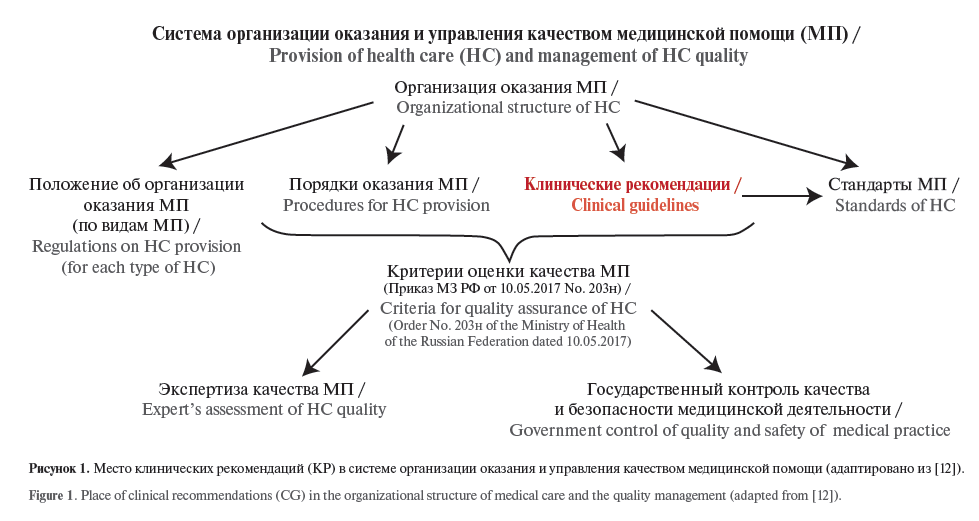
В рамках данного Положения Минздрав РФ закрепил за научно-практическим советом право рассмотрения КР, а Приказом № 103н утверждены порядок и сроки разработки/пересмотра КР; типовая форма КР; требования к структуре КР, составу и научной обоснованности включаемой в КР информации.
Порядок и сроки разработки
КР разрабатываются медицинскими профессиональными некоммерческими организациями по отдельным заболеваниям или состояниям (группам заболеваний или состояний) с указанием медицинских услуг, предусмотренных номенклатурой медицинских услуг [5]. Согласно Приказу 103н КР разрабатываются в соответствии с типовой формой КР, и с требованиями к структуре КР, составу и научной обоснованности включаемой в КР информации, предусмотренными Приложениями № 2 и № 3 к данному Приказу.
КР разрабатываются по перечню заболеваний или состояний (групп заболеваний или состояний), формируемому Минздравом РФ [5]. Медицинские профессиональные некоммерческие организации в течение одного месяца со дня размещения перечня на официальном сайте Минздрава направляют в Минздрава РФ уведомление о начале разработки КР. Они разрабатывают проекты КР и организуют их общественное обсуждение, в т. ч. с участием научных организаций, образовательных организаций высшего образования, медицинских организаций, медицинских профессиональных некоммерческих организаций, их ассоциаций (союзов), а также посредством размещения в сети интернет в течение четырех месяцев со дня направления в Минздрав РФ уведомления о начале разработки клинических рекомендаций.
По окончании этого срока медицинская профессиональная некоммерческая организация направляет в Министерство здравоохранения Российской Федерации письменное заявление о разработке или пересмотре КР на бумажном носителе и в электронном виде, содержащее следующие сведения:
– наименование разработчика (почтовый адрес, контактный телефон, адрес электронной почты);
– наименование проектов клинических рекомендаций с указанием кода заболевания или состояния (группы заболевания или состояний) в соответствии с Международной статистической классификацией болезней и проблем, связанных со здоровьем;
– возрастная категория пациентов.
К заявлению прилагается подготовленный проект КР.
Научно-практический совет Минздрава РФ создает рабочие группы и комиссии с привлечением иных медицинских профессиональных некоммерческих организаций, имеющих в своем составе медицинских работников по соответствующей специальности, в целях разработки КР в случае непредставления КР медицинскими профессиональными некоммерческими организациями в срок, а также в случае, если по отдельным заболеваниям или состояниям (группам заболеваний или состояний), включенным в Перечень, в течение двух месяцев со дня размещения Перечня на официальном сайте Министерства не поступило уведомление о начале разработки клинических рекомендаций ни от одной медицинской профессиональной некоммерческой организации.
Порядок обновления клинических рекомендаций
Механизм обновления КР предусматривает их систематическую актуализацию – не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утвержденным КР, но не чаще одного раза в шесть месяцев. Таким образом, КР должны пересматриваться не реже одного раза в три года и не чаще одного раза в шесть месяцев.
Для разработки и пересмотра КР медицинскими профессиональными некоммерческими организациями формируются рабочие группы по разработке и пересмотру клинических рекомендаций. В их состав могут привлекаться специалисты, участвующие в оказании медицинской помощи при заболевании или состоянии (группе заболеваний или состояний), по которым разрабатываются КР, научные работники, специалисты в области доказательной медицины, социальные работники, представители пациентских организаций, юристы, представители страховых медицинских организаций, специалисты
в области информационных технологий и международные консультанты. Решения рабочей группы принимаются при поддержке не менее двух третей от числа голосов присутствующих на заседании членов рабочей группы, и оформляются протоколом, который подписывается руководителем рабочей группы и членами рабочей группы, присутствовавшими на заседании.
Требования к структуре КР, составу и научной обоснованности включаемой в КР информации
Структура КР согласно Приказу 103н Минздрава РФ должна включать следующие разделы [8,10]:
Титульный лист
Титульный лист должен содержать ключевую информацию: наименование заболевания (состояния), кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем (МКБ), возрастную группу, информацию о годе утверждения и разработчиках КР. При этом в названии КР не рекомендуется уточнение этапа оказания медицинской помощи. В поле «Возрастная группа» указывается «дети» или «взрослые» или «дети/взрослые», если КР предназначены для обеих возрастных групп. В поле «Разработчик клинической рекомендации» должны быть указаны профессиональные медицинские некоммерческие организации (ассоциации) – разработчики КР, при этом не должны указываться федеральные и иные медицинские организации. Поле «Год утверждения» не заполняется до момента утверждения КР после их одобрения Научно-практическим советом Минздрава РФ.
Оглавление
Оглавление должно быть автособираемым. Автособираемое оглавление создается стандартными средствами Word пакета Microsoft Office (Microsoft Inc, США) («Ссылки» → «Оглавление» → «Автособираемое оглавление»), при этом тексту документа должны быть присвоены соответствующие стили. Актуализация оглавления происходит через выбор действия «Обновить поле» из списка, выпадающего при нажатии правой кнопки компьютерной мыши (мышь при этом необходимо навести на оглавление).
Список сокращений
В разделе «Список сокращений» должны быть представлены все применяемые в КР сокращения. Не рекомендуется использовать сокращения наименований лекарственных препаратов, приводить уже устоявшиеся сокращения для определения новых терминов (например, МНО – международное нормализованное отношение, АГ – артериальная гипертензия).
Термины и определения
В данном разделе должны быть представлены все узконаправленные и новые термины, использованные в КР. Типовая форма КР предполагает перечисление терминов и их описание в порядке встречаемости: «Термин 1 – это ………. »; «Термин 2 – это ……….».
Краткая информация по заболеванию или состоянию (группе заболеваний или состояний)
Раздел «Краткая информация по заболеванию или состоянию (группе заболеваний или состояний)» должен содержать подразделы «Определение», «Этиология и патогенез», «Эпидемиология», «Кодирование по МКБ-10», «Классификация», «Клиническая картина». В подразделе «Определение» приводится краткое определение заболевания, состояния или синдрома, относительно которого разработаны КР. Данные по эпидемиологии представляются на момент разработки КР в мире и РФ (при наличии), с приведением ссылок на первоисточники.
Классификация должна либо соответствовать МКБ-10, либо должна быть приведена другая классификация, с приведением ссылок на первоисточники. Допустимо также привести указание на отсутствие систем классификации заболевания/состояния. В разделе «клиническая картина» должна быть указана клиническая картина заболевания, состояния или синдрома, отражены местные симптомы (боль, отек), признаки общих патологических процессов (например, лихорадка, интоксикация, снижение массы тела) и др.
Диагностика заболевания или состояния (группы заболеваний или состояний), медицинские показания и противопоказания к применению методов диагностики
В данном разделе также указываются критерии установления диагноза или состояния; жалобы и анамнез; физикальное обследование; лабораторная диагностика; инструментальная диагностика; иная диагностика.
Критерии установления диагноза/состояния могут быть приведены, например, на основании патогномоничных данных (данные анамнеза; физикального обследования; лабораторных исследований; инструментального обследования и др.). Однако оформление подразделов по сбору жалоб и анамнеза, физикальному обследованию в виде тезисов-рекомендаций не обязательно. В остальных подразделах вся информация о медицинских вмешательствах должна быть представлена в виде кратких тезисов – рекомендаций Рабочей группы практикующему врачу в формате «Что? Кому? В каких целях?» («Рекомендуется / не рекомендуется (что?) … (кому?) … (зачем, в каких целях?) … [8,10]. Уровень убедительности рекомендаций «…» (уровень достоверности доказательств – «…»). При этом под термином «медицинское вмешательство» понимаются выполняемые медицинским работником и иным работником, имеющим право на осуществление медицинской деятельности, по отношению к пациенту, затрагивающие физическое или психическое состояние человека и имеющие профилактическую, исследовательскую, диагностическую, лечебную, реабилитационную направленность виды медицинских обследований и (или) медицинских манипуляций, а также искусственное прерывание беременности [5,8].
Уровни достоверности доказательств (УДД) и уровни убедительности рекомендаций (УУР) должны быть выставлены в соответствии с единой методологией их оценки, описываемой ниже [8,13].
Также должны быть даны ссылки на публикации научных исследований эффективности и/или безопасности медицинских вмешательств, соответствующие содержанию тезиса (совпадающие по контингенту пациентов, медицинскому вмешательству, цели медицинского вмешательства и выставленному УДД, УУР). В подразделе «Лабораторная диагностика» рекомендовано также указывать изменения уровня лабораторных показателей, соответствующие данному заболеванию/состоянию. При этом клинические рекомендации, учебники и монографии являются не научными исследованиями, а результатом анализа данных экспертами, в связи с чем приравниваются к уровням «экспертное мнение». Желательно, но не обязательно приводить комментарии, подробнее раскрывающие тезисекомендацию. При формулировании тезисов-рекомендаций должно использоваться наименование медицинских услуг, предусмотренных номенклатурой медицинских услуг (при наличии соответствующих услуг).
Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
Этот раздел может содержать введение в раздел и несколько подразделов с произвольными наименованиями, например, «консервативное лечение», «хирургическое лечение», «иное лечение». Также как и в предыдущем разделе, вся информация о медицинских вмешательствах должна быть представлена в виде кратких тезисов – рекомендаций Рабочей группы практикующему врачу в формате «Что? Кому? В каких целях?»; должна быть выставлены уровни УДД и УУР в соответствии с единой методологией их оценки; даны ссылки на публикации научных исследований эффективности и/или безопасности медицинских вмешательств, соответствующие содержанию тезиса (совпадающие по контингенту пациентов, медицинскому вмешательству, цели медицинского вмешательства и выставленному УДД, УУР); клинические рекомендации, учебники и монографии признаются не научными исследованиями, а результатом анализа данных экспертами, в связи с чем приравниваются к уровням «экспертное мнение»; при формулировании тезисов-рекомендаций должно использоваться наименование медицинских услуг, предусмотренных номенклатурой медицинских услуг (при их наличии).
Дополнительно определено оформление КР в части лекарственных препаратов (ЛП). Так, в КР необходимо указывать только зарегистрированные в РФ ЛП, для этого необходимо проверить их статус на официальном сайте Государственного Реестра Лекарственных Средств (ГРЛС) http://www.grls.rosminzdrav.ru [14]. Если тезис-рекомендация относится к применению ЛП, названия фармакотерапевтических групп ЛП необходимо приводить в соответствии с анатомо-терапевтическо-химической классификацией (АТХ), рекомендованной Всемирной организацией здравоохранения (ВОЗ), или указать международные непатентованные наименования (МНН), группировочные, или химические наименования ЛП в зависимости от данных об эффективности и безопасности их применения. Торговые марки (ТМ) ЛП указываются только в случаях МНН группировочного и химического наименования. Если лекарственный препарат внесен в перечень ЖНВЛП, наименование лекарственного препарата должно быть выделено двумя звездочками («**»). Если тезис-рекомендация относится к ЛП, используемому не в соответствии с показаниями к применению и противопоказаниями, способами применения и дозами, содержащимися в Инструкции по применению лекарственного препарата, кроме знака «#» необходимо также указать способ применения ЛП; дозу и длительность его приема; ссылки на клинические исследования эффективности и безопасности применяемого режима дозирования при данном заболевании либо ссылки на соответствующие первоисточники.
Оформление КР в части медицинских изделий и специализированных продуктов лечебного питания предусматривает ряд важных положений. В частности, в КР необходимо указывать только зарегистрированные в РФ и рекомендуемые к применению медицинские изделия и специализированные продукты лечебного питания. Любое медицинское изделие, указанное в КР, должно иметь регистрационное удостоверение [5,8,10]. Упоминание в КР торговой марки (ТМ) медицинского изделия недопустимо. Наименование медицинского изделия выделяется тремя звездочками («***») в случае, если тезис-рекомендация относится к медицинскому изделию, имплантируемому в организм человека при оказании медицинской помощи в рамках программы государственных гарантий бесплатного оказания гражданам медицинской помощи (Перечень медицинских изделий, имплантируемых в организм человека при оказании медицинской помощи в рамках программы государственных гарантий бесплатного оказания гражданам медицинской помощи, утвержденный распоряжением Правительства Российской Федерации от 31 декабря 2018 г. N 3053-р) [15]. Наименование специализированного продукта лечебного питания выделяется четырьмя звездочками («****») в случае, если тезис-рекомендация относится к специализированному продукту лечебного питания, включенному в перечень специализированных продуктов лечебного питания для детей-инвалидов (Перечень специализированных продуктов лечебного питания для детей-инвалидов на 2019 г., утвержденный распоряжением Правительства Российской Федерации от 22 октября 2018 г. N 2273-р) [16].
Медицинская реабилитация, медицинские показания и противопоказания к применению методов реабилитации
Раздел состоит из четырех подразделов: введение в раздел (по желанию); собственно тезисы-рекомендации рабочей группы практикующему врачу в формате «Что? Кому? В каких целях?»; уровни убедительности рекомендаций и достоверности доказательств УУР и УДД, а также комментарии. УДД и УУР должны быть выставлены в соответствии с единой методологией их оценки.
Также должны быть даны ссылки на первоисточники научных исследований эффективности и/или безопасности медицинских вмешательств, соответствующие содержанию тезиса, при этом клинические рекомендации, учебники и монографии приравниваются к уровням «экспертное мнение». Комментарии, подробнее раскрывающие тезис-рекомендацию, могут отсутствовать. При формулировании тезисов-рекомендаций используется наименование медицинских услуг, предусмотренных номенклатурой (при их наличии) [5,8,10].
Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
К данному разделу предъявляются те же требования, что и к предыдущему разделу, специфических требований и методических рекомендаций в типовой форме КР не приведено.
Организация оказания медицинской помощи
В разделе «организация оказания медицинской помощи» в двух соответствующих подразделах должны быть перечислены показания к госпитализации в медицинскую организацию и показания к выписке пациента из медицинской организации. Показания формируются отдельно исходя из формы (плановая, экстренная) и условий оказания медицинской помощи в медицинской организации (дневной стационар, стационарно).
Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
В данном разделе может быть указана дополнительная информация, влияющая на течение и исход заболевания/состояния, которую члены рабочей группы считают важным донести до практикующего специалиста. В Приказе 103н и типовой форме КР не специфицируется информация, обязательная к размещению в этом разделе [5,8,10].
Критерии оценки качества медицинской помощи
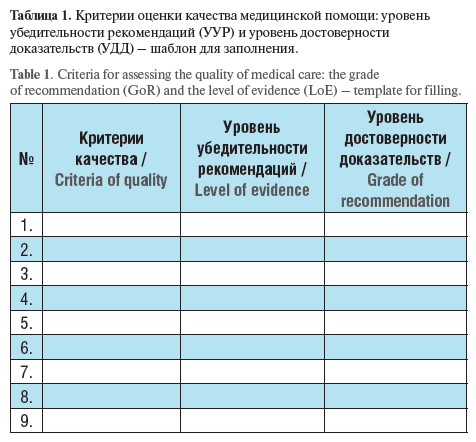
В данном разделе указываются рекомендованные Рабочей группой критерии качества оценки медицинской помощи в РФ при данном заболевании, состоянии или синдроме. Критерии оценки качества медицинской помощи должны соответствовать тезисам-рекомендациям и уровням УДД и УУР. Не допускаются сокращения или аббревиатуры при написании критериев, используются формулировки: выполнено, проведено. Всю информацию нужно консолидировать в таблице (таблица 1).
Список литературы
Список первоисточников, включая источники, на которые ссылаются тезисы-рекомендации рабочей группы, должен быть приведен не в алфавитном порядке, а в порядке цитирования в тексте КР (по встречаемости). Ссылки на первоисточники в тексте необходимо приводить в квадратных скобках. Также необходимо придерживаться единого стиля оформления ссылок, предпочтительно следование ГОСТу. Обязательным является указание страниц первоисточника.
 Приложения
Приложения
Далее в типовом проекте КР приводятся Приложения – Приложение А1 «Состав рабочей группы по разработке и пересмотру клинических рекомендаций»; Приложение А2 «Методология разработки клинических рекомендаций»; Приложение А3 «Справочные материалы», включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных
препаратов, инструкции по применению лекарственного препарата», Приложение Б «Алгоритмы действий врача», Приложение В «Информация для пациента», Приложения Г1-Г№ «Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях».
Состав рабочей группы по разработке и пересмотру клинических рекомендаций
В данном разделе должен быть указан состав рабочей группы.
Рабочая группа должна включать не менее трех человек, при этом необходимо указывать, состоят ли члены рабочей группы в профессиональных ассоциациях, если да – то в каких именно. Также в этом разделе обозначается конфликт интересов – ситуация, при которой у медицинского работника или фармацевтического работника при осуществлении ими профессиональной деятельности либо у члена медицинской профессиональной некоммерческой организации, участвующего в разработке клинических рекомендаций, или члена научно-практического совета возникает личная заинтересованность в получении лично либо через представителя компании материальной выгоды или иного преимущества, которое влияет или может повлиять на надлежащее исполнение ими профессиональных обязанностей, а также иных обязанностей, в т. ч. связанных с разработкой и рассмотрением клинических рекомендаций, вследствие противоречия между личной заинтересованностью указанных лиц и интересами пациентов [5]. Необходимо указывать сведения об отсутствии конфликта интересов, а при его наличии – пути урегулирования конфликта интересов.
Методология разработки КР / Methodology for the development of CG В данном разделе указывается методология разработки КР, методы, использованные для систематического обзора доказательств.
Должна быть указана целевая аудитория данных клинических рекомендаций в соответствии с перечнем должностей медицинских работников [17] и приведена единая шкала УУР и УДД (таблицы 2, 3 и 4).
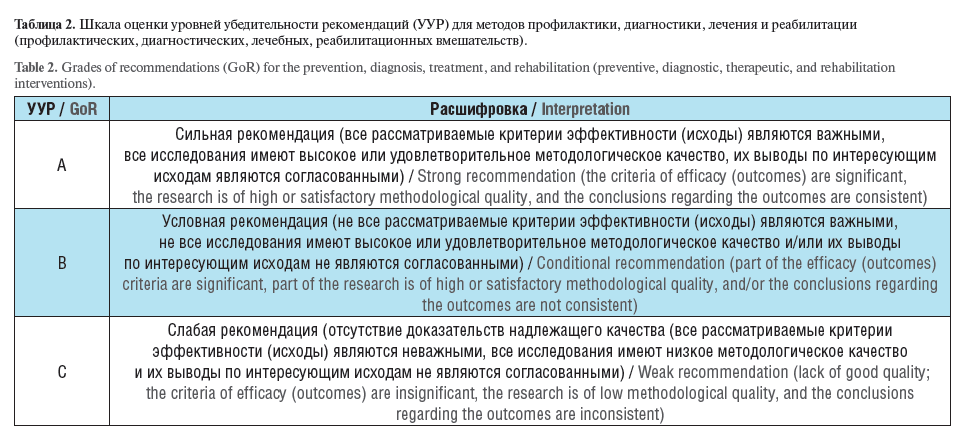
При этом Шкала оценки УДД для методов диагностики (диагностических вмешательств) и Шкала оценки УДД для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств) разнятся (см. таблицы 3 и 4).


Справочные материалы
В Приложении А3 должны быть приведены справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата. В данном разделе могут быть даны ссылки на нормативные правовые акты, другие клинические рекомендации, одобренные Научно-практическим советом Минздрава РФ и т. д.
Алгоритмы действий врача
Алгоритмы действий врача представляют собой четкий перечень действий персонала в конкретной ситуации (например, при оказании первичной помощи при шоке, остром коронарном синдроме и т. д.). В этом приложении должны быть представлены схематические изображения алгоритма действий врача при данном заболевании, состоянии, синдроме (в прямоугольниках указывают действия, в ромбах – вопросы).
Информация для пациента
В данном разделе должна быть описана необходимая информация, которую врач должен предоставить пациенту, при этом не должны быть указаны конкретные ЛП, названия учреждений, в которые может обратиться пациент и т. п., так как данная информация может быть предоставлена пациенту только его лечащим врачом.
Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента
В Приложениях Г1 – Г№ указываются шкалы, опросники и другие валидизированные методы оценки состояния пациента, прогноза рисков возникновения осложнений и прогноза развития заболевания/состояния. Шаблон включения клинических шкал оценки, вопросников и других оценочных инструментов состояния пациента включает следующие пункты:
– Название на русском языке;
– Оригинальное название (если есть);
– Источник (официальный сайт разработчиков – при его наличии; публикация с валидацией);
– Тип: шкала оценки, индекс, вопросник или же другое (уточнить);
– Назначение;
– Содержание (шаблон);
– Ключ (интерпретация);
– Пояснения.
Изменения требований по разработке и оформлению клинических рекомендаций
По сравнению с «Требованиями к оформлению клинических рекомендаций для размещения в Рубрикаторе» [11] есть рад важных изменений требований по разработке и оформлению КР с учетом Приказа Минздрава России от 28 февраля 2019 г. №103н [8,10].
Полный перечень изменений приведен в таблице 5.
Таблица 5. Изменения требований по разработке и оформлению клинических рекомендаций с учетом вступления в силу Приказа Минздрава России от 28 февраля 2019 г. №103н по сравнению с «Требованиями к оформлению клинических рекомендаций для размещения в Рубрикаторе» [11,18].

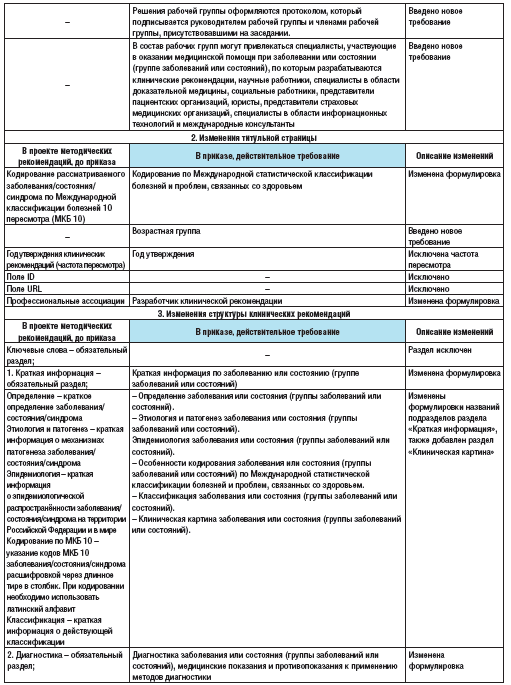
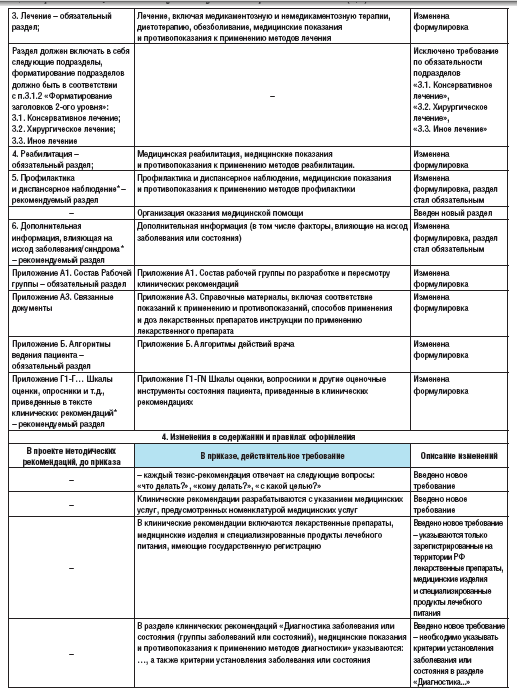

Основные изменения приведены ниже [8,10,11,18]. В частности, изменен порядок разработки КР: введено новое требование относительно срока пересмотра («КР пересматриваются не реже одного раза в три года и не чаще одного раза в шесть месяцев»). Также регламентирован порядок и сроки разработки и пересмотра клинических рекомендаций. Введено новое требование относительно того, что КР разрабатываются по перечню заболеваний или состояний (групп заболеваний или состояний), формируемому Минздравом РФ. Однако медицинские профессиональные некоммерческие организации имеют право разрабатывать КР по заболеваниям, состояниям, не включенным в данный перечень.
Такие КР подлежат одобрению и утверждению в порядке, установленном настоящей статьей. Новыми требованиями также являются следующие: требование о необходимости получить поддержку не менее двух третей от числа голосов присутствующих на заседании членов рабочей группы для принятия решения; оформление решения рабочей группы протоколом, который подписывается руководителем и членами рабочей группы, присутствовавшими на заседании; детализация состава рабочей группы (в них кроме врачей могут входить научные работники, специалисты в области доказательной медицины, социальные работники, представители пациентских организаций, юристы, представители страховых медицинских организаций, специалисты в области информационных технологий и международные консультанты).
Существенно изменена титульная страница: введено новое требование указывать возрастные группы; исключены информация о частоте пересмотра, поля ID и URL.
Из структуры КР исключен раздел «ключевые слова», изменены формулировки названий подразделов раздела «Краткая информация», также добавлен раздел «Клиническая картина». Исключено требование по обязательности подразделов «Консервативное лечение», «Хирургическое лечение», «Иное лечение», но при этом обязательными стали разделы «Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики» и «Дополнительная информация (в т. ч. факторы, влияющие на исход заболевания или состояния)». Также введен новый раздел «Организация оказания медицинской помощи».
Важные новые требования введены в содержании и правилах оформления КР. Теперь каждый тезис-рекомендация должен отвечать на вопросы: «что делать?», «кому делать?», «с какой целью?». КР должны разрабатываться с указанием медицинских услуг, предусмотренных номенклатурой медицинских услуг. Новым требованием является необходимость указывать только зарегистрированные на территории РФ лекарственные препараты, медицинские изделия и специализированные продукты лечебного питания. Т
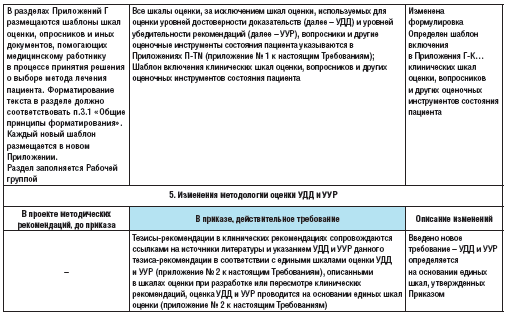
акже введено новое требование, согласно которому необходимо указывать критерии установления заболевания или состояния в разделе «Диагностика…». Новыми требованиями являются и требования выделять тремя звездочками наименование медицинского изделия в случае, если тезис-рекомендация относится к медицинскому изделию, имплантируемому в организм человека при оказании медицинской помощи в рамках программы государственных гарантий бесплатного оказания гражданам медицинской помощи [15]; четырьмя звездочками – если тезис-рекомендация относится к специализированному продукту лечебного питания, включенному в перечень специализированных продуктов лечебного питания для детей-инвалидов [16], и знаком «решетки», если тезис-рекомендация относится к лекарственному препарату для медицинского применения, используемому не в соответствии с показаниями к применению и противопоказаниями, способами применения и дозами, содержащимися в инструкции по применению лекарственного препарата. В этом случае также необходимо указать способ применения лекарственного препарата; дозу и длительность его приема; ссылки на клинические исследования эффективности и безопасности применяемого режима дозирования при данном заболевании либо ссылки на соответствующие источники литературы. Также введены изменения методологии оценки УУР и УДД – теперь УУР и УДД определяются на основании единых шкал, утвержденных Приказом.
По сравнению с Проектом Методических рекомендаций по разработке и актуализации клинических рекомендаций [20] и Проектом методических рекомендаций по оценке достоверности доказательств и убедительности рекомендаций [21] также есть изменения.
Весь процесс разработки КР должен начинаться с оценки методологического качества исследований и оценки достоверности доказательств (рисунок 2).
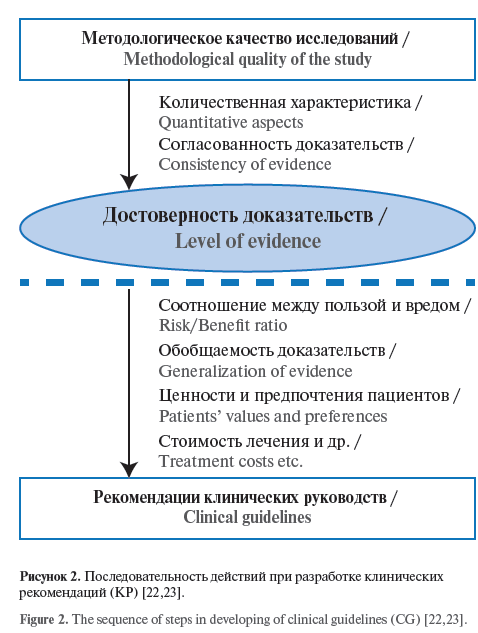
Этапы определения достоверности доказательств и составления рекомендаций должны проводиться последовательно, предпочтительно с присвоением отдельного УДД и УУР. Несмотря на то что высокий УДД в большинстве случаев ассоциируется с высоким УУР, доказательства с определенным УДД не всегда подразумевают точно такой же УУР [22].
Обсуждение
Введение четкого определения КР и внедрение в КР в рутинную практику – безусловно, большой шаг вперед в деле совершенствования медицинской помощи в Российской Федерации. Унификация подходов к лечению, использование современных методов диагностики и лечения, доказавших свою эффективность и безопасность, позволит улучшить преемственность между ЛПУ и отдельно взятыми специалистами.
В нормативных актах, определяющих разработку и обновление КР, впервые законодательно регламентировано понятие доказательной медицины. При обязательном следовании КР увеличится уровень профессиональной экспертизы практикующих специалистов, которые будут больше рекомендовать подходы к диагностике и терапии, основанные на доказательной медицине. Объем рекомендаций методик и ЛП, не имеющих доказательной базы, наоборот, будет уменьшаться (при условии, что такие методы диагностики и лечения не будут упоминаться в тезисах-рекомендациях обновленных КР).
Внедрение КР должно оказать позитивное влияние на медицинское страхование и судебные решения, принимаемые в отношении врачебных ошибок. Соблюдение КР должно являться более объективным и прозрачным критерием качества оказанной медицинской помощи, чем суждения на основе экспертных оценок.
Большую практическую значимость имеет регулирование использования ЛП вне инструкции по медицинскому применению (off label). Сегодня это большая проблема, поскольку ряд ЛП в массовом порядке выписывается off label, особенно в детской практике, отчасти из-за отсутствия препаратов с доказанной эффективностью, разрешенных для детской возрастной группы, или на основании предыдущего личного опыта лечащего врача. Теперь если ЛП предполагается использовать не в соответствии с показаниями к применению и противопоказаниями, способами применения и дозами, содержащимися в Инструкции по применению, необходимо указывать ссылки на клинические исследования эффективности и безопасности применяемого режима дозирования при данном заболевании либо ссылки на соответствующие первоисточники.
В отношении ряда ЛП такая доказательная база есть (например, использование высоких доз левоцетиризина и дезлоратадина при крапивнице при отсутствии ответа на стандартные дозировки [24,25]).
Для других широко применяемых в рутинной практике ЛП таких доказательств недостаточно. Так, недостаточно доказательств на использование в детской практике калия и магния аспарагината в составе комплексной терапии, направленной на понижение внутричерепного давления; ГАМК-ергических анксиолитиков, и в первую очередь, бензодиазепина [26].
Необходимость приводить ссылки на доказательную базу, включая публикации результатов клинических исследований, будет препятствием для включения в КР и, соответственно, использования в рутинной клинической практике препаратов с недоказанной эффективностью и безопасностью, а также назначения off label.
Вместе с тем, оставлена возможность делать такие назначения решением врачебной комиссии (консилиума), что расширяет возможности, хотя и способствует увеличению затрат времени и ресурсов практикующих специалистов на ведение документооборота.
Вместе с тем, в течение всего времени концепция КР собирала критические замечания от представителей профессионального врачебного сообщества и медицинских юристов [27-30].
Так, на момент подготовки данной публикации Минздравом РФ еще не утвержден Перечень заболеваний или состояний (групп заболеваний или состояний), по которым разрабатываются КР, хотя заложены довольно ограниченные сроки на их разработку.
Также не регламентированы форма и порядок направления в Минздрав РФ уведомления о начале разработки КР, которые медицинские профессиональные некоммерческие организации должны направить в течение месяца после публикации данного Перечня.
В нормативных документах указывается, что медицинским профессиональным некоммерческим организациям на разработку проекта КР и общественное обсуждение отводится срок в четыре месяца с даты направления в Минздрав РФ уведомления о начале разработки КР. Однако не специфицируется, сколько из этих четырех месяцев необходимо потратить на разработку, а сколько – на процедуру общественного обсуждения. Чрезмерное сокращение продолжительности общественного обсуждения несет в себе риски обесценивания значимости разработки КР. Порядок общественного обсуждения также не детализирован, в частности, на каких ресурсах в сети интернет должен быть размещен проект КР, как должен быть организован доступ к документу.
Приказом определено направление Заявления о разработке и пересмотре КР вместе с текстом проекта КР по окончании четырех месяцев разработки и общественного обсуждения, то есть точный срок направления этих документов не регламентирован. Так, направление пакета документов, например, через год после окончания процесса, формально не противоречит регламенту.
Разработка проекта КР и организация общественного обсуждения требуют значительных ресурсов, включая привлечение ведущих экспертов, научную работу по селекции публикаций и валидацию доказательной базы. Выделение ресурсов нормативными актами сейчас не предусмотрено. Предполагается, что ресурсы будут выделять сами медицинские профессиональные некоммерческие организации. В этих условиях есть риск низкой заинтересованности высококвалифицированных экспертов, привлечения для такой работы наименее квалифицированных кадров, причем в качестве неоплачиваемой дополнительной нагрузки, что не способствует их мотивации. Это может повлечь копирование зарубежных гайдлайнов либо создание проектов КР низкого качества [28-30].
Общепризнанной методики оценки достоверности научных доказательств и убедительности рекомендаций не существует [31].
В мире наиболее распространены методики SIGN, OCEBM, GRADE, AHCPR/AHRQ, NHMRC и NCCN. SIGN (англ. – Scottish Intercollegiate Guidelines Network Levels of Evidence and Grades of Recommendations) предусматривает оценку УДД по категориям от 1 до 4 на основании иерархии дизайнов исследований. УУР имеет буквенные обозначения A, B, C, D, которые отражают степень достижения клинического эффекта [32]. В шкале OCEBM (англ. – Oxford Centre for Evidence-Based Medicine Levels of Evidence) оценивается только УДД по категориям от 1 до 5 на основании иерархии дизайнов исследований, при этом оценка УУР не производится [33]. GRADE (англ. – Grading of Recommendations Assessment, Development and Evaluation). предусматривает оценку УДД для каждого исхода заболевания/состояния по четырем категориям от высокого до очень низкого, наивысшую категорию имеют рандомизированные клинические исследования (РКИ), в то время как систематические обзоры и метаанализы не оцениваются. УУР оценивается только по двум градациям (сильная или слабая рекомендация) в зависимости от соотношения преимуществ и недостатков медицинского вмешательства [34,35].
AHCPR/AHRQ (англ. – Agency for Health Care Policy and Research / Agency for Health Care Research and Quality) предусматривает оценку УДД по градациям от 1 до 5 на основании иерархии дизайнов исследований, а УУР по градациям с буквенными обозначениями от А до Е [36]. В шкале NHMRC (англ. – National Health and Medical Research Council levels of evidence and grades for recommendations for developers of guidelines) оценка УДД не предусмотрена, оцениваются отдельные параметры каждого исследования. УУР имеет градации с буквенными обозначениями A, B, C, D, которые определяются суммированием результатов отдельных параметров оценки [37]. В шкале NCCN (англ. – National Comprehensive Cancer Network Categories of Evidence and Consensus and Categories of Preference) оценивается только итоговый УУР, при определении которого учитываются качество исследований в соответствии с иерархией дизайнов, их количественные показатели и согласованность результатов.
В соответствии с полученными данными рекомендациям присваивается категория от 1 до 3 [38]. Ассоциация SIGN в 2009 г. приняла решение использовать для определения УДД и УУР основные принципы методологии GRADE [31,39].
В последнее время большинство разработчиков КР в мире также используют систему GRADE. Журавлева Н. И. с соавт. провели анализ использования шкал УУР и УДД в российской практике разработки КР. Их анализ позволил сделать однозначный вывод об отсутствии единого подхода к их оценке при разработке КР профессиональными некоммерческими медицинскими организациями в РФ. Большое число применяемых методик делает процесс оценки медицинских технологий непрозрачным и даже ошибочным как на этапе формирования КР, так и при последующем принятии решений медицинскими работниками и организаторами здравоохранения. При этом наиболее часто применялась шкала оценки SIGN [31].
Регламентированные Приказами МЗ РФ методы оценки УДД и УУР в КР во многом носят черты подхода SIGN. При этом в требования к КР не вошел исходно применявшийся в шкале SIGN т. н. уровень GPP (англ. – good practice points, сложившаяся клиническая практика). Сотрудниками отдела медицинского обеспечения стандартизации ФГБУ «ЦЭККМП» Минздрава России был проведен опрос ведущих экспертов России в области доказательной медицины с целью формирования подходов по уточнению места уровня GPP в единой методологии по оценке УДД и УУР [40].
Опрос выявил сильную неоднородность мнений и отсутствие единой позиции экспертного сообщества по определению GPP для вмешательств, для которых отсутствуют доказательства выше уровня «мнение эксперта». В частности, многие разработчики КР опасаются отказа практикующих врачей от следования тезисам-рекомендациям с уровнем «мнение эксперта», которым не может быть присвоен уровень GPP в соответствии с разработанной методологией, несмотря на то, что механизм определения и уровня «мнение эксперта», и уровня GPP основан на достижении консенсуса при отсутствии научных доказательств. В связи с этим внедрение уровня GPP в методологию оценки УДД и УУР при разработке КР, требования к их структуре, составу и научной обоснованности, было признано нецелесообразным [40]. Ряд экспертов считают, что было бы оправданно внедрить для оценки уровня доказательности и убедительности рекомендаций систему GRADE или иную международную шкалу вместо того, чтобы имплементировать проприетарную систему оценки УУР и УДД, как это реализовано сейчас.
Наличие государственного контроля в виде научно-практического совета вселяет представителям некоторых медицинских профессиональных некоммерческих организаций опасения в непрозрачности решений, которые будут приниматься данным советом. Также Совет должен принять одно из следующих решений: одобрение проекта КР, отклонение проекта КР или направление проекта КР на доработку. Заседания Совета проводятся по мере поступления КР, но не реже одного раза в три месяца. Однако срок рассмотрения проекта конкретной КР Приказом не регламентирован. Также не определено, в какой срок после получения вердикта Совета медицинская профессиональная некоммерческая организация должна выполнить доработку проекта КР; должно ли быть организовано общественное обсуждение доработанного проекта КР; в какой срок доработанный проект будет рассмотрен Советом; порядок действий, если подготовившая проект КР медицинская профессиональная некоммерческая организация по каким-либо причинам на станет заниматься доработкой проекта. Также не специфицирован порядок действий на случай, если Совет отклонит проект КР [27,28,29,30].
Ряд критиков указывают на риск нескоординированных действий и дублирования процессов в случае, если в одном и том же терапевтическом направлении работают несколько ассоциаций.
Например, в гастроэнтерологии в РФ действуют Российская Гастроэнтерологическая Ассоциация (РГА), научное общество гастроэнтерологов России (НОГР), Российское общество по изучению печени (РОПИП), Российское общество детских гастроэнтерологов, гепатологов и нутрициологов. Все эти медицинские профессиональные некоммерческие организации занимаются валидацией и разработкой клинических рекомендаций. Есть и региональные ассоциации гастроэнтерологов. Похожая ситуация имеет место и по ряду других терапевтических направлений. Сейчас Приказы Минздрава РФ допускают параллельную несогласованную подготовку проектов нескольких версий КР по одному и тому же заболеванию (состоянию). Однако, согласно ФЗ № 323, по одной нозологии может быть утверждено не больше одной КР.
При этом не определены критерии отбора медицинских профессиональных некоммерческих организаций, подходы к организации научно-практическим советом работ по совместной разработке КР, особенно если имеется несколько проектов КР по одной и той же нозологии, разработанных разными медицинскими профессиональными некоммерческими организациями. Похожая ситуация и с пересмотром КР. Критики считают, что остались открытыми следующие вопросы: «Нужно ли медицинским профессиональным некоммерческим организациям подавать уведомление в Минздрав о начале работы по пересмотру КР?», «В какой срок должна быть организована работа по пересмотру КР?», «Требуется ли общественное обсуждение проекта пересмотренной КР?», «Какая медицинская профессиональная некоммерческая организация должна/может подготовить проект пересмотренной КР — только утвердившая КР или любая другая?», «Как должен действовать Совет, если таких проектов пересмотра КР поступит несколько?» [27,28].
Регламент предусматривает выделение в тексте КР тех ЛП, медицинских изделий и специализированных продуктов медицинского питания, которые входят, соответственно, в Перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения (ЖНВЛП), Программу государственных гарантий бесплатного оказания гражданам медицинской помощи и Перечень специализированных продуктов лечебного питания для детей-инвалидов. Поскольку периодичность пересмотра данных перечней чаще, чем максимальный срок пересмотра КР, в реальной практике КР должны будут пересматриваться не реже, чем данные Перечни. Также не определено, на кого будет возложена задача по регулярной проверке изменения статуса ЛП, медицинских изделий и специализированных продуктов медицинского питания в данных Перечнях и инициации пересмотра\актуализации КР при необходимости. Похожие риски и с предоставлением в разделе «Справочные материалы» КР информации из Инструкций по медицинскому применению ЛП. В Инструкции компанией-производителем или регулятором с различной периодичностью вносятся изменения, поэтому есть риск, что практикующий специалист будет следовать устаревшей версии Инструкции, ориентируясь на информацию в разделе «справочные материалы» КР, а не на действующую версию Инструкции по медицинскому применению ЛП [27,28,29].
Среди других комментариев можно отметить неясный порядок действий при ситуации, когда тезисы-рекомендации в утвержденных (и обязательных к применению) КР выходят за рамки тезисов-рекомендаций или противоречат таковым в авторитетных международных гайдлайнах. Например, в зарубежных гайдлайнах нет рекомендаций применять иммуномодуляторы при ОРВИ или гепатопротекторы при неалкогольной жировой болезни печени, а в отечественных КР такие рекомендации могут присутствовать. Похожая ситуация – если необходима форма ЛП, не зарегистрированная в РФ. Например, в детской практике необходимы свечи с диазепамом для контроля судорожных приступов, но данная форма не имеет регистрации в ГРЛС. Действующим законодательством установлена возможность ввоза и применения по жизненным показаниям незарегистрированных в РФ лекарственных препаратов [41]. Но такие препараты априори окажутся вне утвержденных КР, хотя в зарубежных гайдлайнах они присутствуют.
Существующие различия в оснащенности ЛПУ, уровне подготовки специалистов и в доступе населения к медицинской помощи увеличивают риск отступления от исполнения утвержденных КР.
Например, многие методы инструментальной и лабораторной диагностики, привычные в многопрофильных стационарах крупных мегаполисов, просто недоступны жителям отдаленных регионов.
Отдельно следует отметить юридический конфликт между КР, стандартами и порядками. Медицинские юристы полагают, что поскольку КР разрабатываются и утверждаются медицинскими профессиональными некоммерческими организациями, которые не являются органами государственной власти или органами местного самоуправления, то их акты не являются нормативно-правовыми и не создают правовых норм. Даже одобрение КР научно-практическим советом Минздрава РФ не даст повода считать КР нормативным актом. Из этого следует отсутствие правовой возможности ставить стандарты медицинской помощи в зависимость от КР, поскольку нормативный правовой акт, которым является стандарт медицинской помощи, не может быть поставлен в зависимость от ненормативного акта [27]. Также, поскольку КР не являются нормативно-правовыми актами, к ним нельзя апеллировать во время судебных разбирательств [42].
Заключение
Внедрение КР является важным шагом вперед как для унификации подходов к профилактике, диагностике, лечению и реабилитации, так и для приближения качества оказания медицинской помощи к стандартам доказательной медицины. Впервые законом регламентировано, что КР должны содержать структурированную информацию, основанную на научных доказательствах. Это дает основания надеяться на снижение доли вмешательств, не имеющих доказательной базы, в повседневной клинической практике.
Очевидно, что некоторые аспекты процесса разработки и утверждения КР нуждаются в дальнейшем совершенствовании.
Это закономерно и является неотъемлемой частью любого процесса, предусматривающего масштабные изменения нормативной базы и сложившейся практики. Практика быстрой и конструктивной реакции разработчиков законопроекта на комментарии и замечания представителей профессионального сообщества позволяет выразить надежду на то, что совершенствование подходов продолжится. В целом последовательное внедрение обязательного следования КР в клиническую практику к 2022 г. имеет высокие шансы позитивно повлиять на качество оказания медицинской
помощи.
Список литературы смотрите здесь.
Источник: Журнал “Фармакоэкономика. Современная фармакоэкономика и фармакоэпидемиология” №2, 2019
Ссылка на оригинал: https://www.pharmacoeconomics.ru/jour/article/view/293/285
