Ожирение и остеопороз – являются двумя из наиболее распространенных хронических заболеваний 21-го века. Обоим сопутствует значительная заболеваемость. Костный мозг – это единственное место в организме млекопитающих, где кости и жир соседствуют рядом друг с другом. Костномозговая жировая ткань – это динамическое депо, которое, вероятно, существует в виде конститутивного и метаболического отсеков. Адипоциты секретируют цитокины и адипокины, которые либо стимулируют, либо ингибируют соседние остеобласты. Взаимоотношение костномозговой жировой ткани с другими жировыми депо является сложным и может играть очень различающиеся роли в модуляции метаболического гомеостаза, гемопоэза и остеогенеза. Понимание взаимоотношений между костью и жировыми клетками, возникающих из одного и того же укрытого в костном мозге предшественника, дает представление о патофизиологии связанных с возрастом остеопороза, диабета и ожирения.
Введение
Ожирение и остеопороз – хронические заболевания с очень высокими уровнями распространенности, а также сопровождающиеся вторичными расстройствами, которые приводят к существенному увеличению заболеваемости и смертности. Раньше считалось, что это взаимоисключающие заболевания, но теперь стало ясно, что ожирение и остеопороз часто сосуществуют и могут иметь причинно-следственную связь. Действительно, по данным исследования остеопоротических переломов у мужчин (MrOS), проспективного когортного исследования факторов, определяющих развитие переломов у мужчин старше 65 лет, ожирение явилось основным фактором риска развития остеопоротических переломов. Кроме того, сахарный диабет 2 типа, характеризующийся ожирением и инсулин-резистентностью, ассоциируется с уровнем костной массы средним или выше среднего, но с повышенным риском переломов. При диабете 1 типа переломы являются одним из сопутствующих заболеваний, также диабет 1 типа часто ассоциирован с костномозговым ожирением. Знание патофизиологии этих заболеваний предоставляет нам важнейшие связи между дисфункцией адипоцитов и дифференцировкой остеобластов. Более внимательное изучение их происхождения также демонстрирует общие патофизиологические пути в пределах микроокружения костного мозга. Общий мезенхимальный предшественник, найденный в костном мозге, в стромальной сосудистой секции жировых депо и прилегающих сосудистых структурах в других тканях, может давать начало остеобластам, адипоцитам и миоцитам. Широкую поддержку получила гипотеза, согласно которой мезенхимальная стромальная клетка взаимоисключающим образом становится родоначальником только одной клеточной линии и что этот выбор зависит от упорядоченного множества факторов транскрипции и гормонов. Тем не менее, с появлением новых технологий для отслеживания клеточных линий и динамической визуализации этот принцип, вероятно, слишком примитивен, так как он не учитывает потенциальную пластичность клеток-предшественниц, которые, предположительно, стремятся к одной клеточной линии (рисунок 1). Кроме того, модели на животных показали сосуществование костномозговых адипоцитов и остеобластов у мышей с фенотипически высокой массой костной ткани. Несмотря на сложность многих факторов дифференцировки и вариабельности фенотипов генетических моделей, костный мозг все еще обеспечивает нам лучший диапазон в процессе мезенхимальной дифференцировки и в конечном распределении клеточных линий. Как таковые, терапевтические вмешательства как для остеопороза, так и для ожирения в конечном счете будут направлены на взаимодействия костного мозга.
Фундаментальные вопросы
Адипоциты костного мозга были известны со времен 19 века, но считались покоящимися и метаболически инертными. Результаты исследований показали, что костномозговая жировая ткань (КЖТ) в некоторых случаях имеет высокую метаболическую активность (в других низкую), реагируя на физиологические стимулы, такие как снижение содержания калорий в пище и низкую температуру, и активно взаимодействует с остеобластами, опосредуя скелетный гомеостаз. Эндостальные адипоциты редко встречаются у новорожденных, но накапливаются постоянно, в течение всей жизни и занимают значительную долю костномозгового канала длинных костей в старости, при остеопорозе, нервной анорексии, сахарном диабете и скелетной разгрузке (таблица). В осевом скелете многих млекопитающих костномозговое ожирение проявляется только в старости. Увеличение КЖТ при нарушениях обмена веществ, сопровождающихся снижением массы костной ткани, и наблюдение, что остеобласты и адипоциты проистекают из общего пула мезенхимальных клеток-предшественников, предположили простой компромисс между массами кости и жира – преимущественное образование адипоцитов за счет остеобластов, таким образом, приводит к снижению массы кости. Тем не менее, несмотря на более чем десятилетние активные исследования КЖТ, остаются фундаментальные вопросы о том, как взаимодействия кость-жир влияют на скелетный гомеостаз и наоборот. Во-первых, функции КЖТ не ясны, но могут быть зависимы от контекста. Костномозговые адипоциты располагаются в длинных костях здоровых людей и растут наиболее быстрыми темпами во время пика нарастания костной массы, что наводит на мысль о том, что эти клетки могут быть нормальными обитателями эндостальной ниши. Кроме того, КЖТ найдена почти во всех участках скелета у людей и, как предполагается, составляет целых 15% от общего количества жировых запасов у взрослых. Тем не менее, ясны доказательства того, что ожирение костного мозга отрицательно связано с кроветворением как в состоянии здоровья, так и при заболеваниях крови, таких как апластическая анемия и множественная миелома. Благодаря этим наблюдениям был поднят вопрос о том, могут ли костномозговые адипоциты пролонгировать статус гемопоэтических стволовых клеток и ингибировать их дифференцировку. Таким образом, адипоциты могут выступать в качестве местозаполнителей для поддержания стволовости, пока другие факторы замещают секреторные факторы, которые могут регулировать гемопоэтическую дифференциацию. Поддерживает эту гипотезу хорошо известный факт, что после лучевой терапии, сопровождающейся химиотерапией или нет, для трансплантации костного мозга мозговой адипогенез прогрессирует и стихает только в присутствии предшественников гемопоэза. С другой стороны, отрицательная связь ожирения костного мозга высокой степени и низкой костной массы более неоднородна и обнаруживает разнообразный набор метаболических заболеваний. На основании этих наблюдений КЖТ можно было бы рассматривать как пагубную для скелета. Тем не менее, мы знаем, что во время полового созревания костный мозг скелета плечевого пояса, тазового пояса, верхних и нижних конечностей превращается из красного в желтый, даже когда образование кости находится на пике. Кроме того, некоторые животные модели имеют высокую массу костной ткани и увеличение КЖТ. Таким образом, главный вопрос – является ли КЖТ здоровых людей отличной от жира, который накапливается во время болезни. Это различие позволяет предположить, что существует два типа КЖТ: один, присутствующий на протяжении всей жизни (т. е. конститутивный), и регулирующийся местными и системными факторами.
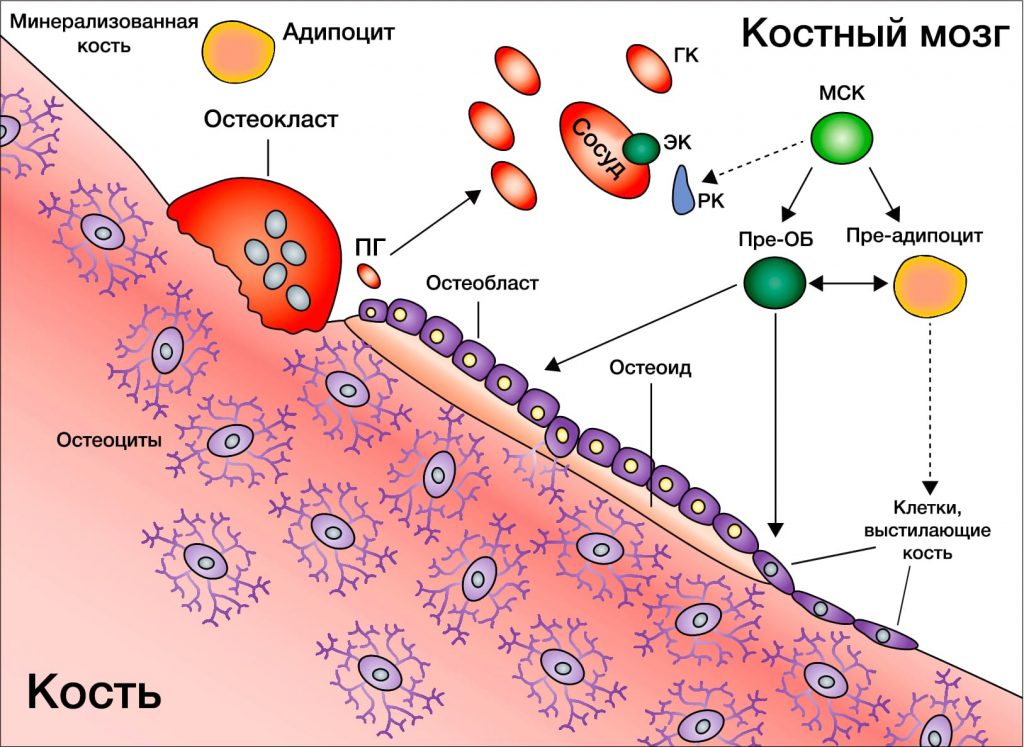
Источник: журнал Lancet Микроокружение костного мозга включает в себя остеобласты, клетки, выстилающие кость, пре-остеобласты, пре-адипоциты, эндотелиальные клетки, ретикулоэндотелиальные клетки, которые могут быть самым ранним прародителем мезенхимальных стромальных клеток, остеокласты, которые обеспечивают резорбцию кости, гемопоэтические клетки, гемопоэтические клетки-предшественники, и, в пределах костного матрикса, остеоциты.
Коммуникации между остеоцитами, клетками, выстилающими кость и остеобластами организуют процесс ремоделирования костной ткани. Мезенхимальные стромальные клетки могут дифференцироваться в пре-остеобласты или пре-адипоциты, так как эти ранние клетки могут быть пластичны. Кроветворные клетки-предшественники тесно связаны с эндостальными остеобластами и оба участвуют в дифференцировке клеток крови. Клетки, выстилающие кость – это фибробластоподобные клетки, их функция неизвестна, хотя вполне вероятно, что эти клетки становятся остеобластами и экспрессируют маркеры остеобластов и остеоцитов. Эти клетки могут стать адипоцитами в ответ на повреждение. Пунктирные линии обозначают предполагаемые пути, сплошные линии обозначают известные пути. Пре-ОБ = пре-остеобласты. ЭК = эндотелиальные клетки. РК = ретикулоэндотелиальные клетки. МСК = мезенхимальные стромальные клетки. ГК = гемопоэтические клетки. ПГ = предшественники гемопоэза. Во-вторых, являются сложными взаимоотношения между КЖТ и белой жировой тканью. Высокая масса тела, как считалось, поддерживает костную массу с помощью большей механической нагрузки, но белый жир может способствовать остеопорозу, нарушая поддержание костной ткани за счет производства воспалительных цитокинов, таких как интерлейкин 6 (IL-6) и фактор некроза опухоли (TNF). Адипоциты костного мозга, накапливаются, как правило, когда депо белого жира истощены, но точные эффекты на кости белого жира в сравнении с КЖТ остаются предметом исследования. В отличие от этого, рацион с высоким содержанием жиров у грызунов приводит к существенному увеличению висцеральных жировых депо, но меньшему увеличению КЖТ (рисунок 2). В-третьих, происхождение адипоцитов костного мозга остается неизвестным. Несмотря на то, что они занимают существенную часть костномозговой ниши, остается неясным как возникают эти клетки, в частности, на протяжении длительных периодов времени, таких как старение, а также то, как эти клетки относятся к остеобластам и гемопоэтическим клеткам. Некоторые данные подтверждают убеждение, согласно которому адипоциты костного мозга могут иметь уникальные свойства, которые отличают их от бурых и белых адипоцитов. Например, после облучения, даже отдаленного от участка прямого воздействия, или химиотерапии, наблюдаемое костномозговое ожирение может сохраняться в течение нескольких месяцев или лет. Повреждение мозга любого вида обеспечивает стимул для адипоцитарной инфильтрации, но эти клетки образуются из клеток, выстилающих кость, предшественников гемопоэза, стромальных элементов, таких как ретикулоэндотелиальные клетки, или же из уникального предшественника адипоцитов, который возникает de novo? Животные и человеческие модели улучшили понимание процессов, но вопросы все еще остаются. Таблица: взаимоотношения между костномозговым ожирением и минеральной плотностью костной ткани в различных группах людей.
| Костномозговое ожирение | Минеральная плотность кости | Ожирение редуцируется при лечении болезни? | Использованная литература | |
| Пубертат | Повышено | Повышена | Н/П | Kricun 1985, Moore 1990 |
| Старость | Повышено | Снижена | Н/П | Tuljapurkar 2011 |
| Голодание | Повышено | Снижена | Да | Abella 2002, Bredella 2009, Ecklund 2010, Fazeli 2012 |
| Остеопороз | Повышено | Снижена | Да | Cohen 2012, Duque 2011, Schwartz 2013, Yeung 2005 |
| Разгрузка | Повышено | Снижена | Нет | Dudley-Javorski 2008, Minaire 1984, Qin 2010, Trudel 2009 |
| Диабет 1 типа | Повышено | Снижена | Нет | Moyer-Mileur 2008, McCabe 2007, 2011 |
Н/П = не применимо В-четвертых, не были хорошо освещены механические последствия обширного ожирения костного мозга. Повышает ли присутствие жира в костном мозге риск переломов путем изменения скелетного ответа на конкретные напряжения? В процессе старения и при диабете кортикальная пористость является отличительной особенностью кортикального вещества кости, окружающего элементы полости костного мозга. Приводит ли наличие КЖТ в этих порах к ослаблению костей, особенно в ответ на значительные нагрузки оказываемые на надкостницу? Несмотря на хорошо известный факт, что адипоциты костного мозга накапливаются со временем у здоровых людей, не слишком ясно преимущество КЖТ над костной массой. Пик накопления КЖТ в скелете плечевого пояса, тазового пояса, верхних и нижних конечностей приходится на пубертатный возраст, совпадая с пиком нарастания костной массы, что подразумевает возможность одновременного быстрого накопления костной массы и КЖТ. В поддержку этого, результаты исследования девочек раннего пубертатного периода показали, что содержание минеральных веществ кости положительно связано с ожирением костного мозга, хотя эта связь может быть опосредованна положительной связью каждого фактора с общей массой жира в организме. Тем не менее, другие исследования показали, что минеральная плотность костной ткани и ожирение костного мозга обратно пропорционально коррелируют даже у молодых, здоровых людей. Еще предстоит установить, существуют ли компромиссы между КЖТ и костной массой молодых, здоровых людей, но такая взаимность проявляется при метаболических заболеваниях, в том числе при нервной анорексии, диабете, ожирении, остеопорозе и механической разгрузке. Наша цель в этом обзоре – охарактеризовать успехи в понимании взаимодействия кость-жир как внутри, так и за пределами отсека костного мозга, а также определить области для дальнейших исследований. В частности, мы ориентируемся на доказательства, поддерживающие наличие общего пути, ведущего к образованию адипоцитов в физиологических состояниях и того, есть ли конкретные метаболические пути, приводящие к ожирению костного мозга при болезни. Мы приводим клинические примеры из изучения этого важного компонента костномозговой ниши, чтобы подчеркнуть значимость КЖТ у человеческих существ.
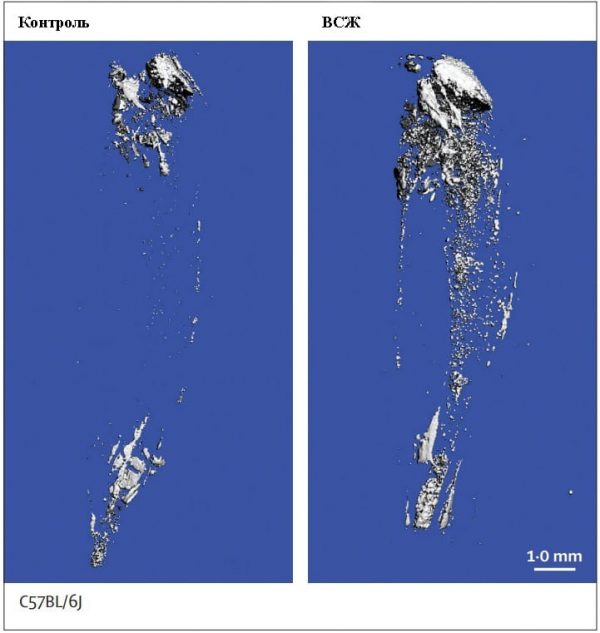
Источник: журнал Lancet Репрезентативные изображения (n=5) большеберцовой кости показывают, что в сравнении со здоровым питанием (контроль, левая панель), костномозговое ожирение незначительно увеличивается при диете с высоким содержанием жиров (ВСЖ, правая панель).
Нервная анорексия
Рост костномозгового ожирения как на аксиальных, так и на аппендикулярных участках кости широко отмечен у пациентов с нервной анорексией, наряду с истощением висцеральной и подкожной жировой клетчатки, гиполептинемией и супрессией минерализации кости. Результаты исследований показали, что накопление КЖТ при анорексии связано с циркулирующими концентрациями DLK-1 (который также известен как преадипоцитарный фактор-1, Pref-1), регулятора дифференцировки адипоцитов и остеобластов, который повышается у женщин с нервной анорексией в сравнении с женщинами в группе контроля. В соответствии с этой концепцией, у женщин, оправившихся от анорексии, концентрация DLK-1 снижается, жировая фракция костного мозга уменьшается, а масса костей увеличивается. Эксперименты на модельных организмах являются существенным дополнением к исследованиям на людях и являются ключом, обеспечивающим понимание механизмов, которые связывают КЖТ и кости. Модели нервной анорексии на грызунах поддерживают обратную связь между лептином и костномозговым ожирением, хотя связь между лептином и костной массой является более сложной. Гиполептинемия, вторичная по отношению к ограничению калорийности, приводит к повышению количества КЖТ и снижению трабекулярной костной массы у молодых, но не у старых грызунов. β-адренергическая блокада во время ограничения калорийности у крыс показала: 1) облегчение снижения не только костной массы, но и большого количества КЖТ; 2) притупление индуцированного голодом снижения сывороточного лептина, подразумевая центральную регуляцию костной массы и КЖТ при ограничении калорийности. Гиполептинемия также ассоциирована с ростом костномозгового ожирения у ob/ob мышей, которые не экспрессируют лептин. Hamrick и коллеги показали, что у ob/ob мышей терапия лептином уменьшает костномозговое ожирение и увеличивает образование костной ткани, что указывает на возможную роль лептина в обеспечении баланса между костью и жиром. Тем не менее, последующие исследования, проведённые на самцах крыс Спрег-Доули (Sprague-Dawley) показали, что лептин стимулирует рецепторы вентромедиальных ядер гипоталамуса, снижая как периферические белые адипоциты, так и костномозговые адипоциты, не затрагивая площадь поверхности остеобластов, подразумевая, что лептин различными путями влияет на формирование костной ткани и костномозговое ожирение.
Диабет
Высокое количество КЖТ также было отмечено при диабете 1 типа наряду с нарушением кортикальной костной геометрии. В противоположность этому при диабете 2 типа не отмечается высокое количество КЖТ. Оно повышает риск перелома, несмотря на более чем среднюю минеральную плотность костной ткани. Тем не менее, разница в композиции КЖТ при диабете 2 типа была показана с помощью магнитно-резонансной спектроскопии: у женщин с сахарным диабетом 2 типа было обнаружено, что полость костного мозга содержит менее насыщенные липиды у больных, ранее перенесших перелом в сравнение с более насыщенными липидами у тех, кто ранее не имел переломов. И хотя эти результаты интригуют, неизвестно, как насыщенность или ненасыщенность жиров костного мозга может быть связана с общим количеством жира или риском перелома. Животные модели диабета 1 типа сопоставимы с человеческими данными, показывая гиполептинемию, высокое количество КЖТ и низкую костную массу. Эта модель будет соответствовать парадоксальному ответу костного мозга на глобальный дефицит субстрата, т. е. росту ожирения костного мозга. Результаты исследований стрептозоцин-индуцированного диабета у BALB/c и у не страдающих ожирением мышей-диабетиков показали, что в обеих моделях в проксимальном конце большеберцовой кости отмечалось увеличение числа костномозговых адипоцитов и концентраций мРНК, кодирующих PPARG и FABP4 (также известный как адипоцитарный белок 2) наряду с уменьшением минеральной плотности губчатой и кортикальной костной ткани и фракции объема костной ткани, а также мРНК, кодирующей остеокальцин. Лечение BALB/c мышей с стрептозоцин-индуцированным диабетом лептином или антагонистом PPARG, диглицидиловым эфиром бисфенола А (BADGE) предотвращало накопление костномозговой жировой ткани, но не потерю костной массы, предполагалось, что эти явления – результат частных независимых механизмов диабета. Предполагалось, что в противоположность этому, лечение BADGE взрослых мышей дикого типа, совместно с витамином D или нет, увеличивало образование костной ткани и снижало костномозговой адипогенез. Подразумевается, что есть PPARG-опосредованная взаимосвязь между образованием костной ткани и образованием адипоцитов костного мозга, но это – не единственный механизм, который приводит к снижению костной массы при сахарном диабете 1 типа. Резистентность к инсулину и ожирение хорошо известны как особенности сахарного диабета 2-го типа. Минеральная плотность костной ткани, как правило, средняя или слегка повышена, но риск переломов увеличивается. Исследуются механизмы, ответственные за хрупкость скелета при этом заболевании, хотя кортикальная пористость – одна из особенностей, которая может нанести ущерб прочности костей, особенно в скелете плечевого пояса, тазового пояса, верхних и нижних конечностей, где переломы являются наиболее распространенными. Костномозговое ожирение не является признаком генерализованной инсулиновой резистентности, хотя мыши В6, получавшие питание с высоким содержанием жиров в течение 12 недель после отлучения от груди, показали небольшое увеличение костномозговых адипоцитов в большеберцовой кости, что было измерено с помощью осмий микро-КТ. С другой стороны, тиазолидиндионы, такие как розиглитазон и пиоглитазон, являются очень сильными индукторами КЖТ и потери костной массы в скелете плечевого пояса, тазового пояса, верхних и нижних конечностей грызунов. In vitro тиазолидиндионы являются мощными стимуляторами адипогенеза в мезенхимальных клетках-предшественниках и ингибируют остеогенез. У человека результаты некоторых исследований свидетельствуют о том, что костномозговое ожирение происходит в ответ на тиазолиндиндионы, хотя в других исследованиях это не было отмечено.
Скелетная разгрузка
Накопление КЖТ в организме человека связано с остеопенией, например при параличе. Результаты международного разведочного исследования космической симуляции у женщин показали увеличение ожирения костного мозга при 60-дневном постельном режиме, а также – сохранение повышенного уровня КЖТ в течение года после разрешения вставать. Выводы из последующих исследований у мужчин показали, что резистивные упражнения по отдельности или в сочетании с низким уровнем общей вибрации тела тормозили накопление КЖТ, хотя воздействие на костную массу не сообщалось и размер выборки был небольшим. В поддержку того понятия, что механическая нагрузка играет роль во взаимодействии кость-жир, разгрузка скелета на животных моделях ассоциирована с высоким уровнем ожирения костного мозга и низкой костной массой. Результаты ранних исследований крыс, подвергшихся воздействию микрогравитации в космическом полете или наземной разгрузке задних конечностей показали, что нарушение минерализации костной ткани и повышенное ожирение костного мозга нормализовались при разрешении нагрузки в обеих моделях. Выводы из исследования разгрузки задних конечностей, достаточной для того, чтобы вызвать потерю костной массы и увеличение КЖТ показали: лечение с помощью антител склеростина уменьшает потерю костной массы, но не оказывает никакого влияния на ожирение мозга; предположительно, потеря костной массы и увеличение КЖТ в этой модели опосредованы независимо друг от друга. На механистическом уровне разгрузка крыс показала снижение образования костной ткани и более низкие концентрации мРНК, кодирующей RUNX2, остеокластин и коллаген 1 типа, но более высокое количество адипоцитов костного мозга и высокие концентрации PPARG, липопротеин липазы и FAPB4. Как экспрессия генов, так и лечение костей нормализовались после лечения TGFB2. Результаты последующих экспериментов показали, что разгрузка повышает экспрессию CEBPA и СЕВРВ, которые в свою очередь повышают экспрессию PPARG2, но TGFB2 предотвращает индуцированные разгрузкой изменения экспрессии и активности генов. Эти данные обеспечивают поддержку прямого компромисса между образованием кости и формированием жировой ткани костного мозга при скелетной разгрузке с повышением экспрессии генов жировой ткани, а далее предполагают что TGFB2 может быть эффективным для смягчения эффекта у людей, подвергшихся этой разгрузке.
Остеопороз
Meunier и коллегами впервые было отмечено, что при остеопорозе происходит увеличение количества КЖТ. Трансилиакальная биопсия у женщин в пременопаузе с идиопатическим остеопорозом или остеопенией показала более многочисленные, объемистые адипоциты костного мозга, чем в контрольной группе, хотя только контроль имел ожидаемую положительную корреляцию КЖТ и возраста и отрицательную корреляцию КЖТ, формирования и объема костной ткани. Результаты исследования в когорте AGES-Reykjavik показали, что высокие количества КЖТ обратно связаны с минеральной плотностью губчатой кости, которая измерялась с помощью количественной КТ у женщин, и положительно связаны с имеющимися переломами позвонков у мужчин. Как остеопороз, так и остеопения были связаны с уменьшением доли ненасыщенных липидов, которая определялась с помощью магнитно-резонансной спектроскопии. Один из сохранившихся вопросов о КЖТ и кости – накопление КЖТ предшествует, следует или проходит параллельно с потерей костной ткани. В большинстве моделей на грызунах старение связано со значительным ожирением костного мозга, которое связано с низкой минеральной плотностью губчатых костей у грызунов и человека, таким образом, предполагается, что образование КЖТ и кости – взаимоисключающие процессы. С другой стороны, самки мышей С57BL6 начинают терять губчатую кость еще на 8 неделе, хотя отсутствие нарастающего ожирения костного мозга станет очевидным намного позже. В модели глюкокортикоид-индуцированного остеопороза у кроликов продольная оценка липидной костномозговой фракции и минеральной плотности кости в проксимальной части бедренной кости показала, что увеличение КЖТ предшествовало снижению минеральной плотности костной ткани. Также количественное гистологическое исследование показало, что первоначальное увеличение числа костномозговых адипоцитов сопровождалось увеличением диаметра адипоцитов. Хотя одновременное лечение золедроновой кислотой было достаточным для устранения индуцированного глюкокортикоидами количества и диаметра адипоцитов, минеральная плотность костной ткани была восстановлена лишь частично.
Потенциальное терапевтическое значение
Подводя итог, у людей происходит конфликт данных о том, положительно или же отрицательно коррелируют ожирение костного мозга и костная масса. В то время, как у подростков одновременно наблюдается прирост КЖТ и кости, позже, в зрелом возрасте, зависимость обратна. Данные из животных моделей в целом поддерживают идею о том, что, что костномозговое ожирение обратно коррелирует с костной массой при некоторых метаболических расстройствах, хотя бывают и исключения: фенотип ob/ob мышей включал прирост КЖТ и высокую осевую, но низкую аппендикулярную костную массу, несмотря на полное отсутствие лептина. Кроме того, сравнение штаммов C3H и C57Bl/6J показывает, что масса кости и ожирение костного мозга часто, ,но не всегда, обратно зависимы, в частности, у штамма C57Bl/6J. В штамме С3Н высокая костная масса (трабекулярная и кортикальная) сосуществует с высоким количеством КЖТ на протяжении всей жизни. Данные как у людей, так и у животных также указывают на то, что рост ожирения костного мозга развивается с помощью нескольких механизмов. Причиной накопления КЖТ, по всей видимости, частично может являться гиполептинемия при нервной анорексии и диабете 1 типа, но при постельном режиме вероятной причиной является механическая разгрузка, также причиной может являться возрастной остеопороз. Концентрации грелина, которые растут при анорексии, могут стимулировать костномозговое ожирение. Полученные в результате костномозговые адипоциты также демонстрируют различную степень пластичности в ответ на метаболические сигналы. Индуцированное анорексией ожирение костного мозга постепенно редуцируется с увеличением веса, в то время как КЖТ при разгрузке и диабете оказывается более стойкой, несмотря на возвращение способности передвигаться и терапию инсулином соответственно. Частично эта персистенция может быть связана с тем, какая КЖТ обнаруживается, так как различают два типа КЖТ: конститутивный (т. е., в обязательном порядке отмечаемый в дистальной части бедренной кости) и регулируемый в диафизах и проксимальных отделах бедренной и большеберцовой костей (т. е. вариабельно присутствующий в ответ на метаболические расстройства). Таким образом, требуется дополнительная работа для идентификации специфических путей, лежащих в основе формирования костномозговых адипоцитов у здоровых людей и при метаболических расстройствах, а также для понимания механизмов, которые приводят к регрессу или персистенции КЖТ в различных участках скелета и распределению КЖТ с последующим восстановлением. Некоторые потенциальные диагностические и терапевтические воздействия вытекают из наших знаний о костномозговом ожирении и его взаимодействии с элементами костномозговой ниши. Во-первых, основным клиническим осложнением лечения злокачественных заболеваний с помощью химиотерапии и радиации являются остеопоротические переломы. Большинство пациентов, проходящих лечение по поводу гемопоэтических и солидных опухолей (таких как лимфома, лейкоз), нуждаются в этих терапевтических подходах для потенциального излечения. Тем не менее, в результате этого позже, в течение жизни увеличивается хрупкость скелета, развивается остеопения, являющаяся одним из сопутствующих заболеваний, в особенности, у детей, рано проходящих лечение. Многие из этих пациентов имеют постоянное ожирение костного мозга, отмечаемое при биопсии кости или МРТ; плотность костной ткани у них, как правило, ниже, чем у контрольной группы того же возраста. Пожизненная терапия анти-остеопоротическими препаратами не является приемлемым или экономически эффективным вариантом. Тем не менее, если препарат сможет на ранней стадии изменить распределение линии в пользу остеогенеза, это может иметь огромное терапевтическое значение и позволит значительно сэкономить средства. Во-вторых, диабет 1 типа ассоциирован с хрупкостью скелета, особенно у лиц, длительность заболевания у которых составляет более 20 лет. Основной заботой таких пациентов является низкая костная масса и снижение образования костной ткани, еще одной характерной чертой является нарастающее костномозговое ожирение. Опять же, разработка препаратов, которые должны улучшить остеогенез и уменьшить жировую инфильтрацию костного мозга, окажет значительное влияние на болезни скелета при этом хроническом заболевании. В-третьих, если КЖТ показывает на МРТ-специфический спектроскопический сигнал жирового насыщения у пациентов высокого риска, имеющих возрастной остеопороз или диабет 2 типа, то скрининг пораженных лиц, особенно со здоровой плотностью костной ткани, может оказаться экономически эффективным средством выявления пациентов, которым показано лечение анти-остеопоротическими препаратами. Крайне важно понять участь клеток в костном мозге и их причастность к физиологическим и патологическим состояниям. Костномозговое ожирение обеспечивает окно возможностей для понимания ремоделирования ниши костного мозга и потенциальных манипуляций для лечения хронических и сопутствующих им заболеваний. Оригинал
источник: medach.pro
