Аметов Александр Сергеевич,
д.м.н., профессор, заведующий кафедрой эндокринологии ФГБОУ ДПО “Российская медицинская академия непрерывного профессионального образования”, член Президиума Правления Российской ассоциации эндокринологов
Косян Анюта Амаяковна,
эндокринолог, аспирант кафедры эндокринологии ФГБОУ ДПО “Российская медицинская академия непрерывного профессионального образования”
Пашкова Евгения Юрьевна,
к.м.н., доцент кафедры эндокринологии ФГБОУ ДПО “Российская медицинская академия непрерывного профессионального образования”, заведующая отделением эндокринологии ГБУЗ “Городская клиническая больница им. С.П. Боткина”
Cо стремительным ростом сахарного диабета (СД) во всем мире растет и частота его поздних осложнений, которые чреваты снижением трудоспособности и ухудшением качества жизни населения. Одним из наиболее распространенных осложнений СД является диабетическая невропатия (ДН). По мнению разных авторов, распространенность ДН достигает 90% среди больных СД. ДН, являясь основной причиной нетравматической ампутации нижних конечностей, приводит к снижению трудоспособности и увеличению инвалидности [1-4].
Теории патогенеза ДН многочисленны, но они все сводятся к двум основным взаимосвязанным патогенетическим механизмам – метаболическому и сосудистому. В основе развития метаболических и сосудистых нарушений при СД типа 2 (СД2) в условиях гипергликемии лежит активация оксидативного стресса [5].
Несмотря на то что изучению ДН посвящены многочисленные исследования, до сих пор механизмы ее развития полностью не раскрыты, и далеко не во всех случаях коррекция только традиционных факторов риска приводит к уменьшению проявлений ДН [6]. Следовательно, поиск недостающих звеньев патогенеза и их соответствующая терапия остаются чрезвычайно актуальной задачей.
В ряде недавних исследований говорится о новом факторе риска, поражающем нервную систему – повышенном уровне незаменимой аминокислоты гомоцистеина (гипергомоцистеинемия) [7]. Из данных отечественных и зарубежных исследователей следует, что гипергомоцистеинемия, активируя оксидативный стресс, приводит к прогрессированию микро- и макрососудистых осложнений СД [8-13].
Механизмы активации оксидативного стресса в условиях гипергомоцистеинемии, как считают многие авторы, связаны с усиленным образованием гомоцистеиновой кислоты в организме [12]. Гомоцистеиновая кислота, вступая во взаимодействие с эндогенными тиолами, к которым относятся метионин, цистеин, таурин, глутатион, сероводород, липоевая кислота, полисульфиды и др., восстанавливается до гомоцистеина. В процессе восстановления гомоцистеиновой кислоты усиливается образование супероксид-анион-радикала (O-₂), что в условиях гипергомоцистеинемии приводит к истощению запасов антиоксидантной системы [14]. Антиоксидантная система представлена в организме ферментами [супероксиддисмутазой (СОД), каталазой и глутатионпероксидазой (ГПО)] и веществами с антиоксидантной активностью (витамины А, С, Е, фолиевая кислота, глутатион, коэнзим Q10 и др.). В норме антиоксидантная система работает как буфер, нейтрализуя свободные радикалы, а в условиях длительной гипергомоцистеинемии ресурсы антиоксидантной системы истощаются [15].
Учитывая, что повышенный уровень гомоцистеина при СД2 встречается более чем у 30% пациентов, изучение роли гипергомоцистеинемии в развитии диабетических осложнений, в том числе ДН, имеет важнейшее значение [16].
Цель – определение влияния гипергомоцистеинемии на уровень антиоксидантных ферментов в крови и на степень выраженности ДН у пациентов с СД2.
Материал и методы
В исследовании приняли участие 30 пациентов в возрасте 45-65 лет с установленным диагнозом “СД2 с дистальной сенсомоторной диабетической полиневропатией”.
Критерии включения:
- установленный диагноз “СД2 с дистальной сенсомоторной диабетической полиневропатией”;
- возраст 45-65 лет;
- уровень гликированного гемоглобина (НЬА1с) от 6,5 до 8,5%;
- способность и желание пациента следовать протоколу исследования.
Критерии исключения:
- СД типа 1;
- тяжелая патология сердечно-сосудистой системы: инфаркт миокарда в последние 6 мес, нестабильная стенокардия, некомпенсированная сердечная недостаточность, неконтролируемая артериальная гипертензия (АД >200/110 мм рт.ст.);
- тяжелая патология желудочно-кишечного тракта;
- хроническая почечная недостаточность, уровень креатинина >130 мкмоль/л;
- наличие острых осложнений СД;
- недостаточность витамина В12;
- прием препаратов и веществ, влияющих на обмен гомоцистеина и антиоксидантных ферментов (альфа-липоевая кислота, фолиевая кислота, витамины В12, В6 и др., диета с повышенным содержанием белка и злоупотребление алкоголем) в течение 3 нед до исследования, а также несоблюдение диетических рекомендаций СД в полном объеме;
- наличие клинически значимых проявлений интеркур-рентного заболевания;
- беременность, лактация.
Методы исследования включали общее клиническое обследование (осмотр, сбор анамнеза, клинический и биохимический анализы крови, анализ мочи, измерение артериального давления, ЭКГ) и оценку углеводного обмена путем определения уровня НЬА1с и глюкозы в венозной крови натощак, а также определение уровня витамина В12 (референс-ные значения 191-663 пг/мл), гомоцистеина (референсные значения 5,0-15,0 мкмоль/л), ферментов антиоксидантной системы – СОД и ГПО в венозной крови натощак. Референсные значения СОД в эритроцитах составляют 164-240 Ед/мл, а ГПО – 4171-10881 Ед/л.
Для оценки функционального состояния периферической нервной системы использовалась шкала общей оценки симптомов невропатии (Total Symptoms Score, TSS), что дает возможность с помощью опросника оценить частоту и интенсивность отдельных сенсорных симптомов невропатии: боли, жжения, онемения и парестезии за последние сутки, а также физикальное обследование с оценкой невропатических нарушений нижних конечностей по шкале неврологического дефицита NIS-LL (Neuropathy Impairment Score in the Lower Limbs).
В исследовании методом стимуляционной электромиографии по стандартной методике были обследованы моторные (общий малоберцовый нерв – nervus рeroneus и больше берцовый нерв – nervus tibialis) и сенсорные (икроножный нерв – nervus suralis) нервы нижних конечностей. Для оценки состояния моторных нервов определяли амплитуду моторного ответа (М-ответ), скорость распространения возбуждения (СРВ) по моторному нерву, резидуальную латентность (РЛ). Для оценки состояния сенсорного нерва определяли амплитуду сенсорного ответа, СРВ по сенсорному нерву.
Статистическую обработку полученных данных осуществляли с использованием программ Microsoft Excel 2010, Statistica (версия 10.0). Сравнение средних количественных признаков в двух группах проводили с помощью t-критерия Стьюдента. Различия считали достоверными при уровне значимости р<0,05.
Для оценки связи между признаками внутри групп использовали коэффициент корреляции Спирмена. Для оценки тесноты связи между признаками использовали следующие критерии:
- rs≤±0,3 – тесная слабая прямая или обратная связь;
- ±0,4<rs<±0,7 – тесная умеренная прямая или обратная связь;
- rs≥±0,7 – тесная сильная прямая или обратная связь.
Если коэффициент корреляции равен нулю, то связь между величинами практически отсутствует. Чем ближе модуль коэффициента корреляции к единице, тем более сильной является связь между измеряемыми величинами.
Пациенты, удовлетворяющие критериям включения, исходя из уровня гомоцистеина (референсные значения 5,0-15,0 мкмоль/л) были разделены на 2 группы: в 1-ю группу вошли 14 человек с повышенным уровнем гомоцистеина в крови, а во 2-ю – 16 человек с нормальным уровнем гомоцистеина в крови.
Поскольку уровень гомоцистеина в крови зависит от количества употребляемых животных белков (мясо, молоко), кофе и алкоголя, а также от количества выкуренных сигарет [17], были изучены дневники питания пациентов, по этим признакам группы были сопоставимые. Были выявлены 3 пациента из 1-й группы и 5 пациентов из 2-й группы, которые выкуривали до 20 сигарет в день, но значительной взаимосвязи факта курения с уровнем гомоцистеина в данном исследовании не наблюдалось.
Общая клиническая характеристика пациентов с СД2, включенных в исследование, представлена в табл. 1.
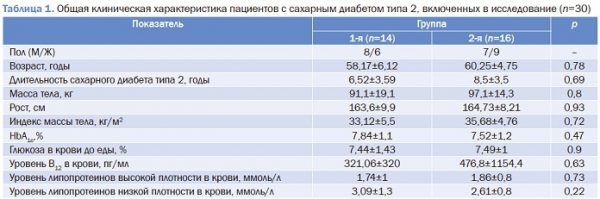
Достоверных отличий между двумя группами по основным показателям на момент исследования не выявлено (p>0,05).
Таким образом, основную когорту исследования составили пациенты в возрасте 53-64 лет с длительностью СД2 более 3 лет и показателем гликемии, близким к целевым значениям для данной категории пациентов.
Результаты
Оценка взаимосвязи уровня гомоцистеина с функциональным состоянием периферической нервной системы
После включения пациентов в исследование оценивали проявление невропатической симптоматики по шкале TSS и невропатические нарушения или невропатический дефицит нижних конечностей по шкале NIS-LL. В группе, где наблюдалась гипергомоцистеинемия, средние баллы TSS (12,37±1,04 против 5,07±2,7) и NIS-LL (14,57±2,5 против 8,5±1,6) были значительно больше, чем в группе с физиологическими показателями гомоцистеина в крови (p<0,05). Кроме этого, в группе с гипергомоцистеинемией наблюдалась положительная корреляция между уровнем гомоцистеина и показателями TSS (rs=0,2), NIS-LL (rs=0,3) (p<0,05) (рис. 1).

Корреляционный анализ электронейромиографических данных показал, что в 1-й группе уровень гомоцистеина отрицательно коррелировал с амплитудой сенсорного ответа (rs=-0,3) (p<0,05) и СРВ (rs=-0,364) (p<0,05) икроножного нерва (рис. 2).
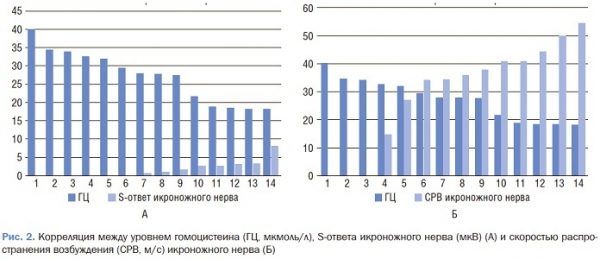
Во 2-й группе значительная взаимосвязь баллов TSS, NIS-LL с уровнем гомоцистеина не наблюдалась. Но уровень гомоцистеина отрицательно коррелировал с амплитудой моторного ответа (rs=-0,2) малоберцового нерва.
Оценка взаимосвязи уровня гомоцистеина и ферментов антиоксидантной системы
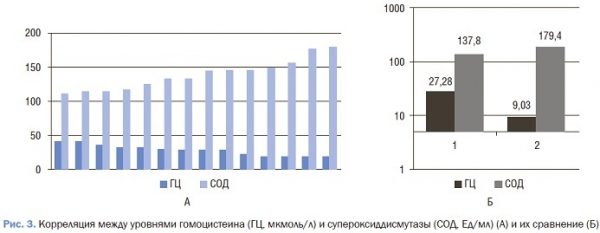
В данном исследовании для оценки взаимосвязи гомоцистеина и ферментов антиоксидантной системы определяли его уровень, СОД и ГПО. Средние значения сывороточного уровня гомоцистеина в 1-й группе были значительно выше по сравнению со 2-й группой (p<0,05); кроме того, в 1-й группе средние значения СОД и ГПО были значительно ниже, чем в группе с нормальным значением сывороточного уровня гомоцистеина (p<0,05) (табл. 2).
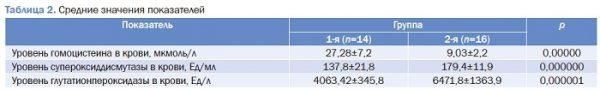
Корреляционный анализ показал, что в группе с гипер-гомоцистеинемиой наблюдается отрицательная связь межу уровнями гомоцистеина с ГПО (rs=-0,4) (p<0,05) и СОД (rs=-0,4) (p<0,05) (рис. 3).
Оценка взаимосвязи уровня ферментов антиоксидантной системы с функциональным состоянием периферической нервной системы
Корреляционный анализ данных показал, что в 1-й группе уровень ГПО отрицательно коррелировал с баллами TSS (rs=-0,2) (p<0,05), а также с РЛ большеберцового (rs=-0,62) (p<0,05) и малоберцового нерва (rs=-0,2) (p<0,05). Кроме того, была выявлена положительная корреляция между сывороточным уровнем ГПО и амплитудой сенсорного ответа (rs=0,699) (p<0,05) и СРВ (rs=0,54) (p<0,05) икроножного нерва.
В 1-й группе уровень СОД отрицательно коррелировал с баллами по шкале NIS-LL (rs=-0,42) (p<0,05). Уровень СОД положительно коррелировал с амплитудой моторного ответа (rs=0,2) (p<0,05), РЛ (rs=0,75) (p<0,05) и СРВ (rs=0,49) (p<0,05) малоберцового нерва, а также с амплитудой моторного ответа большеберцового нерва (rs=0,34) (p<0,05).
Во 2-й группе уровень ГПО отрицательно коррелировал с баллами по шкале NIS-LL (rs=-0,22). Наблюдалась положительная корреляция с амплитудой сенсорного ответа (rs=0,51) (p<0,05) и СРВ (rs=0,3) (p<0,05) икроножного нерва, а также с амплитудой моторного ответа большеберцового нерва (rs=0,55) (p<0,05).
Во 2-й группе уровень СОД положительно коррелировал с амплитудой сенсорного ответа (rs=0,599) (p<0,05) и СРВ (rs=0,6) (p<0,05) икроножного нерва, а также с амплитудой моторного ответа большеберцового нерва (rs=0,26) (p<0,05).
Обсуждение
Роль оксидативного стресса в развитии ДН, несомненно, очень существенна. Активные формы кислорода, которые бесконтрольно образуются во время активации оксидативного стресса, губительно влияют на нервную систему [18]. В данном исследовании была показана значительная корреляция между уровнями антиоксидантных ферментов и функциональным состоянием периферической нервной системы. В частности, на фоне снижения уровня ГПО в 1-й группе средние баллы TSS, РЛ большеберцового и малоберцового нервов увеличиваются, а амплитуда сенсорного ответа и СРВ уменьшаются. Кроме этого, снижение уровня СОД приводит к увеличению значения средних баллов NIS-LL и отрицательно влияет на амплитуду моторного ответа и СРВ малоберцового нерва, а также амплитуду моторного ответа большеберцового нерва. Анализ данных во 2-й группе показывает, что уровень СОД и ГПО положительно влияет на амплитуду сенсорного ответа и СРВ икроножного нерва, а также на амплитуду моторного ответа большеберцового нерва.
Одной из причин активации оксидативного стресса и истощения запасов антиоксидантной системы является гипергомоцистеинемия. В экспериментальных условиях было доказано, что даже субфизиологическая концентрация гомоцистеина (от 1 до 10 мкмоль/л) приводит к образованию активных форм кислорода [12]. А в исследовании N. Weiss и соавт. было продемонстрировано, что повышенный уровень гомоцистеина истощает запасы ГПО и самого глутатиона [14]. В данном исследовании статистический анализ данных показал, что гипергомоцистеинемия приводит к значительному снижению уровня антиоксидантных ферментов (СОД и ГПО), кроме этого, уровень гомоцистеина отрицательно коррелирует с уровнем СОД и ГПО.
И в зарубежной, и в отечественной литературе данные исследователей последних нескольких лет демонстрируют корреляцию между уровнем гомоцистеина и выраженностью ДН [19, 20].
Данное исследование тоже демонстрирует статистически значимую связь между уровнем гомоцистеина и выраженностью проявления ДН в условиях гипергомоцистеинемии. В частности, в условиях гипергомоцистеинемии средние баллы TSS и NIS-LL были значительно выше, а с увеличением уровня гомоцистеина наблюдался их рост.
Статистический анализ электрофизиологических данных в основной группе выявил, что амплитуда сенсорного ответа и СРВ икроножного нерва отрицательно коррелируют с повышенным уровнем гомоцистеина.
Надо отметить, что в основном исследования, которые оценивали влияние уровня гомоцистеина на выраженность ДН, проводились у пациентов с недостаточностью витамина В12 [19, 20]. Как известно, недостаток витамина В12 отрицательно влияет на функциональное состояние периферической нервной системы, поскольку сам может стать причиной развития невропатии [21, 22].
В данном исследовании одним из критериев исключения являлся дефицит витамина В12, в нем принимали участие пациенты с физиологическими значениями уровня этого витамина в крови (см. табл. 1).
Заключение
Результаты данного исследования свидетельствуют о том, что у пациентов с СД2:
- функциональное состояние периферической нервной системы тесно связано с уровнем антиоксидантных ферментов и гомоцистеина в крови;
- повышение уровня гомоцистеина, отрицательно коррелируя с уровнем антиоксидантных ферментов в крови, негативно влияет на степень выраженности ДН.
Возможная коррекция уровня гомоцистеина в крови должна стать важным критерием при выборе патогенетически обусловленной терапии ДН у пациентов с СД2.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Литература
1. Tesfaye S., Boulton A.J., Dickenson A.H. Mechanisms and management of diabetic painful distal symmetrical polyneuropathy // Diabetes diabetic foot ulcers // N. Engl. J. Med. 2004. Vol. 351. P. 48-55.
2. Boulton A.J., Kirsner R.S., Vileikyte L. Clinical practice. Neuropathic Care. 2013. Vol. 36. P. 2456-2465.
3. Singh N., Armstrong D.G., Lipsky B.A. Preventing foot ulcers in patients with diabetes // JAMA. 2005. Vol. 293. P. 217-228.
4. Gore M., Brandenburg N.A., Dukes E., Hoffman D.L. et al. Pain severity in diabetic peripheral neuropathy is associated with patient functioning, symptom levels of anxiety and depression, and sleep // J. Pain Symptom Manage. 2005. Vol. 30. P. 374-385.
5. Brownlee M. The pathobiology of diabetic complications: a unifying mechanism // Diabetes. 2005. Vol. 54. P. 1615-1625/
6. Богданов Э.И., Талантов В.В., Мухамедзянов Р.З. Диабетические нейропатии // Вестн. неврол. 2000. № 3/4. С. 59-67.
7. Obeid R., Herrmann W. Mechanisms of homocysteine neurotoxicity in neurodegenerative diseases with special reference to dementia // FEBS Lett. 2006. Vol. 580, N 13. P. 2994-3005.
8. Wang H., Cui K., Xu K., Xu S. Association between plasma homocysteine and progression of early nephropathy in type 2 diabetic patients // Int. J. Clin. Exp. Med. 2015. Vol. 8, N 7. P. 11 174-11 180.
9. Li J., Shi M., Zhang H., Yan L. et al. Relation of homocysteine to early nephropathy in patients with type 2 diabetes // Clin. Nephrol. 2012. Vol. 77, N 4. P 305-310.
10. Brazionis L., Rowley K., Itsiopoulos C., Harper C.A. et al. Homocysteine and diabetic retinopathy // Diabetes Care. 2008. Vol. 31, N 1. P. 50-56.
11. Rudy A., Kowalska I., Str^czkowski M., Kinalska I. Homocysteine concentrations and vascular complications in patients with type 2 diabetes // Diabetes Metab. 2005. Vol. 31, N 2. P 112-117.
12. Jacobsen D.W. Hyperhomocysteinemia and oxidative stress // Arterioscler. Thromb. Vasc. Biol. 2000. Vol. 20. P 1182-1184,
13. Аметов А.С., Косян А.А. Роль гомоцистеина в развитии диабетической полиневропатии и эндотелиальной дисфункции // Эндокринология: новости, мнения, обучение. 2019. Т. 8, № 1. С. 32-39.
14. Weiss N., Zhang Y.Y., Heydrick S., Bierl C. et al. Overexpression of cellular glutathione peroxidase rescues homocyst(e)ine-induced endothelial dysfunction // Proc. Natl Acad. Sci. USA. 2001. Vol. 98, N 22. P. 12 503-12 508,
15. Аметов А.С., Камынина Л.Л., Рождественская О.А., Пашкова Е.Ю. Положительные метаболические и антиоксидантные свойства тесто-стерон-заместительной терапии при сочетании сахарного диабета типа 2 и гипогонадизма // Эндокринология: новости, мнения, обучение. 2016. № 3. С. 83-93.
16. Hoogeveen E.K., Kostense PJ., Jakobs C. et al. Hyperhomocysteinemia increases risk of death, especially in type 2 diabetes: 5-year follow-up of the Hoorn Study // Circulation. 2000. Vol. 101. P 1506-1511.
17. Stanger O., Herrmann W., Pietrzik K. et al. Consensus paper on the rational clinical use of homocysteine, folic acid and B-vitamins incardiovascular and thrombotic diseases: guidelines and recommendations // Clin. Chem. Lab. Med. 2003. Vol. 41. P 1392-1403.
18. Pop-Busui R., Sima A., Stevens M. Diabetic neuropathy and oxidative stress // Diabetes Metab. Res. Rev. 2006. Vol. 22, N 4. P 257273.
19. Wile D.J., Toth C. Association of metformin, elevated homocysteine, and methylmalonic acid levels and clinically worsened diabetic peripheral neuropathy // Diabetes Care. 2010. Vol. 33, N 1. P 156-161.
20. Roy R.P., Ghosh K., Ghosh M., Acharyya A. et al. Study of Vitamin B 12 deficiency and peripheral neuropathy in metformin-treated early type 2 diabetes mellitus // Indian J. Endocrinol. Metab. 2016. Vol. 20. P 631-637.
21. Nardin R.A., Amic A.N., Raynor E.M. Vitamin B(12) and methylmalonic acid levels in patients presenting with polyneuropathy // Muscle Nerve. 2007. Vol. 36, N 4. P 532-535.
22. Markle H.V. Cobalamin // Crit. Rev. Clin. Lab. Sci. 1996. Vol. 33. P. 247-356.
Источник: Журнал “Эндокринология: новости, мнения, обучение” №2, 2019
