Н.В. Артымук, О.А. Тачкова, Н.А. Сухова
ФГБОУ ВО «Кемеровский государственный
медицинский университет»
 Введение
Введение
В настоящее время ожирение является растущей проблемой во всем мире и связано с серьезными рисками для здоровья [1]. Это глобальная эпидемия, а ее последствия для заболеваемости и смертности как у взрослых, так и у детей приобретают все большее значение [2]. Доказана роль ожирения как фактора риска атеросклероза и дислипидемии, диабета и остеоартрита, а также артериальной гипертензии, сердечно-сосудистых заболеваний, инсульта, желчнокаменной болезни, некоторых гормонозависимых раков (молочной железы, яичника, эндометрия, толстого кишечника), а также бесплодия [3, 4].
Кроме того, доказано, что ожирение является фактором риска серьезных осложнений беременности: гестационного диабета, преэклампсии, внутриутробной задержки роста плода, преждевременных родов, асфиксии. Тучные пациентки чаще родоразрешаются операцией кесарева сечения, имеют дистоцию плечиков в родах, страдают гипогалактией, а их дети достоверно чаще рождаются с некоторыми пороками развития и крупновесными или, напротив, имеют гипотрофию, страдают детским церебральным параличом и эпилепсией, имеют задержку нервно-психического развития, риск сердечно-сосудистых заболеваний и, соответственно, ранней смерти [5–7]. В настоящее время доказано, что ожирение является фактором риска как материнской, так и перинатальной смертности. У тучных беременных выше риск внутриутробной гибели плода, асфиксии новорожденного, ранней неонатальной смерти [5–7].
Все больше появляется доказательств, что ожирение может развиваться внутриутробно. Так, исследование D. Sellayah с соавт. (2019) показало, что ожирение матери способствует увеличению размеров адипоцитов у их потомства, однако увеличения количества адипоцитов зарегистрировано не было [8].
Систематический обзор T. Brown с соавт. (2019), включивший 153 рандомизированных клинических испытания, показал, что для профилактики ожирения у детей в возрасте 0–5 лет эффективными интервенциями является комбинация диетических интервенций и физической активности; физические упражнения имеют преимущества у детей в возрасте 6–12 лет и у подростков 13–18 лет [9].
Снижение массы тела на этапе планирования беременности является важной интервенцией как для решения вопросов фертильности, так и для профилактики неблагоприятных материнских и перинатальных исходов, а также для предупреждения метаболических и кардиоваскулярных заболеваний у потомства этих женщин [1, 5, 10].
Так, наиболее современными опциями с доказанной эффективностью в снижении риска ожирения у потомства тучных женщин являются рациональное питание и физические упражнения, контроль прибавки массы тела и уровня глюкозы во время беременности [11].
Эффективным при планировании беременности у пациенток с ожирением может быть как медикаментозный [12–14], так и хирургический подход, особенно при морбидном ожирении [15]. Однако первым базовым мероприятием для коррекции массы тела в рамках преконцепционного ухода является назначение сбалансированной гипокалорийной диеты в сочетании с физическими упражнениями и коррекцией пищевого поведения с применением поведенческой терапии [1, 5].
Эффективность этой базовой интервенции изолированно без применения медикаментозного лечения изучена недостаточно, особенно у женщин с глютеофеморальным ожирением I степени.
Цель исследования: оценить динамику антропометрических, гормональных и метаболических показателей у бесплодных женщин репродуктивного возраста с глютеофеморальным ожирением I степени при назначении сбалансированной гипокалорийной диеты.
Материалы и методы
Проведено проспективное интервенционное исследование 23 пациенток на базе ГАУЗ КО «ОКБ СМП им. М. А. Подгорбунского» (Кемерово).
Этические аспекты
Дизайн исследования утвержден этическим комитетом ФГБОУ ВО «КемГМУ» МЗ РФ (протокол № 2 от 25.09.2005). Все пациентки, включенные в исследование, дали информированное согласие на участие.
Критерии включения, невключения и исключения
Критерии включения:
- репродуктивный возраст (18–45 лет);
- наличие глютеофеморального ожирения I степени – индекс массы тела (ИМТ) = 30,0–34,9 кг/м2;
- ановуляторное бесплодие;
- подписанное информированное согласие и желание пациентки соблюдать протокол исследования.
Критерии невключения:
- возраст менее 18 и старше 45 лет;
- установленные другие факторы бесплодия (трубный, мужской, иммунологический);
- ИМТ менее 30 кг/м2 и более 34,9 кг/м2;
- новообразования гипофиза и надпочечников по результатам магнитно-резонансной томографии и/или компьютерной томографии.
Критерии исключения:
- несоблюдение протокола исследования;
- несоблюдение пациенткой любой из трех составляющих протокола (диеты, физической активности, поведенческой терапии).
Методы коррекции
Всем пациенткам было назначено сбалансированное гипокалорийное питание (1200 ккал/сут), физические упражнения, а также поведенческая терапия для коррекции нарушений пищевого поведения. Сбалансированное питание предполагало физиологическое соотношение: углеводы – 50 %, белки – 20 %, жиры – 30 %, клетчатка – 30–40 г. Распределение калорий: завтрак – 40 %, обед – 40 %, ужин – 20 %; при необходимости – 2–3 дополнительных приема пищи. Физические упражнения: ходьба – 1–2 ч в день со скоростью 120 шагов в минуту. Поведенческая терапия для коррекции нарушений пищевого поведения включала ведение дневника питания и образа жизни, мотивационные звонки еженедельно.
Физикальные методы
При проведении скрининга и оценки критериев включения/невключения, а также через 12 мес после включения в исследование всем пациенткам проводили общее клиническое обследование, измерение роста, массы тела, окружности талии (ОТ) и окружности бедер (ОБ), определение соотношения ОТ/ОБ, расчет ИМТ. Степень тяжести ожирения оценивали согласно классификации
ВОЗ (1997). Сагиттальный диаметр (СД) оценивали в положении на спине, определяя с помощью линейки перпендикуляр от верхнего края туловища на уровне подвздошного гребня до поверхности, на которой располагалась пациентка. Расчет показателей объемов (V) и массы (M) общей жировой ткани (ОЖТ), висцеральной жировой ткани (ВЖТ), подкожной жировой ткани (ПЖТ) проводили по следующим формулам:

Методы лабораторной диагностики
Уровень гликемии измеряли в сыворотке капиллярной крови натощак на анализаторе Эксан-Г (Завод точной механики, Литва). Содержание общего холестерина, триглицеридов, холестерина липопротеидов высокой и низкой плотности оценивали на анализаторе Express 550 (Ciba Corning, Великобритания) с применением реактивов Human (Германия), International Bio-Analytic Industries (США). Концентрацию гормонов определяли методом иммуноферментного анализа при помощи наборов «Алкор Био» (Россия), Diagnostic system laboratories (США). Содержание фолликулостимулирующего гормона (ФСГ), лютеинизирующего гормона (ЛГ), пролактина, эстрадиола, эстрона, тестостерона, лептина и иммунореактивного инсулина в сыворотке крови оценивали на 5–6 день, а уровень прогестерона определяли на 21–22 день менструального цикла. Оценку инсулинорезистентности проводили с применением модели гомеостаза глюкозы (англ. Homeostasis Model Assessment of Insulin Resistance, HOMA-IR).
Исследование калорийности и сбалансированности питания проводили с применением дневника питания с ежедневным самоконтролем и контролем врача первоначально через 2 нед, а далее – ежемесячно.
Протокол исследования представлен в таблице 1.
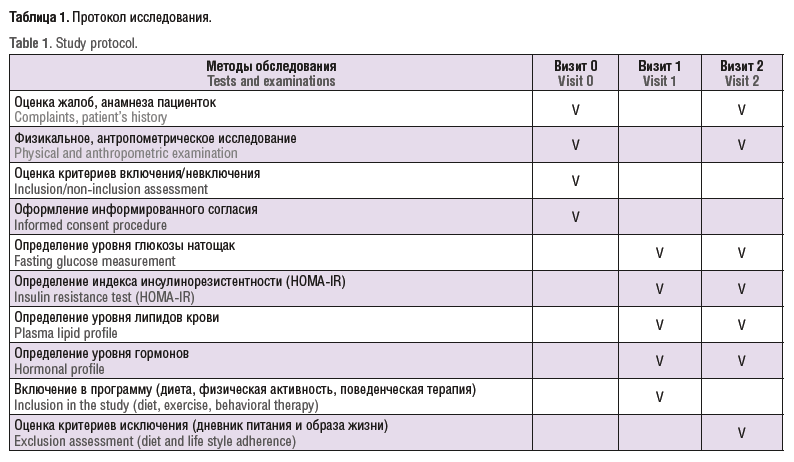
Протокол данного исследования включал 3 визита.
На визите 0 проводили сбор жалоб, анамнеза, клиническое и антропометрическое обследование пациенток. На данном визите из 153 были отобраны 23 женщины, соответствующие критериям включения и подписавшие информированное согласие на участие в исследовании. На визите 1 проводили включение пациентки в программу исследования с назначением лабораторных исследований, гипокалорийной диеты (1200 ккал/сут), физической активности и поведенческой терапии. Промежуточный контроль включал ежемесячные визиты к врачу-эндокринологу для оценки дневника питания и еженедельные мотивационные звонки.
На визите 2 через 12 мес проводили оценку комплаентности к программе диетотерапии, оценку критериев исключения, клиническое и антропометрическое обследование, лабораторную диагностику.
Статистический анализ
Статистическую обработку результатов исследования проводили с использованием пакета прикладных программ Exсel 2000 (Microsoft, США), Statistica 6.0. (StatSoft Inc., США). По каждому признаку определяли среднюю арифметическую величину (М) и среднее квадратичное отклонение (σ). Проверку гипотезы о равенстве генеральных средних в двух сравниваемых группах проводили с помощью непараметрического U-критерия Манна–Уитни для независимых выборок. У пациенток в процессе лечения применяли W-критерий Вилкоксона для зависимых выборок.
Нулевую гипотезу отвергали при критическом уровне значимости p < 0,05.
Результаты и обсуждение
В исследование было включено 23 пациентки.
Завершили протокол лечения 20 (87 %) женщин из 23, включенных в исследование; 3 пациентки выбыли из исследования в связи с несоблюдением режима диетотерапии, им в последующем дополнительно потребовалось назначение медикаментозной терапии (метформин 850 мг 3 раза в сутки и орлистат 120 мг 3 раза в сутки). Снижение массы тела от 4 до 24 кг (в среднем на 10,58 ± 5,70 кг) зарегистрировано у всех пациенток, завершивших протокол (р < 0,001).
Динамика основных антропометрических показателей у обследованных пациенток на фоне диетотерапии представлена в таблице 2.
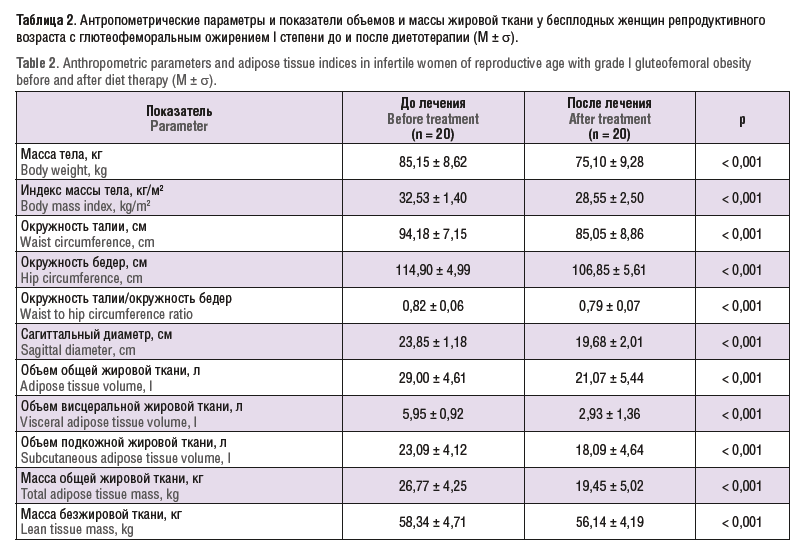
Результаты проведенного исследования показали, что у обследованных женщин на фоне диетотерапии имело место статистически значимое снижение массы тела и ИМТ (р < 0,001). ОТ за 12 мес диетотерапии уменьшилась в среднем на 9 см – с 94,18 ± 7,15 см до 85,05 ± 8,86 см (р < 0,001); кроме того, уменьшилось соотношение ОТ/ОБ с 0,82 до 0,79 (р < 0,001).
Зарегистрировано статистически значимое (р < 0,001) уменьшение объема жировой ткани как за счет подкожного, так и за счет висцерального жира: уменьшение объема висцеральной жировой ткани, объема подкожной жировой ткани, объема общей жировой ткани.
Показатели гормонального и метаболического статуса на фоне проводимой диетотерапии у бесплодных женщин с ожирением представлены в таблице 3.
Таблица 3. Гормональные и метаболические показатели крови у бесплодных женщин репродуктивного возраста с глютеофеморальным ожирением I степени до и после диетотерапии (М ± σ).
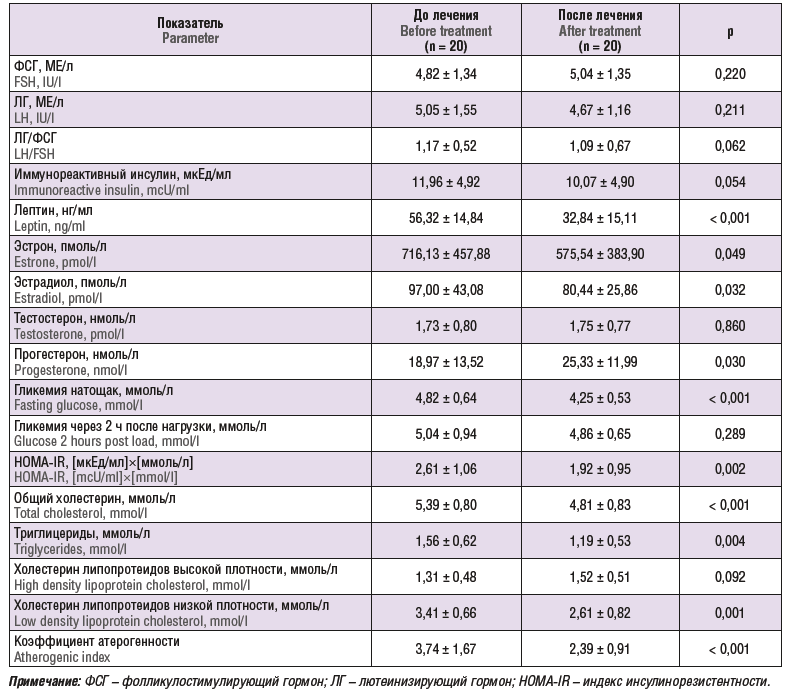
В динамике при использовании диетотерапии у бесплодных пациенток с глютеофеморальным ожирением I степени при снижении массы тела зарегистрировано статистически значимое снижение содержания лептина в 1,8 раз (р < 0,001), эстрона (р = 0,049), эстрадиола (р = 0,032) и повышение уровня прогестерона (p = 0,030), что свидетельствует о восстановлении овуляторного менструального цикла. Отмечено статистически значимое снижение концентрации глюкозы натощак, уменьшение в 1,3 раза индекса НОМА-IR. В результате диетотерапии зарегистрирована нормализация уровня липидов сыворотки крови: снижение содержания общего холестерина, триглицеридов, холестерина липопротеидов низкой плотности и коэффициента атерогенности.
При включении в исследование 9 (45 %) пациенток предъявляли жалобы на нарушения менструального цикла; через 12 мес лечения нарушения менструального цикла отсутствовали у всех женщин (р = 0,002).
Двухфазный овуляторный менструальный цикл восстановился у всех женщин, желанная беременность в течение года наступила у 1 пациентки.
Таким образом, установлено, что у женщин с глютеофеморальным типом ожирения с ИМТ от 30,0 до 34,9 кг/м2 диетотерапия в сочетании с умеренной физической активностью и поведенческой терапией, направленной на коррекцию пищевого поведения, является достаточно эффективной и позволяет в большинстве случаев снизить массу тела, улучшить метаболические и гормональные показатели, нормализовать менструальную функцию.
В исследовании M. Rahad с соавт. (2019) было также показано, что сывороточный лептин может быть ценным диагностическим маркером ожирения и сопутствующих ему заболеваний. Кроме того, авторами представлены данные о том, что значительная потеря массы тела приводит к снижению уровня лептина в сыворотке и улучшению гликемического и липидного профилей [16].
В настоящее время существуют эпидемиологические исследования, которые показали, что как только женщина узнает о беременности, она не должна изменять свой образ жизни [11], т. е. не вызывает сомнений необходимость применения диетотерапии именно на этапе преконцепционной подготовки. Больше дискуссий в отношении методов, которые позволят повысить комплаентность к данному методу лечения.
Так, в настоящее время в Нидерландах проводится продольное рандомизированное контролируемое исследование одногодичного трехкомпонентного вмешательства в когнитивно-поведенческий образ жизни у женщин с избыточной массой тела/ожирением с синдромом поликистозных яичников. Авторы исследования ожидают получить более значимый эффект в модификации образа жизни и снижении массы тела на 5–10 % при работе мультидисциплинарной команды [17]. В нашем исследовании 87 % женщин с глютеофеморальным ожирением I степени завершили протокол и продемонстрировали хорошую мотивацию и высокую комплаентность к диетотерапии, которая сопровождалась адекватной физической активностью и поведенческой терапией. Только 3 пациенткам из 23 потребовалось назначение медикаментозной терапии.
И несмотря на всю очевидность необходимости снижения массы тела на этапе планирования беременности, характер питания на преконцепционном этапе и во время беременности у тучных широко обсуждается. Например, в исследовании, проведенном B. H. Al Wattar с соавт. (2019), было показано, что простая средиземноморская диета не снижает общий риск неблагоприятных материнских и перинатальных исходов, за исключением большой прибавки массы тела при беременности и гестационного диабета [18].
Тем не менее на сегодняшний день пока ни одно рандомизированное контролируемое исследование не продемонстрировало эффективных средств снижения массы тела, которые приводят к улучшению исходов беременности как для матери, так и для ребенка.
В настоящее время в Австралии зарегистрировано исследование ANZCTR, целью которого является определить оптимальный подход к снижению массы тела на этапе планирования беременности. В исследование будет включено 164 пациентки с ИМТ 30–55 кг/м2.
Пациентки будут распределены в 2 группы: 1-я группа – женщины, у которых запланировано незначительное снижение массы тела (на 3–5 %) с применением умеренно гипокалорийной диеты в течение 12 мес; 2-я группа – женщины, у которых запланировано значительное снижение массы тела (на 10–15 %) с использованием модифицированной выраженной низкоэнергетической диеты [19].
Кроме того, по мнению T.M. van Elten с соавт. (2019), преконцепционный период может стать оптимальным окном возможностей для улучшения образа жизни в целом. Так, в рандомизированном контролированном испытании, проведенном этими авторами, было показано, что изменения образа жизни, которые были на этапе планирования беременности у бесплодных женщин (диета, ограничение потребления высококалорийной пищи, физическая активность), сохранялись и через 5,5 лет (диапазон – 3,7–7,0 лет) после вмешательства [20].
В исследовании V. Wekker с соавт. (2019) проведен анализ 2 рандомизированных клинических исследований, в которых также наблюдали женщин после изменения образа жизни в преконцепционном периоде. Женщины, которые успешно снизили массу тела во время преконцепционной подготовки, имели лучшее кардиометаболическое здоровье спустя 6 лет, что еще раз подчеркивает потенциал улучшения образа жизни до зачатия [21].
Заключение
Таким образом, применение сбалансированной гипокалорийной диеты в течение 12 мес у бесплодных женщин с глютеофеморальным ожирением I степени способствует нормализации метаболических процессов, снижению массы тела и в 100 % случаев восстановлению овуляторного менструального цикла.
Список литературы смотрите здесь.
Источник: Журнал ” Акушерство, гинекология и репродукция” №1, 2020
