О.Р. Григорян1 *, Р.К. Михеев1 , А.Н. Куринова1 ,
М.О. Чернова1 , Д.В. Сазонова1 , Р.Р. Ахматова1 , Л.И. Ибрагимова1 , Ю.С. Абсатарова1 , Е.В. Шереметьева1 , Е.И. Дегтярева3 , Е.Н. Андреева1,4
1 Национальный медицинский исследовательский центр эндокринологии, Москва, Россия
2 Первый Московский государственный медицинский университет им. И.М. Сеченова (Сеченовский Университет), Москва, Россия
3 Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова, Москва, Россия
4 Московский государственный медико-стоматологический университет имени А.И. Евдокимова, Москва, Россия
Обоснование
Гестационный сахарный диабет (ГСД) — заболевание, характеризующееся гипергликемией, впервые выявленной во время беременности, но не соответствующей критериям «манифестного» сахарного диабета (СД) [1]. При этом беременность рассматривается как непосредственный фактор риска развития гипергликемии в связи с физиологической перестройкой организма матери [1].
Согласно данным атласа Международной Федерации Диабета (International Diabetes Federation) 2019 г., беременность у 15,8% (20,4 млн) женщин сопровождалась гипергликемией, в 83,6% из этих случаев был установлен диагноз «гестационный сахарный диабет» [2]. В основе патогенеза данного состояния лежит недостаточная секреция инсулина бета-клетками поджелудочной железы женщины в ответ на закономерно развивающуюся во время беременности инсулинорезистентность (ИР) [3].
Во время беременности в организме женщины происходят генетически детерминированные изменения, главным образом направленные на создание оптимальных условий функционирования органов и систем беременной, обеспечивающих нормальное развитие плода. В I триместре наблюдается снижение гликемии натощак (в среднем на 0,5–1,0 ммоль/л), обусловленное как расходом глюкозы для обеспечения энергетических потребностей при формировании фетоплацентарного комплекса, так и уменьшением субстратов глюконеогенеза вследствие активного транспорта аминокислот через плаценту к плоду [4, 5]. Однако в дальнейшем прогрессирует ИР (↑ до 50–60% на 34–36-й неделях [6]), ключевым звеном развития которой является эндокринная функция плаценты — синтез плацентарного лактогена (плацентарного соматомаммотропина) и прогестерона, обладающих контринсулярными свойствами [3]. Вклад в снижение чувствительности тканей к инсулину вносит и повышенный уровень кортизола вследствие стимуляции коры надпочечников беременной гипофизарным адренокортикотропным гормоном под воздействием плацентарного кортикотропинрилизингового гормона [7, 8].
Также необходимо отметить ряд негормональных факторов, влияющих на развитие гипергликемии, таких как снижение физической активности беременной, повышение калорийности рациона, увеличение массы тела за счет жирового компонента, снижение моторики желудочно-кишечного тракта [9]. Ведущая роль в патогенезе связанных с гипергликемией осложнений беременности принадлежит микроциркуляторным нарушениям. Оксидативный стресс, индуцированный в ишемизированной плаценте, сопровождается активацией апоптоза, эндотелиальной дисфункцией с возможным развитием плацентарной недостаточности, преэклампсии, гипоксии плода [4, 10–12]. В ответ на гипергликемию матери у плода компенсаторно прогрессирует гиперинсулинемия [3, 6], приводящая к активации анаболических процессов и формированию макросомии (9,5%) [6, 11, 13]. Предрасполагающими факторами в развитии макросомии плода также являются: индекс массы тела (ИМТ) матери до беременности, гестационный возраст при родах, патологическая прибавка массы тела во время беременности, рост матери, артериальная гипертензия (АГ), курение. В родах макросомия плода увеличивает риски как со стороны плода (дистоция плечиков, переломы ключиц и травмы плечевого сплетения (1,3%), неврологическая симптоматика) [11], так и со стороны матери (кесарево сечение (КС), послеродовое гипотоническое кровотечение и глубокие разрывы промежности) [13]. Кроме того, гиперинсулинемия плода обусловливает принадлежность новорожденных от матерей с синдромом гипергликемии (в том числе, вследствие ГСД) к группе риска развития неонатальной гипогликемии (2,1%) [11].
Таким образом, возрастающая распространенность данного заболевания, высокая вероятность неблагоприятных исходов беременности для матери и плода, а также ряд отдаленных последствий при ГСД являются серьезной медико-социальной проблемой и диктуют необходимость его профилактики с помощью коррекции факторов риска, своевременной диагностики и эффективного лечения заболевания [1, 11].
Цель исследования
Оценить структуру факторов риска развития ГСД, выявить взаимосвязь между ГСД, течением и исходами беременности путем ретроспективного анализа карт стационарных больных отделения патологии беременности Научного центра акушерства, гинекологии и перинатологии им. В.И. Кулакова.
Материалы и методы
Место и время проведения исследования
Место проведения. ФГБУ «НМИЦ акушерства, гинекологии и перинатологии им. В.И. Кулакова» Минздрава России, Москва; ФГБУ «НМИЦ эндокринологии» Минздрава России, Москва.
Время исследования. Период с 2015 по 2017 гг. (02.03.2015–06.09.2017).
Изучаемые популяции
Популяция: беременные пациентки, находившиеся на лечении в отделении патологии беременности.
Критерии включения: возраст от 18 до 40 лет; диагноз «гестационный сахарный диабет»; одноплодная беременность.
Критерии исключения: многоплодная беременность; беременность, наступившая после применения вспомогательных репродуктивных технологий; привычные интоксикации у матери (курение, алкоголизм, наркомания); прием пероральных сахароснижающих препаратов; манифестный (впервые выявленный) сахарный диабет во время беременности; сахарный диабет, диагностированный до беременности.
Способ формирования выборки из изучаемой популяции (или нескольких выборок из нескольких изучаемых популяций)
Сплошной способ формирования выборки.
Дизайн исследования:
- многоцентровое;
- наблюдательное (обсервационное);
- одномоментное ретроспективное;
- одновыборочное несравнительное.
Проведен ретроспективный анализ 79 историй родов стационарных беременных больных, находившихся на лечении в отделении патологии беременности ФГБУ «НМИЦ акушерства, гинекологии и перинатологии им. В.И. Кулакова» Минздрава России, наблюдавшихся в ФГБУ «НМИЦ эндокринологии» Минздрава России в период с 2015 по 2017 гг.
Методы
Основной исход исследования
Получение данных о структуре факторов риска развития ГСД, проверка взаимосвязи между ГСД, течением беременности и ее исходами.
Методы регистрации исходов
В данном исследовании проведен анализ стационарных карт беременных по следующим параметрам: возраст, наследственность (наличие/отсутствие нарушений углеводного обмена (СД 2 типа и др.)), ИМТ матери при наступлении беременности, общая прибавка веса (ОПВ) за период гестации, паритет, акушерский анамнез (наличие в предыдущие беременности ГСД, крупных размеров и врожденных травм новорожденных, врожденных пороков развития (ВПР), а также наличие рубца на матке после операции КС), гинекологический анамнез (синдром поликистозных яичников (СПЯ) и др.), соматический анамнез (в т.ч. эндокринопатии). Проанализированы: срок постановки диагноза ГСД; уровень глюкозы венозной плазмы натощак, показатели гликемии в ходе перорального глюкозотолерантного теста (ПГТТ); методы лечения ГСД (диета/инсулинотерапия); течение беременности; срок и методы родоразрешения, а также: масса плода по данным ультразвукового исследования (УЗИ) (не более чем за 10 дней до родоразрешения), массо-ростовые параметры новорожденных, оценка по шкале Апгар на 1-й и 5-й минутах, наличие ВПР у новорожденных.
Диагностика ГСД проводилась согласно критериям Российского национального консенсуса «Гестационный сахарный диабет: диагностика, лечение, послеродовое наблюдение» (2012 г.).
В исследовании использовался срок беременности, установленный по дате последней менструации, в случае менструальной дисфункции — по результатам скрининга I триместра (УЗИ в 11–13 нед 6 дней).
Преэклампсия (ПЭ) диагностировалась у пациенток при сроке беременности более 20 нед, наличии АГ (>140/90 мм рт. ст.), протеинурии (>300 мг/л в суточной моче), в соответствии с рекомендациями ВОЗ.
Диагностика ожирения проводилась в соответствии с показателями ИМТ до беременности.
Статистический анализ
Статистический анализ проводился в программном пакете IBM SPSS Statistics 24.0. Количественные показатели представлены в виде: медиана; среднее ± стандартное отклонение; категориальные — в процентах и долях от целого. Статистически значимыми предполагались различия при р<0,05 (отвергали нулевую гипотезу). Доли категориальных переменных сравнивали в таблицах сопряженности критерием χ2 (или точным критерием Фишера, если ожидаемое число хотя бы в 1 ячейке таблицы было <5). Влияние категориальных факторов на количественные переменные оценивали ANOVA или t-критерием Стьюдента. В случае дисперсионного анализа проводили post hoc анализ. Во всех случаях использовали двусторонние варианты критериев.
В работе были исследованы средние значения выбранных показателей: факторы риска развития ГСД, влияние осложнений ГСД для матери и плода. Исследована корреляция между гликемией и следующими параметрами: ИМТ матери до беременности, ОПВ матери, срок родоразрешения, масса плода при рождении, баллы по шкале Апгар на 1-й и 5-й минутах после рождения. Изучалась корреляция между ОПВ и следующими показателями: масса плода, баллы по шкале Апгар.
Этическая экспертиза
Исследование было одобрено на заседании этического комитета ФГБУ «НМИЦ эндокринологии» Минздрава России» от 16 января 2015 г. (протокол №2).
Результаты и обсуждение
Медиана возраста пациенток составила 33,0 года [14]. Повторнобеременные составили 78% (62 женщины), из них повторнородящих — 51 (82%).
Медиана срока постановки диагноза — 26 нед гестации. Причем 32,1% беременных диагноз был поставлен позже 28 нед, что свидетельствовало о позднем выявлении нарушений углеводного обмена. Медиана задержки диагноза — 6,0 нед. В некоторых случаях более позднее выявление углеводных нарушений связано с отказом от проведения ПГТТ или с отсутствием проведения теста в рекомендуемые сроки.
Подавляющему большинству пациенток (91%) диагноз был поставлен по данным результата анализа глюкозы венозной плазмы натощак. Средний показатель гликемии при этом составил 5,49±0,45 ммоль/л (минимум — 5,1 ммоль/л, максимум — 7,4 ммоль/л). Диагноз ГСД по результатам ПГТТ был поставлен 7 пациенткам (8,97%) (табл. 1).
В соответствии с проектом рекомендаций [1], пациенткам назначалась диета, при ее неэффективности, наличии УЗ-симптомов диабетической фетопатии (ДФ), в том числе наличии крупных размеров плода, врачами-эндокринологами инициировалась инсулинотерапия.
Получены статические результаты краткосрочных осложнений ГСД для матери и новорожденного (рис. 1).
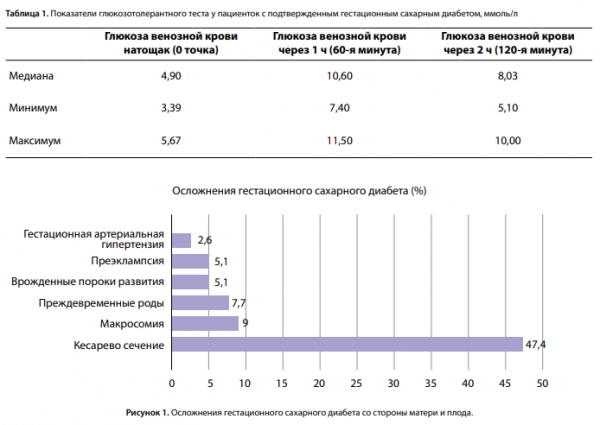
Предпочтительным методом родоразрешения у пациенток с ГСД являются роды через естественные родовые пути. Однако самым частым осложнением среди всех обследованных в данной выборке оказалась необходимость родоразрешения путем операции КС (37 случаев — 47,4%), что несколько превышает описанную в недавних исследованиях среднюю частоту данного осложнения у пациенток с ГСД (31–39,4%) [4, 15, 16] и практически в 2 раза выше средней частоты выполнения операций КС в Российской Федерации (24–25%) [17]. Это обусловлено показаниями со стороны матери (наличие рубца на матке после предыдущей операции КС и миомэктомии, сочетанная экстрагенитальная патология, поздний репродуктивный возраст). Также данный факт объясняется более сложным контингентом женщин, которые наблюдаются и родоразрешаются в «НМИЦ акушерства, гинекологии и перинатологии им. В.И. Кулакова» Минздрава России. В 13,5% (5) случаев произведено КС в родах в экстренном порядке. Показанием послужило наличие клинически узкого таза, одной из причин которого является наличие крупного плода.
Поздние преждевременные роды в сроке 36±0,6 нед были у 6 (7,7%) пациенток, что оказалось ниже описанной в литературе средней частоты преждевременных родов у женщин с ГСД (15–25%) и сопоставимо со значением данного показателя в среднем в популяции (6,4–8,6%) [14, 16, 18]. Учитывая отсутствие УЗ-симптомов ДФ у плода, благодаря удовлетворительной компенсации ГСД, остальные пациентки были родоразрешены в сроке 39±0,8 нед.
Макросомия выявлена у 7 (9%) новорожденных, что оказалось в 2 раза ниже средней частоты макросомии плода при ГСД (16–21%) и сопоставимо со среднепопуляционным значением этого показателя (8,3–12,3%) [16, 18]. Данный факт подтверждает, что выявление ГСД и своевременное назначение лечения, в том числе инсулинотерапии, снижает риск рождения крупного плода. При этом средняя масса плода составила 3390,13±529,626 г (минимум — 1700,0 г, максимум — 4540 г). Рождение детей более 4000 г зарегистрировано в группе женщин, которые находились на диетотерапии.
ВПР подтверждены при рождении у 4 новорожденных (5,1%), что также оказалось ниже описанной в литературе частоты ВПР при ГСД (8–9%) [16], но в 2 раза выше общепопуляционной (2,4%) [19]. Среди них: тетрада Фалло, дефект межжелудочковой перегородки (ДМЖП), малая аномалия развития — дополнительная хорда левого желудочка, укорочение трубчатых костей. Малые аномалии ВПР сердца характерны для детей, рожденных пациентками с ГСД.
Умеренная ПЭ диагностирована в 4 случаях (5,1%), гестационная артериальная гипертензия (ГАГ) — в 2 (2,6%). Данные показатели в исследовании оказались на порядок ниже описанной в литературе частоты ПЭ (25–70%) [4, 18] и ГАГ (12,4%) [15] при ГСД и сопоставимы со среднепопуляционными показателями ПЭ (4–5%) [16]. Здесь стоит отметить, что хронической артериальной гипертензией (ХАГ) страдали 12 пациенток (15,38%). Всем пациенткам проводилась адекватная антигипертензивная терапия.
Случаев травматизма плода в родах не зафиксировано, что не соответствует данным литературы и, вероятнее всего, обусловлено грамотно оказанным акушерским пособием и тщательным выбором метода родоразрешения в исследуемой группе.
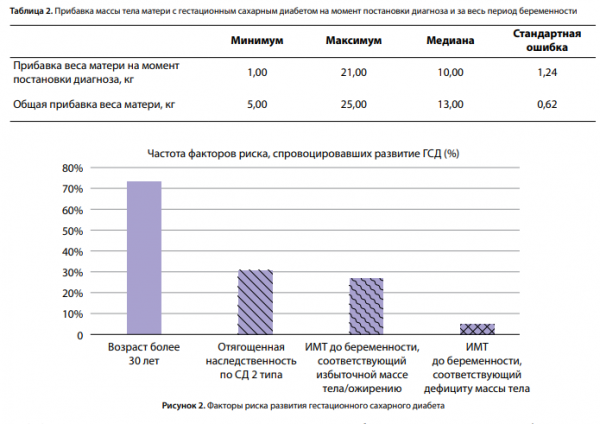
В проведенном исследовании медиана общей прибавки веса за беременность составила 13,00 кг, а максимальная прибавка веса — 25,00 кг (табл. 2).
Оценка новорожденного по шкале Апгар является интегративным показателем, определяющим состояние при рождении. Медиана балла по шкале Апгар на 1-й минуте составила 8, на 2-й — 9 баллов, что в целом соответствует среднепопуляционным значениям.
Также была проведена оценка частоты факторов риска развития ГСД (рис. 2).
Возраст старше 30 лет оказался самым распространенным фактором риска и составил 73,1% (58 пациенток). У 30,8% беременных наследственность была отягощена наличием родственников с СД 2 типа, что согласуется с рядом других исследований [14, 15, 20].
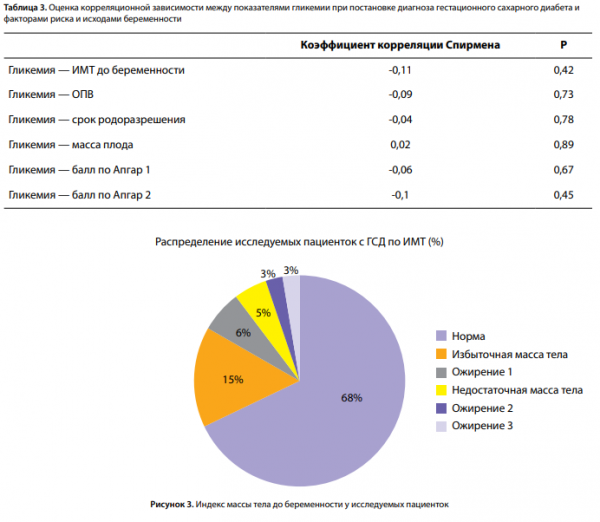
Высокий ИМТ до наступления беременности имели 26,9% исследуемых. Стоит отметить, что также присутствовали пациентки с дефицитом массы тела (5%). Более подробная информация по характеристикам ИМТ представлена на круговой диаграмме (рис. 3).
Среди исследуемых только у 3,8% был диагностирован ГСД в предыдущих беременностях; рождение крупного плода в исходе предыдущих беременностей было у 6,4%; диагноз СПЯ был поставлен в 3,8% случаев.
Исследован соматический анамнез пациенток. Заболевания половой системы (гинекологические заболевания) выявлены у 65,38% участниц, заболевания сердечно-сосудистой системы — 37,18%, заболевания мочевыводящей системы — 25,9%, заболевания органов пищеварения — 21,79%, заболевания органов дыхания — 15,38%, заболевания эндокринной системы — 23,08%, психические расстройства и расстройства поведения — 1,28%, болезни глаза и придаточного аппарата — 37,18%, болезни костно-мышечной системы и соединительной ткани — 7,7%.
Было изучено наличие корреляционной зависимости между гликемией и следующими параметрами: ИМТ матери до беременности, ОПВ матери, сроком родоразрешения, массой плода при рождении, балльной оценкой по шкале Апгар. Однако положительной корреляции, как, например, в исследованиях Baz B., Riveline J.P. [6], выявлено не было (табл. 3).
Была исследована взаимосвязь между уровнем гликемии венозной плазмы натощак при постановке диагноза и наличием ВПР плода. Для изучения взаимосвязи использовался критерий Краскела–Уоллиса для независимых выборок — гипотеза не подтвердилась. Изучалась корреляция между ОПВ и следующими показателями: массой тела и оценкой состояния новорожденного по шкале Апгар. Корреляционной взаимосвязи, как, например, в исследованиях Erjavec K., Poljičanin T., а также Pongcharoen T., Gowachirapant S. [21, 22], обнаружено не было (табл. 4).
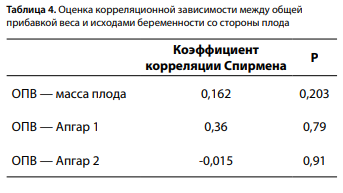
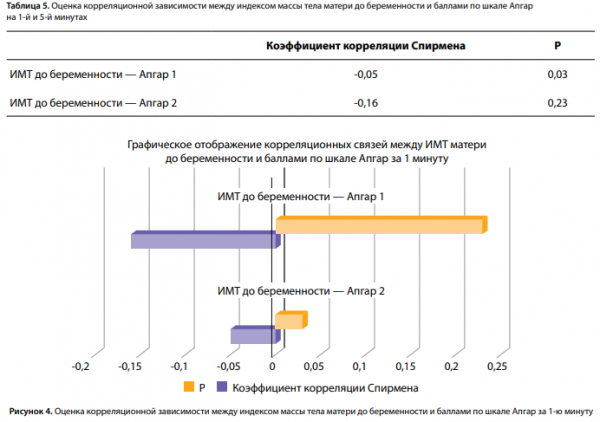
В ходе исследования ожидалось получение данной корреляции, однако, исходя из полученных результатов, мы можем предположить, что большинству пациенток была оказана своевременная адекватная врачебная помощь: скрининг, наблюдение, консультирование, лечение и контроль за выполнением рекомендаций, что повышало комплаентность женщин, которые добросовестно выполняли все назначения, соблюдали диету, что и привело к разрыву связи. Кроме того, исследована корреляция между ИМТ матери до беременности с балльной оценкой новорожденного по шкале Апгар. Выявлено, что чем больше ИМТ матери до беременности, тем ниже балл по шкале Апгар на 1-й минуте после рождения (табл. 5, рис. 4). Такой же результат был получен в исследовании, проведенном Pongcharoen T., Gowachirapant S. [22]. Также была исследована взаимосвязь между уровнем глюкозы плазмы крови матери и СПЯ. По итогам проверки гипотезы с помощью критерия U Манна–Уитни нулевая гипотеза была принята, то есть взаимосвязи выявлено не было, однако стоит сказать, что было всего 3 пациентки с СПЯ в анамнезе, поэтому результат может быть не достоверен.
Заключение
Анализ структуры факторов риска у беременных с ГСД показал, что это: возраст более 30 лет (73,1%), отягощенная наследственность по СД2 (30,8%), ИМТ до беременности, соответствующий избыточной массе тела/ ожирению (26,9%). Была изучена частота осложнений беременности и ее исходов в группе данных пациенток. Частота родоразрешения путем операции КС составила 47,4%; макросомии — 9%; преждевременных родов — 7,7%, из чего можно сделать вывод, что пациентки, страдающие ГСД, требуют более тщательного наблюдения за течением беременности, состоянием плода и своевременной госпитализации для подготовки к родоразрешению при наличии макросомии, что снижает риск травматизации плода во время родов.
В исследовании не было выявлено ожидаемой корреляционной зависимости между уровнем глюкозы плазмы крови матери и ИМТ матери до беременности (rs=-0,11; р=0,42), сроком родоразрешения (rs=-0,04; р=0,78), баллами по шкале Апгар на 1-й (rs=-0,06; р=0,67) и 5-й минутах (rs=- 0,1, р=0,45). В исследовании не обнаружилось корреляции между ОПВ и следующими показателями: массой плода (rs=0,36; р=0,79), баллами по шкале Апгар на 1-й (rs=0,36; р=0,79) и 5-й (rs=-0,015, р=0,91) минутах. Исходя из полученных данных, мы можем предположить, что большинство участниц исследования получили своевременную врачебную помощь: адекватное лечение и тщательное наблюдение, а также наблюдалась высокая комплаентность пациенток, которые находились под контролем специалистов и соблюдали рекомендации, что и привело к разрыву ожидаемой связи и полученным результатам.
