Аннотация
ОБОСНОВАНИЕ. Мировые и отечественные данные свидетельствуют о более высокой смертности пациентов с сахарным диабетом (СД) вследствие COVID-19, что определяет высокую актуальность анализа факторов риска неблагоприятных исходов заболевания при СД для обоснования тактики ведения данной категории пациентов.
ЦЕЛЬ — оценить влияние клинико-демографических параметров (возраста; пола; индекса массы тела, ИМТ; гликемического контроля, HbA1c), а также антидиабетических и антигипертензивных препаратов, в том числе ингибиторов ангиотензинпревращающего фермента (иАПФ) и блокаторов рецепторов ангиотензина II (БРА), на клинические исходы (выздоровление или смерть) у пациентов с СД 2-го типа (СД2).
МАТЕРИАЛЫ И МЕТОДЫ. Выполнен ретроспективный анализ базы данных Федерального регистра СД (ФРСД), включивший пациентов с СД2 (n=309) с перенесенными в период с 01.02.2020 по 27.04.2020 пневмонией/COVID-19 и указанным исходом заболевания (выздоровление/смерть).
РЕЗУЛЬТАТЫ. Летальность составила 15,2% (47 из 309 человек). Установлено, что летальность достоверно выше у лиц мужского пола (OR=2,08; 95% ДИ 1,1−3,9; p=0,022) и пациентов на инсулинотерапии (OR=2,67; 95% ДИ 1,42−5,02; p=0,002). Летальность была достоверно ниже у пациентов в возрасте менее 65 лет (OR=0,34; 95% ДИ 0,18−0,67; p=0,001); у лиц, получающих метформин (OR=0,26; 95% ДИ 0,14−0,5; p<0,0001), антигипертензивную терапию в целом (OR=0,43; 95% ДИ 0,22−0,82; p=0,009), бета-блокаторов (OR=0,26; 95% ДИ 0,08−0,86; p=0,018), диуретики (OR=0,4; 95% ДИ 0,17−0,93; p=0,028) и блокаторы ренин-ангиотензиновой системы (иАПФ или БРА) (OR=0,36; 95% ДИ 0,18−0,74; p=0,004). Отмечалась тенденция к увеличению летальности при более высоких показателях HbA1c и ИМТ, не достигшая статистической значимости. Пациенты, получающие инсулинотерапию, отличались от лиц без терапии инсулином значимо большей длительностью СД2 (13,4 против 6,8 года, p<0,0001) худшим контролем гликемии в целом (HbA1c 8,1 против 7,0%, p<0,0001) и в 3 раза более частым недостижением цели HbA1c более чем на 2,5% (14,7 против 5,9%, p=0,04).
ЗАКЛЮЧЕНИЕ. Выявленные факторы риска летальности больных СД2 указывают на то, что хороший контроль гликемии, предшествующее лечение метформином и антигипертензивными препаратами (в том числе блокаторами ренин-ангиотензиновой системы) позволяют снизить частоту летальных исходов. Более высокая летальность на инсулинотерапии была связана с худшим гликемическим контролем данной группы пациентов.
ОБОСНОВАНИЕ
Мировые и отечественные данные свидетельствуют о более высокой смертности пациентов с сахарным диабетом (СД) вследствие COVID-19, что определяет высокую актуальность анализа факторов риска неблагоприятных исходов заболевания при СД для обоснования тактики ведения данной категории пациентов.
11 марта 2020 г. Всемирная организация здравоохранения (ВОЗ) объявила глобальную пандемию новой коронавирусной инфекции COVID-19, охватившую к настоящему времени 187 стран мира. В Российской Федерации (РФ) на 08.06.2020 официально зафиксировано более 470 тыс. подтвержденных случаев COVID-19 в 85 регионах страны, из них 5971 закончились летальным исходом [1].
Сахарный диабет (СД) как сопутствующее заболевание при COVID-19 рассматривается в качестве одного из значимых факторов риска развития неблагоприятных исходов вследствие более тяжелого течения инфекции в условиях гипергликемии и других отягощающих факторов у данных пациентов, таких как пожилой возраст, ожирение, высокая частота сопутствующей патологии (артериальная гипертензия, сердечно-сосудистые заболевания) [2]. Доля больных СД среди заболевших COVID-19 колеблется от 16,2% в Китае [3] до 25% в РФ [4]. При этом, несмотря на неуклонный рост числа публикаций, посвященных анализу различных факторов риска тяжелого течения COVID-19 при СД и его осложнений, прогрессивно возрастает и количество противоречий в отношении тактики ведения данной категории пациентов, чему способствуют небольшой объем и разнородность выборок в исследованиях, а также высокая скорость анализа информации. Так, верифицированные данные о влиянии различных классов сахароснижающих препаратов на исходы COVID-19 при СД в настоящее время практически отсутствуют [5]. Нерешенным остается и принципиальный вопрос об отмене либо продолжении органопротективной терапии препаратами, блокирующими ренин-ангиотензиновую систему (РАС), а именно ингибиторами ангиотензинпревращающего фермента (иАПФ) или блокаторами рецепторов ангиотензина II (БРА) [6].
В РФ в 1996 г. в рамках федеральной целевой программы «Сахарный диабет» был организован общенациональный Федеральный регистр пациентов с СД (ФРСД) [7]. С 2014 г. ФРСД был переведен в онлайн-формат ввода данных, что позволяет осуществлять клинико-эпидемиологический мониторинг ключевых показателей в режиме реального времени в масштабах всей страны. В связи с необходимостью контроля заболеваемости и исходов COVID-19 с 01.02.2020 в ФРСД были внесены дополнительные поля для регистрации случаев перенесенной пневмонии или СOVID-19 c указанием подтверждения положительного/отрицательного теста на COVID-19 и конкретизацией клинических исходов (выздоровление или смерть).
ЦЕЛЬ
Целью настоящего анализа было оценить влияние клинико-демографических параметров (возраста; пола; индекса массы тела, ИМТ; гликемического контроля, HbA1c), антидиабетических и антигипертензивных препаратов, в том числе иАПФ и БРА, на клинические исходы (выздоровление или смерть) у пациентов с СД 2-го типа (СД2), имеющих сведения о перенесенных пневмониях/COVID-19 из базы данных ФРСД.
МЕТОДЫ
Дизайн исследования
Выполнен ретроспективный анализ базы данных ФРСД за период с 01.02.2020 по 27.04.2020.
Критерии соответствия
Общая численность пациентов с СД в РФ, состоящих на диспансерном учете, на 01.01.2020 г., по данным ФРСД, составила 4 752 585 (3,23% населения РФ), из них: СД1 — 5,5% (261,2 тыс.), СД2 — 92,5% (4,39 млн), другие типы СД — 2,0% (96,5 тыс.). С 01.02.2020 в онлайн-карту регистра были добавлены новые поля.
- Перенесены ОРВИ/пневмония после 01.02.2020 г.: Да/Нет.
- Подтвержден COVID-19: Да/Нет/Диагностика не проводилась.
- Исход заболевания: выздоровление/смерть.
В перечень непосредственных причин смерти был добавлен вариант:
- Коронавирус/осложнения коронавируса.
27 апреля 2020 г. была произведена выгрузка данных.
Критерии включения в анализ:
1.указание на перенесенное заболевание — пневмония/COVID-19;
2.указание на исход заболевания — выздоровление/смерть;
3.наличие результатов клинического и лабораторного обследования, выполненных на визите в период с 01.01.2020 до момента выгрузки базы данных (27.04.2020).
Дизайн включения пациентов в анализ представлен на рис. 1.
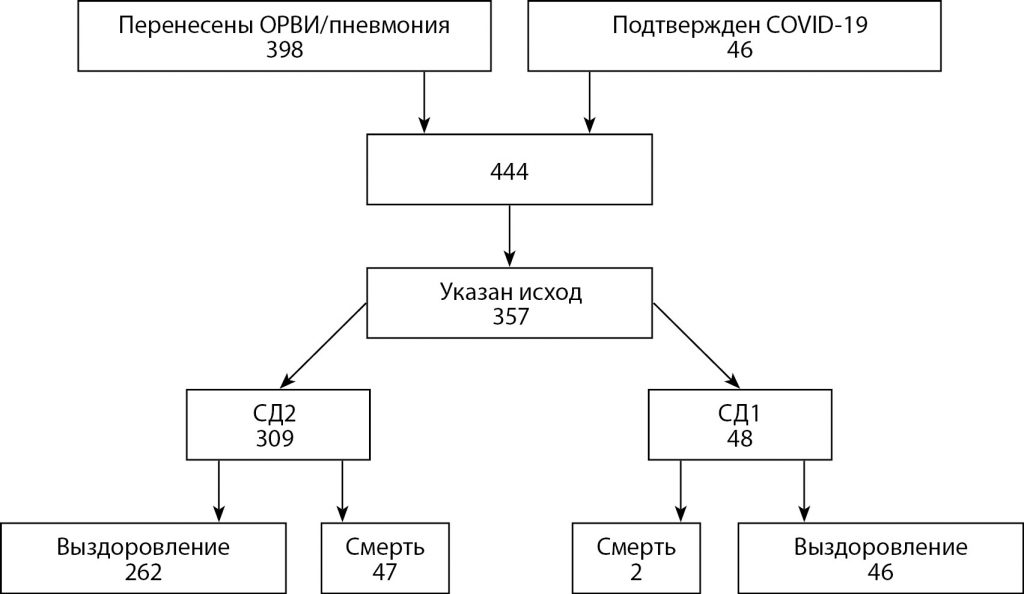
Рис. 1. Дизайн включения пациентов в анализ.
На 27.04.2020 критериям включения соответствовали 444 пациента, из них вариант «Да» в поле «Перенесены ОРВИ/пневмония» был отмечен у 398, в поле «Подтвержден COVID-19» — у 46 человек. Из них исходы заболевания («Выздоровление» или «Смерть») были указаны у 357 пациентов: у 48 пациентов с СД1 и у 309 с СД2. В финальный анализ были включены только пациенты с СД2 как более однородная и многочисленная группа больных. Пациенты с СД1 не включались в данный анализ в связи с недостаточным количеством исходов для выполнения статистических расчетов. У всех включенных пациентов имелись результаты клинико-лабораторного обследования в период с 01.01.2020 г. до даты выгрузки базы данных. В анализ включались данные, полученные на последнем из визитов перед инфекционным заболеванием.
Статистический анализ
Статистический анализ осуществляли с помощью пакета прикладных программ IBM SPSS Statistics версия 24.0.0.1. Проверка нормальности распределения количественных признаков проводилась при помощи теста Колмогорова−Смирнова с коррекцией значимости Лильефорса. Для описания признаков с нормальным распределением использовали среднее значение с указанием 95% доверительного интервала (ДИ), для признаков с отличным от нормального распределением — медиану с указанием межквартильного диапазона (25-й и 75-й процентили). Данные из совокупностей с нормальным распределением сравнивались с помощью t-критерия Стьюдента для независимых выборок. Сравнение данных из совокупностей с распределением, отличающимся от нормального, проводилось с применением критерия Манна–Уитни. Сравнение качественных параметров — с использованием таблиц сопряженности по критерию χ² Пирсона и точному критерию Фишера. Различия расценивались как статистически значимые при р<0,05.
Показатель летальности был рассчитан как соотношение умерших к числу заболевших, выраженное в %. В нашей работе показатели летальности в зависимости от различных демографических и клинических параметров, в том числе от получаемой пациентами терапии, представлены на рис. 2−5.
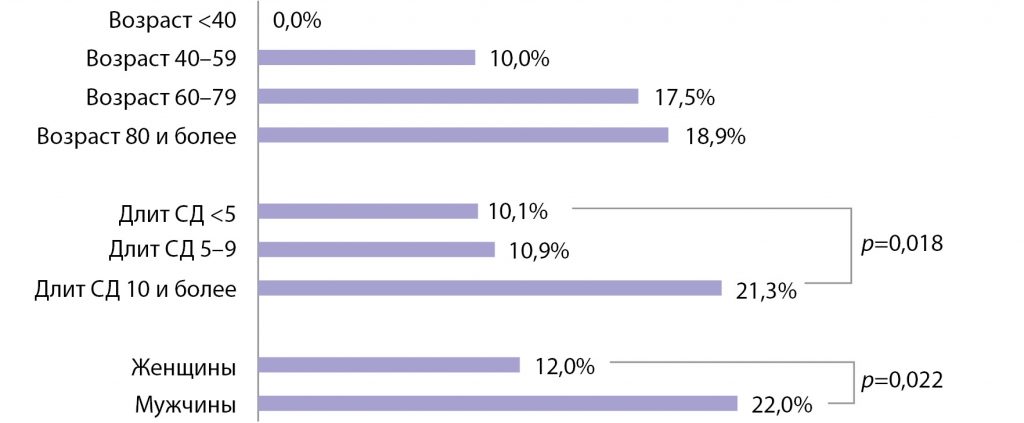
Рис. 2. Уровень летальности в зависимости от возраста (лет), длительности сахарного диабета 2-го типа (лет) и пола.
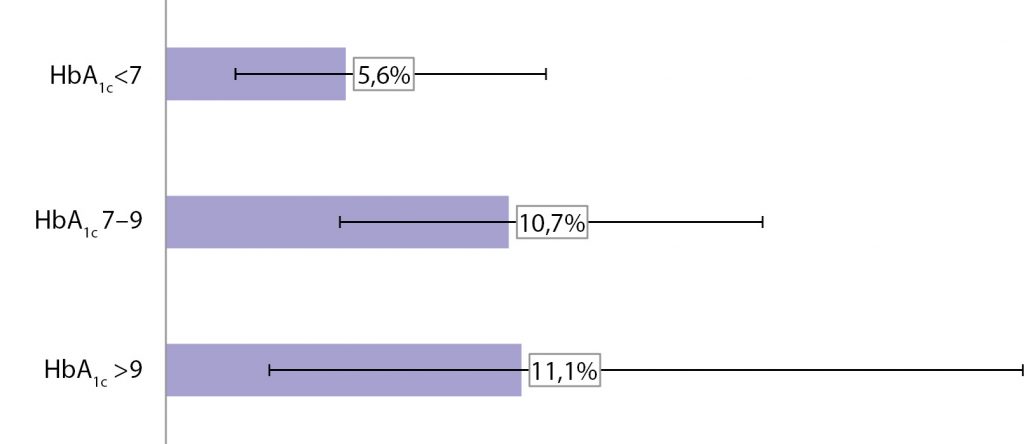
Рис. 3. Уровень летальности в зависимости от показателей HbA1c (%).
Рис. 4. Уровень летальности в зависимости от показателей индекса массы тела (кг/м2).
РЕЗУЛЬТАТЫ
Пациенты, вошедшие в анализ, представляли 51 регион России. Распределение пациентов из региональных сегментов ФРСД было следующим: Москва (13,9%; n=43), Ярославская область (12%; n=37), Саратовская область (5,5%; n=17), Оренбургская область (5,2%; n=16), Приморский край (5,2%; n=16). В остальных регионах РФ численность включенных больных не превышала 5%. Такое распределение не полностью совпадает с официальной частотой заболеваемости COVID-19 в регионах РФ, где первые три места по частоте инфицирования занимают Москва, Московская область и Санкт-Петербург, что в большей степени отражает локальную активность врачей регионов по заполнению базы данных ФРСД.
Летальность включенных в анализ больных СД2 составила 15,2% (47 из 309), выздоровели 84,8% пациентов (262 из 309).
Клиническая характеристика пациентов в зависимости от исхода заболевания представлена в табл. 1.
Таблица 1. Клиническая характеристика пациентов с сахарным диабетом 2-го типа в зависимости от клинического исхода (выздоровление/смерть)
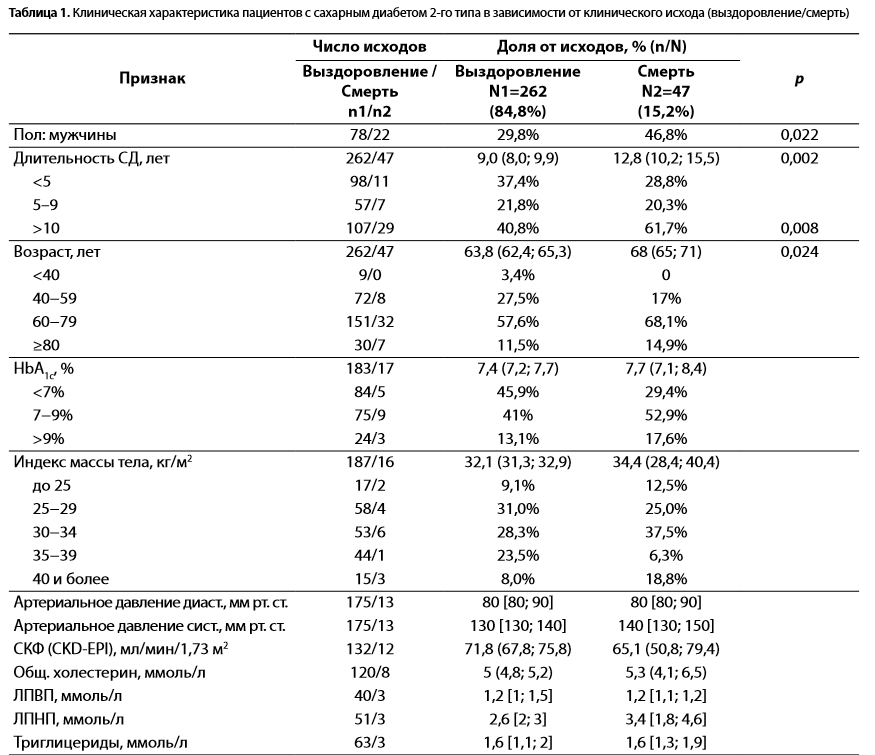
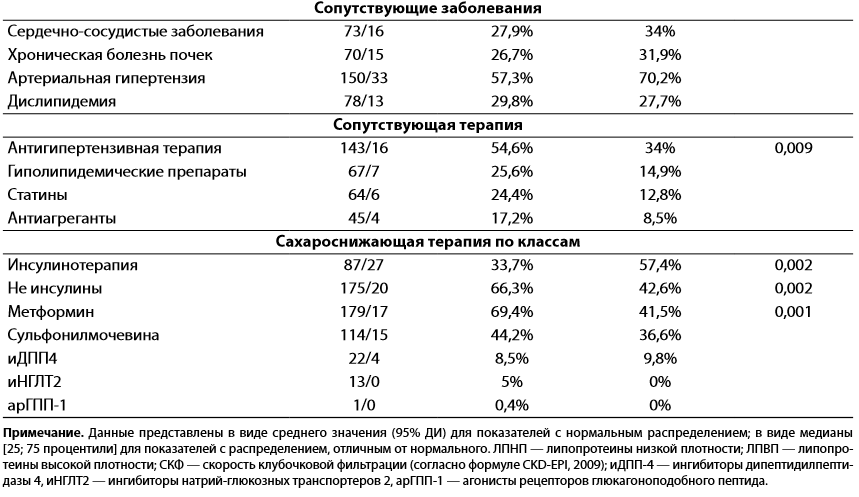
Примечание. Данные представлены в виде среднего значения (95% ДИ) для показателей с нормальным распределением; в виде медианы [25; 75 процентили] для показателей с распределением, отличным от нормального. ЛПНП — липопротеины низкой плотности; ЛПВП — липопротеины высокой плотности; СКФ — скорость клубочковой фильтрации (согласно формуле CKD-EPI, 2009); иДПП-4 — ингибиторы дипептидилпептидазы 4, иНГЛТ2 — ингибиторы натрий-глюкозных транспортеров 2, арГПП-1 — агонисты рецепторов глюкагоноподобного пептида.
Основные результаты исследования
По данным сравнительного анализа, группа больных с летальными исходами в отличие от группы выздоровевших была значимо чаще представлена мужчинами (46,8 против 29,8%, р=0,022), отличалась достоверно большей длительностью СД2 (12,8 против 9 лет, p=0,002), старшим возрастом (68 против 63,8 года, p=0,024), более частым применением инсулина (57,4 против 33,7%, p=0,002), более редким применением метформина (41,5 против 69,4%, p=0,001) и антигипертензивной терапии (34 против 54,6%, p=0,009) (см. табл. 1). Достоверных различий по уровню АД, показателям липидного обмена, скорости клубочковой фильтрации (СКФ), частоте сопутствующих заболеваний и терапии статинами и антиагрегантами между группами умерших и выздоровевших не выявлено (см. табл. 1).
Анализ летальности в зависимости от половозрастных и клинико-лабораторных показателей
При анализе летальности было установлено, что мужчины умирали в 2 раза чаще, чем женщины (22,0 и 12,0% соответственно, p=0,022) (рис. 2). Летальность прогрессивно возрастала по мере увеличения возраста больных (недостоверно) и длительности СД2 (в 2 раза выше при длительности СД2 более 10 лет по сравнению с длительностью менее 5 лет; (p=0,018) (рис. 2).
При анализе зависимости летальности от контроля гликемии было выявлено, что она была наименьшей у пациентов в подгруппе HbA1c <7%, где этот показатель составлял 5,6%, но возрастала в 2 раза у пациентов с уровнем HbA1c 7−9% и >9% (10,7 и 11,1% соответственно) (рис. 3). Однако зависимость не была достоверной вследствие малого количества наблюдений в группе умерших больных.
Анализ летальности в зависимости от величины ИМТ показал, что летальность в группе пациентов с ИМТ >40 кг/м2 была в 1,5−2,5 раза выше по сравнению с группами с нормальной массой тела и ИМТ 25−29 кг/м2, однако различия не достигали статистической значимости вследствие малой выборки в группе умерших (рис. 4).
Анализ летальности в зависимости от получаемой антидиабетической терапии
Достоверные различия по уровню летальности обнаружены в отношении только 2 антигипергликемических препаратов — метформина и инсулина (рис. 5). Летальность у пациентов на терапии метформином регистрировалась в 2,7 раза реже по сравнению с пациентами, не получающими метформин — 8,7 против 23,3% (р<0,001). Кроме того, летальность в подгруппе метформина была наименьшей среди других вариантов терапии: все не инсулины — 10,2%, СМ — 11,6%, иДПП-4 — 15,4%, инсулины — 23,7%.
Летальность пациентов на инсулинотерапии была в 2 раза выше по сравнению с не получающими инсулин — 23,7 против 10,3% (р=0,002). Напротив, если пациенты получали любые неинсулиновые препараты, уровень летальности среди них был в 3 раза ниже по сравнению с инсулинотерапией — 10,2 против 34,4% (р<0,001) (см. рис. 5).
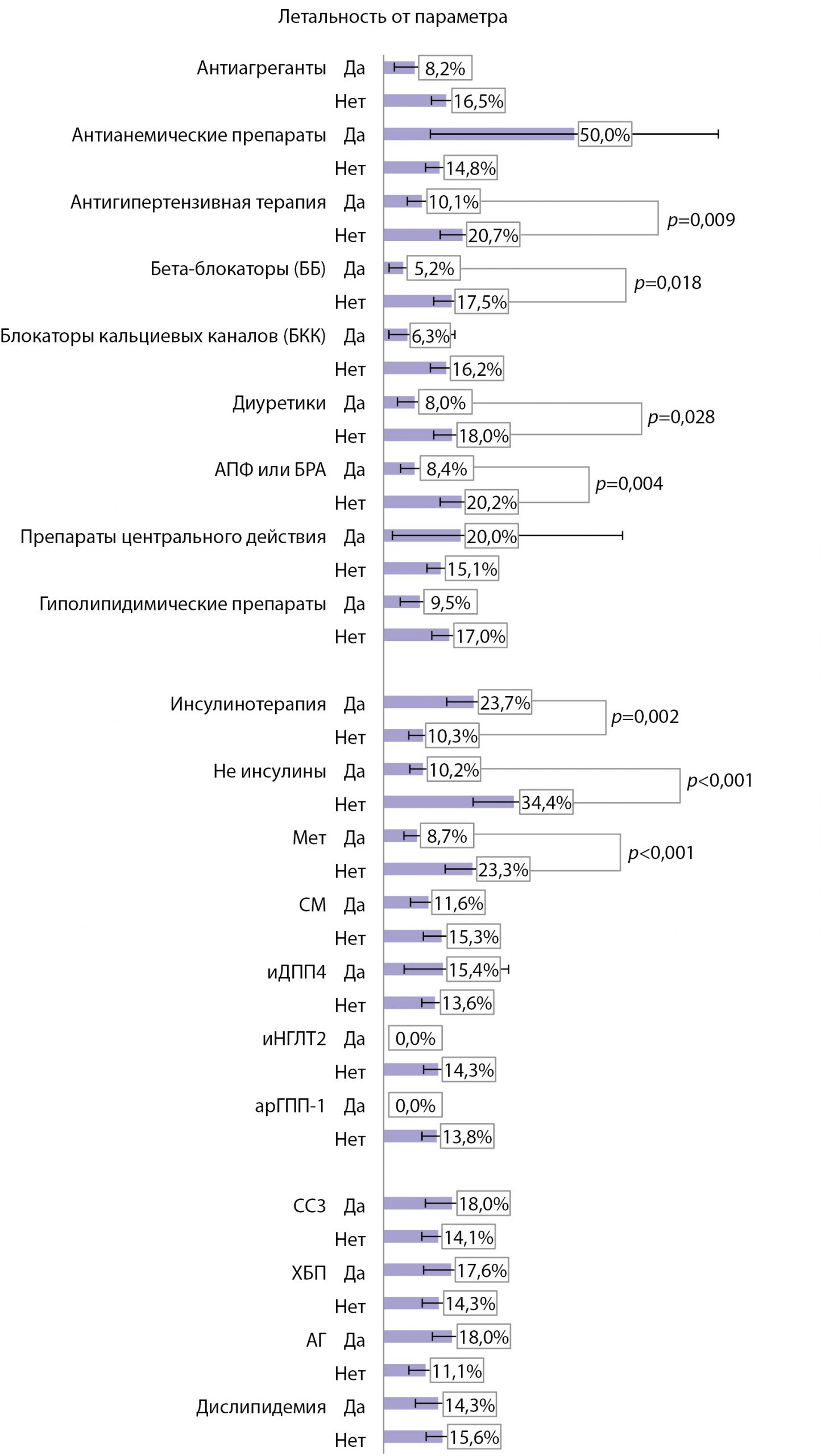
Рис. 5. Уровень летальности в зависимости от параметров терапии и сопутствующей патологии.
Получив более высокие показатели летальности среди пациентов на инсулинотерапии, мы провели более глубокий субанализ выявленных закономерностей. У пациентов, получающих инсулин, отмечались следующие достоверные различия, которые можно характеризовать как совокупность факторов неблагоприятного исхода (табл. 2):
1.бо́льшая длительность СД (13,4 против 6,8 года, р<0,0001);
2.большее количество пациентов старшего возраста (65−79 лет; 45,2 против 31,4%, р=0,015) и меньшая доля пациентов более молодого возраста (45−64 года; 37,4 против 49,5%, р=0,039);
3.худший контроль гликемии в целом: средний HbA1c (8,1 против 7,0%, р<0,0001);
4.меньшая доля пациентов с HbA1c <7% (26,0 против 56,1%, р<0,001) и большее количество пациентов с недостижением цели HbA1c ≥2,5% (14,7 против 5,9%, р<0,04).
Таблица 2. Клиническая характеристика пациентов с сахарным диабетом 2-го типа, получающих/не получающих терапию инсулином
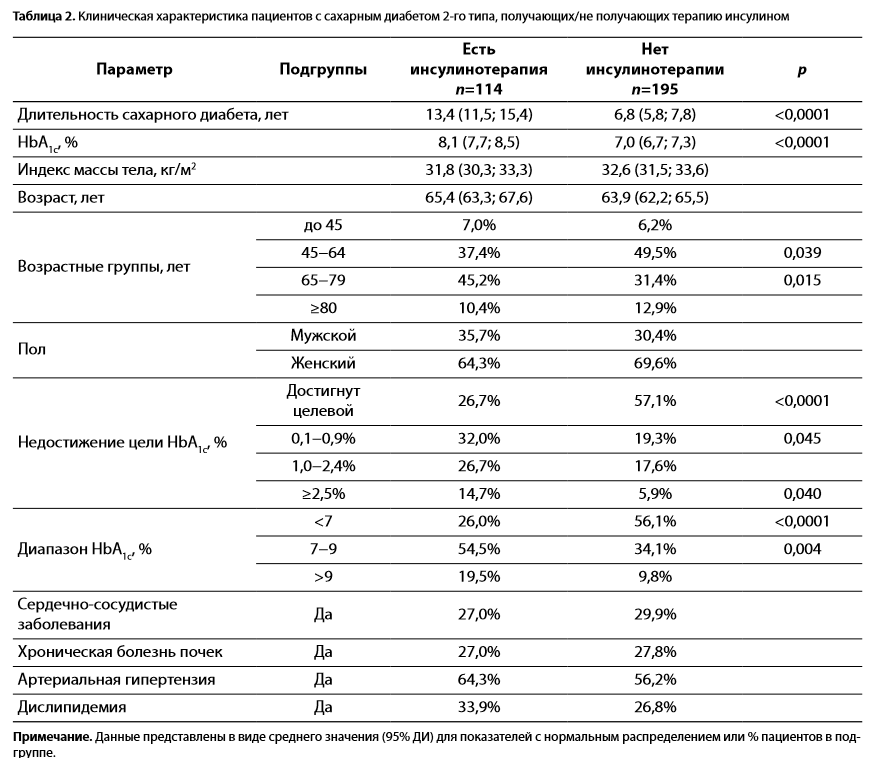
Примечание. Данные представлены в виде среднего значения (95% ДИ) для показателей с нормальным распределением или % пациентов в подгруппе.
Следует отметить, что, вопреки ожиданиям, группа на инсулине не различалась по количеству пациентов с сопутствующей патологией (сердечно-сосудистыми заболеваниями, артериальной гипертензией, хронической болезнью почек, дислипидемией), а также по доле пациентов, получающих антигипертензивную и кардиопротективную терапию, т.е. пациенты на инсулинотерапии не были объективно тяжелее соматически, но имели значимо худший контроль гликемии.
Анализ летальности в зависимости от сопутствующей терапии
Мы проанализировали сопутствующую терапию для лечения артериальной гипертензии, сердечно-сосудистых заболеваний и дислипидемии. Установлено, что летальность была ниже в группах пациентов, получающих антиагреганты, гиполипидемические и антигипертензивные препараты, которые, согласно современным клиническим рекомендациям, позиционируются в качестве основных органопротективных препаратов.
Различия в показателях летальности достигали уровня статистической значимости у пациентов, получающих антигипертензивную терапию в целом, иАПФ или БРА, бета-блокаторы (ББ) и диуретики (рис. 5).
Анализ вероятности развития исходов «выздоровления» или «смерти»
Заключительным этапом исследования был расчет отношения шансов (odds ratio, OR), т.е. вероятности развития исходов выздоровления или смерти в зависимости от демографических и клинических параметров.
Расчет OR показал, что факторами, достоверно повышающими риск смерти, являются (рис. 6):
- мужской пол (OR=2,08; (95 ДИ 1,1−3,9); р=0,022);
- терапия инсулином (OR=2,67; (95 ДИ 1,42−5,02); р=0,002).
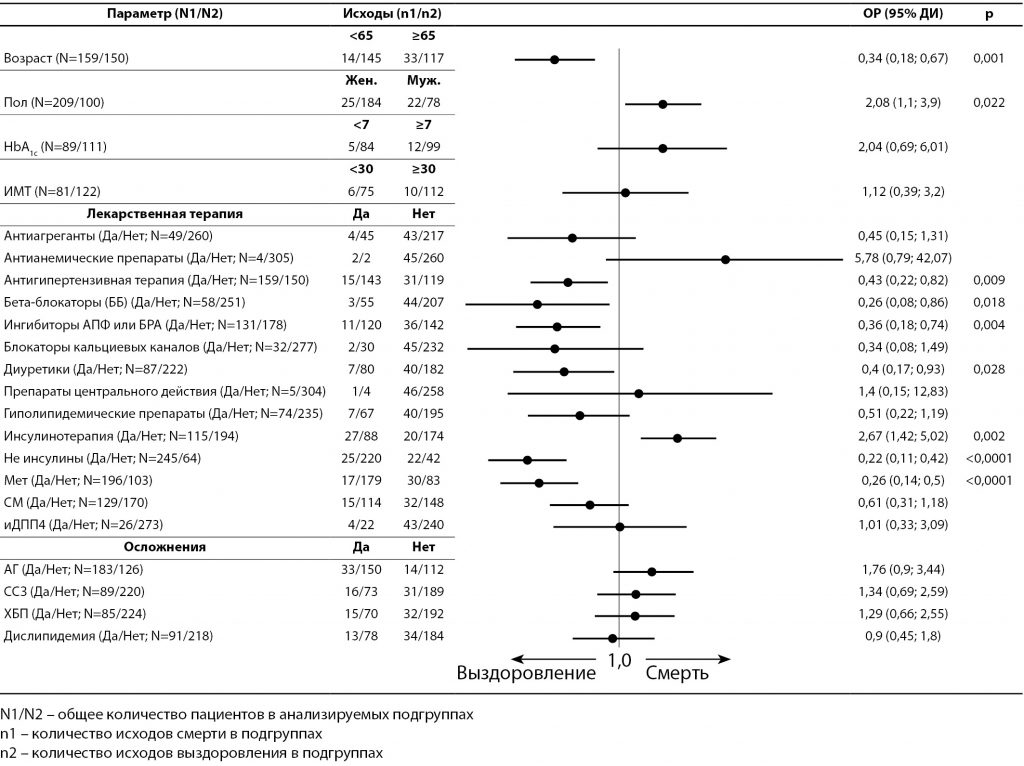
Рис. 6. Анализ вероятности развития исходов выздоровления и смерти у пациентов с сахарным диабетом 2-го типа в зависимости от клинических параметров.
Уровень HbA1c >7% также оказывал влияние на повышение риска смерти (OR=2,04; 95% ДИ 0,69−6,01), однако его значения не были статистически значимы из-за малого числа наблюдений в группе со смертельным исходом.
Факторами, которые ассоциировались с достоверным снижением риска смертности, были (см. рис. 6):
- возраст менее 65 лет: риск смерти на 66% ниже, чем у лиц в возрасте старше 65 лет (OR=0,34; 95 ДИ 0,18−0,67; р=0,001);
- терапия метформином: снижение риска смерти на 74% (OR=0,26; 95 ДИ 0,14−0,5; р<0,0001);
- антигипертензивная терапия: снижение риска смерти на 57% (ОR=0,43; 95 ДИ 0,22−0,82; р=0,009);
- терапия иАПФ или БРА: снижение риска смерти на 64% (ОR=0,36; 95 ДИ 0,18−0,74; р=0,004);
- терапия бета-блокаторами: снижение риска смерти на 74% (ОR=0,26; 95 ДИ 0,08−0,86; р=0,018);
- терапия диуретиками: снижение риска смерти на 60% (ОR=0,4; 95 ДИ 0,17−0,33; р=0,028).
ОБСУЖДЕНИЕ
Больные СД относятся к наиболее уязвимой категории лиц, пострадавших от вирусной пандемии COVID-19. По предварительным оценкам, летальность больных СД от нового коронавируса значимо выше, чем лиц без СД: в Китае – 7,8 против 2,7%, в США – 28,8 против 6,2%, в Англии – 31,4 против 14,2% соответственно [8−10]. В нашем исследовании летальность больных СД2 составила 15,2%, что в 2 раза выше, чем в Китае, но в 2 раза ниже по сравнению с США и Англией.
По результатам нашего анализа, летальность у мужчин оказалась в 2 раза выше, чем у женщин (22 против 12%, p=0,022). Это совпадает с данными большинства других стран мира (Китай, США, страны Европы) — где также была зарегистрирована в 1,5−2,5 раза бо́льшая частота летальных исходов у мужчин по сравнению с женщинами [11−13]. При этом авторы указывают, что частота инфицирования и возраст были сопоставимы между полами [11]. Этот факт свидетельствует о том, что мужчины более склонны к тяжелому и даже летальному течению COVID-19. Причины этого неясны. Предполагают несколько гипотез: либо одна из двух Х-хромосом у женщин может обеспечивать более сильный иммунитет, либо эстрогены женщин в большей степени защищают от вирусной инфекции, чем тестостерон у мужчин, либо рецепторы АПФ2 у мужчин более чувствительны к вирусу SARS-COV-2 [14]. Гипотез много, но ни одна из них пока не получила убедительного подтверждения.
В нашем исследовании, как и в большинстве других, умершие пациенты характеризовались значимо более старшим возрастом и большей длительностью заболевания, худшим контролем гликемии (по HbA1c) и бо́льшим ИМТ. Неудовлетворительный контроль гликемии в большинстве исследований указывается как один из самых сильных факторов риска тяжелого течения и высокой смертности инфицированных больных СД2. Так, в исследованиях китайских коллег продемонстрировано, что суточные колебания гликемии в пределах удовлетворительного контроля (от 3,9 до 10,0 ммоль/л) ассоциировались со значимо меньшей летальностью, чем при уровне гликемии, стабильно превышающем 10 ммоль/л [8]. По данным популяционного исследования в Англии, включившего 7466 больных СД2, инфицированных COVID-19, повышение HbA1c >7,5% сопровождалось увеличением летальности в 1,23 раза, а HbA1c >10% — в 1,62 раза [10]. В нашем исследовании летальность больных при HbA1c >9% была в 2 раза выше, чем при HbA1c <7% (11,1 против 5,6% соответственно), однако статистической значимости эти данные не достигли (вероятно, по причине низкого числа больных в группе умерших) (см. рис. 3).
Интересным представляется анализ летальности больных СД2 в зависимости от получаемой антидиабетической терапии. Значимое влияние на летальность оказали только 2 вида терапии — метформином и инсулином. Летальность была достоверно ниже у лиц, получающих метформин (OR=0,26; 95% ДИ 0,14−0,5; p<0,0001), и достоверно выше у лиц на инсулинотерапии (OR=2,67; 95% ДИ 1,42−5,02; p=0,002).
В доступной литературе удалось найти лишь одну статью, опубликованную китайскими коллегами онлайн 21 мая 2020 г., подтверждающую значимо более низкую летальность у больных СД2, инфицированных COVID-19, получающих терапию метформином (104 человека) в сравнении с таковой у больных без терапии метформином (179 человек): 2,9 против 12,3% соответственно, p=0,01 [15]. Ранее были опубликованы масштабные исследования, подтверждающие, что длительное лечение метформином больных с хроническими респираторными заболеваниями (до эпидемии COVID-19) приводило к значимому снижению риска смертности по сравнению с больными, не получавшими этот препарат [16]. Также опубликованы результаты наблюдения за пациентами с СД2, находившимися в отделениях интенсивной терапии по разным причинам, в том числе с тяжелой пневмонией, у которых применение метформина за 3 мес до развития критически тяжелого состояния снижало летальность на 17−20% по сравнению с больными, не получавшими метформин [17]. Наверное, все эти клинические находки, подтверждающие снижение смертности на метформине от респираторных заболеваний и от COVID-19 (как и в нашем исследовании), неслучайны. Имеется теоретическое обоснование защитных свойств метформина при коронавирусной инфекции. Известно, что метформин способен фосфорилировать АПФ2-рецептор вируса SARS-CoV-2, что приводит к изменению конформации рецептора и снижению его связывания с вирусом [18]. Возможно, именно этот механизм позволяет защитить клетки от избыточного вторжения коронавируса и обеспечивает протективное действие метформина. Однако важно обратить внимание, что во всех указанных исследованиях (как и в нашем) препарат метформина применялся заблаговременно, т.е. до развития острой респираторной инфекции. Необходимо напомнить, что прием метформина противопоказан в случае тяжелой гипоксии и дыхательной недостаточности. В международных и российских рекомендациях по лечению COVID-19 содержится информация об отмене этого препарата при тяжелом течении коронавирусной инфекции при низкой сатурации кислорода [19, 20].
Относительно неожиданной находкой нашего исследования явилось увеличение летальности больных СД2, получающих инсулинотерапию. Этот факт был подтвержден как при сравнительном анализе (доля умерших против выздоровевших больных, получавших инсулинотерапию, — 57,4 против 33,7%, р=0,002; см. табл. 1), так и при оценке отношения шансов (риски летальности были в 2,67 раза выше у лиц на инсулинотерапии; см. рис. 6). В доступной литературе нам удалось найти лишь одно исследование, в котором был получен аналогичный результат [21]. В этом исследовании китайские коллеги провели ретроспективный анализ 904 больных, из которых 120 имели СД2. Пациенты с СД2 на инсулинотерапии имели значимо более тяжелое или критическое течение заболевания (81,7 против 44,9%, р<0,001) и значимо бо́льшую госпитальную летальность (22,5 против 6,1%, р=0,021). Авторы этой публикации не стали анализировать причины такого результата. В нашем анализе мы предприняли попытку исследовать возможные причины худшего прогноза больных СД2, получающих инсулинотерапию. Все больные, включенные в наш анализ, были распределены в группы с/без инсулинотерапии (см. табл. 2), затем было проведено их сравнение по основным клиническим параметрам. Как и ожидалось, пациенты на инсулинотерапии имели достоверно бо́льшую длительность СД2 (13,4 против 6,8 года, p<0,0001), худший контроль гликемии по HbА1c (8,1 против 7,0%, p<0,0001), реже достигали целевого HbA1c (26,7 против 57,1%, p<0,0001), причем достоверно чаще недостижение цели превышало 2,5 условных % по HbA1c (14,7 против 5,9%, p=0,04). Однако по частоте сопутствующих заболеваний (сердечно-сосудистые заболевания, хроническая болезнь почек, артериальная гипертензия, дислипидемия) больные на инсулинотерапии и без нее были сопоставимы. Таким образом, мы вправе предполагать, что больные СД2 на инсулинотерапии имели худший прогноз не вследствие самой инсулинотерапии, а вследствие отсутствия должного контроля гликемии.
Мы также провели анализ летальности инфицированных больных СД2 в зависимости от терапии сопутствующих заболеваний. Достоверные различия были получены только в отношении доли пациентов, получающих антигипертензивную терапию, среди которых умерших было 34,0%, а выздоровевших 54,6%, p=0,009 (см. табл. 1). Эти данные были подтверждены при анализе летальности, которая оказалась в 2 раза выше у лиц без антигипертензивной терапии — 20,7 против 10,1% (p=0,009) (см. рис. 5). При анализе летальности в зависимости от структуры антигипертензивной терапии достоверные различия были получены в отношении применения бета-блокаторов, диуретиков и блокаторов РАС (иАПФ и БРА). Применение этих групп препаратов ассоциировалось с меньшей летальностью (в 3,3; 2,3 и 2,4 раза соответственно, чем при их отсутствии в схемах лечения (см. рис. 5).
Наибольшие споры в литературе в отношении безопасности применения у больных, инфицированных новым коронавирусом, вызывала группа блокаторов РАС (иАПФ и БРА). Хорошо известно, что эти препараты значимо повышают экспрессию фермента АПФ2, который одновременно является рецептором нового коронавируса SARS-COV-2 [6, 22]. В связи с этим возникли опасения, что более высокая экспрессия АПФ2-рецептора позволит коронавирусу активнее внедряться в клетки и вызывать более глубокое и тяжелое повреждение органов-мишеней и прежде всего — ткани легких, где этот рецептор находится в больших количествах. В то же время именно эти группы препаратов имеют наибольший пул доказательств по кардио- и нефропротективной активности у больных кардиоренальными заболеваниями в целом и у больных СД в частности. Именно поэтому прекращение применения этих препаратов в период коронавирусной инфекции может нанести урон здоровью больных СД2. Именно по этой причине анализ безопасности применения блокаторов РАС в данном исследовании был в особом фокусе нашего внимания.
При анализе вероятности развития исходов мы убедились, что применение блокаторов РАС (иАПФ или БРА) снижает риски развития летального исхода на 64% (OR=0,36; 95% ДИ 0,18−0,74; p=0,004; см. рис. 6). Наши данные нашли подтверждение в трех только что опубликованных анализах. В исследовании М. Mehra и соавт. [23] был доказан протективный эффект применения иАПФ, подтвержденный высоким шансом выживания инфицированных больных (OR 0,33; 95% ДИ 0,22−0,54). В двух других исследованиях [24, 25] показан нейтральный эффект блокаторов РАС на выживаемость больных COVID-19.
Полученные данные чрезвычайно важны для формирования обоснованных рекомендаций пациентам о продолжении приема данных препаратов, отказ от которых может привести к повышению смертности не только от сопутствующих заболеваний, но и от COVID-19.
Ограничения исследования
К ограничениям исследования можно отнести недостаточно полное заполнение полей регистра по клинико-лабораторным показателям, в связи с чем в ряде случаев анализ не достигал статистически значимого результата, а также включение в анализ пациентов с перенесенной пневмонией (в период, указанный в исследовании), хотя не все из них имели подтвержденный диагноз COVID-19.
ЗАКЛЮЧЕНИЕ
Наше исследование представляет на сегодняшний день первый анализ факторов риска летальности больных СД2 с пневмонией/COVID-19, выполненный на основе базы данных ФРСД. Выявленные факторы риска летальности больных СД2 указывают на то, что хороший контроль гликемии, предшествующее лечение метформином и антигипертензивными препаратами (в том числе блокаторами РАС) позволяет снизить частоту летальных исходов. Больные СД2 на терапии инсулином имели худший прогноз из-за отсутствия должного контроля гликемии, а не вследствие самой инсулинотерапии.
Полученные результаты позволяют оценить высокую значимость достижения гликемического контроля для снижения летальных исходов COVID-19, а также ответить на ряд спорных вопросов в отношении безопасности и даже приоритетов в применении метформина и блокаторов РАС у пациентов с СД2, инфицированных коронавирусом.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Для анализа использованы деперсонифицированные выборки из Федерального регистра сахарного диабета (ФРСД), курируемого ФГБУ «НМИЦ эндокринологии» Минздрава РФ в рамках выполнения Государственного задания Министерства здравоохранения Российской Федерации No АААА-А18-118051590061-9.
Конфликт интересов. Исаков М.А. является также сотрудником ЗАО «Астон Консалтинг», обеспечивающего техническое сопровождение ФРСД в онлайн-формате (компания ЗАО «Астон Консалтинг» не являлась спонсором исследования, не принимала участие в анализе данных, их интерпретации и подготовке статьи, не состояла в финансовых отношениях с другими членами авторского коллектива).
Остальные авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Участие авторов. Идея и дизайн исследования, анализ и интерпретация данных, написание текста статьи — Шестакова М.В.; анализ и интерпретация данных, написание текста статьи — Викулова О.К; формирование деперсонифицированной выборки пациентов из базы данных РСД, подготовка графических и табличных данных — Исаков М.А.; финальный анализ и редактирование текста рукописи — Дедов И.И. Все авторы внесли существенный вклад в проведение исследования и подготовку статьи, прочли и одобрили финальную версию перед публикацией.
Благодарности. ЗАО «Астон Консалтинг» за техническое сопровождение регистра СД в онлайн-формате. Всем медицинским специалистам (врачам, медицинским сестрам, регистраторам данных), ведущим активную работу по заполнению базы данных ФРСД.
Список литературы
↑1. World Health Organization. Coronavirus disease (COVID-2019) situation reports. Available from: https://www.who.int/emergencies/diseases/novel-coronavirus-2019/situation-reports
↑2. Huang I, Lim MA, Pranata R. Diabetes mellitus is associated with increased mortality and severity of disease in COVID-19 pneumonia – a systematic review, meta-analysis, and meta-regression. Diabetes Metab Syndr. 2020;14(4):395−403. https://doi.org/https://doi.org/10.1016/j.dsx.2020.04.018
↑3. Guan WJ, Ni ZY, Hu Y, et al. China medical treatment expert group for COVID-19. Clinical characteristics of coronavirus disease 2019 in China. N Engl J Med. 2020;382(18):1708−1720. https://doi.org/https://doi.org/10.1056/NEJMoa2002032
↑4. Глыбочко П.В., Фомин В.В., Авдеев С.В., и др. Клиническая характеристика 1007 больных тяжелой SARS-COV-2 пневмонией, нуждавшихся в респираторной поддержке // Клиническая фармакология и терапия. – 2020. – Т. 29. – №2. – С. 21−29. [Glybochko P, Fomin V, Avdeev S, et al. Clinical characteristics of 1007 intensive care unit patients with SARS-CoV-2 pneumonia. Clinical pharmacology and therapy. 2020;29(2):21-29. (In Russ).] https://doi.org/https://doi.org/10.32756/0869-5490-2020-2-21-29
↑5. Bornstein SR, Rubino F, Khunti K, et al. Practical recommendations for the management of diabetes in patients with COVID-19. Lancet Diabetes Endocrinol. 2020;8(6):546−550. https://doi.org/https://doi.org/10.1016/S2213-8587(20)30152-2
↑6. Mali SN, Thorat BR, Chopade AR. A viewpoint on angiotensin-converting enzyme 2, anti-hypertensives and Coronavirus Disease 2019 (COVID-19). Infect Disord Drug Targets. 2020. https://doi.org/https://doi.org/10.2174/1871526520666200511005546
↑7. Дедов И.И., Шестакова М.В., Сунцов Ю.И., и др. Результаты реализации подпрограммы «Сахарный диабет» федеральной целевой программы «Предупреждение и борьба с социально значимыми заболеваниями 2007-2012 годы» // Сахарный диабет. – 2013. – №25. – С. 2−46. [Dedov II, Shestakova MV, Suntsov YI, et al. Federal targeted programme «Prevention and Management of Socially Significant Diseases (2007−2012)»: results of the «Diabetes mellitus» sub-programme. Diabetes mellitus. 2013;(25):2-46. (In Russ).]
↑8. Zhu L, She ZG, Cheng X, et al. Association of blood glucose control and outcomes in patients with COVID-19 and pre-existing type 2 diabetes. Cell Metab. 2020;S1550-4131(20)30238-2. https://doi.org/https://doi.org/10.1016/j.cmet.2020.04.021
↑9. Bode B, Garrett V, Messler J, et al. Glycemic characteristics and clinical outcomes of COVID-19 patients hospitalized in the United States. J Diabetes Sci Technol. 2020;1932296820924469. https://doi.org/https://doi.org/10.1177//1932296820924469
↑10. Barron E, Bakhai C, Kar P, et al. Type 1 and type 2 diabetes and COVID-19 related mortality in England: a whole population study. Available from: https://www.england.nhs.uk/wp-content/uploads/2020/05/Valabhji-COVID-19-and-Diabetes-Paper-2-Full-Manuscript.pdf
↑11. Jin JM, Bai P, He W, et al. Gender differences in patients with COVID-19: focus on severity and mortality. Front Public Health. 2020;8:152. https://doi.org/https://doi.org/10.3389/fpubh.2020.00152
↑12. Roper W. More men dying of COVID-19 than women. [cited 2020 Apr 3] Available from: https://www.statista.com/chart/21345/coronavirus-deaths-by-gender
↑13. Global Health 50/50 [Internet]. Why Global Health 50/50? Available from: https://globalhealth5050.org/about-us
↑14. Walter LA, MacGregor AJ. Sex- and gender-specific observations and implications for COVID-19. J West Emerg Med. 2020;21(3)507−509. https://doi.org/https://doi.org/10.5811/westjem.2020.4.47536
↑15. Luo P, Qiu L, Liu Y, et al. Metformin treatment was associated with decreased mortality in COVID-19 patients with diabetes in a retrospective analysis. Am J Trop Med Hyg. 2020. https://doi.org/https://doi.org/10.4269/ajtmh.20-0375
↑16. Mendy A, Gopal R, Alcorn JF, Forno E. Reduced mortality from lower respiratory tract disease in adult diabetic patients treated with metformin. Respirology. 2019;24(7):646−651. https://doi.org/https://doi.org/10.1111/resp.13486
↑17. Ho T, Huang C, Tsai Y, et al. Metformin use mitigates the adverse prognostic effect of diabetes mellitus in chronic obstructive pulmonary disease. Respir Res. 2019;20(1):69. https://doi.org/https://doi.org/10.1186/s12931-019-1035-9
↑18. Sharma S, Ray A, Sadasivam B. Metformin in COVID-19: a possible role beyond diabetes. Diab Res Clin Pract. 2020;164:108183. https://doi.org/https://doi.org/10.1016/j.diabres.2020.108183
↑19. Мокрышева Н.Г., Галстян Г.Р., Киржаков М.А., и др. Рекомендации для врачей по лечению эндокринных заболеваний в условиях пандемии COVID-19 [интернет]. – М.: НМИЦ эндокринологии, 2020. [Mokrysheva NG, Galstyan GR, Kirzhakov MA, et al. Rekomendatsii dlya vrachey po lecheniyu endokrinnykh zabolevaniy v usloviyakh pandemii COVID-19 [Internet]. Moscow: NMITS endokrinologii; 2020. (In Russ).] Доступно по: https://www.endocrincentr.ru/rekomendacii-dlya-vrachey-po-lecheniyu-endokrinnyh-zabolevaniy-v-usloviyah. Ссылка активна на 14.05.2020.
↑20. Hartmann-Boyce J, Morris E, Goyder C, et al. Managing diabetes during the COVID-19 pandemic. [cited 2020 Apr 8] Available from: https://www.cebm.net/covid-19/managing-diabetes-during-the-covid-19-pandemic
↑21. Chen Y, Yang D, Cheng B, et al. Clinical characteristics and outcomes pf patients with diabetes and COVID-19 in association with glucose-lowering medication. Diabetes care. 2020;dc200660. https://doi.org/https://doi.org/10.2337/dc20-0660
↑22. Hoffmann M, Kleine-Weber H, Schroeder S, et al. SARS-CoV-2 cell entry depends on ACE2 and TMPRSS2 and is blocked by a clinically proven protease inhibitor. Cell. 2020;181(2):271−280.e8. https://doi.org/https://doi.org/10.1016/j.cell.2020.02.052
↑23. Mehra MR, Desai SS, Kuy S, et al. Cardiovascular disease, drug therapy, and mortality in Covid-19. N Engl J Med. 2020;NEJMoa2007621. https://doi.org/https://doi.org/10.1056/NEJMoa2007621
↑24. Mancia G, Rea F, Ludergnani M, et al. Renin-angiotensin-aldosterone system blockers and the risk of Covid-19. N Engl J Med. 2020;NEJMoa2006923. https://doi.org/https://doi.org/10.1056/NEJMoa2006923
↑25. Reynolds HR, Adhikari S, Pulgarin C, et al. Renin-angiotensin-aldosterone system inhibitors and risk of Covid-19. N Engl J Med. 2020;NEJMoa2008975. https://doi.org/https://doi.org/10.1056/NEJMoa2008975
