С.В. Щелоченков
Г.С. Джулай
Балтийский федеральный университет им. Иммануила Канта
Тверской государственный медицинский университет
Неалкогольная жировая болезнь печени (НАЖБП) является наиболее распространенным заболеванием печени как в Западных странах, так и в России. По данным различных авторов, распространенность заболевания среди взрослого населения с учетом возраста, пола, этнической принадлежности, а также степени доказательности применяемых методов диагностики варьируется от 17 до 46% [1, 2]. При этом общемировая распространенность НАЖБП достигает 25% [1].
Чаще НАЖБП выявляется в Южной Америке и на Ближнем Востоке, за которыми следуют Азия, Соединенные Штаты Америки и Европа [3].
Согласно результатам исследования DIREG 1, в 2007 г. в Российской Федерации частота выявления НАЖБП составляла 27%, а в 2014 г., по данным исследования DIREG 2, уже 37% [4].
Традиционно НАЖБП рассматривается в тесной этиопатогенетической связи с абдоминальным ожирением, сахарным диабетом 2-го типа, атерогенной дислипидемией, объединенных понятием метаболического синдрома (МС). В многочисленных исследованиях продемонстрировано значительное увеличение распространенности НАЖБП, развитие его прогрессивных форм (неалкогольный стеатогепатит, цирроз печени) у пациентов с ожирением, инсулинорезистентностью и типичными для МС обменными нарушениями. Однако все больше исследователей обращают внимание на иные возможные причины развития НАЖБП, в частности синдром гипотиреоза [5, 6]. Необходимость детализации причин НАЖБП, не связанных с МС, обусловлена еще и тем, что данное заболевание с типичными для НАЖБП морфологическими признаками выявляется у 7–9% людей с нормальной массой тела, чаще у женщин, протекает без изменения уровня сывороточных трансаминаз [7–9].
В настоящее время опубликовано четыре метаанализа исследований взаимосвязи НАЖБП и гипотиреоза [10–13]. В первом из них, объединившем 14 исследований с участием 42 000 пациентов, показано, что НАЖБП не связана с субклиническим (коэффициент риска случайных эффектов – отношение шансов (ОШ) 0,63; 95%-ный доверительный интервал (ДИ) 0,18–2,20) и явным гипотиреозом (ОШ 1,37; 95% ДИ 0,78–2,41) [10]. Напротив, в другом метаанализе, включавшем 13 обсервационных исследований с участием 37 000 пациентов, первичный субклинический и явный гипотиреоз были связаны с повышением распространенности НАЖБП (ОШ 1,52; 95% ДИ 1,24–1,87) [11].
К аналогичным выводам пришли авторы и другого метаанализа 12 поперечных и трех продольных исследований (n = 44 140): как субклинический, так и явный гипотиреоз были независимо связаны с повышенным риском развития НАЖБП (ОШ 1,42; 95% ДИ 1,15–1,77) [12].
Проведение метаанализа данных только продольных исследований показало, что субклинический гипотиреоз не связан с повышенным риском возникновения НАЖБП в среднем за пятилетний период наблюдения (ОШ 1,29; 95% ДИ 0,89–1,86) [12].
Метаанализ 2018 г. (26 исследований, n = 61 548) подтвердил, что у пациентов с НАЖБП уровень тиреотропного гормона (ТТГ) значительно выше, чем у пациентов без НАЖБП. Гипотиреоз связан с повышением распространенности НАЖБП [13].
В недавнем исследовании [14] выявлена значимая связь между НАЖБП и уровнем ТТГ. 425 пациентов с морфологически верифицированной НАЖБП были разделены на три группы в зависимости от уровня ТТГ. Первую составили 282 пациента с эутиреозом (ТТГ 0,4–2,5 мЕД/л), вторую – 59 пациентов с субклиническим гипотиреозом (ТТГ > 4,5 мЕД/л) и третью – 84 пациента с низкой нормальной функцией щитовидной железы (ТТГ 2,5–4,5 мЕД/л). У всех обследованных Т4св. оставался в пределах референсных значений. Согласно результатам исследования, неалкогольный стеатогепатит (НАСГ) и прогрессирующий фиброз выявлены с большей частотой в группе пациентов с субклиническим гипотиреозом по сравнению с группой эутиреоза (52,4 против 37,2% для НАСГ и 21,0 против 10,6% для распространенного фиброза; p < 0,01). У пациентов второй группы (субклинический гипотиреоз) в отличие от пациентов третьей группы (низкая нормальная функция щитовидной железы) чаще выявлялись НАСГ и прогрессирующий фиброз (57,6 против 48,8% для НАСГ и 25,4 против 17,9% для распространенного фиброза; p < 0,01). У обследованных с субклиническим гипотиреозом стеатоз печени характеризовался большей степенью выраженности баллонной дистрофии и фиброза. При проведении многофакторного анализа установлено, что низкая функция щитовидной железы ассоциирована с НАСГ (ОШ 1,61; 95% ДИ 1,04–2,50; p = 0,035) и прогрессирующим фиброзом (ОШ 2,23; 95% ДИ 1,18–4,23; p = 0,014). Риск НАСГ и прогрессирующего фиброза значительно повышался при увеличении содержания ТТГ в плазме крови (p–тренд < 0,05 для каждого).
Очевидно, что весь массив проведенных исследований не дает системных представлений о механизмах коморбидности указанных патологических состояний, хотя высокая распространенность обоих заболеваний в популяции делает данную проблему значимой в медико-социальном аспекте.
Целью клинико-экспериментального исследования стало установление клинико-морфологических параллелей патологии печени при первичном (послеоперационном) гипотиреозе.
В эксперименте на лабораторных животных (самки крыс, 40 особей) был смоделирован послеоперационный гипотиреоз [15]. На светооптическом и электронномикроскопическом уровнях изучена морфологическая картина печени.
Экспериментальные животные были разделены на две группы. Крысам первой (исследовательской) группы выполнена тотальная тиреоидэктомия, животным второй (контрольной) группы – мобилизация щитовидной железы, но без удаления органа. Животных выводили из эксперимента на 28-й и 56-й дни, осуществлялся забор печени, а также осмотр области трахеи животных исследовательской группы в непосредственной топографической близости со щитовидной железой для исключения возможности регенерации ее ткани. Гистопрепараты окрашивали гематоксилином и эозином, а также пикрофуксином по Ван Гизону, нейтральный жир выявляли при окраске нативных срезов суданом III.
Анализ результатов экспериментального исследования показал, что в контрольной группе независимо от сроков наблюдения (28 и 56 дней) после экспериментального вмешательства на светооптическом и электронномикроскопическом уровнях отмечалась типичная морфологическая картина неизмененной печени.
В исследовательской группе животных на 28-й и 56-й дни (табл. 1) после тиреоидэктомии наблюдалось сочетание белковой и жировой дистрофии, нараставшей с увеличением продолжительности эксперимента, признаки хронического гепатита минимальной степени активности. На 56-й день эксперимента выявлено расширение портальных трактов с формированием в отдельных полях зрения соединительнотканных тяжей, направленных от триад к центральной вене, с умеренно выраженным перивенулярным склерозом. Обнаружено расширение центральных вен и прилежащих к ним синусоидов, что свидетельствовало об отеке ткани.

На ультраструктурном уровне на 28-й день эксперимента выявлены увеличение числа и размеров липидных включений, признаки внутриклеточного отека: обилие вакуолей, сформированных в результате расширения цистерн эндоплазматического ретикулума, набухание митохондрий, расширение их межмембранных пространств, нечеткость контуров наружной мембраны, значительное уменьшение количества крист. Изменения ядер гепатоцитов проявлялись неровностью контуров, расширением перинуклеарных пространств, в ряде ядер отсутствовали ядрышки. На 56-й день эксперимента зафиксированы частичная или полная деструкция органелл гепатоцитов, отек митохондрий, лизис и деструкция их крист. Выявлены значительные скопления крупных вторичных лизосом, сформировавшихся на месте деструктивно измененных электронноплотных митохондрий, и фрагментов гранулярного эндоплазматического ретикулума. В цитоплазме гепатоцитов обнаружены липидные включения, заполнившие большую часть объема цитоплазмы клетки и деформировавшие ядро. В большинстве ядер гепатоцитов имели место участки расслоения и микронадрывы ядерной мембраны, хроматин занимал маргинальное положение.
Клиническая часть исследования проводилась по типу «случай – контроль». 170 женщин были разделены на три группы (рис. 1).
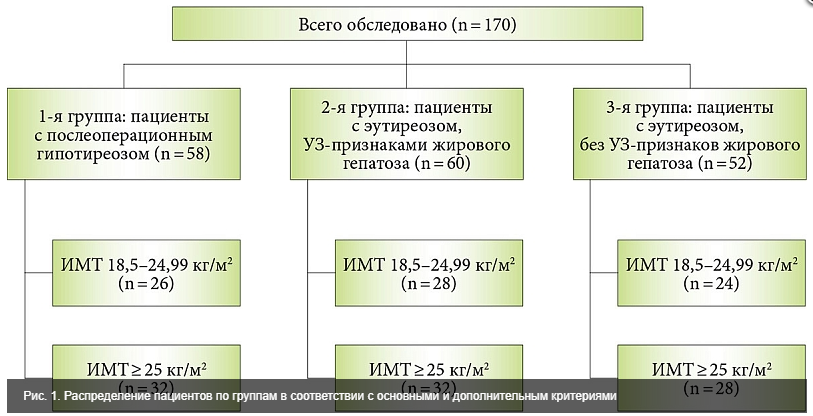
Критерии включения в основную (первую) группу:
- женский пол (средний возраст – 51,67 ± 11,26 года, Ме – 52 года);
- наличие сформировавшегося в результате хирургического вмешательства (частичное или полное удаление щитовидной железы) гипотиреоза, требующего заместительной терапии левотироксином.
Критерии включения в группу сравнения (вторая группа):
- женский пол (средний возраст – 50,22 ± 10,46 года, Ме – 49 лет);
- сонографические признаки жирового гепатоза;
- отсутствие структурных и функциональных нарушений щитовидной железы (эутиреоз).
Критерии включения в контрольную (третью) группу:
- женский пол (средний возраст – 49,45 ± 9,14 года, Ме – 50 лет);
- отсутствие сонографических признаков жирового гепатоза, структурных и функциональных нарушений щитовидной железы (эутиреоз).
Жировой гепатоз диагностировали при выявлении стандартных сонографических признаков, по данным ультразвукового (УЗ) исследования органов брюшной полости. Его результаты служили также критерием формирования пар больных с целью их отбора в группы сравнения и контроля.
У 50 (86,2%) из 58 пациенток первой группы выявлены УЗ-признаки жирового гепатоза. При этом 8 пациенток без сонографических признаков стеатоза печени имели нормальную массу тела (средний индекс массы тела (ИМТ) – 22,04 кг/м2).
Критерии исключения из исследования для всех групп пациенток были однотипными:
- употребление гепатотоксичных доз алкоголя (более 20 г чистого алкоголя в сутки) (EASL-EASD-EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver disease, 2016);
- возраст старше 70 лет;
- тяжелая сопутствующая патология;
- сахарный диабет;
- положительные маркеры вирусных гепатитов В и С или указания в анамнезе на перенесенные ранее вирусные гепатиты В и С;
- прием лекарственных препаратов с известным гепатотоксичным действием;
- диффузные заболевания печени другой этиологии.
Из-за малочисленности пациенток с ожирением 1-й и 2-й степени они были отнесены к группе обследованных с избыточной массой тела, поэтому для формирования подгрупп использовались следующие градации. Нормальной массе тела соответствовал диапазон ИМТ по Кетле от 18,5 до 24,99 кг/м2; условно избыточной массой тела считали ИМТ ≥ 25,0 кг/м2.
Всем пациенткам выполнено антропометрическое исследование: измерение роста, веса, окружности талии, бедер, шеи. На основании антропометрических показателей были рассчитаны ИМТ по Кетле, индекс «талия/рост», индекс «талия/бедра», содержание жира в организме. Комплексное лабораторное обследование включало определение сывороточных показателей крови – уровней общего холестерина, холестерина липопротеинов высокой плотности (ЛПВП), холестерина липопротеинов низкой плотности (ЛПНП), липопротеинов очень низкой плотности (ЛПОНП), триглицеридов, аполипопротеина А1 (АпоА1), аполипопротеина В (АпоB), общего белка, альбумина, аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), общего билирубина, непрямого билирубина, прямого билирубина, щелочной фосфатазы, гамма-глутамилтрансферазы, лактатдегидрогеназы, глюкозы, гликированного гемоглобина (HbA1c), инсулина.
Статистическая обработка проводилась с помощью программы SPSS Statistics (v. 22). Использованы параметрические критерии – t-критерий Стьюдента, коэффициент корреляции Пирсона. Для сравнения трех и более выборок применяли непараметрический критерий Краскела – Уоллиса, для попарного сравнения групп – критерий Манна – Уитни. Критический уровень значимости при проверке статистических гипотез (p) составил < 0,05. Силу связи количественных показателей оценивали с помощью корреляционного анализа с расчетом коэффициента корреляции Пирсона (r) при использовании статистической методики Бутстреп. Связь между признаками считалась высокой при r ≥ 0,7, средней − при r = 0,5–0,7, умеренной – при r = 0,3–0,49, слабой – при r ≤ 0,29.
Результаты клинического исследования
При изучении особенностей формирования первичного гипертиреоза (ПГ) у пациенток первой группы установлено, что показаниями к оперативному вмешательству на щитовидной железе были многоузловой коллоидный зоб – 28 (48,3%) случаев, узловой коллоидный зоб – 17 (29,3%), аденома щитовидной железы – 12 (20,7%) случаев. По объему выполненных операций преобладала субтотальная резекция обеих долей щитовидной железы (32 (55,2%) пациентки), реже − гемитиреоидэктомия (19 (32,7%)) и тиреоидэктомия (7 (12,1%) случаев). Большинство больных (38 (65,5%)) было прооперировано в течение последних пяти лет, 10 (17,2%) пациенток – в срок от пяти до десяти лет, 7 (12,1%) – от десяти до 15 лет, 3 (5,2%) пациентки – от 15 до 20 лет.
Все пациентки получали заместительную терапию левотироксином в индивидуально подобранной эндокринологом дозе. При этом тиреоидный статус, оцененный по уровням ТТГ (в среднем по группе – 2,61 ± 0,85 мЕд/л) и Т4св. (12,74 ± 6,42 пмоль/л), на момент проведения исследования соответствовал эутиреозу у 51 (87,9%) больной. В 6 (10,4%) случаях выявлен субклинический гипотиреоз, в одном (1,7%) – клинически выраженный гипотиреоз.
Сравнительный анализ антропометрических параметров в трех группах продемонстрировал ряд существенных отличий, определяемых ИМТ. Для пациенток с ИМТ ≥ 25 кг/м2 было характерно дисгармоничное телосложение со значительным увеличением окружности талии по отношению к росту, высокое процентное содержание жира в организме. У большинства пациенток первой и второй групп тип жирораспределения соответствовал промежуточному, у пациенток третьей группы − гиноидному. При этом у четырех женщин первой группы выявлен андроидный тип жирораспределения (табл. 2).
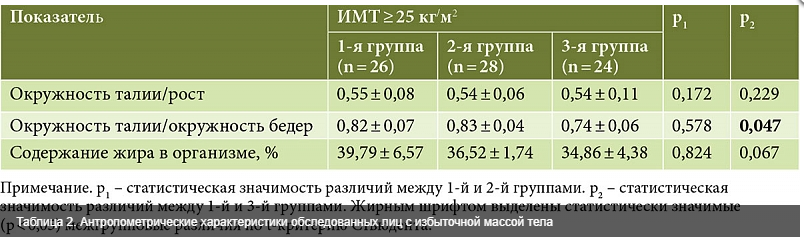
По антропометрическим характеристикам женщины с ИМТ ≤ 24,99 кг/м2 во всех трех группах значимо не различались между собой (p > 0,05), пациентки имели правильное соотношение окружности талии к росту, умеренное развитие подкожной жировой клетчатки, нормальное содержание жира и гиноидный тип его распределения.
При оценке биохимических показателей крови, характеризующих углеводный, липидный и белковый метаболизм, выявлены существенные различия в сравниваемых группах, ассоциированные с ИМТ. Так, у женщин первой группы с ИМТ ≥ 25 кг/м2 по сравнению с пациентками второй и третьей групп были значимо выше индекс инсулинорезистентности НОМО-IR, уровни общего холестерина, ЛПНП, ЛПОНП, АпоВ, коэффициента атерогенности и индекса АпоВ/АпоА1. Уровень ЛПВП было значимо ниже в первой группе, различий показателей белкового обмена в группах больных не выявлено (табл. 3).

У пациенток с ПГ и ИМТ ≤ 24,99 кг/м2 уровни ЛПОНП и АпоВ были значимо выше, чем у пациенток второй и третьей групп: 0,43 ± 0,19, 0,37 ± 0,09, 0,33 ± 0,11 ммоль/л (p = 0,047) и 104,00 ± 42,59, 96,78 ± 39,48, 86,29 ± 14,09 мг/дл (p = 0,027) соответственно. Индекс АпоВ/АпоА1 у лиц с нормальной массой тела находился в пределах референсных значений, однако его показатели в первой группе были значимо выше, чем во второй и третьей (0,59 ± 0,06, 0,57 ± 0,13, 0,52 ± 0,09; p = 0,047).
Оценка биохимических параметров крови, характеризующих функциональное состояние печени, у пациенток как с избыточной, так и с нормальной массой тела не выявила существенных отклонений от референсных значений. Средние показатели сывороточных аминотрансфераз в группах лиц с избыточной массой тела оставались в пределах нормальных значений, однако в первой группе они были значимо выше, чем во второй и третьей (АСТ – 22,94 ± 7,62, 21,39 ± 5,35 и 17,07 ± 4,83 ЕД/л соответственно; p = 0,053; АЛТ – 20,37 ± 7,21, 19,43 ± 8,65 и 17,96 ± 5,02 ЕД/л соответственно; p = 0,021).
У пациенток с нормальной массой тела значимые различия выявлены лишь по показателю АЛТ с его минимальным значением в первой группе (14,68 ± 7,76, 25,00 ± 9,90, 19,71 ± 9,66 ЕД/л соответственно; p = 0,046). При расчете коэффициента де Ритиса (АCТ/АЛТ) значимые различия установлены только в подгруппах лиц с избыточной массой тела (1,11 ± 0,28, 1,18 ± 0,13, 0,96 ± 0,15 соответственно; p = 0,041).
С целью выявления взаимосвязи между нарушениями углеводного и липидного метаболизма и функциональными параметрами печени в первой группе выполнен парный корреляционный анализ. Он показал прямые и обратные связи средней и слабой силы преимущественно между липидными индексами (коэффициент атерогенности, коэффициент АпоВ/АпоА1) и уровнем сывороточных аминотрансфераз (рис. 2 и 3), коэффициентом де Ритиса и индексом НОМО-IR, характеризующим инсулинорезистентность.
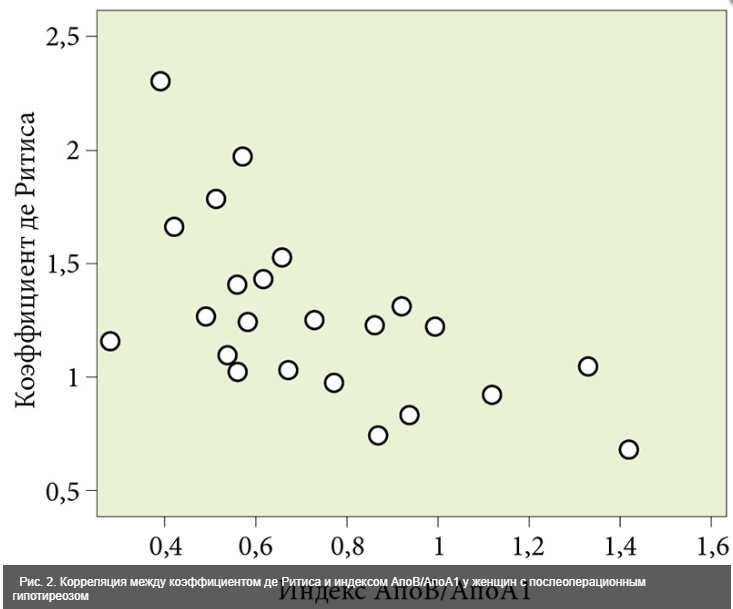
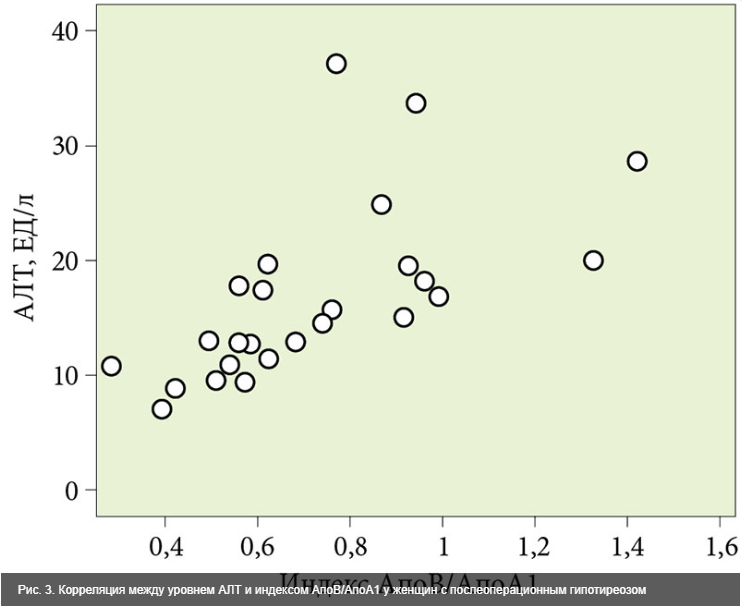
Средней силы парная корреляционная связь выявлена между следующими показателями: индекс АпоВ/Апо1 и коэффициент де Ритиса (r = -0,579; p = 0,002); индекс АпоВ/АпоА1 и уровень сывороточной АЛТ (r = 0,611; p = 0,001); АпоВ и коэффициент де Ритиса (r = -0,509; p = 0,008); коэффициент атерогенности и индекс инсулинорезистентности HOMO-IR (r = 0,578; p = 0,001).
Корреляционная связь слабой силы установлена между следующими показателями: уровень ЛПОНП и коэффициент де Ритиса (r = -0,364; p = 0,034); АпоВ и уровень сывороточной АЛТ (r = 0,465; p = 0,017); уровень ЛПОНП и АЛТ (r = 0,377; p = 0,028). Во второй и третьей группах указанные парные корреляции характеризовались очень слабой силой связи или являлись незначимыми.
Обсуждение
Полученные в эксперименте данные показали развитие дистрофических процессов в печени при «выключении» тиреоидной функции щитовидной железы у лабораторных животных. Типичные морфологические признаки НАЖБП, воспроизведенные в эксперименте с тотальной тиреоидэктомией, – жировая дистрофия и гидропическая дистрофия и ее частный вариант – баллонная дистрофия. Причем оба признака отчетливо выявлялись в эксперименте уже на раннем сроке наблюдения (28-й день). Обращает на себя внимание тот факт, что одной из стадий НАЖБП является неалкогольный стеатогепатит, однако в эксперименте выявлены минимальные признаки воспаления без существенного прогрессирования по мере увеличения продолжительности наблюдения. При этом у лабораторных животных с увеличением срока послеоперационного гипотиреоза наблюдалось развитие фиброза преимущественно перивенулярно.
Характер дистрофических процессов, минимальная степень выраженности гепатита, преимущественная локализация фиброзных изменений печени, обнаружение признаков отека ткани позволили предположить преимущественно ишемический генез поражения. Морфологическая картина печени при экспериментальном послеоперационном гипотиреозе не в полной мере соответствовала таковой при «классическом» варианте НАЖБП, ассоциированном с МС.
Данные, полученные с помощью электронной микроскопии, подтвердили и дополнили результаты светооптической микроскопии. Об ишемическом генезе патологических процессов в печени прежде всего свидетельствовали изменения в митохондриях в виде их набухания, уменьшения количества крист, а на более поздних сроках эксперимента – деструкции органелл с развитием митохондриальной недостаточности. Ультраструктурной основой белковой и жировой дистрофии служили отчетливо выявляемые признаки перегрузки (стресса) эндоплазматического ретикулума.
С учетом того что взаимоотношения в функциональной системе «печень – щитовидная железа» считаются эволюционно устоявшимися без существенных различий у млекопитающих, результаты, полученные в эксперименте на лабораторных животных, могут быть с высокой степенью доказательности экстраполированы на человека.
В клинической части исследования удалось показать высокую частоту формирования (86,2%) НАЖБП у пациенток, которым выполнена субтотальная/тотальная резекция щитовидной железы с последующей заместительной терапией левотироксином. В разные сроки после формирования ПГ у них развились метаболические расстройства с преимущественным нарушением углеводного и липидного метаболизма, более выраженные у лиц с избыточной массой тела, ассоциированной с промежуточным или андроидным типом жирораспределения. В этом случае инсулинорезистентность значимо коррелировала с атерогенной дислипидемией. У пациенток с гипотиреозом отмечалось наличие стойких корреляционных связей показателей метаболизма и функциональных печеночных проб. Установленные закономерности подтверждены многократным сравнением при подборе пар с сопоставимыми по возрасту (в исследование были включены только женщины) пациентками с НАЖБП, но без признаков гипотиреоза, с одной стороны, и пациентками как без НАЖБП, так и без гипотиреоза – с другой. Выявленные в клинической части исследования метаболические нарушения у женщин с первичным (послеоперационным) гипотиреозом согласуются с результатами эксперимента на животных.
Заключение
Полученные данные позволяют считать первичный (послеоперационный) гипотиреоз независимым этиопатогенетическим фактором развития НАЖБП с характерными клиническими и морфологическими особенностями.
Источник: Журнал “Эффективная фармакотерапия”. 2019.Том 15. № 36. Гастроэнтерология
