Резюме
Повышенная масса тела и ожирение негативно влияют на репродуктивное здоровье, наступление беременности и ее вынашивание. Висцеральное ожирение и инсулинорезистентность являются предикторами целого ряда злокачественных процессов у гинекологических пациенток. Разработка программ, выбор оптимального обследования и лечения невынашивания беременности направлены на коррекцию не только репродуктивных нарушений, но и на повышение качества жизни.
Как известно, индекс массы тела (ИМТ) наряду с окружностью талии (ОТ), окружностью бедер (ОБ) и их соотношением ОТ/ОБ широко используется для диагностики ожирения, особенно висцерального. Нормальным считается ИМТ от 18,5 до 24,9 кг/м2; ИМТ от 25,0 до 29,9 кг/м2 говорит об избыточной массе тела, а ИМТ ≥30,0 кг/м2 – об ожирении [1-4]. Развитие инсулинорезистентности (ИР) на фоне повышенного веса ведет к развитию целого ряда заболеваний, в том числе к сахарному диабету 2 типа. Оно напрямую ассоциировано с гиперандрогенемией, а также с синдромом поликистозных яичников (СПЯ) и бесплодием [5, 6]. Вызываемые ожирением нарушения способствуют повреждению ооцитов и отрицательно воздействуют на рецепторный аппарат эндометрия [6, 7]. Повышенный ИМТ ведет к увеличению частоты невынашивания беременности, бесплодию, что чаще всего ассоциируется с гиперинсулинемией и ИР, которая развивается самостоятельно или на фоне СПЯ, а также с нарушением цитокинового профиля [6, 9-13].
Цель – изучить соматометрический статус и его влияние на репродуктивное здоровье, гормональный гомеостаз, углеводный обмен у пациенток с неразвивающейся беременностью в анамнезе, имеющих повышенную массу тела или ожирение, для создания модели прогнозирования самоаборта.
Материал и методы
В исследовании приняли участие 97 пациенток с неразвивающейся беременностью в анамнезе. В зависимости от ИМТ, полученного путем расчета по формуле Кетле [m (кг)/И2 (м2)], все пациентки были разделены на 3 группы: 1-ю группу составили 34 (35,05%) пациентки с ИМТ от 19,0 до 24,9 кг/м2 (нормальный вес); 2-ю группу – 32 (32,99%) пациентки с массой тела от 25,0 до 29,9 кг/м2 (повышенная масса тела) и 3-ю группу – 31 (31,96%) пациентки с ИМТ 30,0-34,9 кг/м2 (с ожирением). Группу контроля (4-я группа) составили 25 здоровых пациенток с ИМТ 18,5-24,9 кг/м2. Средний возраст пациенток – 30,24±1,02 года (от 21 до 47 лет). Определяли окружность талии (ОТ) и бедер (ОБ), рассчитывали соотношение ОТ/ОБ. По специально разработанной карте, предложенной для заполнения всем обследуемым после получения информированного согласия, изучали данные анамнеза, состояние репродуктивного здоровья (менструальная функция, перенесенные артифициальные и самопроизвольные аборты, наличие бесплодия, неразвивающихся беременностей, преждевременных родов). Пациентки первых трех групп имели >1 неразвивающейся беременности в анамнезе и в настоящее время проходили прегравидарную подготовку. Уровень гормонов у обследуемых определяли на 2-3-й дни менструального цикла с 08:00 до 09:00, натощак в плазме крови иммунофлюоресцентным методом с использованием иммуноферментных тест-систем “Anthos 2020” (Австрия), “Elecsys”. Определяли уровни гонадотропных гормонов: фолликулостимулирующего (ФСГ), лютеинизирующего (ЛГ), пролактина (ПРЛ), эстрадиола (Е2), тестостерона (Т), кортизола, свободного тестостерона (св. Т), 17-ОН-прогестерона (17-ОП), тиреотропного гормона (ТТГ). Содержание глюкозы, гликозилированного гемоглобина, инсулина в сыворотке крови определяли с использованием биохимического анализатора “Cobas Integra”, “Cobas Emira” (Roche, Швейцария). Индекс НОМА (Homeostasis Model Assessment) рассчитывали по формуле: глюкоза натощак (ммоль/л) + инсулин (мкЕд/мл) / 22,5. ИР определяли при показателях индекса НОМА >2,77. Индекс Caro рассчитывали по формуле: глюкоза натощак (ммоль/л) / инсулин (мкЕд/мл). О степени нарушения усвоения глюкозы судили при индексе Caro <0,33.
Статистическую обработку полученных результатов проводили при помощи стандартных программ на персональном компьютере в операционной среде Windows 2000 (пакет программ Мicrosoft Excel).
Результаты
Полученные данные трофологических показателей в группах исследования представлены в табл. 1. Кроме средних показателей со средним отклонением в квадратных скобках даны нижняя и верхние квартили.
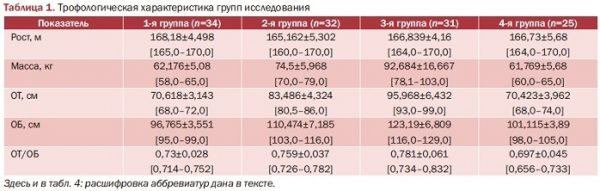
Проведенный анализ продемонстрировал отсутствие разницы между группами в росте (р>0,05), достоверной разницы в весе между пациентками 2-й и 3-й групп (р>0,05), но статистически достоверную разницу в показателях ИМТ между пациентками 1-й, 2-й и 3-й групп (р<0,00000).
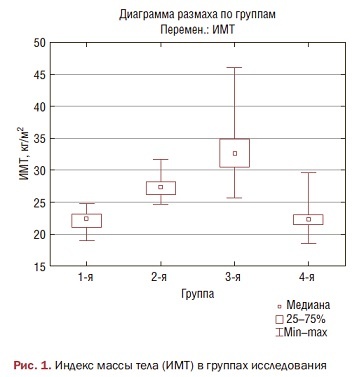
Анализ показателей ОТ по группам продемонстрировал статистически достоверную разницу между пациентками 1-й, 2-й и 3-й групп (р<0,01), как и в размерах ОБ (р<0,01), что отражено на рис. 2.
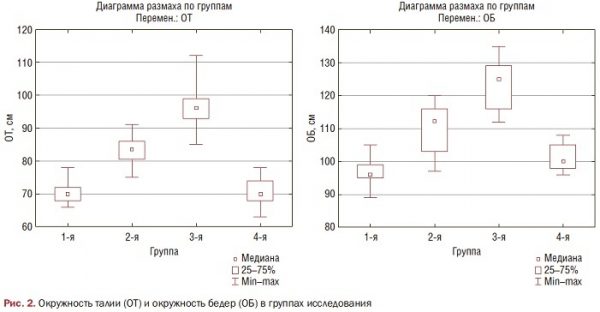
А вот между показателями ОТ/ОБ выявлена достоверная разница только между 1-3-й и 2-4-й группами (р<0,001), что графически отражено на рис. 3.
Оценка менструальной функции продемонстрировала зависимость показателей длительности менструации от веса только между пациентками с ожирением (3-я группа) и здоровыми (4-я группа) (р<0,05) (табл. 2).
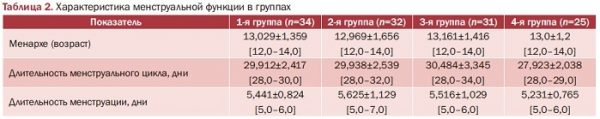
Репродуктивный анамнез продемонстрировал следующие тенденции (табл. 3): по количеству беременностей между группами разницы не выявлено. Имеется достоверная разница между здоровыми и группами исследования в количестве родов (р<0,0000), которых в 4-й группе было больше, и в количестве самопроизвольных абортов, которых в 4-й группе не было (р<0,00000) (табл. 3).
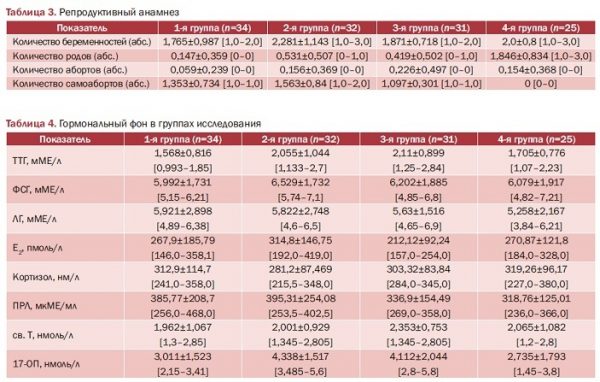
Проведен анализ гормонального фона в группах исследования (табл. 4).
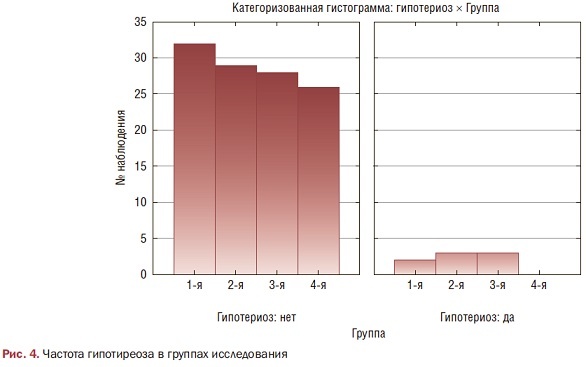
Выявлена достоверная разница в показателях ТТГ между пациентками с самопроизвольными абортами в анамнезе, имеющими нормальный вес, и с ожирением (р<0,05), между 1-й и 2-й группами (р=0,2). При этом гипотиреоз в анамнезе был у пациенток 1-й, 2-й и 3-й групп (рис. 4), причем и во 2- й, и в 3-й группах в абсолютных цифрах показатели были идентичны.
Также у пациенток с избыточным весом (2-я группа) и с ожирением (3-я группа) достоверно отличался уровень Е2 (р<0,01). Статистически достоверная разница выявлена между здоровыми и пациентками с избыточным весом и ожирением и по уровню 17-ОП (р<0,01). Связь между повышенным весом, ожирением и увеличением уровня андрогенов описана давно [14]. Анализ гормонального фона показал высокие результаты уровня ФСГ во всех группах. P. Liu и соавт. (2017) предоставили доказательства того, что ФСГ влияет на термогенез и ожирение в эксперименте на мышах. Лечение антителами ФСГ приводило к значительному снижению жировой массы у самок и самцов мышей, что подтверждено результатами количественной магнитно-резонансной томографии, без изменения общей массы тела. Предполагают, что именно ФСГ модулирует формирование жира сам по себе, а не посредством эстрадиола, но эти вопросы в настоящее время окончательно не решены [15]. При этом необходимо отметить, что особой связи с изменением уровня гормонов, за исключением андрогенов, между массой тела и их уровнем не выявлено, это отмечают и другие авторы [16].
В конце ХХ столетия было высказано предположение о том, что есть связь между уровнями инсулина и андрогенов [17], которая через формирование висцерального ожирения, ИР, дислипидемии и др. трансформируется в развитие репродуктивных нарушений, а в периоде ожидания менопаузы и в постменопаузе при развитии гиперпластических процессов эндометрия, аденокарциномы эндометрия. Показатели углеводного обмена групп исследования представлены в табл. 5.
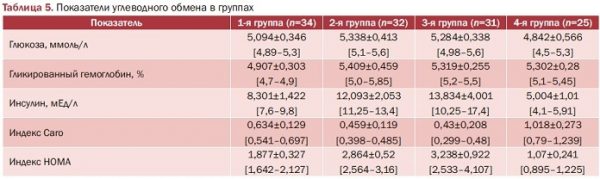
Имеется статистически достоверная разница в показателях гликированного гемоглобина между пациентками с нормальным весом и повышенным, а также между пациентками с нормальным весом и ожирением (р<0,000). Уровень глюкозы достоверно отличен между здоровыми и пациентками с повышенной массой (р<0,001) и с ожирением (р=0,02). Обращает на себя внимание статистически достоверная разница в уровне инсулина между здоровыми пациентками, с нормальным весом и пациентками с повышенным весом (р<0,0000) и ожирением (р<0,0000) (рис. 5).
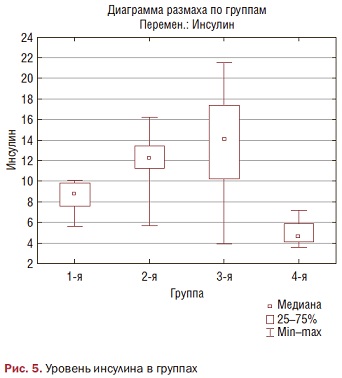
Та же тенденция выявлена и в величине индексов НОМА и Caro (р<0,0000).
Проведенный корреляционный анализ показал, что имеется взаимосвязь между возможным самопроизвольным прерыванием беременности и ИМТ (R=0,448), соотношением ОТ/ОБ (R=0,43), длительностью менструального цикла (R=0,314), уровнями 17-ОП (R=0,282), глюкозы (R=0,284), инсулина (R=0,667), индексов НОМА (R=0,68) и Caro (R=-0,642). Выявленные корреляционные связи легли в основу создания математической модели “Прогнозирование возможности самопроизвольного аборта нейронными сетями” (№ 2018612214, 24 апреля 2018 г.).
Заключение
Внедрение математической модели способствует правильному выбору алгоритма обследования и лечения пациенток с невынашиванием на фоне излишнего веса и ожирения, что способствует повышению качества жизни и предотвращает возникновение злокачественных процессов репродуктивных органов.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Литература
1. Морбидное ожирение / под ред. И.И. Дедова. М. : МИА, 2014. 605 с.
2. Ковалева Ю.В. Роль ожирения в развитии нарушений менструальной и репродуктивной функции // Рос. вестн. акуш.-гин. 2014. Т. 14, № 2. С. 43-51.
3. American College of Obstetricians and Gynecologists. ACOG Committee opinion No. 549: obesity in pregnancy // Obstet. Gynecol. 2013. Vol. 121. Р. 213.
4. Rittenberg V., Seshadri S., Sunkara S.K. et al. Effect of body mass index on IVF treatment outcome: an updated systematic review and metaanalysis // Reprod. Biomed. Online. 2011. Vol. 23. P. 421.
5. Owens L.A., O’Sullivan E.P., Kirwan B. et al. ATLANTIC DIP: the impact of obesity on pregnancy outcome in glucose-tolerant women // Diabetes Care. 2010. Vol. 33. Р. 577.
6. Подзолкова Н.М., Колода Ю.А., Подзолков А.В. Терапия бесплодия у пациенток с ожирением: современный взгляд на проблему // Пробл. репродукции. 2012. № 3. С. 37-41.
7. Marshall N.E., Guild C., Cheng Y.W. et al. Maternal superobesity and perinatal outcomes // Am. J. Obstet. Gynecol. 2012. Vol. 206. P. 417.
8. Reynolds R.M., Allan K.M., Raja E.A. et al. Maternal obesity during pregnancy and premature mortality from cardiovascular event in adult offspring: follow-up of 1 323 275 person years // BMJ. 2013. Vol. 347. Article ID 4539.
9. van der Steeg J.W., Steures P., Eijkemans M.J. et al. Obesity affects spontaneous pregnancy chances in subfertile, ovulatory women // Hum. Reprod. 2008. Vol. 23. P. 324.
10. Kort J.D., Winget C., Kim S.H., Lathi R.B. A retrospective cohort study to evaluate the impact of meaningful weight loss on fertility outcomes in an overweight population with infertility // Fertil. Steril. 2014. Vol. 101. P. 1400.
11. Garvey W.T., Garber A.J., Mechanick J.I. et al., on Behalf of the AACE Obesity Scientific Committee, American Association of Clinical Endocrinologists and American College of Endocrinology. Consensus conference on obesity: building an evidence base for comprehensive action // Endocr. Pract. 2014. Vol. 20, N 9. P. 956-976.
12. Карахалис Л.Ю., Могилина М.Н. Влияние повышенной массы тела и ожирения на частоту гинекологической патологии, течение родов, послеродовый период и состояние новорожденных // Гинекология. 2016. Т. 18, № 6. С. 67-70.
13. Колесникова Е.В., Нестерова И.В., Колесникова Н.В., Чудилова ГА и др. Цитокиновый профиль крови беременных с различными вариантами течения хронической фетоплацентарной недостаточности и их новорожденных // Рос. иммунол. журн. 2014. Т. 8, № 1. С. 61-66.
14. Дедов И.И., Андреева Е.Н., Пищулин А.А., Карпова Е.А. Синдром гиперандрогении у женщин. Патогенез, клинические формы, дифференциальная диагностика и лечение : методическое пособие для врачей. М. : РАМН, 2003. 111 с.
15. Liu P., Ji Y., Yuen T. et al. Blocking FSH induces thermogenic adipose tissue and reduces body fat // Nature. 2017. Vol. 546. P. 107-112.
16. Озолиня Л.А., Лапина И.А., Болдина Е.Б. Ожирение и его роль в развитии гинекологической патологии // Вестн. РГМУ. 2011. № 2. С. 30-33.
17. Пищулин А.А., Карпова Е.А. Овариальная гиперандрогения и метаболический синдром // РМЖ. 2001. № 9. С. 93-98.
