The gut microbiota as an environmental factor that regulates fat storage
Резюме
Введение
В настоящее время в мире более 500 миллионов взрослых людей имеют избыточный вес [индекс массы тела (ИМТ) 25,0-29,9 кг/м2] и 250 миллионов страдают ожирением (ИМТ ≥ 30 кг/м2) (1). Эта растущая эпидемия угрожает как промышленно развитым, так и развивающимся странам и сопровождается во всем мире увеличением числа заболеваний, связанных с ожирением, включая диабет II типа, гипертонию, сердечно-сосудистую патологию и неалкогольную жировую болезнь печени. В Соединенных Штатах 64% взрослых имеют избыточный вес или ожирение (2), что расценивается как самая важная проблема общественного здравоохранения нашего времени (3). Большинство людей не в состоянии изменить свой образ жизни, необходимый для контроля веса (4). Поэтому разработка продуктов питания или определение новых терапевтических целей, которые приводят к некогнитивному сокращению калорийности пищи, снижению усвоения или хранения энергии, имеет большое значение для общественного здравоохранения.
Кишечник человека содержит огромное количество микроорганизмов, известных как микробиота. Это сообщество состоит по крайней мере из 1013 видов, в котором преобладают анаэробные бактерии, и включает в себя 500-1000 видов,коллективные геномы которых, по оценкам, содержат в 100 раз больше генов, чем наш собственный геном человека (5, 6). Микробиоту можно рассматривать как метаболический “орган”, тонко настроенный на нашу физиологию, выполняющий функции, которые нам не пришлось развивать самостоятельно. Эти функции включают способность обрабатывать неперевариваемые компоненты нашего рациона, такие как растительные полисахариды. Определение сигнальных путей хозяина, регулируемых микробиотой, дает возможность определить новые терапевтические цели для укрепления здоровья. В настоящем исследовании мы используем нормальных и генно-инженерных гнотобиотических мышей для решения гипотезы о том, как микробиота действует через интегрированный сигнальный путь хозяина для регулирования накопления энергии в организме.
Материалы и методы
Животные. В исследовании использовались мыши C57BL/ 6J (B6) WT и rag1 – / – , B6 peroxisome proliferator-activator receptor-α (Ppara)-/- , Fasting-induced adipocyte factor (Fiaf) +/- heterozygotes on a mixed B6:129/Sv. Генотипирование животных осуществлялось с использованием протоколов ПЦР, изложенных в вспомогательных материалах и методах, которые публикуются в качестве вспомогательной информации на веб-сайте PNAS.
Gem-free (GF) мыши содержались с гнобиотических изоляторах в строгих условиях световых 12-часов циклах и питались автоклавированной едой. Все манипуляции с мышами проводились с использованием протоколов, одобренных комитетом по изучению животных Вашингтонского университета.
Животные популяции CONV-R содержались в клетках-микроизоляторах в определенном свободном от патогенов состоянии в барьерном помещении на автоклавной диете. Они были переданы гнотобиологический изоляторы в 2-недельном возрасте, прежде чем они были убиты в 8-10-недельном возрасте. От них была получена микробиота, которая впоследствии была введена мышах популяции GF.
В 8- 10-недельном возрасте мышам GF перорально было введено 109 бактероидов thetaiotaomicron strain VPI-5482. Плотность колонизации в дистальном отделе кишечника, слепой кишки и толстой кишки колебалась от 108 до 1011 колониеобразующих единиц/мл люминального содержимого, что определялось культивированием образцов люминального содержимого на кровяном агаре BHI в течение 2-3 дней при 37°C в анаэробных условиях.
Измерение общего содержания жира в организме и скорости метаболизма (потребление кислорода)
Общее содержание жира в организме определяли через 5 мин после обезболивания мышей i.p. инъекции кетамина (10 мг/кг массы тела) и ксилазина (10 мг/кг). Описан протокол, используемый для двухэнергетической рентгеновской абсорбциометрии (Lunar PIXImus Mouse, GE Medical Systems, Waukesha, WI) (9).
Потребление кислорода определялось у мышей, находящихся в сознании, в индивидуальной клетке, в сытом состоянии с помощью непрямой калориметрии с разомкнутым контуром (однокамерная система Oxymax для мелких животных, Columbus Instruments, Columbus, OH). Животным давали возможность адаптироваться в метаболической камере в течение 20 мин до измерения VO2 каждые 30 С в течение 1 ч.
Анализ липопротеиновой липазы (ЛПЛ)
Активность ЛПЛ в эпидидимальных жировых подушечках определяли согласно ref. 11. Дополнительные сведения см. В разделе вспомогательные материалы и методы.
Статистическая обработка результатов
Статистически значимых различий определяли с помощью T-теста Стьюдента. Сравнение между более чем двумя группами мышей проводилось с помощью одностороннего ANOVA с последующим тестом множественного сравнения Tukey’s post hoc.
Результаты и обсуждение
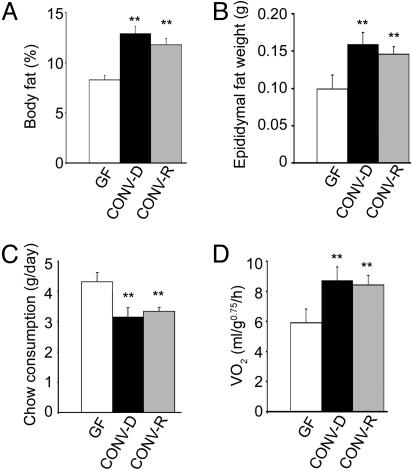 Введение микробиоты кишечника во взрослых мышей GF приводит к быстрому увеличению содержания жира в организме, несмотря на снижение потребления пищи. Сравнение 8-и 10-недельных мышей мужского пола B6, выращенных в отсутствие каких-либо микроорганизмов (GF), с мышами, у которых была микробиота, начиная с рождения (CONV-R), показало, что животные CONV-R содержат на 42% больше общего жира в организме, как определено двойной энергетической рентгеновской абсорбциометрией (рис. 1А). Вес эпидидимальной жировой ткани также был значительно больше (47%; рис. 1B). Более высокий уровень жировых отложений, наблюдаемый у животных CONV-R, обращает на себя особое внимание, учитывая, что их ежедневное потребление стандартного рациона питания грызунов (57% углеводов, 5% жиров) было на 29% меньше, чем у их аналогов GF (рис. 1С).
Введение микробиоты кишечника во взрослых мышей GF приводит к быстрому увеличению содержания жира в организме, несмотря на снижение потребления пищи. Сравнение 8-и 10-недельных мышей мужского пола B6, выращенных в отсутствие каких-либо микроорганизмов (GF), с мышами, у которых была микробиота, начиная с рождения (CONV-R), показало, что животные CONV-R содержат на 42% больше общего жира в организме, как определено двойной энергетической рентгеновской абсорбциометрией (рис. 1А). Вес эпидидимальной жировой ткани также был значительно больше (47%; рис. 1B). Более высокий уровень жировых отложений, наблюдаемый у животных CONV-R, обращает на себя особое внимание, учитывая, что их ежедневное потребление стандартного рациона питания грызунов (57% углеводов, 5% жиров) было на 29% меньше, чем у их аналогов GF (рис. 1С).
Рис 1. Фенотипирование ГНОТОБИОТИЧЕСКИХ мышей. Три группы от 8 – до 10-недельного возраста мыши мужского пола В6 [ (1) выросли в GF состоянии, (2) с заселенным микробиотой кишечником с рождения , (3) заселение микробиотой кишечника была произведена во взрослом возрасте, полученной от CONV-R доноров] были проанализированы на общее содержание жира в организме при помощи двухэнергетической рентгеновской абсорбциометрии (Н = 21-25 в группе) (А), эпидидимальной жировой массы (Н = 10-20 в каждой группе) (Б), потребление пищи (среднесуточные значения за 3 д до прекращения эксперимента; n = 10 в группе) (С) и потребление кислорода (определяется калориметрией разомкнутого контура непосредственно перед гибелью животных; n = 10 в группе) (D). Строятся средние значения ± SEM. ** , P < 0,01 по сравнению с GF.
14-дневная колонизация 8-10-недельных реципиентов GF B6 мужского пола с нефракционированной микробиотой, собранной из дистальных отделов кишечника взрослых доноров CONV-R, процесс, известный как конвенционализация, привел к резкому увеличению общего содержания жира в организме на 57% (рис. 1 А) и увеличение массы эпидидимального жира на 61% (рис. 1B). Увеличение жировых отложений было связано с 7% – ным снижением постной массы тела, в результате чего не было существенных различий в общей массе тела между двумя группами [23,5 ± 2,6 г (GF) против 23,4 ± 2,6 г (CONV-D); n = 21; P > 0,05]. Значения триглицеридов сыворотки натощак были аналогичны (P > 0,05) как у мышей GF, так и у мышей CONV-D (данные не показаны).
Аналогичное увеличение общего содержания жира в организме наблюдалось после более короткой 10-дневной конвенционализации (66%; р > 0,05 по сравнению с 14-дневной). Более длительная конвенционализация (28 дней) не привела к дальнейшему увеличению общего содержания жира в организме или веса эпидидимального жира (данные не показаны). Повышенное накопление жира в результате 14-дневной конвенционализации также происходило в условиях снижения потребления жиров (на 27% ниже, чем ГФ; рис. 1С).
Эти эффекты не являются уникальными для особей мужского пола: CONV-D В6 особи женского пола продемонстрировали увеличение общего жира в организме (85%) и снижение мышечной массы тела (9%), что существенно не отличается от их представителей мужского пола (Р > 0,05). Кроме того, фенотип накопления жира не ограничивался инбредным штаммом В6: 14-дневная конвенционализация 8-недельных мышей-самцов, принадлежащих к ИНБРЕДНОМУ штамму NMRI, привела к увеличению общего содержания жира в организме на 90% (P < 0,01 по сравнению с GF) и снижению потребления питания на 31% (P < 0,05).
Сравнение последовательностей на основе 16С рДНК микробиоты, полученной от разных групп мышей, выявило большое сходство между CONV-D донорами и CONV-D В6 рецепиентами (рис. 6 и Таблица 2, которые публикуются в качестве вспомогательной информации на веб-сайте PNAS). Как и у многих людей, бактериоиды и клостридии были наиболее распространенными родами. B. thetaiotaomicron является наиболее распространенным видом человеческой дистальной микробиоты кишечника с исключительной способностью к расщеплению и деградации растительных полисахаридов (12). Например, его протеом содержит 172 гликозилгидролазы, которые, по приблизительной оценке, расщепляют большинство гликозидных связей, встречающихся в полисахаридах рациона человека. Исследования на мышах GF, колонизированных B. thetaiotaomicron, показали, что его активность в обработке полисахаридов связана с индукцией переносчиков моносахаридов хозяина (13). Поэтому мы колонизировали 8-недельных мышей мужского пола GF B6 в течение 2 недель с секвенированным штаммом (VPI-5482), чтобы определить, может ли один сахаролитический бактериальный вид сам по себе влиять на хранение жира хозяина. Колонизация привела к статистически значимому увеличению общего содержания жира в организме, хотя величина этого увеличения была меньше, чем при нефракционированной микробиоте цекаля (23% против 57% соответственно; n = 10 мышей в группе; P < 0,01).
Уровень метаболизма у мышей CONV-D выше, чем у GF. Поскольку увеличение содержания жира в организме, опосредованное микробиотой, не было вызвано увеличением потребления пищи, была проведена непрямая калориметрия с разомкнутым контуром для определения того, отражает ли она более низкие затраты энергии на основной обмен. Это объяснение было исключено, когда мы обнаружили, что у более худых мышей GF скорость метаболизма (VO2) была на 27% ниже, чем у возрастно – и гендерно-сопоставимых (мужских) мышей B6, условно для возраста в 14 дней (P < 0,01; рис. 1D). Мыши CONV-D имели значения VO2, которые существенно не отличались от возрастных и гендерных животных CONV-R (рис. 1D).
Увеличение VO2, наблюдаемое при конвенционализации, может отражать увеличение скорости метаболизма в хозяине и / или метаболической активности их недавно приобретенной микробной флоры. Отсутствуют доступные методы измерения метаболической активности микробиоты in vivo. Однако, микроаналитические биохимические анализы замораживании мышцы gastrocnemius и печени показали значительные увеличения в устоичивых уровнях промежуточных звен цикла трикарбоновой кислоты в CONV-D против животных GF. Несмотря на эти данные о повышении активности цикла, существенных изменений в тканевых запасах высокоэнергетических фосфатов не произошло (n = 5 животных в группе; Таблица 3, которая опубликована в качестве вспомогательной информации на веб-сайте PNAS). Увеличение потребления кислорода без увеличения запасов высокоэнергетических фосфатов подразумевает наличие бесполезных циклов, биохимический коррелят неэффективного метаболизма в хозяине (см. ниже).
Полный текст статьи на сайте ncbi.gov
