РезюмеВ статье представлены результаты исследования гормонально-метаболических показателей и их взаимосвязь у 106 женщин c первичным мaнифecтным гипoтирeoзoм в зависимости от лечения. Выявлено, что снижение чувствительности к инсулину у женщин с впервые выявленным гипотиреозом играет роль в развитии атерогенной дислипидемии. Обнаруженные гипоадипонектинемия, гиперлептинемия у пациенток со сниженной функцией щитовидной железы также влияют на развитие атерогенной дислипидемии, а терапия левотироксином натрия не приводит к нормализации липидного обмена.
В настоящее время отмечается рост патологий щитовидной железы, одной из них является гипотиреоз. Высокая распространенность манифестного и субклинического гипотиреоза в общей популяции [1], ассоциация гипотиреоза с нарушениями липидного обмена и сердечно-сосудистой патологией все чаще обращают на себя внимание как эндокринологов, так и врачей другого профиля. В этой связи изучение адипокиновой регуляции метаболизма при гипотиреозе является крайне актуальным направлением [2-4].
Цель исследования – изучить гормонально-метаболические показатели и их взаимосвязь с адипокинами у женщин с гипотиреозом в зависимости от наличия лечения.
Материал и методы
Обследованы 106 женщин с первичным манифестным гипотиреозом и 20 человек контрольной группы. Среди пациенток с гипотиреозом 93 получали лечение левотироксином натрия и 13 были обследованы до начала терапии. Медиана возраста больных с леченным гипотиреозом составила 58 (53; 63) лет, впервые выявленным – 52 (48; 59,5) года.
Длительность гипотиреоза была 6 (4; 11) лет. Диагноз заболевания ставился в соответствии с классификацией первичного гипотиреоза на основании клинико-лабораторного обследования, проводимого в специализированных эндокринологических отделениях № 1 и № 2 ГБУЗ Самарской области “Самарская городская больница № 6” с 2012 по 2014 г. Контрольная группа, состоящая из практически здоровых женщин, была разделена на 2 подгруппы: младшую контрольную [медиана возраста 21 (20; 22) год] и старшую контрольную [медиана возраста 48 (47; 50) лет]. Младшая контрольная группа позволила исключить атеросклероз. Практически здоровыми считали лиц, которые не предъявляли жалоб, в анамнезе не имели заболеваний внутренних органов, без патологии при осмотре и физикальном обследовании.
Всем обследованным проводили антропометрические исследования: определяли рост, массу тела, окружность талии (ОТ), окружность бедер (ОБ), с последующим расчетом соотношения ОТ/ОБ и индекса массы тела (ИМТ) по формуле (ВОЗ, 1997):
ИМТ = масса тела (кг)/рост (м2).
Степень ожирения оценивали по классификации ВОЗ (1997): при значении ИМТ 25-29,9 кг/м2 диагностировали избыточную массу тела, 30-34,9 кг/м2 – I степень ожирения, 35-39,9 кг/м2 – II степень, 40 кг/м2 и более – III степень. Тип ожирения определяли по соотношению ОТ/ОБ: глютеофеморальный тип у женщин диагностировали при ОТ/ОБ менее 0,85, абдоминальный – при ОТ/ОБ 0,85 и более.
У лиц с леченым гипотиреозом уровень тиреотропного гормона (ТТГ) составил 1,58 (0,74; 3,24) мМЕ/л, Т4св. – 13,43 (11,48; 15,53) пмоль/л. Доза левотироксина натрия у обследованных составила 62,5 (31,25; 93,75) мкг.
Концентрация ТТГ у пациенток с впервые выявленным гипотиреозом была 10,31 (7,91; 26,49) мМЕ/л, Т4св. – 8,88 (6,71; 9,41) пмоль/л.
У 71 (76%) женщины с леченым гипотиреозом его причиной был хронический аутоиммунный тиреоидит, у 22 (24%) снижение функции щитовидной железы было постоперационным. У обследованных с впервые выявленным заболеванием к гипотиреозу привел хронический аутоиммунный тиреоидит.
Среди сопутствующих заболеваний у обследованных женщин, получавших лечение, у 14 (15%) был гипопаратиреоз, у 22 (24%) – ишемическая болезнь сердца, стенокардия напряжения II, III функционального класса. У 33 (35%) пациенток диагностирована артериальная гипертензия II степени.
У 7 (53,8%) больных с впервые выявленным гипотиреозом до начала лечения диагностированы ишемическая болезнь сердца, стенокардия напряжения II функционального класса; у 4 (30,7%) – артериальная гипертензия II степени.
Диагноз артериальной гипертензии верифицировался в соответствии с рекомендациями Российского медицинского общества по артериальной гипертонии (2016). Диагноз ишемической болезни сердца, стенокардии напряжения ставился кардиологом согласно рекомендациям Европейского общества кардиологов (2013).
Критериями исключения служили болезни крови, сахарный диабет, острые воспалительные заболевания и хронические воспалительные заболевания в стадии обострения, злокачественные новообразования, хроническая почечная и печеночная недостаточность, психические расстройства, наркотическая зависимость, алкоголизм.
Для лабораторных исследований брали венозную кровь натощак после 12-часового голодания. Концентрацию глюкозы крови определяли на биохимическом анализаторе ErbaXL 200 (Чехия) в плазме венозной крови глюкозооксидазным методом. Уровень иммунореактивного инсулина (ИРИ) исследовали на аппарате Architect 1000 (Abbot, США) с помощью метода иммуноферментного анализа. Для оценки инсулинорезистентности вычисляли индекс HOMA-IR (Homeostasis modeL assessment – малая модель оценки гомеостаза для инсулинорезистентности) по формуле:
О наличии инсулинорезистентности свидетельствовало превышение значения индекса HOMA-IR более 2,77 балла.
У пациентов с гипотиреозом изучали параметры жирового обмена спектрофотометрическим методом на биохимическом анализаторе ErbaXL 200 (Чехия). Определяли концентрации общего холестерина (ОХС), триглицеридов (ТГ), холестерина липопротеинов низкой (ХС ЛПНП) и высокой плотности (ХС ЛПВП). На основании полученных результатов рассчитывали коэффициент атерогенности (КА) по формуле:
КА = (ОХ – ЛПВП) / ЛПВП [7].
Повышение КА более 3,0 ассоциируется с риском развития атеросклероза.
В работе также определяли концентрации лептина, резистина, адипонектина на микропланшетном анализаторе Expert plus Asys (Австрия) методом иммуноферментного анализа.
Для статистической обработки полученного материала использовали параметрические и непараметрические методы. С помощью одновыборочного теста нормальности W Шапиро-Уилка сначала проверяли, подчиняется ли выборка нормальному закону распределения. Если полученные в ходе обработки материала данные ему подчинялись, применяли методы параметрического статистического анализа, такие как t-критерий Стьюдента для сравнения количественных характеристик двух групп и метод Пирсона для корреляционного анализа.
В случае, когда закон распределения выборочных данных не соответствовал условиям нормальности, применяли непараметрические методы математической статистики -ранговый корреляционный метод Спирмена, однофакторный непараметрический дисперсионный анализ Краскела-Уоллиса и критерий Манна-Уитни.
Для оценки коэффициента корреляции были использованы следующие критерии: r<0,5 – слабая корреляция; 0,5<r<0,7 – средняя корреляция; r>0,7 – сильная корреляция.
Всю статистическую обработку полученных результатов проводили на компьютере с помощью Microsoft Excel 2010 и пакета программ SPSS 11.5 (SPSSInc., США).
Результаты и обсуждение
Анализ результатов антропометрического обследования (табл. 1) выявил, что распределение жировой ткани у пациентов как с леченым, так и с впервые выявленным гипотиреозом происходило по андроидному типу. При сравнении групп в зависимости от наличия терапии установлено, что ОТ и ОБ у женщин с впервые выявленным заболеванием значимо превышали аналогичные величины у больных, получающих лечение. При этом ИМТ и соотношение ОТ/ОБ различались в группах недостоверно.
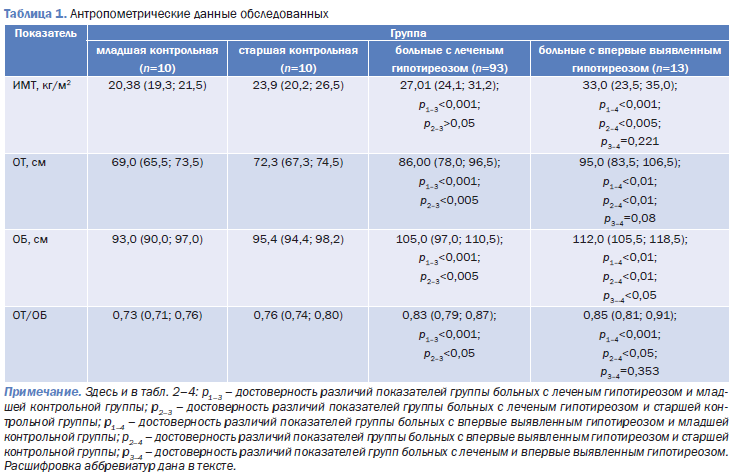
Необходимо также отметить: если при впервые выявленном гипотиреозе ИМТ соответствовал I степени ожирения, то у пациентов, получающих лечение, – избыточной массе тела. Это совпадает с данными, приводимыми В.В. Фадеевым (2005). Автор указывает, что у пациенток с гипофункцией щитовидной железы на фоне монотерапии левотироксином натрия через полгода лечения произошло некоторое уменьшение массы тела.
На фоне андроидного типа распределения жировой ткани у больных гипотиреозом выявлено увеличение индекса инсулинорезистентности относительно и младшей, и старшей контрольных групп (табл. 2). Усиление резистентности к инсулину отмечалось как у пациентов, получающих лечение левотироксином натрия, так и с впервые выявленным заболеванием, при отсутствии достоверных различий (р=0,915) в этих двух группах. Это совпадает с данными литературы – Т.И. Родионова, В.В. Самитин (2007) также выявили усиление инсулинорезистентности у пациентов с гипотиреозом.
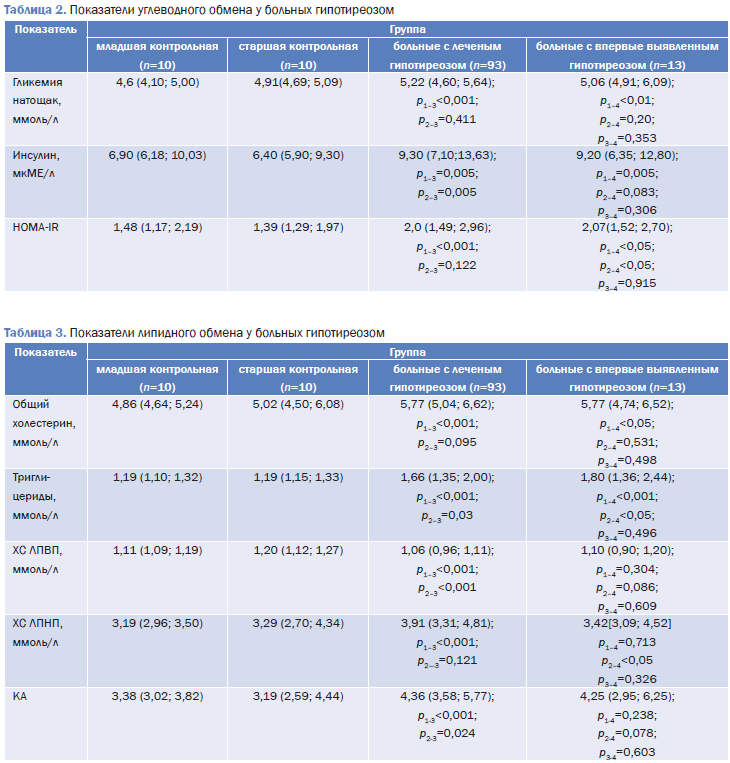
Инсулинорезистентность сопровождалась компенсаторной гиперинсулинемией как у больных, получающих лечение, так и у пациенток с гипотиреозом до начала лечения относительно младшего контроля (р<0,001). Концентрация глюкозы у обследованных была значимо выше аналогичного показателя младшей контрольной группы вне зависимости от наличия лечения. При этом гликемия находилась в границах нормального диапазона. Сравнение групп больных гипотиреозом в зависимости от наличия или отсутствия лечения не выявило существенных отличий.
У всех обследованных с гипотиреозом выявлены положительные корреляции HOMA-IR с ИМТ (r=0,326; p<0,02); глюкозой (r=0,409; p<0,001). В группе женщин с впервые выявленным заболеванием установлены положительные корреляции HOMA-IR с ОТ/ОБ (r=0,658; p=0,028), ОХС (r=0,645; p=0,032), триглицеридами (r=0,700; p=0,036), КА (r=0,645; p=0,032); инсулином (r=0,818; p=0,002); глюкозы и ОТ/ОБ (r=0,708; p=0,015), инсулина с ОХС (г=0,555; p=0,49) и КА (r=0,604; p=0,029), а также отрицательная взаимосвязь HOMA-IR с холестерином ЛПВП (r=-0,638; p=0,035).
Достоверное увеличение индекса инсулинорезистентности по сравнению с контрольной группой, гиперинсулинемия свидетельствуют о снижении чувствительности к инсулину у женщин с впервые выявленным гипотиреозом. Выявленные корреляции индекса инсулинорезистентности с показателями жирового обмена свидетельствуют о ее роли в развитии атерогенной дислипидемии.
Изменения липидного обмена у пациенток с гипотиреозом носили атерогенную направленность (табл. 3). У обследованных, получающих лечение левотироксином натрия, были достоверно повышены уровни ОХС, триглицеридов, ХС ЛПНП, КА и снижен ХС ЛПВП относительно младшей контрольной группы. Подобные изменения выявлены и при сравнении параметров жирового обмена со старшей контрольной группой у этих больных. Значимо выше контрольных величин были уровни триглицеридов, КА на фоне тенденции к повышению ОХС, ХС ЛПНП, при снижении ХС ЛПВП (p<0,001).
Гиперхолестеринемия при гипотиреозе относится к факторам риска сердечно-сосудистой патологии [10], так как приводит к развитию и прогрессированию атеросклероза. А.Р. Волкова, Е.И. Красильникова, С.В. Дора и соавт. (2014) также выявили повышение атерогенных фракций липопротеидов и триглицеридов при гипотиреозе по сравнению с пациентами с нормальной функцией щитовидной железы, что подтверждает существование определенных взаимосвязей функционального состояния щитовидной железы с механизмами развития атеросклероза.
Сравнение показателей жирового обмена в группах пациенток с впервые выявленным гипотиреозом и пациенток, получающих заместительную терапию левотироксином натрия, не выявило существенных различий (р>0,05). Лечение левотироксином натрия не приводит к существенному изменению показателей липидного профиля у пациенток с гипотиреозом.
Исследование адипокинов у женщин с леченым гипотиреозом установило существенное повышение лептина, резистина и снижение адипонектина относительно и старшей, и младшей контрольных групп (табл. 4).
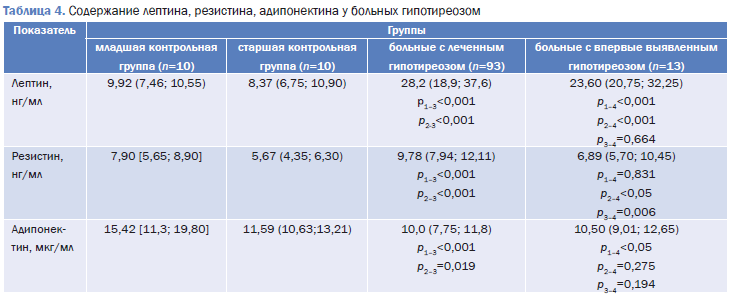
До начала лечения у пациенток со сниженной функцией щитовидной железы изменения содержания этих адипокинов были аналогичны. На фоне достоверно повышенного лептина относительно младшей и старшей контрольных групп уровень адипонектина значимо снижался только при сравнении с младшим контролем. Повышение резистина у пациенток этой группы было статистически значимым только относительно старшей контрольной группы.
Полученные результаты не совпадают с данными, приводимыми в работе Н.А. Петуниной, Н.Э. Альтшулер (2013). Авторы установили, что у женщин с субклиническим гипотиреозом концентрация лептина и резистина практически не отличалась от содержания этих адипокинов в контрольной группе аналогичного возраста и ИМТ, а уровень адипонектина был даже выше контрольных величин [5]. Возможно, что эти различия результатов можно объяснить разной выраженностью гипотиреоза.
Установлено, что лептин стимулирует секрецию липопротеинлипазы [12], увеличивает накопление пенистыми клетками холестерина [13, 14]. Лептин стимулирует миграцию и пролиферацию гладкомышечных клеток, увеличивает продукцию металлопротеазы-2 в сосудах мышечно-эластического типа [13]. В работах J. Beltowski и соавт. (2003), S.I. Yamagishi и соавт. (2001) показано, что под действием лептина увеличивается производство свободных радикалов кислорода в стенке сосудов и усиливается перекисное окисление липидов [15, 16].
У женщин с гипофункцией щитовидной железы на фоне лечения были установлены положительные слабые, но достоверные корреляции лептина с ОХС (r=0,230; p=0,035), триглицеридами (r=0,217; p=0,047), холестерином ЛПНП (r=0,219; p=0,046), КА (r=0,278; p=0,01) и отрицательная корреляция с холестерином ЛПВП (r=-0,383; p=0,006). Это совпадает с данными D.L. Rainwater и соавт. (1997), которые обнаружили обратную зависимость этого адипокина и концентрации холестерина ЛПВП. По-видимому, одной из возможных причин развития атерогенной дислипидемии при гипотиреозе является и повышение лептина у этих больных. Высокий уровень лептина назван в работе R. Wolk, P. Berger, R.J. Lennon и соавт. (2004) прогностически неблагоприятным фактором риска сердечно-сосудистых событий.
Адипонектин у женщин с леченым гипотиреозом отрицательно коррелировал с ОХС (r=-0,624; p=0,001), триглицеридами (r=-0,375; p=0,004), холестерином ЛПНП (r=-0,642; p=0,001), КА (r=-0,603; p=0,001), а положительная взаимосвязь выявлена у этого адипокина с холестерином ЛПВП (r=0,476; p=0,001).
Адипонектин оказывает противовоспалительное, антиатерогенное действие [19], антиапоптотическое действие на эндотелиальные клетки [20], тормозит пролиферацию интимы и гладкомышечных клеток сосудов [21, 22], подавляет воспаление и образование “пенных” клеток из макрофагов [23, 24], препятствует образованию свободных радикалов в культуре клеток эндотелия [25]. Его снижение у пациенток с гипотиреозом, по-видимому, и сопровождается развитием атерогенных изменений в липидном спектре и развитием атерогенной дислипидемии.
Не выявлено никаких взаимосвязей адипонектина, лептина и резистина с тиреоидными гормонами, что согласуется с данными литературы [26, 27].
Выводы
1. У женщин с впервые выявленным гипотиреозом ИМТ соответствовал I степени ожирения, а у пациенток, получающих лечение левотироксином натрия, – избыточной массе тела. Терапия левотироксином сопровождается уменьшением массы тела пациенток с гипотиреозом.
2. На фоне андроидного распределения жировой ткани выявлены усиление инсулинорезистентности и компенсаторная гиперинсулинемия относительно контроля как у пациенток с впервые выявленным гипотиреозом, так и у получающих лечение левотироксином натрия. Снижение чувствительности к инсулину у женщин с впервые выявленным гипотиреозом играет роль в развитии атерогенной дислипидемии.
3. У пациенток с гипотиреозом, как леченым, так и впервые выявленным, установлена атерогенная дислипидемия: гиперхолестеринемия, гипертриглицеридемия, повышение уровня холестерина ЛПНП и снижение холестерина ЛПВП. Терапия левотироксином натрия не приводит к нормализации липидного обмена.
4. У больных с гипотиреозом выявлены гиперлептинемия, гиперрезистинемия, гипоадипонектинемия. Гиперлептинемия и гипоадипонектинемия при сниженной функции щитовидной железы влияют на развитие атерогенной дислипидемии, что подтверждается прямой корреляцией лептина и обратной – адипонектина с атерогенными показателями жирового обмена.
ЛИТЕРАТУРА
1. Аметов А.С. Избранные лекции по эндокринологии. М. : Медицинское информационное агентство, 2012. 544 с.
2. Rodondi N., den Elzen W.P., Bauer D.C. Subclinical hypothyroidism and the risk of coronary heart disease and mortality // JAMA. 2010. Vol. 304, N 12. P. 1365-1374.
3. Петунина Н.А., Трухина Л.В. Гипотиреоз // РМЖ. 2013. Т. 21, № 12. С. 664-666.
4. Килейников Д.В., Орлов Ю.А., Горбачев С.А. и др. Особенности центральной и периферической гемодинамики у больных артериальной гипертензией при первичном гипотиреозе и сахарном диабете 2 типа // Терапевт. 2012. № 5. С. 15-17.
5. Петунина Н.А., Альтшулер Н.Э. Сравнительный анализ уровня адипонектина, лептина, резистина, показателей липидного обмена и инсулинорезистентности при субклиническом гипотиреозе в зависимости от наличия/отсутствия заместительной терапии левотироксином // Эндокринология: новости, мнения, обучение. 2013. № 2. С. 27-31.
6. Fillipsson H., Nystom E., Johansson G. et al. An in vivo study of the direct response of recombinant human THC in serum levels adipocy-tokines // Thyroid. 2007. Vol. 17. P. 45.
7. Климов А.Н. Обмен липидов и липопротеидов и его нарушения : руководство для врачей. СПб. : Питер, 1999. 501 с.
8. Фадеев В.В. Заболевания щитовидной железы в регионе легкого йодного дефицита: эпидемиология, диагностика, лечение. М. : Видар, 2005. 240 с.
9. Родионова Т.И., Самитин В.В. Взаимосвязь инсулинорезистентности и маркеров хронического воспаления при первичном гипотиреозе // Материалы IV Всероссийского тиреодологического конгресса. 2007. С. 142.
10. Балаболкин М.И., Клебанова Е.М., Креминская В.М. Фундаментальная и клиническая тиреоидология. М. : Медицина, 2007. 816 с.
11. Волкова А.Р., Красильникова Е.И., Дора С.В. и др. Тиреоидный статус и выраженность коронарного атеросклероза у больных ишемической болезнью сердца // Вестн. Рос. воен.-мед. акад. 2014. Т. 46, № 2. С. 32-35.
12. Maingrette F., Ranier G. Leptin increases lipoprotein lipase secretion by macrophages: involvement of oxidatize stress and protein kinase C // Diabetes. 2003. Vol. 52. P. 2121-2128.
13. Li L., Mamputu J.C., Wiernsperger N. et al. Signaling pathways involved in human vascular smooth muscle cell proliferation and matrix metalloproteinase-2 expression induced by leptin: inhibitory effect of metformin // Diabetes. 2005. Vol. 54. Р. 2227-2234.
14. O’Rourke L., Gronning L.M., Yeaman S.J., Shepherd P.R., Glucose-dependent regulation of cholesterol ester metabolism in macrophages by insulin and leptin // J. Biol. Chem. 2002. Vol. 277. P. 42 557-42 562.
15. Beltowski J., Wojcicka G., Jamroz A. Leptin decreases plasma paraoxonase 1 (PON1) activity and induces oxidative stress: the possible novel mechanism for proatherogenic effect of chronic hyperleptinemia // Aterosclerosis. 2003. Vol. 170. P. 21-29.
16. Yamauchi T., Kamon J., Waki H. et al. The fat-derived hormone adiponectin reverses insulin resistance associated with both lipoatrophy and obesity // Nat. Med. 2001. Vol. 7. P. 941-946.
17. Rainwater D.L., Comuzzie A.G., Vandeberg J. et al. Serum leptin levels are independently correlated with two measures of HDL // Atherosclerosis. 1997. Vol. 132. P. 237-243.
18. Wolk R., Berger P., Lennon R.J. et al. Plasma leptin and prognosis in patients with established coronary atherosclerosis // J. Am. Coll. Cardiol. 2004. Vol. 44. P. 1819-1824.
19. Рoйтбeрг T.E. Мeтaбoличecкий cиндрoм. М. : МEДпрecc-инфoрм, 2007. 224 c.
20. Hopkins T.A., Ouchi N, Shibata R. et al. Adiponectin actions in the cardiovascular system // Cardiovasc. Res. 2007. Vol. 74. P. 11-18.
21. Matsuda M., Shinromura J., Sata M. et al Role of adiponectin in preventing vascular stenosis. The missing link of adipo-vascular axiss // J. Biol. Chem. 2002. Vol. 277, N 40. P. 37 487-37 491.
22. Motobayashi Y., Jzawa-Jshizawa Y., Jshizawa K. et al. Adiponectin inhibits insulin-like growth factor-1-induced cell migration by the suppression of extracellular signal-regular kinase 1/2 activation but not AKT in Vascular smooth muscle cells // Hypertens. Res. 2009. Vol. 32, N 3. P. 188-193.
23. Ouchi N., Kihara S., Arita Y. et al. Adipocyte-derived plasma protein, adiponectin, suppresses lipid accumulation and class A scavenger receptor expression in human monocyte-derived macrophages // Circulation. 2001. Vol. 103, N 8. P. 1057-1063.
24. Tsubakio-Yamamoto K., Matsura F., Koseki M. et al. Adiponectin prevents atherosclerosis by increasing cholesterol efflux from macrophages // Biohem. Biophys. Res. Commun. 2008. Vol. 375, N 3. P. 390-394.
25. Ouedraogo R., Wu X., Xu S.Q. et al. Adiponectin suppression of high-glucose-induced reactive oxygen species in vascular endothelial cells evidence for involvement of a cAMP signaling pathway // Diabetes. 2006. Vol. 55, N 6. P. 1840-1846.
26. Бoeвa Л.Н., Eкимoвa М.В., Дoгадин C.A. Лeптин и aдипoкины нaтoщaк и пocлe глюкoзнoй нaгрузки у жeнщин c гипeртирeoзoм // ^бир. мeд. oбoзрeниe. 2012. № 1. C. 11-13.
27. Pontikides N., Krassas G.E. Basic endocrine products of adipose tissue in states of thyroid dysfunction // Thyroid. 2007. Vol. 17. P. 421-431.
