Авторы Edward S. Bliss и Eliza Whiteside. Впервые опубликовано 09/2018 в журнале Frontiers in Physiology. Оригинал статьи доступен по ссылке.
Короткоцепочечные жирные кислоты, захват энергии и улавливание нутриентов
Приблизительно 60 граммов углеводов, потребляемых ежедневно в составе типичной западной диеты, не перевариваются. Микрофлора кишечника обладает специфическими гликозид-гидролазами, что позволяет ей ферментировать и гидролизировать неусвояемые полисахариды и вырабатывать короткоцепочечные жирные кислоты (КЖК) в виде метаболита в дистальной ободочной кишке (Moran and Shanahan, 2014). Эта функция и последующая генерация КЖК обеспечивают приблизительно 10% ежедневной энергетической потребности хозяина (Schwiertz et al., 2010). Бутират, пропионат и ацетат составляют 95% биологически значимых КЖК (Bauer et al., 2016). Клетки кишечника используют в качестве первичного источника энергии бутират, печень использует пропионат в глюконеогенезе после того, как он попал в портальную циркуляцию, а ацетат систематически циркулирует по различным периферическим тканям (Gao et al., 2009; Bauer et al., 2016). Производство бутирата обычно приписывается Firmicutes, в то время как синтез пропионата обычно связан с Bacteroidetes (Moran and Shanahan, 2014). У людей с ожирением фекалии содержат повышенное количество КЖК, в частности пропионата (Schwiertz et al., 2010). Предполагается, что это связано с изменением состава микрофлоры, а не с различными типами диеты и/или всасыванием КЖК в толстой кишке (Schwiertz et al., 2010; Rahat-Rozenbloom et al., 2014). Интересно, что Rahat-Rozenbloom et al. (2014) сообщили о превосходстве представленности Firmicutes над представленностью Bacteroidetes в группе с избыточной массой тела, что должно соответствовать увеличению производства бутирата, а не пропионата. Это значит, что для определения различий между худыми людьми и людьми с ожирением, а также для определения причины увеличения содержания КЖК в кале, требуются дополнительные исследования. С учетом того, что КЖК оказывают онкопротективный эффект, дополнительный интерес вызывает тот факт, что диета с высоким содержанием жиров и высоким содержанием углеводов является одним из предрасполагающих факторов развития колоректального рака (Bindels et al., 2012; Grima and Dixon, 2013; Irrazábal et al., 2014). Определение роли КЖК в развитии колоректального рака при ожирении может стать объектом дальнейших исследований.
КЖК также помогают регулировать вес, так как введение пребиотиков, неусвояемых полисахаридов и КЖК в кожу и кишечник приводит к улучшению метаболического состояния, снижению потребления пищи и снижению массы тела (Pan et al., 2009; Bomhof et al., 2014). Это происходит, поскольку пребиотики и добавки способствуют росту и активности благоприятных бактерий, в то время как введение КЖК активирует сигнальные пути, увеличивая синтез гастроинтестинальных гормонов (Pan et al., 2009; Lin et al., 2012; Bomhof et al., 2014). Следовательно, КЖК можно рассматривать как ключевые эндогенные сигнальные молекулы. КЖК связывают и активируют свободные рецепторы жирных кислот 2 и 3 (FFAR2/FFAR3), которые являются GPCR-рецепторами, расположенными по всему ЖКТ, в клетках иммунной системы, печени и жировой ткани (Kasubuchi et al., 2015). Внутри ЖКТ эти рецепторы экспрессируются в эндокринных клетках кишечника, в частности L-клетках (Kasubuchi et al., 2015). После связывания с этими рецепторами в L-клетки поступает сигнал о синтезе и высвобождении гормонов кишечника, таких как GLP1 и PYY (табл. 2). Эти результаты подтверждаются исследованиями in vivo и in vitro, которые продемонстрировали, что в культурах клеток и у мышей, лишенных FFAR2 и FFAR3, нарушается высвобождение GLP1 и PYY даже при инфузии КЖК (Tolhurst et al., 2012). Кроме того, FFAR3 преимущественно экспрессируется в периферической нервной системе, в частности, ЭНС и ВНС (Nøhr et al., 2015). Активация этих рецепторов в симпатической ветви ВНС регулирует механизмы запасания жировой ткани и влияет на потребление энергии, влияя на потребление глюкозы тканями мышц и печени (Moran and Shanahan, 2014; Nøhr et al., 2015). Хотя точный механизм этого явления еще предстоит выяснить, имеющиеся данные указывают на то, что синтез КЖК микрофлорой имеет оказывает сигнальное и стимулирующее влияние на кишечно-мозговую ось.
Абсорбционная и секреторная способность эпителиальных клеток кишечника может зависеть от микрофлоры, влияющей на на кишечно-мозговую ось (Bauer et al., 2016). Исследования продемонстрировали снижение концентрации FFAR2 и FFAR3, увеличение экспрессии переносчиков глюкозы и рецепторов сладкого вкуса, увеличение потребления и поглощения сахарозы и снижение экспрессии рецептора жирных кислот с длинной цепью GPCR 120 (GPR120) у мышей без микрофлоры (Duca et al., 2012; Swartz et al., 2012). Активация GPR120 обеспечивает противовоспалительное и инсулиносенсибилизирующее действие омега-3 жирных кислот, а его отсутствие у GPR120-нокаутных мышей приводит к снижению активности метаболизм жиров и, следовательно, увеличению частоты ожирения (Oh et al., 2010; Ichimura et al., 2012). Концентрация CCK, GLP1 и PYY у мышей без микробиоты снижена, что уменьшает их способность улавливать поступление питательных веществ в кишечник и посылать сигналы обратной связи через кишечно-мозговую ось, приводя к чрезмерному потреблению пищи (Duca et al., 2012; Swartz et al., 2012). Кроме того, Fredborg et al. (2012) продемонстрировали in vitro, что в присутствии определенных штаммов бактерий может происходить апрегуляция GPR120 и снижение экспрессии GLP1. Это значит, что изменения в составе микрофлоры могут влиять на улавливание поступления питательных веществ в кишечник и синтез гастроинтестинальных гормонов. Эта гипотеза еще не доказана, и необходимы дальнейшие исследования той роли, которую играют рецепторы, и механизма их действия.
Пребиотики (например, олигофруктоза) увеличивают чувствительность кишечника к поступлению питательных веществ, что приводит к улучшению барьерной функции, потере веса и уменьшению потребления пищи (Bauer et al., 2016). Было высказано предположение, что эти эффекты обусловлены изменениями микрофлоры кишечника. Исследования показали, что у людей с ожирением снижен уровень отдельных типов бактерий и пептидов. Это было использовано в попытке восстановить уровень этих бактерий и увеличить уровень циркулирующих гастроинтестинальных гормонов (Bauer et al., 2016). Назначение пребиотиков увеличивает количество Akkermansia muciniphilia, Faecalibacterium prausnitzii, Bifidobacterium и Lactobacilli, которые, в свою очередь, связаны с улучшением барьерной функции кишечника посредством воздействия на опосредованный глюкозой пептид 2 (GLP2) и стимуляции эндоканнабиноидной сигнальной системы (Cani et al., 2009; Dewulf et al., 2012). GLP2 секретируется совместно с GLP1, и его высвобождение положительно связано с ростом и функционированием кишечной ткани, увеличивая высоту ворсинок, глубину крипт и скорость пролиферации их клеток, а также уменьшая смертность энтероцитов (Rowland et al., 2011). Кроме того, применение пребиотиков было связано с улучшенной дифференциацией эндокринных клеток кишечника и увеличением концентраций GLP1, GIP и PYY, которые усиливают чувство насыщения, снижают потребление пищи и уменьшают содержание жира (Cani et al., 2005; Neyrinck et al., 2012). Несмотря на то, что необходимы дополнительные исследования для подтверждения связи между манипуляцией составом микрофлоры кишечника и образованием гастроинтестинальных гормонов, имеются данные о том, что микрофлора может влиять на чувствительность к поступлению питательных веществ в ЖКТ, продуцирование гормонов кишечника и стимуляцию кишечно-мозговой оси.
Микрофлора кишечника также может сообщаться с жировой тканью через эндоканнабиноидную систему. Различные модели на мышах продемонстрировали, что периферическая эндоканнабиноидная система в кишечных и жировых тканях, принимающая участие в регуляции барьерной функции кишечника и адипогенеза, регулируется кишечной микрофлорой (Muccioli et al., 2010). Введение пребиотиков для увеличения количества Bifidobacterium у мышей с ожирением вызывает снижение экспрессии CB1 толстой кишки и концентрации анандамида в дополнение к экспрессии жирно-кислотной амидной гидролазы (FAAH) (Muccioli et al., 2010; Moran and Shanahan, 2014) ). FAAH является основным ферментом, ответственным за распад анандамида. Снижение этих факторов в толстой кишке, а также увеличение экспрессии FAAH предполагает, что микрофлора кишечника может избирательно модулировать рецепторы CB1 толстой кишки, которые впоследствии регулируют активность эндоканнабиоидов (Muccioli et al., 2010). Необходимы дополнительные исследования для подтверждения этих данных и уточнения того, как микрофлора может влиять на эндоканнабиноидную систему и ее активность, связанную с ожирением. Нарастание влияния этих факторов в толстой кишке может быть обусловлено увеличением концентрации гастроинтестинальных гормонов, а не составом микрофлоры напрямую. Также возможно, что микрофлора стимулирует сигнализацию посредством гормонов кишечника, чтобы повлиять на эндоканнабиноидную систему посредством стимуляции афферентов блуждающего нерва. Выявление задействованного механизма может предоставить дополнительную информацию о том, как кишечно-мозговая ось и микрофлора связаны с регулированием энергии.
Липополисахарид, воспаление и интеграция микрофлоры в работу кишечно-мозговой оси
Ожирение считается воспалительным состоянием, поскольку оно характеризуется наличием хронического неспецифического воспаления. Недавно было обнаружено, что высококалорийная западная диета, приводящая к ожирению и другим связанным с ним заболеваниям (таблица 1), связана с повышенными системными концентрациями липополисахарида (ЛПС) (Cani et al., 2007; de La Serre et al., 2010). ЛПС является провоспалительным компонентом в клеточной стенке грамотрицательных бактерий. Считается, что ЛПС проникает в системный кровоток через эпителий кишечника, скомпрометированный ожирением и диетой, богатой жирами. Предполагается, что этот процесс, названный метаболической эндотоксемией, происходит из-за неблагоприятного изменения состава микрофлоры кишечника. Из-за них просвет в плотных контактах, образованных кишечным эпителием, увеличивается, а значит, увеличивается и проницаемость кишечной стенки (схема 4) (Cani et al., 2007; de La Serre et al., 2010). Попадание ЛПС в кровоток инициирует каскад провоспалительных событий во всем организме хозяина, особенно в белой жировой ткани.
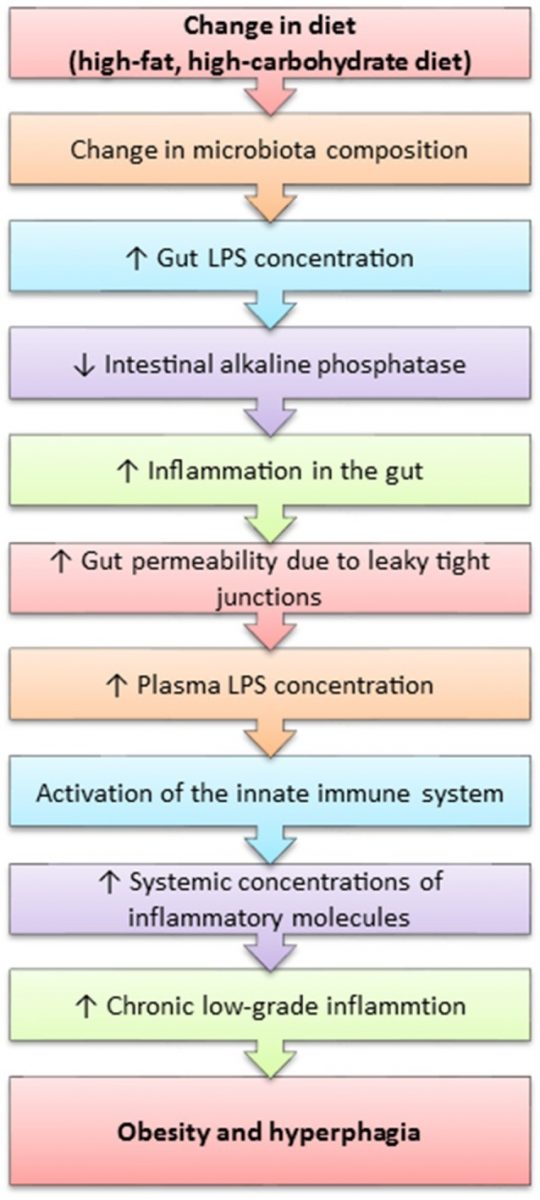
Рис. 4. Механизм развития ожирения при диете с высоким содержанием жира.
ЛПС оказывает мощное стимулирующее воздействие на толл-подобный рецептор 4 (TLR4), активация которого приводит к синтезу воспалительных цитокинов и последующей активации врожденного иммунитета (Vaure and Liu, 2014). Caesar et al. (2015) сообщали об увеличении системной концентрации ЛПС, активации TLR4 и воспалении белой жировой ткани, а также снижении чувствительности к инсулину и изменениях состава микрофлоры кишечника у мышей, придерживавшихся западной диеты.
Повышенная концентрация ЛПС проявляется одновременно с увеличением концентрации TLR4 у крыс, склонных к ожирению (DIO-P), в то время как у устойчивых к ожирению крыс (DIO-R) TLR4 в кишечнике не экспрессируется (de La Serre et al., 2010, 2015). У крыс DIO-P увеличивалось количество Clostridiales и уменьшалось количество Bifidobacterium, что приводило к увеличению концентрации ЛПС (de La Serre et al., 2010). De La Serre et al. (2015) сообщили о снижении концентрации кишечной щелочной фосфатазы (ЩФ) у крыс DIO-P, в то время как у крыс DIO-R она, наоборот, увеличивалась. Поскольку ЩФ является характерным кишечным ферментом, ответственным за детоксикацию ЛПС, это позволяет предположить, что ЛПС может непосредственно воздействовать на кишечник. Эта гипотеза получила дальнейшее развитие в работе Everard et al. (2014), показавшей, что делеция MyD88, центральной молекулы-адаптера для большинства толл-подобных рецепторов, включая TLR4, частично защищает от ожирения склонных к ожирению мышей, а также стерильных мышей, которым была произведена трансплантация микробиоты мышей, склонных к ожирению. Кроме того, Everard et al. (2014) предположили, что делеция MyD88 может улучшить нутритивный статус и даже предлагали использовать ее как мишень в терапии ожирения. Для подтверждения этой гипотезы необходимы дальнейшие исследования. TLR4 также экспрессируется афферентами блуждающего нерва, а значит, ЛПС может инициировать воспалительный каскад и внутри нервов, относящихся к кишечно-мозговой оси (de La Serre et al., 2015).
ЛПС подавляет активность интерстициальных клеток Кахаля, которые выступают в роли пейсмейкеров, регулирующих перистальтику кишечника и работу ЭНС (Zuo et al., 2013; Bauer et al.,2016). Ингибирование этих клеток приводит к нарушению моторики желудочно-кишечного тракта, изменяя частоту высвобождения нейромедиаторов внутри ЭНС, что может влиять на секрецию гастроинтестинальных гормонов и, следовательно, ослаблять связь микрофлоры кишечника с сигнальными механизмами кишечно-мозговой оси (Zuo et al., 2013). Для подтверждения этой гипотезы необходимы дальнейшие исследования, поскольку механизмы, связывающие этот район периферической нервной системы с ЦНС и кишечно-мозговой осью, неизвестны. Возможность восстановления функции интерстициальных клеток Кахаля путем увеличения концентрации ЩФ для снижения образования ЛПС могла бы способствовать уменьшению воспалительных заболеваний кишечника, связанных с ожирением.
Микрофлора кишечника может напрямую влиять на сигнальные механизмы в ЦНС. Хотя механизм влияния на регуляцию энергетического гомеостаза в ЦНС неясен, очевидно что микрофлора может влиять на развитие стресса и тревожности (Bauer et al., 2016). Исследования выявили, что у мышей, лишенных микробиоты, и у мышей без отдельных патогенных штаммов микрофлоры имеются различия в моторном контроле и формировании памяти и тревоги, связанные с центральными нейрохимических измененями. В частности, эти изменения были связаны с нейротрофикой мозга, уровнями серотонина, дофамина, норадреналина и NMDA (Bercik et al., 2010; Heijtz et al., 2011; Neufeld et al., 2011; Steenbergen et al., 2015; Wang and Wang, 2016). Кроме того, лечение пробиотиками, в частности, направленное на увеличение числа Bifidobacterium и Lactobacilli, уменьшает тревожность у мышей с воспалительными заболеваниями кишечника, а также повышает когнитивную реактивность на подавленное настроение у людей и уменьшает показатели депрессии у пациентов с синдромом раздраженного кишечника, и улучшает ответ гипоталамо-гипофизарной оси на острую психологическую травму (Ait-Belgnaoui et al., 2012; Steenbergen et al., 2015; Pinto-Sanchez et al., 2017). Эти изменения в поведении, по-видимому, коррелируют с активностью блуждающего нерва и уменьшенным LPS-индуцированным воспалением. При этом происходит усиление барьерной функции кишечника, и предотвращается всасывание ЛПС (Bercik et al., 2010). Можно предположить, что патогенные бактерии, количество которых увеличивается при стрессе и питании с высоким содержанием жира, высвобождают ЛПС, который активирует TLR4 в афферентах блуждающего нерва. Тем самым в гипоталамус и другие центры головного мозга посылается сигнал, активирующий соответствующее поведение. Впрочем, для подтверждения этой гипотезы необходимы дальнейшие исследования. Кроме того, добавка Lactobacillus rhamnosus CGMCC1.3724 способствовала сжиганию жира у женщин с ожирением, в дополнение к снижению концентрации лептина и относительной численности Lachnospiraceae, семейства Firmicutes (Sanchez et al., 2014). Эти результаты были воспроизведены в более позднем исследовании с использованием того же пробиотика, а также сопровождались увеличением чувства сытости, самооценки пациентов, снижением тяги к пище и депрессии (Sanchez et al., 2017). Кроме того, непатогенные бактерии, такими как Lactobacillus lactis, также могут стимулировать блуждающий нерв, и эта стимуляция усиливает активность симпатической нервной системы. Субдиафрагмальная ваготомия в присутствии Lactobacillus lactis ослабляет этот эффект (Tanida et al., 2005; Forsythe and Kunze, 2013). Краткий итог этих исследований приведен на рис. 5. Механизмы активации блуждающего нерва непатогенной флорой требуют уточнения и представляют собой дополнительный уровень взаимодействия микрофлоры и кишечно-мозговой оси.
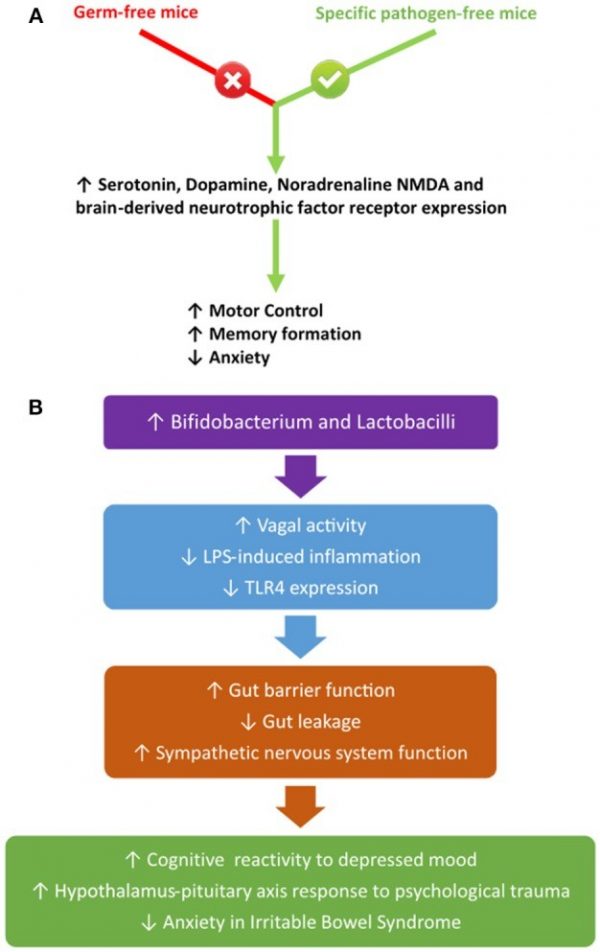
Рис. 5. Пути воздействия (А) и эффект (B) влияния микрофлоры кишечника на блуждающий нерв.
Становится все более очевидным, что микрофлора кишечника влияет на функции ЦНС, связанные с регуляцией энергетического гомеостаза. Bäckhed et al. (2004) продемонстрировали, что мыши, лишенные микробиоты, устойчивы к ожирению, несмотря на увеличение количества потребляемой пищи. Это свидетельствует о том, что микрофлора прямо или косвенно влияет на ЦНС. Это открытие было предпосылкой для более подробного исследования, проведенного Schéle et al. (2013), сравнившего экспрессию генов пептидов, регулирующих потребление пищи, и участие гипоталамуса и мозгового ствола в пищевом поведении у стерильных и нормальных мышей. Schéle et al. (2013) сообщили об уменьшении экспрессии в стволе мозга и гипоталамусе гена GCG, который кодирует препроглюкагон, предшественник пептидов GLP1, GLP2 и оксинтомодулина. Они также сообщили о снижении чувствительности к лептину у обычных мышей по сравнению со стерильными мышами (Schéle et al., 2013). Кроме того, когда обычным мышам вводили лептин, у них не происходило подавления экспрессии в гипоталамусе и мозговом стволе генов, кодирующих способствующие ожирению пептиды NPY и AgRP. Это позволило предположить, что кишечная микрофлора может непосредственно уменьшать экспрессию анорексигенных пептидов и влиять на энергетический гомеостаз, приводя к ожирению (Schéle et al., 2013, 2016). В будущем следует изучить вопрос о том, какие именно манипуляции над микрофлорой кишечника могут влиять на ЦНС и ее роль в регулировании энергетического гомеостаза и развитии ожирения. Кроме того, поскольку изменение концентрации гастроинтестинальных гормонов связано с изменениями высших нервных проявлений (сна, возбуждения и тревожности), будущие исследования могут быть посвящены влиянию микрофлоры на местные и центральные сигнальные механизмы и его связи с регулированием энергетического обмена через кишечно-мозговую ось (рис. 6) (Forsythe and Kunze, 2013).

Рис. 6. Совокупность влияний измененной микрофлоры на кишечно-мозговую ось, способствующих ожирению. Этот рисунок обобщает различные факторы, которые связывают микрофлору кишечника с кишечно-мозговой осью при развитии ожирения. К ним относятся изменение состава микрофлоры, увеличение концентрации ЛПС, достигающее высшей точки при увеличении проницаемости кишечника и хронического неспецифического воспаления, а также увеличение потребления энергии и снижение затрат энергии.
Заключение
Ожирение — это глобальная эпидемия, представляющая социально-экономическую проблему для государств и систем здравоохранения. Существующие данные свидетельствуют о том, что ожидаемая продолжительность жизни будет снижаться по мере того, как уровень ожирения будет расти и станет неконтролируемым (Olshansky et al., 2005; Grima and Dixon, 2013). Сейчас число эффективных методов лечения ожирения ограничено изменениями в образе жизни и диеты, а также хирургическими и фармакологическими методами, которые приводят к нежелательным побочным эффектам из-за недостаточного понимания механизмов, лежащих в их основе (Bauer et al., 2016). Сейчас наиболее действенным вариантом лечения является хирургическое вмешательство (например, шунтирование желудка), но механизмы, обуславливающие успех таких операций, изучены недостаточно хорошо (Grima and Dixon, 2013). Тем не менее, анализ изменений концентрации гастроинтестинальных гормонов, иннервации и состава микрофлоры кишечника (то есть компонентов оси «кишечник-мозг-микрофлора») после операции, а также анализ причин этих изменений, может помочь в разработке новых стратегий лечения. Учитывая, что хирургическое вмешательство может увеличить популяцию эндокринных клеток кишечника, способствуя тем самым увеличению производства пептидов и улучшению нейрональной коммуникации, а также увеличению секреции гормонов после приема пищи, необходимо максимально подробно изучить все аспекты кишечно-мозговой оси (Mumphrey et al., 2013; Bauer et al., 2016). Кроме того, увеличение энергозатрат за счет активации симпатических ветвей ВНС и оси «кишечник-мозг-бурая жировая ткань» в дополнение к работе нейрогуморальной системы может быть эффективным методом регулирования энергетического баланса. Необходимы и исследования роли внутренностного нерва и других соматосенсорных путей, которые привнесут понимание роли этих волокон в пределах кишечно-мозговой оси, особенно учитывая присутствие этих афферентов по всему ЖКТ. Изучение механизмов, связанных с этой осью и вспомогательными нейронными путями, а также интеграция полученной информации в уже имеющуюся систему знаний представляет сложную задачу, но может лечь в основу новых стратегий борьбы с ожирением.
Воздействие на микробиом кишечника может стать новой терапевтической стратегией по борьбе с ожирением и сопутствующими заболеваниями (Bauer et al., 2016). Сообщалось, что быстрые и стойкие изменения в микрофлоре кишечника сопровождаются улучшением метаболических параметров после операции (Liou et al., 2013; Osto et al., 2013). Кроме того, исследования на грызунах, в которых стерильным мышам произвели трансплантацию микрофлоры кишечника мышей после операции, продемонстрировали, что у первых уменьшилось ожирение и увеличился расход энергии, что было связано с изменением продукции КЖК и/или уменьшением концентрации ЛПС (Liou et al., 2013; Casselbrant et al., 2015). Хотя влияние на состав микробиоты может стать новым направлением в лечении ожирения, для изучения «идеального» состава микрофлоры у «здорового» индивида требуются дополнительные исследования. Пребиотики и пробиотики предоставили возможность более детально изучить роль микробиоты в работе кишечно-мозговой оси и развитии ожирения. Впрочем, время необходимое для развития благоприятных изменений, все еще не установлено. Учитывая, что современный образ жизни делает упор на удобство и динамичность, данный тип лечения может оказаться непопулярен, если он не приведет к быстрому результату. Многообещающие результаты также были получены при применении капсул, содержащих «идеальную» композицию микробиоты, и при трансплантации фекальной микробиоты как у крыс, так и у добровольцев. Но, опять же, эффективность этого варианта лечения может быть ограничена из-за психологических ограничений. Для повышения комплаентности и, следовательно, эффективности лечения, необходимо проведение программ, направленных на просвещение и укрепления здоровья населения. Эти программы могут также способствовать закреплению здорового образа жизни и, вследствие этого, формированию здоровой микробиоты.
Хотя пока что имеется лишь зачаточное понимание сложных взаимодействий оси «кишечник-мозг-микрофлора» и ожирения, исследований в этой сфере появляется все больше, и она предоставляет перспективное поле для разработки методов лечения. Появляющиеся факты должны дополнять, а не заменять исследования, касающиеся образа жизни и психологических факторов, связанных с ожирением. В совокупности они способствуют увеличению приверженности пациентов к лечению и улучшению исхода борьбы с эпидемией ожирения.
Библиография
- Abbott C. R., Monteiro M., Small C. J., Sajedi A., Smith K. L., Parkinson J. R. C., et al. (2005). The inhibitory effects of peripheral administration of peptide YY3–36 and glucagon-like peptide-1 on food intake are attenuated by ablation of the vagal–brainstem–hypothalamic pathway. Brain Res. 1044, 127–131. 10.1016/j.brainres.2005.03.011
- Abdel-Salam O. M. (2014). Capsaicin As a Therapeutic Molecule. Basel: Springer.
- Adam T. C., Westerterp-Plantenga M. S. (2005). Glucagon-like peptide-1 release and satiety after a nutrient challenge in normal-weight and obese subjects. Br. J. Nutr. 93, 845–851. 10.1079/BJN20041335
- Adrian T. E., Bloom S. R., Bryant M. G., Polak J. M., Heitz P. H., Barnes A. J. (1976). Distribution and release of human pancreatic polypeptide. Gut 17, 940–944. 10.1136/gut.17.12.940
- Adrian T. E., Ferri G. L., Bacarese-Hamilton A. J., Fuessl H. S., Polak J. M., Bloom S. R. (1985). Human distribution and release of a putative new gut hormone, peptide YY. Gastroenterology 89, 1070–1077. 10.1016/0016-5085(85)90211-2
- Ait-Belgnaoui A., Durand H., Cartier C., Chaumaz G., Eutamene H., Ferrier L., et al.. (2012). Prevention of gut leakiness by a probiotic treatment leads to attenuated HPA response to an acute psychological stress in rats. Psychoneuroendocrinology 37, 1885–1895. 10.1016/j.psyneuen.2012.03.024
- Al-Asmakh M., Zadjali F. (2015). Use of germ-free animal models in microbiota-related research. J. Microbiol. Biotechnol. 25, 1583–1588. 10.4014/jmb.1501.01039
- Amato A., Cinci L., Rotondo A., Serio R., Faussone-pellegrini M. S., Vannucchi M. G., et al.. (2010). Peripheral motor action of glucagon-like peptide-1 through enteric neuronal receptors. Neurogastroenterol. Motility 22, 664–e203. 10.1111/j.1365-2982.2010.01476.x
- Anini Y., Fu-Cheng X., Cuber J. C., Kervran A., Chariot J., Roz,é C. (1999). Comparison of the postprandial release of peptide YY and proglucagon-derived peptides in the rat. Pflügers Archiv. 438, 299–306. 10.1007/s004240050913
- Arendas K., Qiu Q., Gruslin A. (2008). Obesity in pregnancy: pre-conceptional to postpartum consequences. J. Obstet. Gynaecol. Can. 30, 477–488. 10.1016/S1701-2163(16)32863-8
- Aronne L. J., Tonstad S., Moreno M., Gantz I., Erondu N., Suryawanshi S., et al.. (2010). A clinical trial assessing the safety and efficacy of taranabant, a CB1R inverse agonist, in obese and overweight patients: a high-dose study. Int. J. Obes. 34, 919–935. 10.1038/ijo.2010.21
- Aune D., Sen A., Norat T., Janszky I., Romundstad P., Tonstad S., et al.. (2016). Body mass index, abdominal fatness, and heart failure incidence and mortality: a systematic review and dose–response meta-analysis of prospective studies. Circulation 133, 639–649. 10.1161/CIRCULATIONAHA.115.016801
- Australia F. (2009). Let’s Get Physical: The Economic Contribution of Fitness Centres in Australia. Access Economics.
- Babic T., Townsend R. L., Patterson L. M., Sutton G. M., Zheng H., Berthoud H.-R. (2009). Phenotype of neurons in the nucleus of the solitary tract that express CCK-induced activation of the ERK signaling pathway. Am. J. Physiol. Regul. Integr. Compar. Physiol. 296, R845–R854. 10.1152/ajpregu.90531.2008
- Bäckhed F., Ding H., Wang T., Hooper L. V., Koh G. Y., Nagy A., et al.. (2004). The gut microbiota as an environmental factor that regulates fat storage. Proc. Natl. Acad. Sci. U.S.A. 101, 15718–15723. 10.1073/pnas.0407076101
- Baggio L. L., Huang Q., Brown T. J., Drucker D. J. (2004). Oxyntomodulin and glucagon-like peptide-1 differentially regulate murine food intake and energy expenditure. Gastroenterology 127, 546–558. 10.1053/j.gastro.2004.04.063
- Balasubramaniam A., Mullins D. E., Lin S., Zhai W., Tao Z., Dhawan V. C., et al.. (2006). Neuropeptide Y (NPY) Y4 receptor selective agonists based on NPY(32–36): development of an anorectic Y4 receptor selective agonist with picomolar affinity. J. Med. Chem. 49, 2661–2665. 10.1021/jm050907d
- Batterham R. L., Cohen M. A., Ellis S. M., Le Roux C. W., Withers D. J., Frost G. S., et al.. (2003a). Inhibition of food intake in obese subjects by peptide YY3–36. New Engl. J. Med. 349, 941–948. 10.1056/NEJMoa030204
- Batterham R. L., Cowley M. A., Small C. J., Herzog H., Cohen M. A., Dakin C. L., et al. (2002). Gut hormone PYY3-36 physiologically inhibits food intake. Nature. 418, 650–654. 10.1038/nature00887
- Batterham R. L., Heffron H., Kapoor S., Chivers J. E., Chandarana K., Herzog H., et al.. (2006). Critical role for peptide YY in protein-mediated satiation and body-weight regulation. Cell Metab. 4, 223–233. 10.1016/j.cmet.2006.08.001
- Batterham R. L., Le Roux C. W., Cohen M. A., Park A. J., Ellis S. M., Patterson M., et al. (2003b). Pancreatic polypeptide reduces appetite and food intake in humans. J. Clin. Endocrinol. Metab. 88, 3989–3992. 10.1210/jc.2003-030630
- Bauer P. V., Hamr S. C., Duca F. A. (2016). Regulation of energy balance by a gut–brain axis and involvement of the gut microbiota. Cell. Mol. Life Sci. 73, 737–755. 10.1007/s00018-015-2083-z
- Bedendi I., Alloatti G., Marcantoni A., Malan D., Catapano F., Ghé C., et al.. (2003). Cardiac effects of ghrelin and its endogenous derivatives des-octanoyl ghrelin and des-Gln14-ghrelin. Eur. J. Pharmacol. 476, 87–95. 10.1016/S0014-2999(03)02083-1
- Bercik P., Verdu E. F., Foster J. A., Macri J., Potter M., Huang X., et al.. (2010). Chronic gastrointestinal inflammation induces anxiety-like behavior and alters central nervous system biochemistry in mice. Gastroenterology 139, 2102–2112.e1. 10.1053/j.gastro.2010.06.063
- Berntson G. G., Zipf W. B., O’Dorisio T. M., Hoffman J. A., Chance R. E. (1993). Pancreatic polypeptide infusions reduce food intake in Prader-Willi syndrome. Peptides 14, 497–503. 10.1016/0196-9781(93)90138-7
- Berthoud H.-R., Kressel M., Raybould H. E., Neuhuber W. L. (1995). Vagal sensors in the rat duodenal mucosa: distribution and structure as revealed by in vivo DiI-tracing. Anat. Embryol. 191, 203–212. 10.1007/BF00187819
- Bertrand P. P., Bertrand R. L. (2010). Serotonin release and uptake in the gastrointestinal tract. Autonomic Neurosci. Basic Clin. 153, 47–57. 10.1016/j.autneu.2009.08.002
- Bertrand R. L., Senadheera S., Markus I., Liu L., Howitt L., Chen H., et al.. (2011). A Western diet increases serotonin availability in rat small intestine. Endocrinology 152, 36–47. 10.1210/en.2010-0377
- Beydoun M. A., Beydoun H. A., Wang Y. (2008). Obesity and central obesity as risk factors for incident dementia and its subtypes: a systematic review and meta-analysis. Obesity Rev. 9, 204–218. 10.1111/j.1467-789X.2008.00473.x
- Bianchini F., Kaaks R., Vainio H. (2002). Overweight, obesity, and cancer risk. Lancet Oncol. 3, 565–574. 10.1016/S1470-2045(02)00849-5
- Billington C. J., Briggs J. E., Link J. G., Levine A. S. (1991). Glucagon in physiological concentrations stimulates brown fat thermogenesis in vivo. Am. J. Physiol. Regul. Integr. Comparat. Physiol. 261, R501–R507. 10.1152/ajpregu.1991.261.2.R501
- Bindels L. B., Porporato P., Dewulf E. M., Verrax J., Neyrinck A. M., Martin J. C., et al.. (2012). Gut microbiota-derived propionate reduces cancer cell proliferation in the liver. Br. J. Cancer. 107, 1337–1344. 10.1038/bjc.2012.409
- Blackburn A. M., Bloom S. R., Long R. G., Fletcher D. R., Christofides N. D., Fitzpatrick M. L., et al. (1980). Effect of neurotensin on gastric function in man. Lancet 315, 987–989. 10.1016/S0140-6736(80)91434-8
- Blouet C., Schwartz G. J. (2012). Duodenal lipid sensing activates vagal afferents to regulate non-shivering brown fat thermogenesis in rats. PLoS ONE 7:e51898. 10.1371/journal.pone.0051898
- Bomhof M. R., Saha D. C., Reid D. T., Paul H. A., Reimer R. A. (2014). Combined effects of oligofructose and Bifidobacterium animalis on gut microbiota and glycemia in obese rats. Obesity 22, 763–771. 10.1002/oby.20632
- Boyer J. L., Bloomer J. R. (1974). Canalicular bile secretion in man studies utilizing the biliary clearance of [(14)C]mannitol. J. Clin. Investig. 54, 773–781. 10.1172/JCI107817
- Bremer A. A., Devaraj S., Afify A., Jialal I. (2011). Adipose tissue dysregulation in patients with metabolic syndrome. J. Clin. Endocrinol. Metab. 96, E1782–E1788. 10.1210/jc.2011-1577
- Broberger C., Landry M., Wong H., Walsh J. N., Hökfelt T. (1997). Subtypes Y1 and Y2 of the neuropeptide Y Receptor Are Respectively Expressed in Pro-opiomelanocortin- and neuropeptide-Y-containing neurons of the rat hypothalamic arcuate nucleus. Neuroendocrinology 66, 393–408. 10.1159/000127265
- Brown L., Poudyal H., Panchal S. K. (2015). Functional foods as potential therapeutic options for metabolic syndrome. Obesity Rev. 16, 914–941. 10.1111/obr.12313
- Buhmann H., le Roux C. W., Bueter M. (2014). The gut–brain axis in obesity. Best Pract. Res. Clin. Gastroenterol. 28, 559–571. 10.1016/j.bpg.2014.07.003
- Bump R. C., Sugerman H. J., Fantl J. A., McClish D. K. (1992). Obesity and lower urinary tract function in women: effect of surgically induced weight loss. Am. J. Obstet. Gynecol. 167, 392–397; discussion 7–9. 10.1016/S0002-9378(11)91418-5
- Caesar R., Tremaroli V., Kovatcheva-Datchary P., Cani Patrice D., Bäckhed F. (2015). Crosstalk between gut microbiota and dietary lipids aggravates WAT inflammation through TLR signaling. Cell Metabolism 22, 658–668. 10.1016/j.cmet.2015.07.026
- Calingasan N., Ritter S., Ritter R., Brenner L. (1992). Low-dose near-celiac arterial cholecystokinin suppresses food intake in rats. Am. J. Physiol. Regul. Integr. Comparat. Physiol. 263, R572–R5777. 10.1152/ajpregu.1992.263.3.R572
- Campos C. A., Shiina H., Silvas M., Page S., Ritter R. C. (2013). Vagal afferent NMDA receptors modulate CCK-induced reduction of food intake through synapsin I phosphorylation in adult male rats. Endocrinology 154, 2613–2625. 10.1210/en.2013-1062
- Cani P. D., Amar J., Iglesias M. A., Poggi M., Knauf C., Bastelica D., et al.. (2007). Metabolic endotoxemia initiates obesity and insulin resistance. Diabetes 56, 1761–1772. 10.2337/db06-1491
- Cani P. D., Neyrinck A. M., Maton N., Delzenne N. M. (2005). Oligofructose promotes satiety in rats fed a high-fat diet: involvement of glucagon-like peptide-1. Obes. Res. 13, 1000–1007. 10.1038/oby.2005.117
- Cani P. D., Possemiers S., Van de Wiele T., Guiot Y., Everard A., Rottier O., et al.. (2009). Changes in gut microbiota control inflammation in obese mice through a mechanism involving GLP-2-driven improvement of gut permeability. Gut 58, 1091–1103. 10.1136/gut.2008.165886
- Casselbrant A., Elias E., Fändriks L., Wallenius V. (2015). Expression of tight-junction proteins in human proximal small intestinal mucosa before and after Roux-en-Y gastric bypass surgery. Surg. Obes. Relat. Dis. 11, 45–53. 10.1016/j.soard.2014.05.009
- Castillo E. J., Delgado-Aros S., Camilleri M., Burton D., Stephens D., O’Connor-Semmes R., et al.. (2004). Effect of oral CCK-1 agonist GI181771X on fasting and postprandial gastric functions in healthy volunteers. Am. J. Physiol. Gastrointest. Liver Physiol. 287, G363–G369. 10.1152/ajpgi.00074.2004
- Chen S. M., Xiong G. S., Wu S. M. (2012). Is obesity an indicator of complications and mortality in acute pancreatitis? An updated meta-analysis. J. Digest. Dis. 13, 244–251. 10.1111/j.1751-2980.2012.00587.x
- Cheng C. Y., Chu J. Y., Chow B. K. (2011). Central and peripheral administration of secretin inhibits food intake in mice through the activation of the melanocortin system. Neuropsychopharmacology 36, 459–471. 10.1038/npp.2010.178
- Cheung G. W., Kokorovic A., Lam C. K., Chari M., Lam T. K. (2009). Intestinal cholecystokinin controls glucose production through a neuronal network. Cell Metab. 10, 99–109. 10.1016/j.cmet.2009.07.005
- Cho H.-J., Kosari S., Hunne B., Callaghan B., Rivera L. R., Bravo D. M., et al.. (2015). Differences in hormone localisation patterns of K and L type enteroendocrine cells in the mouse and pig small intestine and colon. Cell Tissue Res. 359, 693–698. 10.1007/s00441-014-2033-3
- Cho I., Yamanishi S., Cox L., Methe B. A., Zavadil J., Li K., et al.. (2012). Antibiotics in early life alter the murine colonic microbiome and adiposity. Nature 488, 621–626. 10.1038/nature11400
- Christensen R., Kristensen P. K., Bartels E. M., Bliddal H., Astrup A. (2007). Efficacy and safety of the weight-loss drug rimonabant: a meta-analysis of randomised trials. Lancet 370, 1706–1713. 10.1016/S0140-6736(07)61721-8
- Chu J. Y. S., Chung S. C. K., Lam A. K. M., Tam S., Chung S. K., Chow B. K. C. (2007). Phenotypes developed in secretin receptor-null mice indicated a role for secretin in regulating renal water reabsorption. Mol. Cell. Biol. 27, 2499–2511. 10.1128/MCB.01088-06
- Clark J. T., Kalra P. S., Crowley W. R., Kalra S. P. (1984). Neuropeptide Y and human pancreatic polypeptide stimulate feeding behavior in rats. Endocrinology 115, 427–429. 10.1210/endo-115-1-427
- Cluny N. L., Chambers A. P., Vemuri V. K., Wood J. T., Eller L. K., Freni C., et al. (2011). The neutral cannabinoid CB1 receptor antagonist AM4113 regulates body weight through changes in energy intake in the rat. Pharmacol. Biochem. Behav. 97, 537–543. 10.1016/j.pbb.2010.10.013
- Cohen M. A., Ellis S. M., Le Roux C. W., Batterham R. L., Park A., Patterson M., et al.. (2003). Oxyntomodulin suppresses appetite and reduces food intake in humans. J. Clin. Endocrinol. Metab. 88, 4696–4701. 10.1210/jc.2003-030421
- Cone R., Cowley M., Butler A., Fan W., Marks D., Low M. (2001). The arcuate nucleus as a conduit for diverse signals relevant to energy homeostasis. Int. J. Obes. 25:S63. 10.1038/sj.ijo.0801913
- Cooke A. R., Clark E. D. (1976). Effect of first part of duodenum on gastric emptying in dogs: response to acid, fat, glucose, and neural blockade. Gastroenterology 70, 550–555.
- Costa M., Brookes S. J. H., Hennig G. W. (2000). Anatomy and physiology of the enteric nervous system. Gut 47(Suppl. 4):iv15–iv9. 10.1136/gut.47.suppl_4.iv15
- Cowley M. A., Smart J. L., Rubinstein M., Cerdan M. G., Diano S., Horvath T. L., et al.. (2001). Leptin activates anorexigenic POMC neurons through a neural network in the arcuate nucleus. Nature 411, 480–484. 10.1038/35078085
- Cox J. E., McCown S. M., Bridges J. M., Tyler W. J. (1996). Inhibition of sucrose intake by continuous celiac, superior mesenteric, and intravenous CCK-8 infusions. Am. J. Physiol. Regul. Integr. Compar. Physiol. 270, R319–R325. 10.1152/ajpregu.1996.270.2.R319
- Craig A. D. (1996). Chapter 13 An ascending general homeostatic afferent pathway originating in lamina I. Prog. Brain Res. 107, 225–242. 10.1016/S0079-6123(08)61867-1
- Crane J. D., Palanivel R., Mottillo E. P., Bujak A. L., Wang H., Ford R. J., et al.. (2015). Inhibiting peripheral serotonin synthesis reduces obesity and metabolic dysfunction by promoting brown adipose tissue thermogenesis. Nat. Med. 21, 166–172. 10.1038/nm.3766
- Dakin C. L., Small C. J., Batterham R. L., Neary N. M., Cohen M. A., Patterson M., et al. (2004). Peripheral oxyntomodulin reduces food intake and body weight gain in rats. Endocrinology 145, 2687–2695. 10.1210/en.2003-1338
- Dakin C. L., Small C. J., Park A. J., Seth A., Ghatei M. A., Bloom S. R. (2002). Repeated ICV administration of oxyntomodulin causes a greater reduction in body weight gain than in pair-fed rats. Am. J. Physiol. Endocrinol. Metab. 283, E1173–E1177. 10.1152/ajpendo.00233.2002
- Daly D. M., Park S. J., Valinsky W. C., Beyak M. J. (2011). Impaired intestinal afferent nerve satiety signalling and vagal afferent excitability in diet induced obesity in the mouse. J. Physiol. 589, 2857–2870. 10.1113/jphysiol.2010.204594
- Date Y., Murakami N., Toshinai K., Matsukura S., Niijima A., Matsuo H., et al.. (2002). The role of the gastric afferent vagal nerve in ghrelin-induced feeding and growth hormone secretion in rats. Gastroenterology 123, 1120–1128. 10.1053/gast.2002.35954
- Davenport R. J., Wright S. (2014). Treating obesity: is it all in the gut? Drug Discov. Today. 19, 845–858. 10.1016/j.drudis.2013.10.025
- David L. A., Maurice C. F., Carmody R. N., Gootenberg D. B., Button J. E., Wolfe B. E., et al.. (2014). Diet rapidly and reproducibly alters the human gut microbiome. Nature 505, 559–563. 10.1038/nature12820
- Davis J. D., Smith G. P. (1990). Learning to sham feed: behavioral adjustments to loss of physiological postingestional stimuli. Am. J. Physiol. Regul. Integr. Compar. Physiol. 259, R1228–R1235. 10.1152/ajpregu.1990.259.6.R1228
- De Filippo C., Cavalieri D., Di Paola M., Ramazzotti M., Poullet J. B., Massart S., et al.. (2010). Impact of diet in shaping gut microbiota revealed by a comparative study in children from Europe and rural Africa. Proc. Natl. Acad. Sci. U.S.A. 107, 14691–14696. 10.1073/pnas.1005963107
- de La Serre C. B., de Lartigue G., Raybould H. E. (2015). Chronic exposure to low dose bacterial lipopolysaccharide inhibits leptin signaling in vagal afferent neurons. Physiol. Behav. 139, 188–194. 10.1016/j.physbeh.2014.10.032
- de La Serre C. B., Ellis C. L., Lee J., Hartman A. L., Rutledge J. C., Raybould H. E. (2010). Propensity to high-fat diet-induced obesity in rats is associated with changes in the gut microbiota and gut inflammation. Am. J. Physiol. Gastrointestinal Liver Physiol. 299, G440–G448. 10.1152/ajpgi.00098.2010
- Deacon C. F., Johnsen A. H., Holst J. J. (1995). Degradation of glucagon-like peptide-1 by human plasma in vitro yields an N-terminally truncated peptide that is a major endogenous metabolite in vivo. J. Clin. Endocrinol. Metab. 80, 952–957.
- Depoortere I. (2014). Taste receptors of the gut: emerging roles in health and disease. Gut 63, 179–190. 10.1136/gutjnl-2013-305112
- Dewulf E. M., Cani P. D., Claus S. P., Fuentes S., Puylaert P. G., Neyrinck A. M., et al.. (2012). Insight into the prebiotic concept: lessons from an exploratory, double blind intervention study with inulin-type fructans in obese women. Gut 62, 1112–1121. 10.1136/gutjnl-2012-303304
- Di Francesco V., Zamboni M., Dioli A., Zoico E., Mazzali G., Omizzolo F., et al.. (2005). Delayed postprandial gastric emptying and impaired gallbladder contraction together with elevated cholecystokinin and peptide YY serum levels sustain satiety and inhibit hunger in healthy elderly persons. J. Gerontol. Series A. 60, 1581–1585. 10.1093/gerona/60.12.1581
- DiBaise J. K., Foxx-Orenstein A. E. (2013). Role of the gastroenterologist in managing obesity. Expert Rev. Gastroenterol. Hepatol. 7, 439–451. 10.1586/17474124.2013.811061
- Dicker A., Zhao J., Cannon B., Nedergaard J. (1998). Apparent thermogenic effect of injected glucagon is not due to a direct effect on brown fat cells. Am. J. Physiol. Regul. Integr. Comparat. Physiol. 275, R1674–R1682. 10.1152/ajpregu.1998.275.5.R1674
- Dimaline R., Varro A. (2014). Novel roles of gastrin. J. Physiol. 592, 2951–2958. 10.1113/jphysiol.2014.272435
- Dimitriadis G., Mitrou P., Lambadiari V., Maratou E., Raptis S. A. (2011). Insulin effects in muscle and adipose tissue. Diabetes Res. Clin. Pract. 93, S52–S59. 10.1016/S0168-8227(11)70014-6
- Dirksen C., Jørgensen N. B., Bojsen-Møller K. N., Kielgast U., Jacobsen S. H., Clausen T. R., et al.. (2013). Gut hormones, early dumping and resting energy expenditure in patients with good and poor weight loss response after Roux-en-Y gastric bypass. Int. J. Obes. 37, 1452–1459. 10.1038/ijo.2013.15
- Dixon J. B., Lambert E. A., Lambert G. W. (2015). Neuroendocrine adaptations to bariatric surgery. Mol. Cell. Endocrinol. 418, 143–152. 10.1016/j.mce.2015.05.033
- Dockray G. J. (2013). Enteroendocrine cell signalling via the vagus nerve. Curr. Opin. Pharmacol. 13, 954–958. 10.1016/j.coph.2013.09.007
- Druce M. R., Minnion J. S., Field B. C. T., Patel S. R., Shillito J. C., Tilby M., et al.. (2009). Investigation of structure-activity relationships of oxyntomodulin (Oxm) using oxm analogs. Endocrinology 150, 1712–1721. 10.1210/en.2008-0828
- Dryden S., Pickavance L., Frankish H. M., Williams G. (1995). Increased neuropeptide Y secretion in the hypothalamic paraventricular nucleus of obese (fa/fa) Zucker rats. Brain Res. 690, 185–188. 10.1016/0006-8993(95)00628-4
- Duca F. A., Yue J. T. Y. (2014). Fatty acid sensing in the gut and the hypothalamus: in vivo and in vitro perspectives. Mol. Cell. Endocrinol. 397, 23–33. 10.1016/j.mce.2014.09.022
- Duca F. A., Sakar Y., Lepage P., Devime F., Langelier B., Doré J., et al.. (2014). Replication of obesity and associated signaling pathways through transfer of microbiota from obese prone rat. Diabetes 63, 1624–1636. 10.2337/db13-1526
- Duca F. A., Swartz T. D., Sakar Y., Covasa M. (2012). Increased oral detection, but decreased intestinal signaling for fats in mice lacking gut microbiota. PLoS ONE 7:e39748. 10.1371/journal.pone.0039748
- Edwards C. M., Todd J. F., Mahmoudi M., Wang Z., Wang R. M., Ghatei M. A., et al.. (1999). Glucagon-like peptide 1 has a physiological role in the control of postprandial glucose in humans: studies with the antagonist exendin 9-39. Diabetes 48, 86–93. 10.2337/diabetes.48.1.86
- Eisner M. D., Blanc P. D., Sidney S., Yelin E. H., Lathon P. V., Katz P. P., et al.. (2007). Body composition and functional limitation in COPD. Respir. Res. 8:7. 10.1186/1465-9921-8-7
- Ejerblad E., Fored C. M., Lindblad P., Fryzek J., McLaughlin J. K., Nyrén O. (2006). Obesity and risk for chronic renal failure. J. Am. Soc. Nephrol. 17, 1695–1702. 10.1681/ASN.2005060638
- Elias C. F., Aschkenasi C., Lee C., Kelly J., Ahima R. S., Bjorbæk C., et al.. (1999). Leptin differentially regulates, NPYand POMC neurons projecting to the lateral hypothalamic area. Neuron 23, 775–786. 10.1016/S0896-6273(01)80035-0
- Elliott R. M., Morgan L. M., Tredger J. A., Deacon S., Wright J., Marks V. (1993). Glucagon-like peptide-1(7–36)amide and glucose-dependent insulinotropic polypeptide secretion in response to nutrient ingestion in man: acute post-prandial and 24-h secretion patterns. J. Endocrinol. 138, 159–166. 10.1677/joe.0.1380159
- El-Salhy M., Mazzawi T., Gundersen D., Hatlebakk J. G., Hausken T. (2013). The role of peptide YY in gastrointestinal diseases and disorders (Review). Int. J. Mol. Med. 31, 275–282. 10.3892/ijmm.2012.1222
- Enriori P. J., Evans A. E., Sinnayah P., Jobst E. E., Tonelli-Lemos L., Billes S. K., et al.. (2007). Diet-induced obesity causes severe but reversible leptin resistance in arcuate melanocortin neurons. Cell Metab. 5, 181–194. 10.1016/j.cmet.2007.02.004
- Eslick G. D. (2012). Gastrointestinal symptoms and obesity: a meta-analysis. Obesity Rev. 13, 469–479. 10.1111/j.1467-789X.2011.00969.x
- Esposito K., Giugliano F., Di Palo C., Giugliano G., Marfella R., D’Andrea F., et al.. (2004). Effect of lifestyle changes on erectile dysfunction in obese men: a randomized controlled trial. JAMA 291, 2978–2984. 10.1001/jama.291.24.2978
- Everard A., Geurts L., Caesar R., Van Hul M., Matamoros S., Duparc T., et al.. (2014). Intestinal epithelial MyD88 is a sensor switching host metabolism towards obesity according to nutritional status. Nat. Commun. 5:5648. 10.1038/ncomms6648
- Farooqi I. S., Keogh J. M., Yeo G. S. H., Lank E. J., Cheetham T., O’Rahilly S. (2003). Clinical spectrum of obesity and mutations in the melanocortin 4 receptor gene. New Engl. J. Med. 348, 1085–1095. 10.1056/NEJMoa022050
- Fawaz C. S., Martel P., Leo D., Trudeau L.-E. (2009). Presynaptic action of neurotensin on dopamine release through inhibition of D2 receptor function. BMC Neurosci. 10:96 10.1186/1471-2202-10-96
- Feifel D., Goldenberg J., Melendez G., Shilling P. D. (2010). The acute and subchronic effects of a brain-penetrating, neurotensin-1 receptor agonist on feeding, body weight and temperature. Neuropharmacology 58, 195–198. 10.1016/j.neuropharm.2009.07.001
- Finucane M. M., Sharpton T. J., Laurent T. J., Pollard K. S. (2014). A taxonomic signature of obesity in the microbiome? Getting to the guts of the matter. PLoS ONE 9:e84689. 10.1371/journal.pone.0084689
- Flegal K. M., Graubard B. I., Williamson D. F., Gail M. H. (2007). Cause-specific excess deaths associated with underweight, overweight, and obesity. JAMA 298, 2028–2037. 10.1001/jama.298.17.2028
- Forsythe P., Kunze W. A. (2013). Voices from within: gut microbes and the CNS. Cell. Mol. Life Sci. 70, 55–69. 10.1007/s00018-012-1028-z
- Fredborg M., Theil P. K., Jensen B. B., Purup S. (2012). G protein-coupled receptor120 (GPR120) transcription in intestinal epithelial cells is significantly affected by bacteria belonging to the bacteroides, proteobacteria, and Firmicutes phyla1. J. Anim. Sci. 90(Suppl. 4), 10–12. 10.2527/jas.53792
- Fu-Cheng X., Anini Y., Chariot J., Castex N., Galmiche J.-P., Rozé C. (1997). Mechanisms of peptide YY release induced by an intraduodenal meal in rats: neural regulation by proximal gut. Pflügers Archiv. 433, 571–579. 10.1007/s004240050316
- Furet J.-P., Kong L.-C., Tap J., Poitou C., Basdevant A., Bouillot J.-L., et al.. (2010). Differential adaptation of human gut microbiota to bariatric surgery–induced weight loss. Links with metabolic and low-grade inflammation markers. Diabetes 59, 3049–3057. 10.2337/db10-0253
- Gao Z., Yin J., Zhang J., Ward R. E., Martin R. J., Lefevre M., et al.. (2009). Butyrate improves insulin sensitivity and increases energy expenditure in mice. Diabetes 58, 1509–1517. 10.2337/db08-1637
- Ghanim H., Aljada A., Hofmeyer D., Syed T., Mohanty P., Dandona P. (2004). Circulating mononuclear cells in the obese are in a proinflammatory state. Circulation 110, 1564–1571. 10.1161/01.CIR.0000142055.53122.FA
- Gibbs J., Maddison S., Rolls E. T. (1981). Satiety role of the small intestine examined in sham-feeding rhesus monkeys. J. Comp. Physiol. Psychol. 95, 1003–1015. 10.1037/h0077845
- Gibbs J., Young R. C., Smith G. P. (1973). Cholecystokinin elicits satiety in rats with open gastric fistulas. Nature. 245, 323–325. 10.1038/245323a0
- Global Burden of Metabolic Risk Factors for Chronic Diseases Collaboration. Lu Y., Hajifathalian K., Ezzati M., Woodward M., Rimm E. B., et al.. (2014). Metabolic mediators of the effects of body-mass index, overweight, and obesity on coronary heart disease and stroke: a pooled analysis of 97 prospective cohorts with 1·8 million participants. Lancet 383, 970–983. 10.1016/S0140-6736(13)61836-X
- Gómez R., Navarro M., Ferrer B., Trigo J. M., Bilbao A., Del Arco I., et al.. (2002). A peripheral mechanism for CB1 cannabinoid receptor-dependent modulation of feeding. J. Neurosci. 22, 9612–9617. 10.1523/JNEUROSCI.22-21-09612.2002
- Graaf C., Donnelly D., Wootten D., Lau J., Sexton P. M., Miller L. J., et al.. (2016). Glucagon-like peptide-1 and its class B G protein–coupled receptors: a long march to therapeutic successes. Pharmacol. Rev. 68, 954–1013. 10.1124/pr.115.011395
- Gray M. A., Greenwell J. R., Argent B. E. (1988). Secretin-regulated chloride channel on the apical plasma membrane of pancreatic duct cells. J. Membr. Biol. 105, 131–142. 10.1007/BF02009166
- Grenham S., Clarke G., Cryan J., Dinan T. (2011). Brain–gut–microbe communication in health and disease. Front. Physiol. 2:94. 10.3389/fphys.2011.00094
- Gribble F. M., Reimann F. (2016). Enteroendocrine cells: chemosensors in the intestinal epithelium. Annu. Rev. Physiol. 78, 277–299. 10.1146/annurev-physiol-021115-105439
- Grima M., Dixon J. (2013). Obesity: recommendations for management in general practice and beyond. Aust. Fam. Physician 42, 532–541. Available online at: https://search.informit.com.au/documentSummary;dn=487012525790449;res=IELHEA
- Grunddal K. V., Ratner C. F., Svendsen B., Sommer F., Engelstoft M. S., Madsen A. N., et al.. (2016). Neurotensin is coexpressed, coreleased, and acts together with GLP-1 and PYY in enteroendocrine control of metabolism. Endocrinology 157, 176–194. 10.1210/en.2015-1600
- Guerra S., Sherrill D. L., Bobadilla A., Martinez F. D., Barbee R. A. (2002). The relation of body mass index to asthma, chronic bronchitis, and emphysema. Chest. 122:1256. 10.1378/chest.122.4.1256
- Guyenet S. J., Schwartz M. W. (2012). Regulation of food intake, energy balance, and body fat mass: implications for the pathogenesis and treatment of obesity. J. Clin. Endocrinol. Metab. 97, 745–755. 10.1210/jc.2011-2525
- Habib A. M., Richards P., Cairns L. S., Rogers G. J., Bannon C. A. M., Parker H. E., et al.. (2012). Overlap of endocrine hormone expression in the mouse intestine revealed by transcriptional profiling and flow cytometry. Endocrinology 153, 3054–3065. 10.1210/en.2011-2170
- Halford J. C. G., Harrold J. A. (2012). 5-HT2C receptor agonists and the control of appetite, in Appetite Control, ed Joost H.-G., editor. (Berlin, Heidelberg: Springer Berlin; ), 349–356.
- Halford J. C. G., Lawton C. L., Blundell J. E. (1997). The 5-HT2 receptor agonist MK-212 reduces food intake and increases resting but prevents the behavioural satiety sequence. Pharmacol. Biochem. Behav. 56, 41–46. 10.1016/S0091-3057(96)00152-9
- Hall J. E. (2015). Guyton and Hall Textbook of Medical Physiology. Saint Louis, MO: Elsevier; Health Sciences.
- Hamr S. C., Wang B., Swartz T. D., Duca F. A. (2015). Does nutrient sensing determine how we «see» food? Curr. Diab. Rep. 15:38. 10.1007/s11892-015-0604-7
- Hay D. L., Chen S., Lutz T. A., Parkes D. G., Roth J. D. (2015). Amylin: pharmacology, physiology, and clinical potential. Pharmacol. Rev. 67, 564–600. 10.1124/pr.115.010629
- Hayes A. J., Lung T. W. C., Bauman A., Howard K. (2017). Modelling obesity trends in Australia: unravelling the past and predicting the future. Int. J. Obes. 41, 178–185. 10.1038/ijo.2016.165
- Heijtz R. D., Wang S., Anuar F., Qian Y., Björkholm B., Samuelsson A., et al. (2011). Normal gut microbiota modulates brain development and behavior. Proc. Natl. Acad. Sci. U.S.A. 108, 3047–3052. 10.1073/pnas.1010529108
- Higham C. E., Hull R. L., Lawrie L., Shennan K. I. J., Morris J. F., Birch N. P., et al.. (2000). Processing of synthetic pro-islet amyloid polypeptide (proIAPP) ‘amylin’ by recombinant prohormone convertase enzymes, PC2 and PC3, in vitro. Eur. J. Biochem. 267, 4998–5004. 10.1046/j.1432-1327.2000.01548.x
- Hilbert A., Braehler E., Haeuser W., Zenger M. (2014). Weight bias internalization, core self-evaluation, and health in overweight and obese persons. Obesity 22, 79–85. 10.1002/oby.20561
- Holst J. J. (2007). The physiology of glucagon-like peptide 1. Physiol. Rev. 87, 1409–1439. 10.1152/physrev.00034.2006
- Ichimura A., Hirasawa A., Poulain-Godefroy O., Bonnefond A., Hara T., Yengo L., et al.. (2012). Dysfunction of lipid sensor GPR120 leads to obesity in both mouse and human. Nature 483, 350–354. 10.1038/nature10798
- Irrazábal T., Belcheva A., Girardin Stephen E., Martin A., Philpott Dana J. (2014). The multifaceted role of the intestinal microbiota in colon cancer. Mol. Cell. 54, 309–320. 10.1016/j.molcel.2014.03.039
- Izzo A. A., Piscitelli F., Capasso R., Aviello G., Romano B., Borrelli F., et al.. (2009). Peripheral endocannabinoid dysregulation in obesity: relation to intestinal motility and energy processing induced by food deprivation and re-feeding. Br. J. Pharmacol. 158, 451–461. 10.1111/j.1476-5381.2009.00183.x
- Janssens P. L., Hursel R., Westerterp-Plantenga M. S. (2014). Capsaicin increases sensation of fullness in energy balance, and decreases desire to eat after dinner in negative energy balance. Appetite 77, 46–51. 10.1016/j.appet.2014.02.018
- Jones B. J., Tan T., Bloom S. R. (2012). Minireview: glucagon in stress and energy homeostasis. Endocrinology 153, 1049–1054. 10.1210/en.2011-1979
- Jutel M., Watanabe T., Klunker S., Akdis M., Thomet O. A. R., Malolepszy J., et al.. (2001). Histamine regulates T-cell and antibody responses by differential expression of H1 and H2 receptors. Nature 413, 420–425. 10.1038/35096564
- Kalafatakis K., Triantafyllou K. (2011). Contribution of neurotensin in the immune and neuroendocrine modulation of normal and abnormal enteric function. Regul. Pept. 170, 7–17. 10.1016/j.regpep.2011.04.005
- Kanneganti T.-D., Dixit V. D. (2012). Immunological complications of obesity. Nat. Immunol. 13, 707–712. 10.1038/ni.2343
- Kasubuchi M., Hasegawa S., Hiramatsu T., Ichimura A., Kimura I. (2015). Dietary gut microbial metabolites, short-chain fatty acids, and host metabolic regulation. Nutrients 7, 2839–2849. 10.3390/nu7042839
- Katz L. M., Young A., Frank J. E., Wang Y., Park K. (2004). Neurotensin-induced hypothermia improves neurologic outcome after hypoxic-ischemia*. Crit. Care Med. 32, 806–810. 10.1097/01.CCM.0000114998.00860.FD
- Kawabata F., Inoue N., Masamoto Y., Matsumura S., Kimura W., Kadowaki M., et al.. (2009). Non-pungent capsaicin analogs (capsinoids) increase metabolic rate and enhance thermogenesis via gastrointestinal TRPV1 in mice. Biosci. Biotechnol. Biochem. 73, 2690–2697. 10.1271/bbb.90555
- Kazumori H., Ishihara S., Kawashima K., Fukuda R., Chiba T., Kinoshita Y. (2001). Analysis of gastrin receptor gene expression in proliferating cells in the neck zone of gastric fundic glands using laser capture microdissection. FEBS Lett. 489, 208–214. 10.1016/S0014-5793(01)02084-1
- Kentish S. J., Page A. J. (2015). The role of gastrointestinal vagal afferent fibres in obesity. J. Physiol. 593, 775–786. 10.1113/jphysiol.2014.278226
- Khandekar N., Berning B. A., Sainsbury A., Lin S. (2015). The role of pancreatic polypeptide in the regulation of energy homeostasis. Mol. Cell. Endocrinol. 418, (Part 1), 33–41. 10.1016/j.mce.2015.06.028
- Kim G. W., Lin J. E., Valentino M. A., Colon-Gonzalez F., Waldman S. A. (2011). Regulation of appetite to treat obesity. Expert Rev. Clin. Pharmacol. 4, 243–259. 10.1586/ecp.11.3
- Kleinridders A., Ferris H. A., Cai W., Kahn C. R. (2014). Insulin action in brain regulates systemic metabolism and brain function. Diabetes 63, 2232–2243. 10.2337/db14-0568
- Klovaite J., Benn M., Nordestgaard B. G. (2015). Obesity as a causal risk factor for deep venous thrombosis: a Mendelian randomization study. J. Intern. Med. 277, 573–584. 10.1111/joim.12299
- Koda S., Date Y., Murakami N., Shimbara T., Hanada T., Toshinai K., et al.. (2005). The role of the vagal nerve in peripheral PYY3–36-induced feeding reduction in rats. Endocrinology 146, 2369–2375. 10.1210/en.2004-1266
- Kohno D., Yada T. (2012). Arcuate NPY neurons sense and integrate peripheral metabolic signals to control feeding. Neuropeptides 46, 315–319. 10.1016/j.npep.2012.09.004
- Kojima M., Hosoda H., Date Y., Nakazato M., Matsuo H., Kangawa K. (1999). Ghrelin is a growth-hormone-releasing acylated peptide from stomach. Nature 402, 656–660. 10.1038/45230
- Kopin A. S., Mathes W. F., McBride E. W., Nguyen M., Al-Haider W., Schmitz F., et al. (1999). The cholecystokinin-A receptor mediates inhibition of food intake yet is not essential for the maintenance of body weight. J. Clin. Invest. 103, 383–391. 10.1172/JCI4901
- Korner J., Bessler M., Cirilo L. J., Conwell I. M., Daud A., Restuccia N. L., et al.. (2005). Effects of Roux-en-Y gastric bypass surgery on fasting and postprandial concentrations of plasma ghrelin, peptide, YY, and Insulin. J. Clin. Endocrinol. Metab. 90, 359–365. 10.1210/jc.2004-1076
- Korner J., Inabnet W., Conwell I. M., Taveras C., Daud A., Olivero-Rivera L., et al.. (2006). Differential effects of gastric bypass and banding on circulating gut hormone and leptin levels. Obesity 14, 1553–1561. 10.1038/oby.2006.179
- Kuhre R. E., Wewer Albrechtsen N. J., Hartmann B., Deacon C. F., Holst J. J. (2015). Measurement of the incretin hormones: glucagon-like peptide-1 and glucose-dependent insulinotropic peptide. J. Diabetes Complicat. 29, 445–450. 10.1016/j.jdiacomp.2014.12.006
- Laferrère B., Teixeira J., McGinty J., Tran H., Egger J. R., Colarusso A., et al.. (2008). Effect of weight loss by gastric bypass surgery versus hypocaloric diet on glucose and incretin levels in patients with type 2 diabetes. J. Clin. Endocrinol. Metab. 93, 2479–2485. 10.1210/jc.2007-2851
- Lam D. D., Przydzial M. J., Ridley S. H., Yeo G. S. H., Rochford J. J., O’Rahilly S., et al.. (2008). Serotonin 5-HT2C receptor agonist promotes hypophagia via downstream activation of melanocortin 4 receptors. Endocrinology 149, 1323–1328. 10.1210/en.2007-1321
- Larsen P. J., Tang-Christensen M., Jessop D. S. (1997). Central administration of glucagon-like peptide-1 activates hypothalamic neuroendocrine neurons in the rat*. Endocrinology 138, 4445–4455. 10.1210/endo.138.10.5270
- Lassmann V., Vague P., Vialettes B., Simon M.-C. (1980). Low plasma levels of pancreatic polypeptide in obesity. Diabetes 29, 428–430. 10.2337/diab.29.6.428
- le Roux C. W., Batterham R. L., Aylwin S. J. B., Patterson M., Borg C. M., Wynne K. J., et al.. (2006). Attenuated peptide YY release in obese subjects is associated with reduced satiety. Endocrinology 147, 3–8. 10.1210/en.2005-0972
- Ley R. E., Turnbaugh P. J., Klein S., Gordon J. I. (2006). Microbial ecology: human gut microbes associated with obesity. Nature 444:1022. 10.1038/4441022a
- Li B., Shao D., Luo Y., Wang P., Liu C., Zhang X., et al.. (2015). Role of 5-HT3 receptor on food intake in fed and fasted mice. PLoS ONE 10:e0121473. 10.1371/journal.pone.0121473
- Li J., Song J., Zaytseva Y. Y., Liu Y., Rychahou P., Jiang K., et al.. (2016). An obligatory role for neurotensin in high-fat-diet-induced obesity. Nature 533, 411–415. 10.1038/nature17662
- Li M., Luo X., Chen L., Zhang J., Hu J., Lu B. (2003). Co-localization of histamine and dopamine-β-hydroxylase in sympathetic ganglion and release of histamine from cardiac sympathetic terminals of guinea-pig. Autonomic Autacoid Pharmacol. 23, 327–333. 10.1111/j.1474-8673.2004.00305.x
- Li Y., Perry T., Kindy M. S., Harvey B. K., Tweedie D., Holloway H. W., et al.. (2009). GLP-1 receptor stimulation preserves primary cortical and dopaminergic neurons in cellular and rodent models of stroke and Parkinsonism. Proc. Natl. Acad. Sci. U.S.A. 106, 1285–1290. 10.1073/pnas.0806720106
- Lieverse R. J., Jansen J. B., Masclee A. A., Lamers C. B. (1995). Satiety effects of a physiological dose of cholecystokinin in humans. Gut 36, 176–179. 10.1136/gut.36.2.176
- Lin H. V., Frassetto A., Kowalik E. J., Jr, Nawrocki A. R., Lu M. M., Kosinski J. R., et al.. (2012). Butyrate and propionate protect against diet-induced obesity and regulate gut hormones via free fatty acid receptor 3-independent mechanisms. PLoS ONE 7:e35240. 10.1371/journal.pone.0035240
- Lin S., Shi Y.-C., Yulyaningsih E., Aljanova A., Zhang L., Macia L., et al.. (2009). Critical role of arcuate Y4 receptors and the melanocortin system in pancreatic polypeptide-induced reduction in food intake in mice. PLoS ONE 4:e8488. 10.1371/journal.pone.0008488
- Liou A. P., Paziuk M., Luevano J.-M., Machineni S., Turnbaugh P. J., Kaplan L. M. (2013). Conserved shifts in the gut microbiota due to gastric bypass reduce host weight and adiposity. Sci. Transl. Med. 5:178ra41. 10.1126/scitranslmed.3005687
- Liu Q., Zhang J., Zerbinatti C., Zhan Y., Kolber B. J., Herz J., et al.. (2011). Lipoprotein receptor LRP1 regulates leptin signaling and energy homeostasis in the adult central nervous system. PLoS Biol. 9:e1000575. 10.1371/journal.pbio.1000575
- Lo C. C., Sean Davidson W., Hibbard S. K., Georgievsky M., Lee A., Tso P., et al.. (2014). Intraperitoneal CCK, and fourth-intraventricular Apo AIV require both peripheral and NTS CCK1R to reduce food intake in male rats. Endocrinology 155, 1700–1707. 10.1210/en.2013-1846
- Löffler H., Aramaki J. U. N., Effendy I. (2002). The influence of body mass index on skin susceptibility to sodium lauryl sulphate. Skin Res. Technol. 8, 19–22. 10.1046/j.0909-752x
- Ludy M.-J., Moore G. E., Mattes R. D. (2011). The effects of capsaicin and capsiate on energy balance: critical review and meta-analyses of studies in humans. Chemical Senses. 152, 103–121. 10.1093/chemse/bjr100
- Mackie K. (2008). Cannabinoid receptors: where they are and what they do. J. Neuroendocrinol. 20, 10–14. 10.1111/j.1365-2826.2008.01671.x
- Maida A., Lovshin J. A., Baggio L. L., Drucker D. J. (2008). The glucagon-like peptide-1 receptor agonist oxyntomodulin enhances β-cell function but does not inhibit gastric emptying in mice. Endocrinology 149, 5670–5678. 10.1210/en.2008-0336
- Mayer E. A., Tillisch K., Gupta A. (2015). Gut/brain axis and the microbiota. J. Clin. Invest. 125, 926–938. 10.1172/JCI76304
- McAdams DeMarco M. A., Maynard J. W., Huizinga M. M., Baer A. N., Köttgen A., Gelber A. C., et al. (2011). Obesity and younger age at gout onset in a community-based cohort. Arthritis Care Res. 63, 1108–1114. 10.1002/acr.20479
- Meek C. L., Lewis H. B., Reimann F., Gribble F. M., Park A. J. (2016). The effect of bariatric surgery on gastrointestinal and pancreatic peptide hormones. Peptides 77, 28–37. 10.1016/j.peptides.2015.08.013
- Meier J. J., Hücking K., Holst J. J., Deacon C. F., Schmiegel W. H., Nauck M. A. (2001). Reduced insulinotropic effect of gastric inhibitory polypeptide in first-degree relatives of patients with type 2 diabetes. Diabetes 50, 2497–2504. 10.2337/diabetes.50.11.2497
- Melanson E. L. (2017). The effect of exercise on non-exercise physical activity and sedentary behavior in adults. Obesity Rev. 18, 40–49. 10.1111/obr.12507
- Mentlein R. (2009). Mechanisms underlying the rapid degradation and elimination of the incretin hormones GLP-1 and GIP. Best Pract. Res. Clin. Endocrinol. Metab. 23, 443–452. 10.1016/j.beem.2009.03.005
- Mieczkowska A., Irwin N., Flatt P. R., Chappard D., Mabilleau G. (2013). Glucose-dependent insulinotropic polypeptide (GIP) receptor deletion leads to reduced bone strength and quality. Bone 56, 337–342. 10.1016/j.bone.2013.07.003
- Molenaar E. A., Numans M. E., van Ameijden E. J., Grobbee D. E. (2008). Considerable comorbidity in overweight adults: results from the Utrecht Health Project. Netherlands J. Med. 152, 2457–2463.
- Monje M. (2017). Settling a nervous stomach: the neural regulation of enteric cancer. Cancer Cell 31, 1–2. 10.1016/j.ccell.2016.12.008
- Mönnikes H., Lauer G., Bauer C., Tebbe J., Zittel T. T., Arnold R. (1997). Pathways of Fos expression in locus ceruleus, dorsal vagal complex, and PVN in response to intestinal lipid. Am. J. Physiol. Regul. Integr. Compar. Physiol. 273, R2059–R2071. 10.1152/ajpregu.1997.273.6.R2059
- Moran C. P., Shanahan F. (2014). Gut microbiota and obesity: role in aetiology and potential therapeutic target. Best Pract. Res. Clin. Gastroenterol. 28, 585–597. 10.1016/j.bpg.2014.07.005
- Muccioli G. G., Naslain D., Bäckhed F., Reigstad C. S., Lambert D. M., Delzenne N. M., et al.. (2010). The endocannabinoid system links gut microbiota to adipogenesis. Mol. Syst. Biol. 6:392. 10.1038/msb.2010.46
- Mumphrey M. B., Patterson L. M., Zheng H., Berthoud H. R. (2013). Roux-en-Y gastric bypass surgery increases number but not density of CCK-, GLP-1-, 5-HT-, and neurotensin-expressing enteroendocrine cells in rats. Neurogastroenterol. Motility 25, e70–e79. 10.1111/nmo.12034
- Munkhaugen J., Lydersen S., Widerøe T.-E., Hallan S. (2009). Prehypertension, obesity, and risk of kidney disease: 20-year follow-up of the HUNT I study in Norway. Am. J. Kidney Dis. 54, 638–646. 10.1053/j.ajkd.2009.03.023
- Münzberg H., Laque A., Yu S., Rezai-Zadeh K., Berthoud H. R. (2015). Appetite and body weight regulation after bariatric surgery. Obesity Rev. 16, 77–90. 10.1111/obr.12258
- Nakhate K. T., Kokare D. M., Singru P. S., Subhedar N. K. (2011). Central regulation of feeding behavior during social isolation of rat: evidence for the role of endogenous CART system. Int. J. Obes. 35, 773–784. 10.1038/ijo.2010.231
- Neufeld K. M., Kang N., Bienenstock J., Foster J. A. (2011). Reduced anxiety-like behavior and central neurochemical change in germ-free mice. Neurogastroenterol. Motility 23, 255–264. 10.1111/j.1365-2982.2010.01620.x
- Neyrinck A. M., Van Hee V. F., Piront N., De Backer F., Toussaint O., Cani P. D., et al.. (2012). Wheat-derived arabinoxylan oligosaccharides with prebiotic effect increase satietogenic gut peptides and reduce metabolic endotoxemia in diet-induced obese mice. Nutr. Diabetes 2:e28. 10.1038/nutd.2011.24
- Nøhr M. K., Egerod K. L., Christiansen S. H., Gille A., Offermanns S., Schwartz T. W., et al.. (2015). Expression of the short chain fatty acid receptor GPR41/FFAR3 in autonomic and somatic sensory ganglia. Neuroscience 290, 126–137. 10.1016/j.neuroscience.2015.01.040
- Nørsett K. G., Lægreid A., Kusnierczyk W., Langaas M., Ylving S., Fossmark R., et al.. (2008). Changes in gene expression of gastric mucosa during therapeutic acid inhibition. Eur. J. Gastroenterol. Hepatol. 20, 613–623. 10.1097/MEG.0b013e3282f5dc19
- Nørsett K. G., Steele I., Duval C., Sammut S. J., Murugesan S. V. M., Kenny S., et al.. (2011). Gastrin stimulates expression of plasminogen activator inhibitor-1 in gastric epithelial cells. Am. J. Physiol. 301, G446–G4453. 10.1152/ajpgi.00527.2010
- O’Donnell D. E., Ciavaglia C. E., Neder J. A. (2014). When obesity and chronic obstructive pulmonary disease collide. physiological and clinical consequences. Ann. Am. Thorac. Soc. 11, 635–644. 10.1513/AnnalsATS.201312-438FR
- Oesch S., Rüegg C., Fischer B., Degen L., Beglinger C. (2006). Effect of gastric distension prior to eating on food intake and feelings of satiety in humans. Physiol. Behav. 87, 903–910. 10.1016/j.physbeh.2006.02.003
- Oh D. Y., Talukdar S., Bae E. J., Imamura T., Morinaga H., Fan W., et al.. (2010). GPR120 is an omega-3 fatty acid receptor mediating potent anti-inflammatory and insulin-sensitizing effects. Cell 142, 687–698. 10.1016/j.cell.2010.07.041
- Ohlsson L., Kohan A. B., Tso P., Ahrén B. (2014). GLP-1 released to the mesenteric lymph duct in mice: effects of glucose and fat. Regul. Pept. 189, 40–45. 10.1016/j.regpep.2014.02.001
- Ollmann M. M., Wilson B. D., Yang Y.-K., Kerns J. A., Chen Y., Gantz I., et al.. (1997). Antagonism of central melanocortin receptors in vitro and in vivo by Agouti-related protein. Science 278, 135–138. 10.1126/science.278.5335.135
- Olshansky S. J., Passaro D. J., Hershow R. C., Layden J., Carnes B. A., Brody J., et al.. (2005). A potential decline in life expectancy in the United States in the 21st Century. N. Engl. J. Med. 352, 1138–1145. 10.1056/NEJMsr043743
- Onakpoya I. J., Heneghan C. J., Aronson J. K. (2016). Post-marketing withdrawal of anti-obesity medicinal products because of adverse drug reactions: a systematic review. BMC Med. 14:191. 10.1186/s12916-016-0735-y
- Ono K., Tsukamoto-Yasui M., Hara-Kimura Y., Inoue N., Nogusa Y., Okabe Y., et al.. (2011). Intragastric administration of capsiate, a transient receptor potential channel agonist, triggers thermogenic sympathetic responses. J. Appl. Physiol. 110, 789–798. 10.1152/japplphysiol.00128.2010
- Ortega F. J., Moreno-Navarrete J. M., Sabater M., Ricart W., Frühbeck G., Fernández-Real J. M. (2011). Circulating glucagon is associated with inflammatory mediators in metabolically compromised subjects. Eur. J. Endocrinol. 165, 639–645. 10.1530/EJE-11-0384
- Osto M., Abegg K., Bueter M., le Roux C. W., Cani P. D., Lutz T. A. (2013). Roux-en-Y gastric bypass surgery in rats alters gut microbiota profile along the intestine. Physiol. Behav. 119, 92–96. 10.1016/j.physbeh.2013.06.008
- Owen Bryn M., Ding X., Morgan Donald A., Coate Katie C., Bookout Angie L., Rahmouni K., et al.. (2014). FGF21 acts centrally to induce sympathetic nerve activity, energy expenditure, and weight loss. Cell Metab. 20, 670–677. 10.1016/j.cmet.2014.07.012
- Palamiuc L., Noble T., Witham E., Ratanpal H., Vaughan M., Srinivasan S. (2017). A tachykinin-like neuroendocrine signalling axis couples central serotonin action and nutrient sensing with peripheral lipid metabolism. Nat. Commun. 8:14237. 10.1038/ncomms14237
- Pan H., Guo J., Su Z. (2014). Advances in understanding the interrelations between leptin resistance and obesity. Physiol. Behav. 130, 157–169. 10.1016/j.physbeh.2014.04.003
- Pan X.-D., Chen F.-Q, Wu, T.-X, Tang, H.-G, Zhao, Z.-Y. (2009). Prebiotic oligosaccharides change the concentrations of short-chain fatty acids and the microbial population of mouse bowel. J. Zhejiang Univ. Sci. B. 10, 258–263. 10.1631/jzus.B0820261
- Panchal S. K., Poudyal H., Waanders J., Brown L. (2012). Coffee extract attenuates changes in cardiovascular and hepatic structure and function without decreasing obesity in high-carbohydrate, high-fat diet-fed male rats. J. Nutr. 142, 690–697. 10.3945/jn.111.153577
- Panchal S. K., Ward L., Brown L. (2013). Ellagic acid attenuates high-carbohydrate, high-fat diet-induced metabolic syndrome in rats. Eur. J. Nutr. 52, 559–568. 10.1007/s00394-012-0358-9
- Pankov Y. A. (2016). Adipogenic function and other biologic effects of insulin. Biomed. Khim. 62, 5–13. 10.18097/pbmc20166201005
- Panula P., Chazot P. L., Cowart M., Gutzmer R., Leurs R., Liu W. L. S., et al.. (2015). International union of basic and clinical pharmacology. XCVIII. Histamine receptors. Pharmacol. Rev. 67, 601–655. 10.1124/pr.114.010249
- Parker R. M., Herzog H. (1999). Regional distribution of Y-receptor subtype mRNAs in rat brain. Eur. J. Neurosci. 11, 1431–1448. 10.1046/j.1460-9568.1999.00553.x
- Parmentier R., Ohtsu H., Djebbara-Hannas Z., Valatx J.-L., Watanabe T., Lin J.-S. (2002). Anatomical, physiological, and pharmacological characteristics of histidine decarboxylase knock-out mice: evidence for the role of brain histamine in behavioral and sleep–wake control. J. Neurosci. 22, 7695–7711. 10.1523/JNEUROSCI.22-17-07695.2002
- Pestana I. A., Greenfield J. M., Walsh M., Donatucci C. F., Erdmann D. (2009). Management of «buried» penis in adulthood: an overview. Plast. Reconstr. Surg. 124, 1186–1195. 10.1097/PRS.0b013e3181b5a37f
- Phillips R. J., Powley T. L. (1996). Gastric volume rather than nutrient content inhibits food intake. Am. J. Physiol. Regul. Integr. Compar. Physiol. 271, R766–R769. 10.1152/ajpregu.1996.271.3.R766
- Pinto-Sanchez M. I., Hall G. B., Ghajar K., Nardelli A., Bolino C., Lau J. T., et al.. (2017). Probiotic bifidobacterium longum NCC3001 reduces depression scores and alters brain activity: a pilot study in patients with irritable bowel syndrome. Gastroenterology 153, 448–459.e8. 10.1053/j.gastro.2017.05.003
- Pocai A. (2014). Action and therapeutic potential of oxyntomodulin. Mol. Metab. 3, 241–251. 10.1016/j.molmet.2013.12.001
- Pocai A., Carrington P. E., Adams J. R., Wright M., Eiermann G., Zhu L., et al.. (2009). Glucagon-like peptide 1/glucagon receptor dual agonism reverses obesity in mice. Diabetes 58, 2258–2266. 10.2337/db09-0278
- Polednak A. P. (2008). Estimating the number of U.S. incident cancers attributable to obesity and the impact on temporal trends in incidence rates for obesity-related cancers. Cancer Detect. Prev. 32, 190–199. 10.1016/j.cdp.2008.08.004
- Powell B. M. (1976). Participation of H1 and H2 histamine receptors in physiological vasodilator responses. Am. J. Physiol. 231, 1002–1009. 10.1152/ajplegacy.1976.231.4.1002
- Prechtl J. C., Powley T. L. (1990). The fiber composition of the abdominal vagus of the rat. Anat. Embryol. 181, 101–115. 10.1007/BF00198950
- Psichas A., Reimann F., Gribble F. M. (2015). Gut chemosensing mechanisms. J. Clin. Invest. 125, 908–917. 10.1172/JCI76309
- Puente N., Cui Y., Lassalle O., Lafourcade M., Georges F., Venance L., et al.. (2011). Polymodal activation of the endocannabinoid system in the extended amygdala. Nat. Neurosci. 14, 1542–1547. 10.1038/nn.2974
- Pyarokhil A. H., Ishihara M., Sasaki M., Kitamura N. (2012). Immunohistochemical study on the ontogenetic development of the regional distribution of peptide YY, pancreatic polypeptide, and glucagon-like peptide 1 endocrine cells in bovine gastrointestinal tract. Regul. Peptides 175, 15–20. 10.1016/j.regpep.2011.12.004
- Qin J., Li R., Raes J., Arumugam M., Burgdorf K. S., Manichanh C., et al.. (2010). A human gut microbial gene catalogue established by metagenomic sequencing. Nature 464, 59–65. 10.1038/nature08821
- Rahat-Rozenbloom S., Fernandes J., Gloor G. B., Wolever T. M. S. (2014). Evidence for greater production of colonic short-chain fatty acids in overweight than lean humans. Int. J. Obes. 38, 1525–1531. 10.1038/ijo.2014.46
- Rasmussen B. A., Breen D. M., Luo P., Cheung G. W. C., Yang C. S., Sun B., et al.. (2012). Duodenal activation of cAMP-dependent protein kinase induces vagal afferent firing and lowers glucose production in rats. Gastroenterology 142, 834.e3–843.e3. 10.1053/j.gastro.2011.12.053
- Ratner R. E., Dickey R., Fineman M., Maggs D. G., Shen L., Strobel S. A., et al.. (2004). Amylin replacement with pramlintide as an adjunct to insulin therapy improves long-term glycaemic and weight control in Type 1 diabetes mellitus: a 1-year, randomized controlled trial. Diabetic Medicine 21, 1204–1212. 10.1111/j.1464-5491.2004.01319.x
- Ravinet Trillou C., Delgorge C., Menet C., Arnone M., Soubrie P. (2004). CB1 cannabinoid receptor knockout in mice leads to leanness, resistance to diet-induced obesity and enhanced leptin sensitivity. Int. J. Obes. Relat. Metab. Disord. 28, 640–648. 10.1038/sj.ijo.0802583
- Reidelberger R. D., Kalogeris T. J., Leung P. M., Mendel V. E. (1983). Postgastric satiety in the sham-feeding rat. Am. J. Physiol. Regul. Integr. Comparat. Physiol. 244, R872–R881. 10.1152/ajpregu.1983.244.6.R872
- Richards P., Parker H. E., Adriaenssens A. E., Hodgson J. M., Cork S. C., Trapp S., et al.. (2014). Identification and characterization of GLP-1 receptor–expressing cells using a new transgenic mouse model. Diabetes 63, 1224–1233. 10.2337/db13-1440
- Ritter R. C. (2011). A tale of two endings: modulation of satiation by NMDA receptors on or near central and peripheral vagal afferent terminals. Physiol. Behav. 105, 94–99. 10.1016/j.physbeh.2011.02.042
- Rowland K. J., Trivedi S., Lee D., Wan K., Kulkarni R. N., Holzenberger M., et al.. (2011). Loss of glucagon-like peptide-2–induced proliferation following intestinal epithelial insulin-like growth factor-1–receptor deletion. Gastroenterology 141, 2166–2175.e7. 10.1053/j.gastro.2011.09.014
- Rüttimann E. B., Arnold M., Hillebrand J. J., Geary N., Langhans W. (2009). Intrameal hepatic portal and intraperitoneal infusions of glucagon-like peptide-1 reduce spontaneous meal size in the rat via different mechanisms. Endocrinology 150, 1174–1181. 10.1210/en.2008-1221
- Sakata I., Sakai T. (2010). Ghrelin cells in the gastrointestinal tract. Int. J. Pept. 2010:945056. 10.1155/2010/945056
- Sanchez M., Darimont C., Drapeau V., Emady-Azar S., Lepage M., Rezzonico E., et al.. (2014). Effect of Lactobacillus rhamnosus CGMCC1.3724 supplementation on weight loss and maintenance in obese men and women. Br. J. Nutr. 111, 1507–1519. 10.1017/S0007114513003875
- Sanchez M., Darimont C., Panahi S., Drapeau V., Marette A., Taylor V., et al.. (2017). Effects of a diet-based weight-reducing program with probiotic supplementation on satiety efficiency, eating behaviour traits, and psychosocial behaviours in obese individuals. Nutrients 9:284. 10.3390/nu9030284
- Sánchez-Villegas A., Ruíz-Canela M., Gea A., Lahortiga F., Martínez-González M. A. (2016). The association between the mediterranean lifestyle and depression. Clin. Psychol. Sci. 4, 1085–1093. 10.1177/2167702616638651
- Santo M. A., Riccioppo D., Pajecki D., Kawamoto F., de Cleva R., Antonangelo L., et al.. (2016). Weight regain after gastric bypass: influence of gut hormones. Obes. Surg. 26, 919–925. 10.1007/s11695-015-1908-z
- Savastano D. M., Hayes M. R., Covasa M. (2007). Serotonin-type 3 receptors mediate intestinal lipid-induced satiation and Fos-like immunoreactivity in the dorsal hindbrain. Am. J. Physiol. Regul. Integr. Compar. Physiol. 292, R1063–R1070. 10.1152/ajpregu.00699.2006
- Sayegh A. I., Covasa M., Ritter R. C. (2004). Intestinal infusions of oleate and glucose activate distinct enteric neurons in the rat. Autonomic Neurosci. 115, 54–63. 10.1016/j.autneu.2004.08.006
- Schéle E., Grahnemo L., Anesten F., Hallén A., Bäckhed F., Jansson J.-O. (2013). The gut microbiota reduces leptin sensitivity and the expression of the obesity-suppressing neuropeptides proglucagon (Gcg) and brain-derived neurotrophic factor (Bdnf) in the central nervous system. Endocrinology 154, 3643–3651. 10.1210/en.2012-2151
- Schéle E., Grahnemo L., Anesten F., Hallén A., Bäckhed F., Jansson J.-O. (2016). Regulation of body fat mass by the gut microbiota: possible mediation by the brain. Peptides 77, 54–59. 10.1016/j.peptides.2015.03.027
- Schwartz M. W., Woods S. C., Porte D., Seeley R. J., Baskin D. G. (2000). Central nervous system control of food intake. Nature 404, 661–671. 10.1038/35007534
- Schwartz T. W., Holst J. J., Fahrenkrug J., Jensen S. L., Nielsen O. V., Rehfeld J. F., et al.. (1978). Vagal, cholinergic regulation of pancreatic polypeptide secretion. J. Clin. Invest. 61, 781–789. 10.1172/JCI108992
- Schwiertz A., Taras D., Schäfer K., Beijer S., Bos N. A., Donus C., et al.. (2010). Microbiota and SCFA in lean and overweight healthy subjects. Obesity 18, 190–195. 10.1038/oby.2009.167
- Seeley R. J., Grill H. J., Kaplan J. M. (1994). Neurological dissociation of gastrointestinal and metabolic contributions to meal size control. Behav. Neurosci. 108, 347–352. 10.1037/0735-7044.108.2.347
- Sender R., Fuchs S., Milo R. (2016a). Are we really vastly outnumbered? Revisiting the ratio of bacterial to host cells in humans. Cell 164, 337–340. 10.1016/j.cell.2016.01.013
- Sender R., Fuchs S., Milo R. (2016b). Revised estimates for the number of human and bacteria cells in the body. PLoS Biol. 14:e1002533. 10.1371/journal.pbio.1002533
- Shak J. R., Roper J., Perez-Perez G. I., Tseng C.H., Francois F., Gamagaris Z., et al.. (2008). The effect of laparoscopic gastric banding surgery on plasma levels of appetite-control, insulinotropic, and digestive hormones. Obes. Surg. 18, 1089–1096. 10.1007/s11695-008-9454-6
- Sheridan P. A., Paich H. A., Handy J., Karlsson E. A., Hudgens M. G., Sammon A. B., et al.. (2012). Obesity is associated with impaired immune response to influenza vaccination in humans. Int. J. Obes. 36, 1072–1077. 10.1038/ijo.2011.208
- Smith S. R., Weissman N. J., Anderson C. M., Sanchez M., Chuang E., Stubbe S., et al.. (2010). Multicenter, placebo-controlled trial of lorcaserin for weight management. New Engl. J. Med. 363, 245–256. 10.1056/NEJMoa0909809
- Smits L. P., Bouter K. E. C., de Vos W. M., Borody T. J., Nieuwdorp M. (2013). Therapeutic potential of fecal microbiota transplantation. Gastroenterology 145, 946–953. 10.1053/j.gastro.2013.08.058
- Steenbergen L., Sellaro R., van Hemert S., Bosch J. A., Colzato L. S. (2015). A randomized controlled trial to test the effect of multispecies probiotics on cognitive reactivity to sad mood. Brain Behav. Immun. 48, 258–264. 10.1016/j.bbi.2015.04.003
- Stein P. D., Matta F., Goldman J. (2011). Obesity and pulmonary embolism: the mounting evidence of risk and the mortality paradox. Thromb. Res. 128, 518–523. 10.1016/j.thromres.2011.10.019
- Steuten L. M., Creutzberg E. C., Vrijhoef H. J., Wouters E. F. (2006). COPD as a multicomponent disease: inventory of dyspnoea, underweight, obesity and fat free mass depletion in primary care. Primary Care Respir. J. 15, 84–91. 10.1016/j.pcrj.2005.09.001
- Stiedl O., Pappa E., Konradsson-Geuken Å., Ögren S. O. (2015). The role of the serotonin receptor subtypes 5-HT(1A) and 5-HT(7) and its interaction in emotional learning and memory. Front. Pharmacol. 6:162 10.3389/fphar.2015.00162
- Stinton L. M., Shaffer E. A. (2012). Epidemiology of gallbladder disease: cholelithiasis and cancer. Gut Liver 6, 172–187. 10.5009/gnl.2012.6.2.172
- Stock S., Leichner P., Wong A. C. K., Ghatei M. A., Kieffer T. J., Bloom S. R., et al.. (2005). Ghrelin, Peptide, YY glucose-dependent insulinotropic polypeptide, and hunger responses to a mixed meal in anorexic, obese, and control female adolescents. J. Clin. Endocrinol. Metab. 90, 2161–2168. 10.1210/jc.2004-1251
- Suzuki K., Jayasena C. N., Bloom S. R. (2012). Obesity and appetite control. Exp. Diabetes Res. 2012:824305. 10.1155/2012/824305
- Svendsen B., Pedersen J., Albrechtsen N. J. W., Hartmann B., Toräng S., Rehfeld J. F., et al.. (2015). An analysis of cosecretion and coexpression of gut hormones from male rat proximal and distal small intestine. Endocrinology 156, 847–857. 10.1210/en.2014-1710
- Swarbrick M. M., Stanhope K. L., Austrheim-Smith I. T., Van Loan M. D., Ali M. R., Wolfe B. M., et al.. (2008). Longitudinal changes in pancreatic and adipocyte hormones following Roux-en-Y gastric bypass surgery. Diabetologia 51, 1901–1911. 10.1007/s00125-008-1118-5
- Swartz T. D., Duca F., De Wouters T., Sakar Y., Covasa M. (2012). Up-regulation of intestinal type 1 taste receptor 3 and sodium glucose luminal transporter-1 expression and increased sucrose intake in mice lacking gut microbiota. Br. J. Nutr. 107, 621–630. 10.1017/S0007114511003412
- Talsania T., Anini Y., Siu S., Drucker D. J., Brubaker P. L. (2005). Peripheral exendin-4 and peptide YY3–36 synergistically reduce food intake through different mechanisms in mice. Endocrinology 146, 3748–3756. 10.1210/en.2005-0473
- Tanida M., Yamano T., Maeda K., Okumura N., Fukushima Y., Nagai K. (2005). Effects of intraduodenal injection of Lactobacillus johnsonii La1 on renal sympathetic nerve activity and blood pressure in urethane-anesthetized rats. Neurosci. Lett. 389, 109–114. 10.1016/j.neulet.2005.07.036
- Tims S., Derom C., Jonkers D. M., Vlietinck R., Saris W. H., Kleerebezem M., et al.. (2013). Microbiota conservation and BMI signatures in adult monozygotic twins. ISME J. 7, 707–717. 10.1038/ismej.2012.146
- Tolhurst G., Heffron H., Lam Y. S., Parker H. E., Habib A. M., Diakogiannaki E., et al.. (2012). Short-chain fatty acids stimulate glucagon-like peptide-1 secretion via the G-Protein–coupled receptor FFAR2. Diabetes 61, 364–371. 10.2337/db11-1019
- Tolhurst P., Lindberg R., Calder R., de Courten M. (2016). Australia’s Health Tracker 2016. Melbourne: The Australian Health Policy.
- Tukker A., Visscher T. L. S., Picavet H. S. J. (2009). Overweight and health problems of the lower extremities: osteoarthritis, pain and disability. Public Health Nutr. 12, 359–368. 10.1017/S1368980008002103
- Turnbaugh P. J., Hamady M., Yatsunenko T., Cantarel B. L., Duncan A., Ley R. E., et al.. (2009). A core gut microbiome in obese and lean twins. Nature 457, 480–484. 10.1038/nature07540
- Valenzuela J. E., Walsh J. H., Isenberg J. I. (1976). Effect of gastrin on pancreatic enzyme secretion and gallbladder emptying in man. Gastroenterology 71, 409–411.
- van der Kooy D. (1984). Area postrema: site where cholecystokinin acts to decrease food intake. Brain Res. 295, 345–347. 10.1016/0006-8993(84)90982-X
- Vaure C., Liu Y. (2014). A comparative review of toll-like receptor 4 expression and functionality in different animal species. Front. Immunol. 5:316. 10.3389/fimmu.2014.00316
- Villanueva-Peñacarrillo M. L., Márquez L., González N., Díaz-Miguel M., Valverde I. (2001). Effect of GLP-1 on lipid metabolism in human adipocytes. Horm. Metab. Res. 33, 73–77. 10.1055/s-2001-12428
- Vilsbøll T., Agersø H., Krarup T., Holst J. J. (2003). Similar elimination rates of glucagon-like peptide-1 in obese type 2 diabetic patients and healthy subjects. J. Clin. Endocrinol. Metab. 88, 220–224. 10.1210/jc.2002-021053
- Wang H.-X., Wang Y.-P. (2016). Gut microbiota-brain axis. Chin. Med. J. 129, 2373–2380. 10.4103/0366-6999.190667
- Wang J., Barbuskaite D., Tozzi M., Giannuzzo A., Sørensen C. E., Novak I. (2015). Proton pump inhibitors inhibit pancreatic secretion: role of gastric and non-gastric H+/K+-ATPases. PLoS ONE 10:e0126432 10.1371/journal.pone.0126432
- Wang P., Yan Z., Zhong J., Chen J., Ni Y., Li L., et al.. (2012). Transient receptor potential vanilloid 1 activation enhances gut glucagon-like peptide-1 secretion and improves glucose homeostasis. Diabetes 61, 2155–2165. 10.2337/db11-1503
- Wilson P. F., D’Agostino R. B., Sullivan L., Parise H., Kannel W. B. (2002). Overweight and obesity as determinants of cardiovascular risk: the framingham experience. Arch. Intern. Med. 162, 1867–1872. 10.1001/archinte.162.16.1867
- Wostmann B. S., Larkin C., Moriarty A., Bruckner-Kardoss E. (1983). Dietary intake, energy metabolism, and excretory losses of adult male germfree Wistar rats. Lab. Anim. Sci. 33, 46–50.
- Writing Group M., Go A. S., Mozaffarian D., Roger V. L., Benjamin E. J., Berry J. D., et al. (2014). Heart disease and stroke statistics-−2014 update: a report from the American Heart Association. Circulation 129, e28–e292. 10.1161/01.cir.0000441139.02102.80
- Wynne K., Park A. J., Small C. J., Meeran K., Ghatei M. A., Frost G. S., et al.. (2006). Oxyntomodulin increases energy expenditure in addition to decreasing energy intake in overweight and obese humans: a randomised controlled trial. Int. J. Obes. 30, 1729–1736. 10.1038/sj.ijo.0803344
- Wynne K., Park A. J., Small C. J., Patterson M., Ellis S. M., Murphy K. G., et al.. (2005). Subcutaneous oxyntomodulin reduces body weight in overweight and obese subjects. A double-blind, randomized, controlled trial. Diabetes 54, 2390–2395. 10.2337/diabetes.54.8.2390
- Yamato E., Ikegami H., Takekawa K., Fujisawa T., Nakagawa Y., Hamada Y., et al.. (1997). Tissue-specific and glucose-dependent expression of receptor genes for glucagon and glucagon-like peptide-1 (GLP-1). Horm. Metab. Res. 29, 56–59. 10.1055/s-2007-978985
- Yang Y.-K., Chen M., Clements R. H., Abrams G. A., Aprahamian C. J., Harmon C. M. (2008). Human mesenteric adipose tissue plays unique role versus subcutaneous and omental fat in obesity related diabetes. Cell. Physiol. Biochem. 22, 531–538. 10.1159/000185527
- Yavuz Y., Kumral Z. N. Ö., Memi G., Çevik Ö. D., Yegen C., Yegen B. Ç. (2017). Serum leptin, obestatin, and ghrelin levels and gastric emptying rates of liquid and solid meals in non-obese rats with roux-en-Y bypass surgery or prosthesis placement: implications for the role of vagal afferents. Obes. Surg. 27, 1037–1046. 10.1007/s11695-016-2420-9
- Yosipovitch G., DeVore A., Dawn A. (2007). Obesity and the skin: skin physiology and skin manifestations of obesity. J. Am. Acad. Dermatol. 56, 901–916. 10.1016/j.jaad.2006.12.004
- Yosipovitch G., Sackett-Lundeen L., Goon A., Yiong Huak C., Leok Goh C., Haus E. (2004). Circadian and ultradian (12 h) variations of skin blood flow and barrier function in non-irritated and irritated skin—effect of topical corticosteroids. J. Investig. Dermatol. 122, 824–829. 10.1111/j.0022-202X.2004.22313.x
- Young R. L., Sutherland K., Pezos N., Brierley S. M., Horowitz M., Rayner C. K., et al.. (2009). Expression of taste molecules in the upper gastrointestinal tract in humans with and without type 2 diabetes. Gut 58, 337–346. 10.1136/gut.2008.148932
- Yuan X., Yao P. Y., Jiang J., Zhang Y., Su Z., Yao W., et al.. (2017). MST4 phosphorylates ACAP4 to orchestrate apical membrane remodeling during gastric acid secretion. J. Biol. Chem. 292, 16174–16187. 10.1074/jbc.M117.808212
- Zhang H., DiBaise J. K., Zuccolo A., Kudrna D., Braidotti M., Yu Y., et al.. (2009). Human gut microbiota in obesity and after gastric bypass. Proc. Natl. Acad. Sci. U.S.A. 106, 2365–2370. 10.1073/pnas.0812600106
- Zhang J., Ritter R. C. (2012). Circulating GLP-1 and CCK-8 reduce food intake by capsaicin-insensitive, nonvagal mechanisms. Am. J. Physiol. Regul. Integr. Comparat. Physiol. 302, R264–R273. 10.1152/ajpregu.00114.2011
- Zittel T. T., De Giorgio R., Sternini C., Raybould H. E. (1994). Fos protein expression in the nucleus of the solitary tract in response to intestinal nutrients in awake rats. Brain Res. 663, 266–270. 10.1016/0006-8993(94)91272-6
- Zuo D. C., Choi S., Shahi P. K., Kim M. Y., Park C. G., Kim Y. D., et al.. (2013). Inhibition of pacemaker activity in interstitial cells of Cajal by LPS via NF-κB and MAP kinase. World J. Gastroenterol. 19, 1210–1218. 10.3748/wjg.v19.i8.1210
