Некоторые аспекты лекарственной терапии сахарного диабета
Дисклеймер: я далеко не эндокринолог, и представленная информация ниже скорее ознакомительная (и подразумевает дальнейшее самостоятельное погружение в проблему).
Ниже представлены некоторые группы сахароснижающих лекарств — тех препаратов, что нашли применение в терапии инсулинрезистентного сахарного диабета. Их использование направлено на увеличение эффективности воздействия инсулина на ткани. Важно помнить, что образование инсулина при диабете II типа и других вариантах, не относящихся к инсулинозависимому сахарному диабету, не прекращается, а поначалу даже является повышенным. Препараты могут влиять на самые разные уровни реализации эффектов инсулина — от его секреции из β-клеток островков Лангерганса до воздействия на клетки-мишени. Приведу лишь некоторые данные, уместные для освещения в рамках биохимии.
Производные сульфонилмочевины (глибенкламид, гликлазид, глимеприд) ингибируют калиевые каналы в β-клетках поджелудочной железы, приводя к деполяризации их плазматических мембран. Это вызывает открытие кальциевых каналов в мембранах депо кальция, что приводит к повышению внутриклеточной концентрации кальция. В результате происходит экзоцитоз инсулина.
Между нами говоря, во всем мире от них постепенно отходят в пользу более удобных и эффективных препаратов, но встретить пациентов, получающих сульфонилмочевину, по-прежнему возможно.
Инкретиномиметики (ингибиторы дипептидазы и глюкагоноподобный пептид — эксенатид, ситаглиптин, вилдаглиптин, саксаглиптин) осуществляют активацию соответствующих рецепторов на мембране β-клеток; последующий рост уровня цАМФ приводит к усилению секреции инсулина.
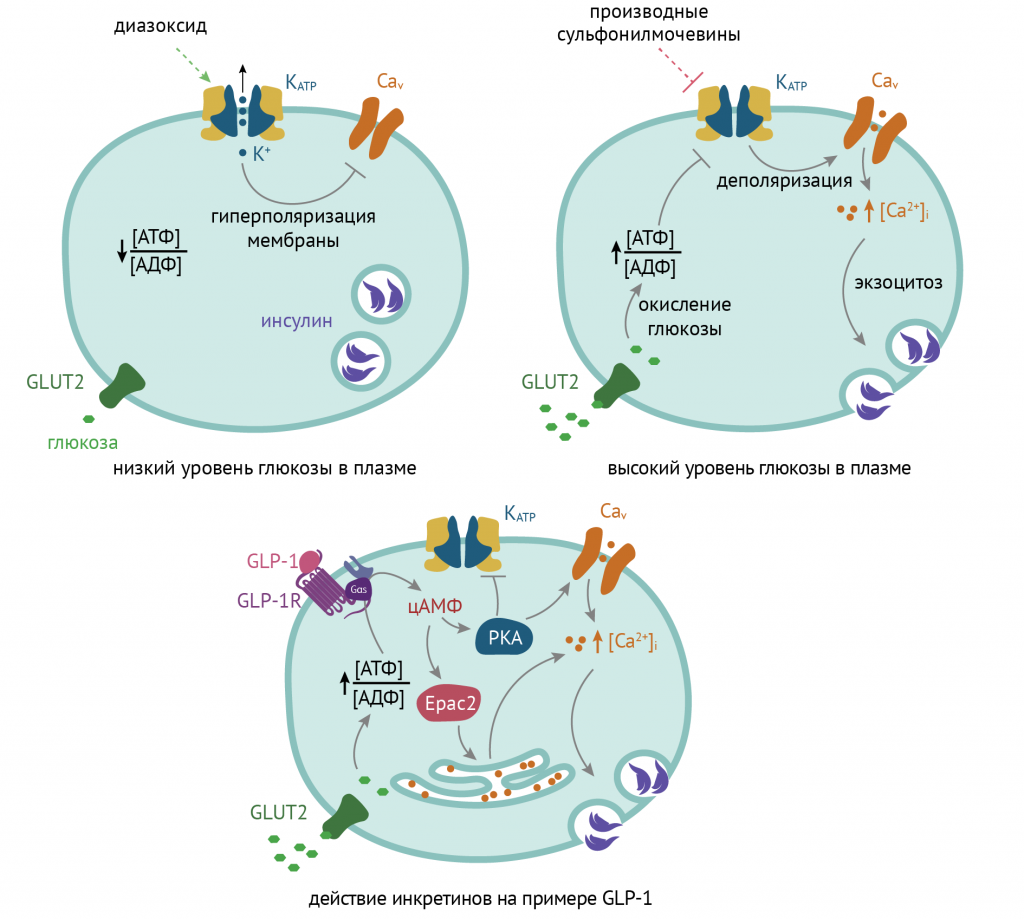
(Напоминаю о том, что К+-каналы в β-клетках могут ингибироваться при повышении уровня цАМФ, которое происходит под действием инкретинов.)
Бигуаниды (метформин) способствуют активации АМФ-зависимой протеинкиназы (АМФК). АМФ-зависимая протеинкиназа активирует транскрипционные факторы, которые подавляют экспрессию генов, кодирующих ферменты глюконеогенеза — фосфоенолпируваткарбоксикиназы и глюкозо-6-фосфатазы. С АМФК связывают и усиление транслокации GLUТ4 — переносчика глюкозы в плазматическую мембрану клеток, ведущую к утилизации клеткой глюкозы.
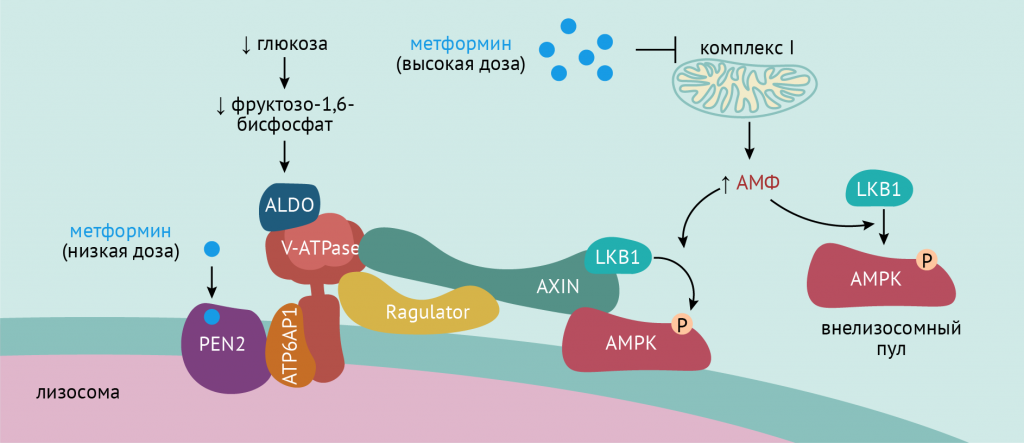
Долгое время считалось, что механизм действия бигуанидов сопряжен, главным образом, с повышением в клетках содержания АМФ (что должно повлечь за собой активацию АМФК). Однако, это реализуется лишь при высоких дозах метформина (порядка 1,5–2 г/сут), что в реальной жизни не увидишь.
Между тем, недавно миру стало известно, что активация AMФK при воздействии метформина в терапевтических дозах не сопряжена с увеличения соотношения аденозинмонофосфата/аденозиндифосфата (АМФ/АДФ), и что механизм оказывается более вычурным и сложным.
Метформина связывается с белком PEN2 (presenilin enhancer 2). PEN2 связывается с субъединицей ATP6AP1, входящей в состав АТФ-азы V (вакуолярного) типа. Сложным путем это приводит к инактивации АТФ-азы V и активации АМФК, Последствия же, в виде “имитирования” внутриклеточных эффектов инсулина на углеводный обмен, вы знаете из прочитанного ранее в этой главе. [1-3]
Глифлозины (канаглифлозин, дапаглифлозин и пр.) останавливают реабсорбцию глюкозы в почках путем ингибирования SGLT2-транспортера, что усиливает выведение глюкозы с мочой и снижает выраженность гипергликемии. Эти препараты новые, на них возлагаются большие надежды. Окончательно в клиническую практику они пока вошли недостаточно широко, но это вопрос времени [10].
- Ma, T., Tian, X., Zhang, B. et al. Low-dose metformin targets the lysosomal AMPK pathway through PEN2. Nature 603, 159–165 (2022).
- Foretz M, Guigas B, Bertrand L, Pollak M, Viollet B. Metformin: from mechanisms of action to therapies. Cell Metab. 2014
- Musi N, Hirshman MF, Nygren J, Svanfeldt M, Bavenholm P, Rooyackers O, Zhou G, Williamson JM, Ljunqvist O, Efendic S, Moller DE, Thorell A, Goodyear LJ. Metformin increases AMP-activated protein kinase activity in skeletal muscle of subjects with type 2 diabetes. Diabetes. 2002
- Chávez-Reyes J, Escárcega-González CE, Chavira-Suárez E, León-Buitimea A, Vázquez-León P, Morones-Ramírez JR, Villalón CM, Quintanar-Stephano A, Marichal-Cancino BA. Susceptibility for Some Infectious Diseases in Patients With Diabetes: The Key Role of Glycemia. Front Public Health. 2021
- Chávez-Reyes J, Escárcega-González CE, Chavira-Suárez E, León-Buitimea A, Vázquez-León P, Morones-Ramírez JR, Villalón CM, Quintanar-Stephano A, Marichal-Cancino BA. Susceptibility for Some Infectious Diseases in Patients With Diabetes: The Key Role of Glycemia. Front Public Health. 2021
- Solá E, Rivera C, Mangual M, Martinez J, Rivera K, Fernandez R. Diabetes mellitus: an important risk factor for reactivation of tuberculosis. Endocrinol Diabetes Metab Case Rep. 2016
- Aronson, D., Rayfield, E.J. How hyperglycemia promotes atherosclerosis: molecular mechanisms. Cardiovasc Diabetol 1, 1 (2002)
- Sivanmaliappan TS, Sevanan M. Antimicrobial Susceptibility Patterns of Pseudomonas aeruginosa from Diabetes Patients with Foot Ulcers. Int J Microbiol. 2011;2011:605195. doi:10.1155/2011/605195
- Huang X, Liu G, Guo J, Su Z. The PI3K/AKT pathway in obesity and type 2 diabetes. Int J Biol Sci. 2018
- Manning BD, Cantley LC. AKT/PKB signaling: navigating downstream. Cell. 2007
- Magaway C, Kim E, Jacinto E. Targeting mTOR and Metabolism in Cancer: Lessons and Innovations. Cells. 2019;8(12):1584. Published 2019 Dec 6. doi:10.3390/cells8121584
- Abu-Ashour W, Twells LK, Valcour JE, Gamble JM. Diabetes and the occurrence of infection in primary care: a matched cohort study. BMC Infect Dis. 2018
- Таганович А. Д. , Олецкий Э. И., Котович И. Л.. Патологическая биохимия, 2015 г. Главы 1, 2.
- Портал «Биохимия для студента». Раздел: «Сахарный диабет».
- Тимин О. А. Основы биологической химии, 2018 г., с. 291.
- Виноградов В. М., Каткова Е. Б. Информация про противодиабетические препараты. Фармакология с рецептурой, 2016 г.
- Кольман Я. , Рём К.-Г. Наглядная биохимия, 5-е издание, 2018 г., с. 152, 382–386.
- Танбаева Г. З., «Кардиоваскулярная безопасность менеджмента сахарного диабета», МВА, 2018 г.
- Шанин В. Ю. Патофизиология критических состояний. 2-е издание, 2018 г., с. 274–281.
- Зилбернагль, Ланг Ф. Клиническая патофизиология, 2-е издание, 2016 г., с.310.
