Действие инсулина на аминокислотный и белковый обмен [2]:
- Торможение глюконеогенеза снижает степень вовлечения аминокислот в процессы превращения их в соответствующие кетокислоты и в образование глюкозы. Это позволяет им интенсивнее участвовать в биосинтезе белка.
- По разным данным, инсулин ускоряет течение всех фаз биосинтеза белка путем активации факторов элонгации mTOR-зависимым путем:
- Изменения, связанные с активацией МАРК-путей.
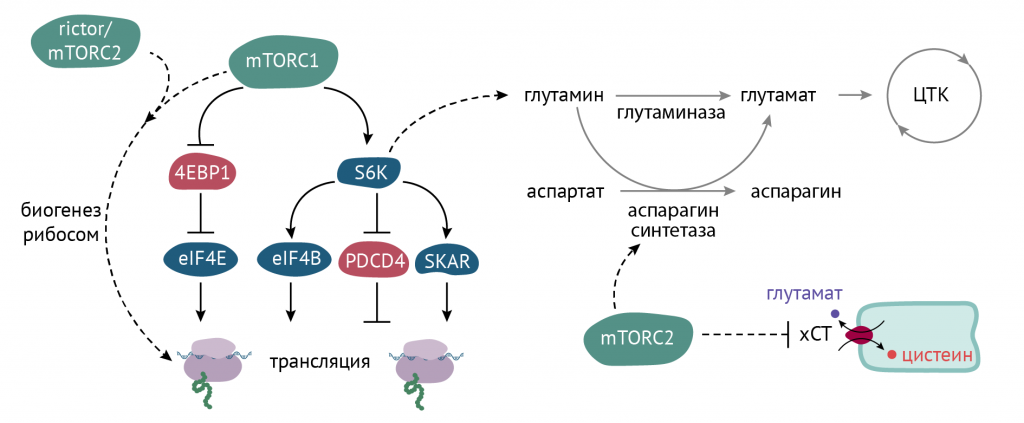
Отдельно стоит упомянуть и об этом моменте. На схеме выше вы могли видеть запуск митоген активного протеинкиназного каскада (SOS — RAS — RAF — MEK) от инсулинового рецептора. Данный каскад поддерживает процессы фосфорилирования внутриядерных транскрипционных факторов (ERK и прочих), что неминуемо приводит к и изменениям экспрессии генов, отвечающих за за смену фаз клеточного цикла (циклины D, E, циклин-зависимые киназы (CDK) 4, 6, 1, 2).
Они заставляют клетку переходить из фазы G1 в S. В синтетической фазе активируется крайне важный транскрипционный фактор — E2F. Он-то и опосредует запуск программы реализации синтетических процессов, необходимых для пролиферации, которые мы обсуждали во второй статье данного цикла.
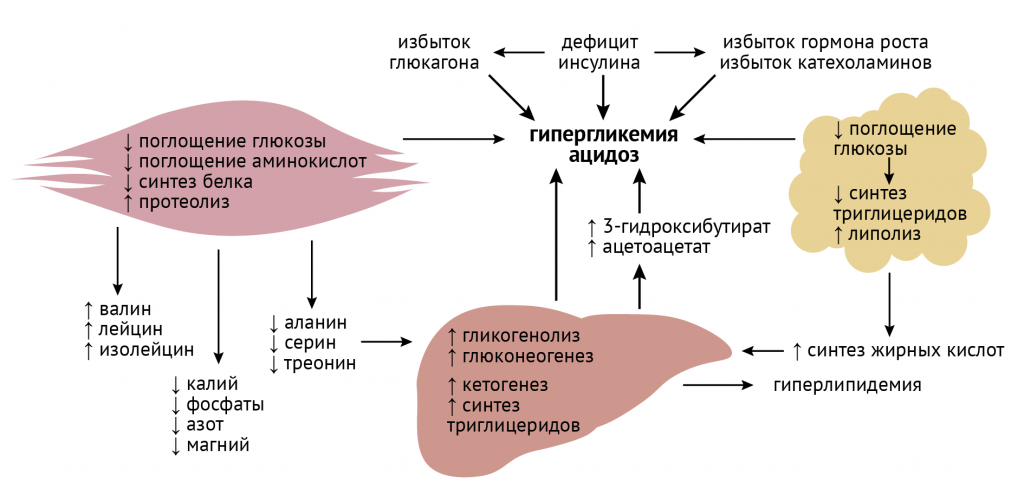
Метаболические последствия гипергликемии и отсутствия инсулина
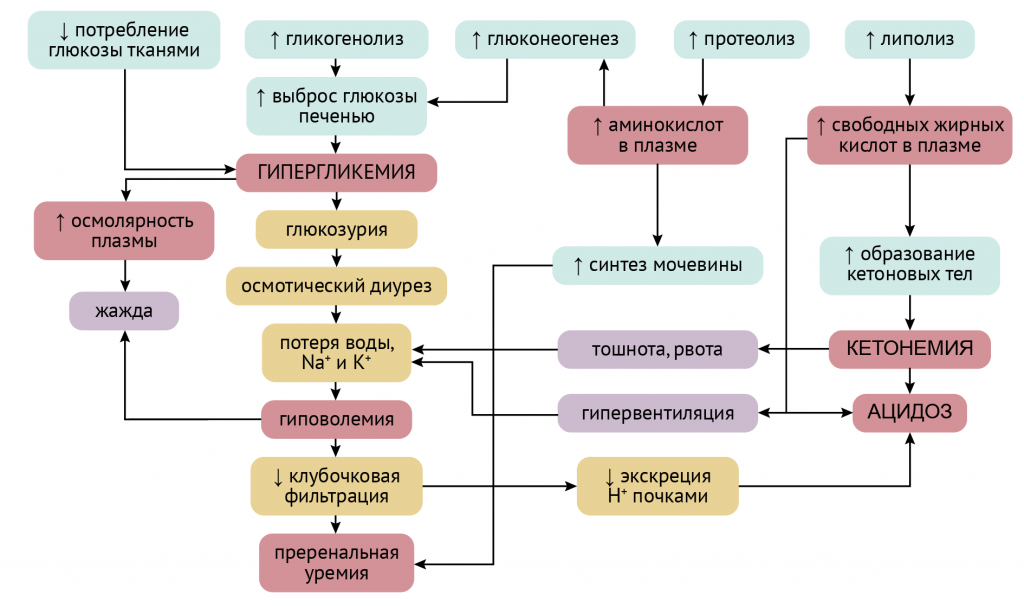
В отсутствие инсулина в печени и почках усиливается глюконеогенез, что приводит к постоянному расходованию аминокислот и повышению уровня белкового катаболизма.
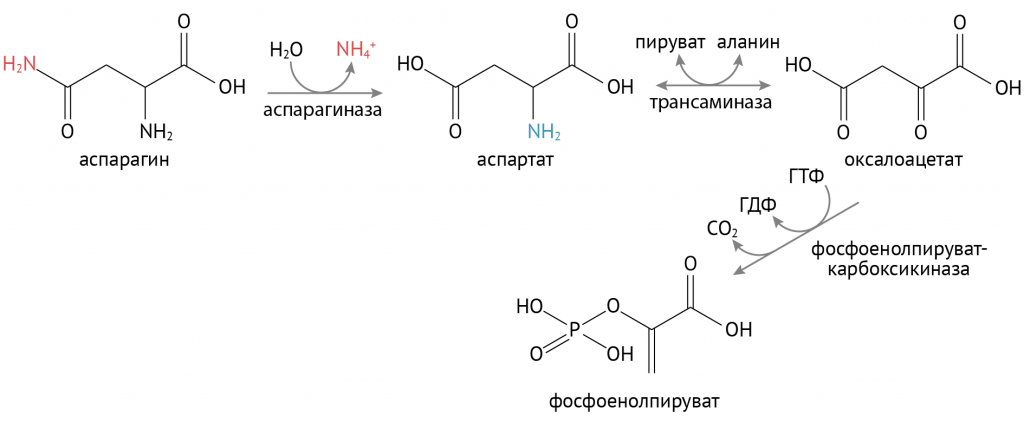
Так, аспарагин в реакции трансаминирования (АсТ) становится оксалацетатом, который превращается в фосфоенолпируват.
Снижение пула оксалацетата ослабляет течение ЦТК: ведь мы с вами помним, что уменьшение количества субстрата биохимической реакции снижает ее интенсивность. Утилизация оксалацетата в процессах глюконеогенеза улучшает биоэнергетику клетки и снижает образование АТФ. Но глюконеогенез без инсулина, несмотря на снижение уровня АТФ, лишь усиливается, и концентрация глюкозы в клетке растет.
При этом утилизировать ее все равно сложно в силу отсутствия стимулирующего влияния инсулина на фосфофруктокиназу — ключевой фермент гликолиза, катализирующий термодинамически необратимую стадию этого процесса [3, 5]. Я уж не говорю о нарушении GLUT4-зависимого транспорта глюкозы в клетку и о вовлечении аминокислот в процессы глюконеогенеза и катаболизм белков.
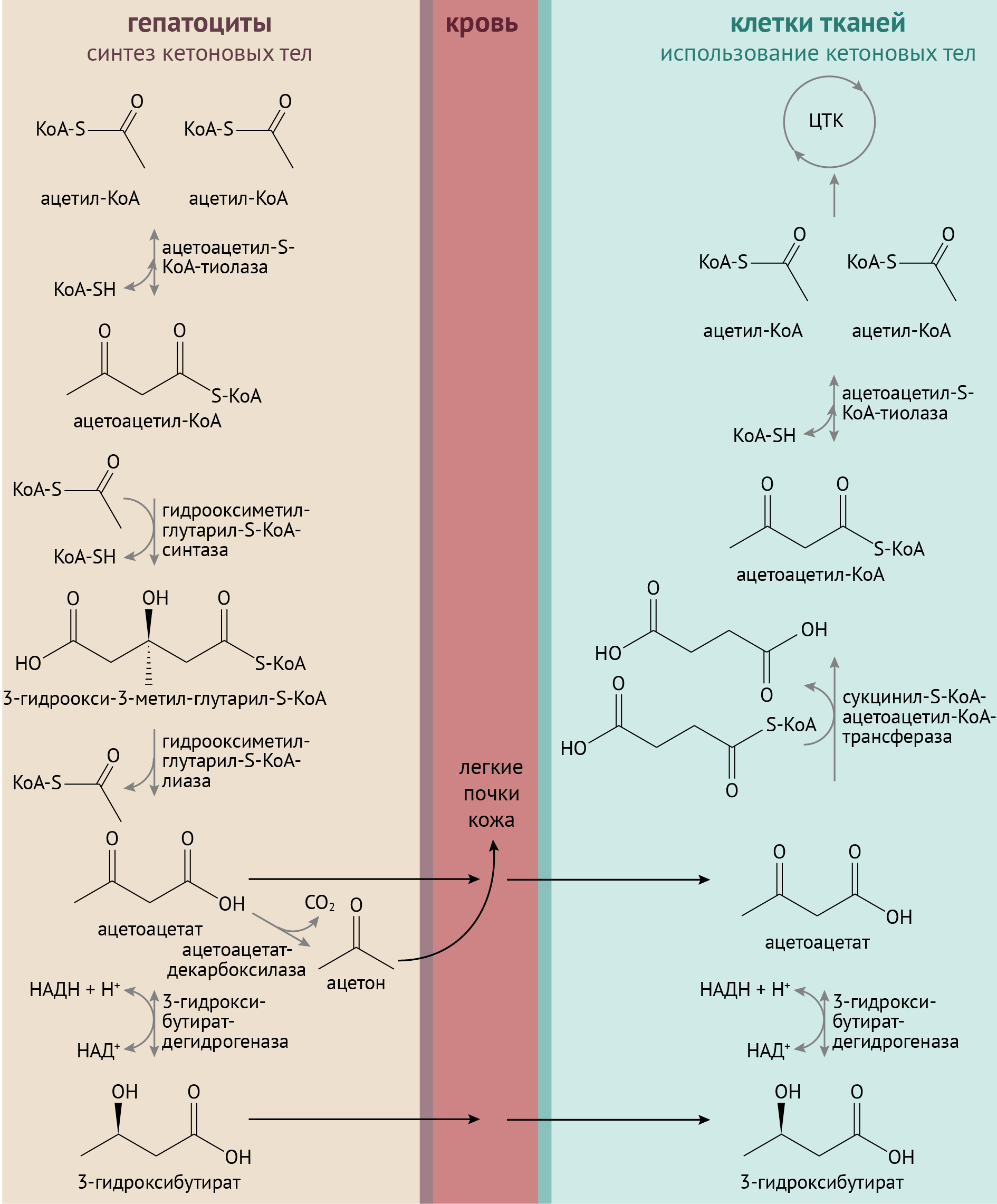
Второй момент: в отсутствие инсулина жиры начинают интенсивно расщепляться (организм пытается получить энергию хоть откуда-нибудь). Повышенное образование жирных кислот из ТАГ приводит к увеличению их уровня в плазме. Усиливается их β-окисление, образуется много ацетил-КоА, но вот проблема: относительно уменьшающегося содержания оксалацетата ацетил-КоА становится чрезвычайно много. Природа не терпит пустоты, и из этого избытка ацетил-КоА образуются кетоновые тела.
Клинические последствия метаболических изменений
Инфекционные заболевания
В условиях повышенного белкового катаболизма (во многом связанного с усилением глюконеогенеза) возникает белковая недостаточность. Страдает от этого все, особенно иммунная система. Белок необходим для синтеза антител, интерлейкинов и прочих штук, которыми располагает иммунитет, реализуя защитный ответ против чужеродных антигенов. Есть данные, что гипергликемия служит непосредственной причиной нарушения функции лейкоцитов. Все это приводит к тому, что люди с диабетом часто страдают от некоторых инфекционных заболеваний. Так, при диабете увеличивается риск возникновения инфекций желудочно – кишечного тракта (соотношение шансов наступления данного явления — 1,38 (95 ДИ 1,15–1,67,p < 0.001), кожи и мягких тканей (соотношение шансов — 1,48 (95 ДИ 1,21–1,69, p < 0,001).
Нередко у них встречается и носительство синегнойной палочки — особенно при хронических неспецифических заболеваниях легких (бронхоэктатическая болезнь). Туберкулез у таких больных — особенно его реактивация после лекарственного лечения — тоже, к сожалению, не редкость.
Метаболический ацидоз
В условиях усиленного кетогенеза возникает метаболический ацидоз, так как кетоновые тела — это существенный источник протонов, и уровень их диссоциации коррелирует со степенью закисления внутренней среды. Изменение концентрации протонов до поры до времени компенсируется работами буферных систем (бикарбонатной, белковой и прочих), но в конечном итоге этого становится недостаточно. Развивается метаболический ацидоз, имеющий решающее значение в декомпенсации сахарного диабета.
Гиповолемия, усугубление метаболического ацидоза и его влияние на функцию внутренних органов
Гипергликемия превращается в глюкозурию при преодолении порога в 9–11 ммоль/л (по разным данным). Будучи сильно водорастворимым соединением, глюкоза поступает в почки и оказывает диуретический эффект, т. к. тянет за собой воду. С мочой теряются и электролиты. Все это приводит к гиповолемии.
По последним данным, при неконтролируемом сахарном диабете парадоксальным образом почечная реабсорбция глюкозы увеличивается (имеет место дезадаптация защитного механизма, позволяющего почкам экскретировать глюкозу при повышении уровня сахара в крови), а почечный порог глюкозы смещается к более высоким значениям гликемии. Ключевую роль в этом играет повышенная активность белков-транспортеров глюкозы, преимущественно SGLT2, что способствует возрастанию реабсорбции глюкозы в почках и поддержанию хронической гипергликемии.
Гиперкалиемия
В ответ на ацидоз из клеток выходит калий, пытаясь компенсировать этот беспредел, но это у него получается плохо [7, 8].
При декомпенсации сахарного диабета в виде гипергликемии и лактатного ацидоза инсулинотерапия приводит к возвращению калия в клетку, что может стать причиной угрожающей жизни гипокалиемии. В этом случае лабораторная оценка уровня калия в крови не всегда отражает реальное его содержание в организме.
Декомпенсация и развитие полиорганной недостаточности
Стимуляция кетогенеза, гипергликемия, потеря воды и электролитов — натрия, калия, хлора, бикарбонатов (в том числе как результат ацидоза) — составляют потенциально смертельную метаболическую комбинацию. Все эти изменения чреваты развитием полиорганной недостаточности. Ведущими линиями декомпенсации будут метаболический ацидоз и циркуляторная гипоксия (связанная, главным образом, с гиповолемией).
Последняя является причиной ухудшения почечного кровотока и развития азотемии (чем и почему опасна азотемия декомпенсации, мы рассмотрим в будущих главах). Главной мишенью и решающим элементом в декомпенсации, существенно ухудшающим прогноз, будет поражение нервной системы — как в результате циркуляторной гипоксии и метаболического ацидоза, так и вследствие вторично развивающейся на этом метаболическом фоне острой преренальной почечной недостаточности.
Надо сказать, что наиболее часто декомпенсация свойственна людям с диабетом I типа: для них очень характерно развитие диабетического кетоацидоза. Для диабета II типа и иных, специфических типов диабета развитие кетоацидоза является редкостью (но «редко» — не значит «никогда»).
Длительное течение сахарного диабета приводит к поражению сосудов среднего и мелкого калибра, которое носит название диабетической ангиопатии. В целом, это выражается в реализации дистрофических и фиброзно-пролиферативных процессов в стенках сосудов, что существенно ухудшает микроциркуляцию и транскапиллярный обмен между сосудами и тканями, а также кровоснабжение сосудистых стенок. Наиболее выраженные изменения возникают в почках (диабетическая нефропатия и нефросклероз — одна из ведущих причин хронической почечной недостаточности), в сетчатке глаза (диабетическая ретинопатия — постепенное ухудшение зрения вплоть до слепоты), сосудах, питающих нервные волокна (нейропатия, развитие вегетативных нарушений — нарушение функции тазовых органов; развитие двигательных и чувствительных неврологических нарушений; в ряде случаев это проявляется усугублением течения ишемической болезни сердца за счет безболевой ишемии миокарда и бессимптомного течения инфаркта миокарда).
Сахарный диабет имеет системные проявления, и это особенно заметно при его комбинации с другими заболеваниями. В ряде случаев диабет играет роковую роль, утяжеляя их течение. В особенности это касается атеросклероза и гипертонической болезни, что связано с уже упомянутой диабетической ангиопатией. При ее наличии атеросклероз становится более распространенным и затрагивает сосуды мышечного типа среднего калибра, что не характерно для такого заболевания при отсутствии сахарного диабета.
О роли сахарного диабета в течении других болезней и его последствиях можно говорить бесконечно. Особого внимания заслуживает повышенный риск возникновения и усугубление течения инфекционных заболеваний в целом, и туберкулеза, синегнойной инфекции, кандидоза и других видов микозов — в частности. Больные диабетом требуют особого подхода и в хирургической практике. Операция является для организма стрессовой ситуацией, на которую он отвечает неспецифично — выбросом глюкокортикостероидов и активацией симпато-адреналовой системы. Как ты уже понял, в этих условиях возникает гипергликемия, в силу чего такие пациенты нуждаются в консультации с эндокринологом; подробнее об этом рассказано тут.
Многие заболевания у пожилых пациентов зачастую проявляются атипично, иначе говоря — «смазанно», без выраженной характерной для конкретного заболевания симптоматики. Например, одним из немногих симптомов пневомнии, инфаркта миокарда, острых гнойных заболеваний брюшной полости и т. д. может быть гипергликемия (т. е. повышение уровня сахара относительно «привычного» для конкретного пациента уровня) и декомпенсация сахарного диабета — опять же, в связи с неспецифическим ответом организма на возникающие повреждения в органах и тканях. Будь внимательнее.
Продолжение следует.
