Выдержка
Как йод, так и селен являются важными элементами для выработки гормонов щитовидной железы, и в то же время они играют главную роль в развитии аутоиммунного тиреоидита. По данным множества исследований, длительное потребление большого количества йода связывается с большей частотой случаев аутоиммунного тиреоидита. Избыточное потребление иода чувствительными лицами приводит к увеличению инфильтрации тканей щитовидной железы Т-хелперами 17 и подавляет дифференцировку регуляторных Т-лимфоцитов (Treg), в то же время увеличивая экспрессию родственного фактору некроза опухоли апоптоз-индуцирующего лиганда (TRAIL) в тироцитах, что приводит к их апоптозу и разрушению паренхимы щитовидной железы. Как было показано на мышиной модели, высокий уровень потребления йода приводит к изменению иммуногенности молекулы тиреоглобулина, увеличению экспрессии молекулы межклеточной адгезии-1 (ICAM-1), а также образованию активных форм кислорода (АФК) в тироцитах. Было обнаружено, что содержание селена в плазме крови снижено у больных тиреоидитом Хашимото, диффузным токсическим зобом, а также заболеваниями глаз, связанными с функцией щитовидной железы. При этом уровень селена оказался связан с течением и исходом заболевания. Посредством множества селенпротеинов селен активно участвует в антиокислительных, окислительно-восстановительных и противовоспалительных процессах. Селен усиливает активность CD4+/CD25 FOXP3 и Treg-лимфоцитов и подавляет выделение цитокинов, таким образом предупреждая апоптоз фолликулярных клеток и защищая от тиреоидита. Препараты селена могут быть полезны при лечении аутоиммунного тиреоидита, но, несмотря на их хорошую переносимость, они не должны быть рекомендованы всем пациентам без исключения. Также они могут использоваться лицами с дефицитом селена и страдающими аутоиммунными заболеваниями. В общем и целом, поддержание необходимого уровня селена в организме и нормального уровня выделяемого с мочой йода является обязательным условием контроля течения тиреоидита, и, предположительно, может играть важную роль в предупреждении болезни.
Введение
Аутоиммунный тиреоидит (АИТ), в том числе его наиболее распространенная форма – тиреоидит Хашимото (ТХ) – это органоспецифичная болезнь, для которой характерно глубокое взаимодействие генетических факторов с факторами окружающей среды . Заболеваемость АИТ растет во многих странах. Он затрагивает около 12% популяции в зависимости от возраста (чаще встречается у женщин в постменопаузе), пола (в 10 раз чаще встречается у женщин) и расы (европеоиды болеют чаще негроидов) . Для ознакомления с масштабным анализом взаимодействия факторов внешней среды и генетики читателю предлагаются несколько последних обзоров . В данной статье рассматривается ключевая роль, которую могут играть йод и селен в развитии АИТ, причем основной упор сделан на обновлении информации о молекулярных механизмах, включенных в сложный патогенез АИТ.
Йод
Недостаточное содержание йода в продуктах питания в некоторых регионах мира, которое долгое время вызывало болезни дефицита йода, сегодня в значительной мере преодолено при помощи программ обязательного йодирования продуктов во множестве стран. Так или иначе, эти усилия привели к фактическому искоренению серьёзного дефицита йода в этих регионах, а вместе с этим и к росту заболеваемости АИТ. Между тем, в последнее время во множестве стран было отмечено, что снижение потребления йода приводит к снижению частоты случаев АИТ . Влияние программы по достижению потребления йода на минимально рекомендованном уровне было изучено в двух идентичных исследованиях, охватывающих разные группы и слои населения до проведения программ йодирования и спустя 4-5 лет после того, как было проведено обязательное йодирование соли в Дании . После того, как программа была реализована, встречаемость антител к тиреоидной пероксидазе (АТ-ТПО) и антител к тиреоглобулину (АТ-ТГ) увеличилась, в особенности среди молодых женщин и в низкой концентрации . Согласно популяционному исследованию, охватившему 1085 человек из Сан-Паулу, повышенное потребление йода в течение 5 лет привело к повышению среднего значения выделения йода с мочой свыше 300 мкг/л и 400 мкг/л у 45.6% и 14.1% участников исследования соответственно . Помимо этого, распространенность АИТ выросла до 17%, у 8% лиц был выявлен гипотиреоз и 3.3% исследуемых страдали гипертиреозом. Что еще более важно, потребление избыточного количества йода (выделение свыше 300 мкг/л) может представлять серьёзную опасность для общества из-за того, что это значительно повышает частоту случаев субклинического гипотиреоза и АИТ . Это также было отмечено при наблюдении за двумя китайскими общинами, для которых было характерно высокое (261 мкг/л) и нормальное (145 мкг/л) потребление йода, а также в исследовании, проведенном в коммуне Пескопагано на юге Италии. В последнем случае исследование охватило 1411 человек в 1995 и 1148 человек в 2010 после введения программы по йодированию соли . Распространенность гипотиреоза возросла с 2.8% в 1995 до 5.0% в 2010 (pp<0.005) главным образом из-за участившихся случаев субклинического гипотиреоза (СКГ) у лиц младше 15 лет. Вместе с этим, уровни АТ-ТПО (19,5% к 12,6%, p<0.0001) и доля заболевших тиреоидитом Хашимото (14,5% к 3,5%, p<0.0001) увеличились в 2010 по сравнению с 1995 . Таким образом, становится очевидным, что даже небольшие изменения в объеме потребляемого йода могут привести к довольно большой разнице в распространенности тиреоидитов, при том, что потребление йода на уровне чуть ниже или чуть выше нормы оказалось связанным с повышенным риском болезни . На основе этих данных можно сделать вывод о том, что наиболее целесообразным является потребление йода в узком интервале, что позволит предупредить заболевания, связанные с дефицитом йода, а также сведет риск заболеть аутоиммунным тиреоидитом к минимуму. На различных экспериментальных животных моделях, таких как крысы BioBreeding/Worcester (BB/W) и в особенности мыши с нормальным весом, страдающие диабетом (NOD) , больных АИТ, потребление йода существенно увеличивало и ускоряло заболеваемость АИТ в зависимости от дозировки, таким образом подтверждая выводы о том, что чрезмерное потребление йода связано с аутоиммунными процессами, направленными на щитовидную железу.
Йод и аутоиммунный тиреоидит: механизмы возникновения
Важность тиреоглобулина (ТГ), первого обнаруженного гена предрасположенности к тиреоидиту, в индукции АИТ при взаимодействии с йодом хорошо известна с 1956 . В 1992 при исследовании на крысах BB/W было обнаружено, что высокое потребление йода приводило к спонтанному развитию сахарного диабета первого типа и лимфоцитарного тиреоидита и существенно повышало заболеваемость тиреоидитом, в то время как сниженное потребление йода вызывало противоположный эффект . Также было отмечено, что степень йодирования тиреоглобулина находится в связи с развитием лимфоцитарного тиреоидита у крысы. С тех пор было установлено, что йод вызывает аутоиммунные реакции, индуцируя формирование «криптических пептидов» в молекуле тиреоглобулина, которые, в свою очередь, окружают «криптические антигенные детерминанты» на тиреоглобулине с иммуностимулирующими свойствами . В то же время было продемонстрировано, что действие АТ-ТГ, направленное на В-антигенную детерминанту тиреоглобулина, чаще встречалось у лиц, употреблявших йодированную соль . Более того, аутореактивные Т-клетки могут размножаться в ответ на нормальный уровень тиреоглобулина, в то время как это не наблюдалось при отсутствии йодизации этого белка . Избыточное количество йода вызывает повышение экспрессии молекулы межклеточной адгезии-1 (ICAM-1) на поверхности клеток разных типов, в том числе тироцитов . Образующиеся во время органификации йода в щитовидной железе АФК и в особенности перекись водорода могут повлиять на повышение содержание ICAM-1 и активировать её транскрипцию синергетически вместе с йодом при помощи сигнального пути MAPK . Иммунологическая реакция при ТХ запускается в тироцитах и индуцируется выработкой воспалительных цитокинов, в частности γ-интерферона (γ-ИФН), Т-лимфоцитами 1 типа . Таким образом, была выдвинута гипотеза о том, что γ-ИФН индуцирует экспресиию ГКГ II класса на кроветворных и эпителиальных клетках, а также активирует макрофаги и ICAM-1. Все это приводит к увеличению рекрутинга лейкоцитов в области воспаления . Этот предложенный вариант развития аутоиммунной реакции при участии γ-ИФН по-прежнему противоречив, так как было выявлено, что γ-ИФН способен оказывать подавляющее болезнь действие . Например, у трансгенных мышей NOD.H-2h4, имеющих такой же, как у диких мышей, уровень γ-ИФН в плазме, наблюдалась повышенная экспрессия ГКГ II класса в тироцитах, однако это не вызывало спонтанный тиреоидит. Иммунизация мышиным тиреоглобулином приводила к более мягкому протеканию болезни и снижала активацию CD4+ лимфоцитов в шейных лимфатических узлах . Этот эффект был подтвержден, и был сделан вывод о блоке системного утяжеления течения болезни γ-ИФН благодаря его локальному подавляющему эффекту. Это может объясняться снижением количества тиреоидных антигенов, которые могут быть поглощены резидентными антиген-презентирующими клетками (АПК), а также индукцией регуляторных белков, относящихся к семейству подавителей цитокиновых сигналов (suppressor of the cytokine signalling, SOCS), а именно SOCS-1, которые ослабляют или прекращают иммуностимулирующие сигналы . С другой стороны, γ-ИФН индуцирует выработку протеина 10 (IP-10), который является хемокином, действующим через связывание с хемокиновым рецептором с мотивом C-X-C 3 (CXCR3) . Оказалось, что IP-10 и его рецептор CXCR3 участвуют в патогенезе различных органоспецифичных аутоиммунных болезней, таких как ТХ и болезнь Грейвса (БГ). Было предположено, что уровень IP-10 может быть маркером тяжести аутоиммунного процесса, так как он был значительно повышен у пациентов с гипоэхогенной картиной УЗИ, что является признаком более существенной лимфомоноцитарной инфильтрации у пациентов с тиреоидитом . Эти результаты были подтверждены экспериментальным исследованием, которое показало, что потребление йода у крыс вызывало увеличение числа CD4(+) T клеток, а также IP-10 в сыворотке, что свидетельствовало о том, что высокое потребление йода усиливало воспалительную реакцию в щитовидной железе при помощи повышения уровня IP-10 в сыворотке после запуска АИТ бычьим тиреоглобулином . Другие исследования трансгенных мышей NOD.H-2h4 выявили ведущую роль Т-хелперов 17 в АИТ, индуцированном избытком йода, принимая во внимание то, что они способны усиливать воспалительную реакцию, которая отрицательно регулируется Т-хелперами 1 и 2 типов и Т-reg лимфоцитами . Таким образом, высокое потребление йода способствует образованию Т-хелперов 17 из Т-клеток и замедляет образование Т-reg лимфоцитов. Необходимо отметить, что повышенная концентрация IL-17 в сыворотке обратно коррелировала с остаточной функцией щитовидной железы у пациентов, в то время как экспрессия IL-17 внутри щитовидной железы коррелировала со степенью локального фиброза . Повышенное отношение Т-хелперов 17 к Т-хелперам 10, обнаруженное у пациентов, больных ТХ, после стимуляции тиреоид-специфичными аутоантигенами одновременно с повышенной базовой выработкой интерлейкина-6 (IL-6), фактора роста опухолей-β1 (TGF-β1) и мРНК, кодирующей молекулы FoxP3, лишенные экзона (FOXP3Δ2), могут играть роль в усилении реакции Т-хелперов 17 при ТХ . Более того, экспрессия преобразователя сигнала и активатора транскрипции 3 (STAT3) была значительно повышена, в то время как экспрессия FOXP3 была значительно снижена, а доля Т-хелперов 17 – также значительно увеличена (Рис. 1). Необходимо подчеркнуть ключевую роль гена FOXP3 в развитии Т-reg лимфоцитов, учитывая тот факт, что мутации в данном гене вызывают серьёзные системные аутоиммунные болезни у человека и у мышей, так как полиморфизм FOXP3 гена может изменять функцию и/или экспрессию белка FOXP3 и вызывать генетическую предрасположенность к АИТ . Повышенное потребление йода (315 мкг и 615 мкг в день соответственно) у трансгенных мышей без антител, TAZ10, которые иммунологически восприимчивы к АИТ, изменяет профиль иммунных клеток (CD8+ и регуляторных Т-клеток, естественных киллеров) и образование цитокинов, не влияя на развитие болезни . Повышенное потребление йода у NOD.H2(h4) мышей, наоборот, усиливало заболеваемость и тяжесть случаев спонтанного аутоиммунного тиреоидита. Наиболее вероятным механизмом этого эффекта является активация апоптоза тироцитов под действием CD4 и СВ8 Т-лимфоцитов и последующее нарушение механизмов иммунной регуляции . Ряд сигнальных путей апоптоза, в том числе лиганд Fas и лиганд, индуцирующий апоптоз, связанный с фактором некроза опухолей (TRAIL), предположительно играют роль в разрушительном процессе тиреоидита. Таким образом, существует вероятность, что избыточное потребление йода индуцирует аномальную экспрессию TRAIL в щитовидной железе, способствует апоптозу фолликулярных клеток и выступает в качестве посредника при разрушении щитовидной железы .

Источник: Metabolic and Hormone Research Высокое потребление йода у восприимчивых людей может приводить к повышенной экспрессии ICAM-1 на фолликуллярных клетках ЩЖ, индуцировать дифференцировку Т-хелперов в сторону Т-хелперов-1 (Th1), снижать уровень CD4+ / CD+ 25, FOXP3 и TREG, усиливать секрецию цитокинов, индуцировать апоптоз через аномальную экспрессию TRAIL и опосредовать разрушение щитовидной железы. ICAM: внутриклеточные молекулы адгезии; TRAIL: фактор некроза опухоли (ФНО), связанный с апоптоз-индуцирующими лигандами (TRAIL); FOXP3: транскрипционный белок-фактор p3 (FOXP3).
Селен и аутоиммунный тиреоидит
В живых организмах селен существует либо в качестве соединений с низким молекулярным весом, таких как селенит, селенометионин, метилселенол или селенометилселеноцистеин, или собирается из селеноцистеина (аминокислота; Sec) в селеносодержащие протеины (селенопротеины). В тканях щитовидной железы содержится больше селена (в мкг/г ткани), чем в каком-либо другом органе. Селен необходим для процесса дейодирования тироксина дейодиназой, а также для разрушения избытка H2O2 при помощи глутатионпероксидазы и тиоредоксинредуктазы . По этой причине многие исследования больных АИТ проводились в некоторых странах с непостоянным уровнем содержания селена в почве с целью определить влияние селена на маркеры АИТ . Большинство исследований показали, что применение органического соединения селена в форме селеленметионина приводит к снижению АТ-ТПО, в то время как использование неорганического соединения селена в нескольких других исследованиях не оказало никакого влияния на тироидные антитела по сравнению с плацебо. Два мета-анализа подтвердили роль селена в снижении АТ-ТПО и улучшении течения ТХ , в то время как другой мета-анализ, результаты которого хранятся в Кокрановской библиотеке, показал, что пока недостаточно знаний для того, чтобы поддерживать или отрицать эффективность применения селена при лечении ТХ . В недавно проведенном двойном слепом, рандомизированном, плацебо-контролируемом исследовании на 230 женщинах с одноплодной беременностью было выявлено, что применение препаратов селена в низкой дозировке (60 мкг/день) не влияло на уровень АТ-ТПО, но изменяло функцию щитовидной железы, снижая уровень тиреотропного гормона и свободного тироксина у пациентов с тиреоидными антителами . Расходящиеся результаты различных исследований могут объясняться неоднородностью групп пациентов, а также различиями в базальном уровне селена и йода, продолжительности исследования и применяемых соединениях селена . У пациентов, больных АИТ, был отмечен несколько пониженный уровень селена по сравнению с лицами из контрольной группы в рамках исследования, проведенного в Нижней Австрии . Также другое исследование, проведенное в Дании, показало, что у пациентов с впервые диагностированным АИТ, и в особенности у больных болезнью Грейвса, был значительно более низкий уровень селена в иммунной сыворотке по сравнению со случайной выборкой здоровых лиц, что указывает на потенциальную связь между недостаточным потреблением селена и явным аутоиммунным заболеванием щитовидной железы, в особенности при болезни Грейвса . В то же время уровень селена в сыворотке был снижен по сравнению с контрольной группой у больных АИТ и болезнью Грейвса, в то время как высокие уровни селена (>120 мкг/л) были связаны с ремиссией и лучшим исходом болезни . Более того, более низкие уровни селена в сыворотке были отмечены у пациентов с офтальмопатией, вызванной заболеваниями щитовидной железы, по сравнению с больными болезнью Грейвса, как показало автралийское исследование населения с пограничным состоянием по уровню селена. Эти результаты подчёркивают связь между недостаточным потреблением селена и аутоиммунными процессами в щитовидной железе и убедительно показывают, что низкий уровень селена может быть фактором риска для развития тиреогенной офтальмопатии у пациентов с болезнью Грейвса. Применение селена в лечении этого заболевания, сопровождающегося умеренной офтальмопатией, статистически значительно снижало поражение глаз и повышало уровень жизни, так как замедляло течение болезни после 3 и 6 месяцев лечения . Таким образом, эти результаты указывают на возможность положительного влияния применения селена на пациентов, которое может выступать средством снижения индивидуального риска развития аутоиммунных процессов, ровно как и средством от селенодефицита, который обычно развивается с течением болезни.
Механизмы действия селена
Селен переменным образом связан с аутоиммунным тиреоидитом. Помимо регуляторной роли, которую селен, являясь центральным обязательным элементом дейодиназы, играет в дейодизации тиреоидных гормонов, он также нейтрализует диффузию и активность избытка перекиси водорода при помощи глутатионпероксидазы 1 (GPx1) и глутатионпероксидазы 3 (GPx1) и таким образом сохраняет целостность тироцитов . Соответственно, было отмечено, что условное нокаутирование (conditional knockout) гена, отвечающего за синтез Sec-тРНКSec (специфическая тРНК, отвечающая за включение в белковую цепочку селеноцистеина при условии наличия в мРНК кодона UGA прим. переводчика) приводит к снижению экспресии всего набора селенопротеинов (или селенопротеома) как в гепатоцитах, так и в Т-клетках . CD4+T-клетки могут дифференцироваться и в Т-хелперы 1 (Th1), и в Т-хелперы 2, в зависимости от условий. Диета с высоким уровнем селена может запустить окислительный всплеск в ответ на стимуляцию Т-клеточного рецептора (TCR) . Также известно то, что Т-хелперы 0 (недифференцированные Т-клетки) и Т-хелперы 1 могут выполнять функции Т-хелперов и приводить к выработке аутоантител к ТГ и ТПО . TCR индуцирует дифференцировку CD+T-клеток в FOXP3+ T-reg клетки, на которые предположительно влияет высокое потребление селена . Сокращение количества или нарушение функций CD25+CD4+ TREG клеток приводит к развитию аутоиммунной болезни. Важно отметить, что удаление CD4+CD25+TREG клеток у трансгенных NOD мышей с нокаутным геном HLA DR3 (ГКГ II класса) (DRB1*0301) перед терапией дигидратом иодида натрия индуцировало образование антител, разрушающих клетки щитовидной железы, в 68% случаев и увеличивало титр антител к тиреоглобулину в сыворотке. . В экспериментальном исследовании селен в неорганической форме ингибировал в зависимости от дозы экспрессию молекул HDL-DR при помощи снижения концентрации АФК в культурах человеческих тироцитов, подверженных действию γ-ИФН . Применение селена при лечении АИТ влияет, в зависимости от дозировки, на IL-2 и другие цитокины, играющие разные роли в патогенезе АИТ (Рис. 2).
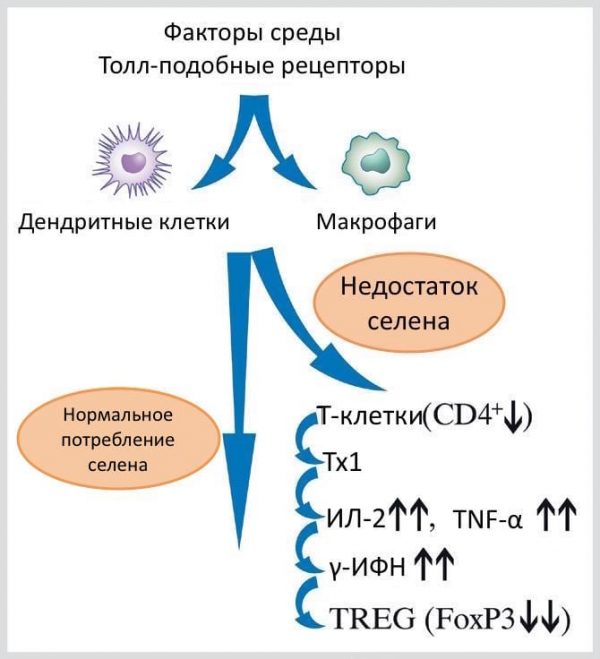
Источник: журнал Metabolic and Hormone Research Увеличение захвата Se индуцирует через активацию Т-клеточного рецептора (ТКС) дифференцировка CD4+ Т-клеток в CD25+, Foxp3+ и Т-регуляторные клетки (TREG). Достаточный уровень потребления селена не влияет на Т-клетки и Т-хелперы (Th0) и их дифференциацию в Th1 или Th2 клетки. И напротив, дефицит селена, как фактор окружающей среды, повышает активацию Т-клеток, в то время как соотношение Т-хелперов-1 (Th1) / и Т-хелперов-2 (Th2) может перейти к ответной реакции Th1-типа, увеличивая выработку таких цитокинов, как ИЛ-2, ФНО-a, ИФ-гамма, тем самым уменьшая число CD25+ Т-регуляторных клеток (Treg) и FOXP3 и параллельно ингибируя активацию дендритных клеток и макрофагов через подобные Toll-рецепторам (TLR) клеток. TREG, вероятно, отвечает на различные лиганды TLRs, таким образом, TLRs может оказывать разные эффекты на Treg, в зависимости от степени воспаления, в результате чего вызывать увеличение, или, напротив, снижение супрессии. Селен может косвенно подавлять активацию фактора некроза опухолей (TNF) и высвобождение цитокинов. Стоит отметить, что при увеличении дозы селена может быть снижена концентрация активатора рецепторов лиганда ядерного фактора-κB (RANKL), связанного с активацией TNF-α . В соответствии с этими данными в экспериментальном исследовании, целью которого было изучение действия селенометионина на высвобождение противовоспалительных цитокинов из моноцитов и лимфоцитов у больных ТХ, не принимающих лекарств, было обнаружено существенное торможение γ-ИФН и IL-2 селенометионином, при этом эффект увеличивался при одновременной терапии LT4 и селенометионином . Таким образом, селен напрямую и косвенно оказывает противовоспалительное и антиокислительное действие, что периодически выявлялось при исследовании иммунных клеток человека и животных. В данной связи, применение селена в виде селенита (50 мкг/день или 100 мкг/день) увеличило активность GPX1 и GPX4 в лимфоцитах у лиц, получавших препараты селена, по сравнению с группой контроля . Макрофаги, класс миелоидных лейкоцитов с фагоцитарной активностью, определяют присутствие характерных молекул, сигнализирующих о микробной инфекции или повреждении тканей . Недавно одно экспериментальное исследование показало, что повышенное образование перекиси водорода макрофагами после стимуляции зимозаном может быть непосредственно связано со снижением активности глутатионпероксидазы (GSH-Px), приводящей к сниженному разложению перекиси . Более того, влияние недостаточного потребления селена у мышей и крыс было изучено в исследовании GSH-Px и секреторной функции перитонеальных макрофагов, митогенеза клеток селезенки и адъювантного артрита. Макрофагальная активность GSH-Px была существенно снижена в течение 9 недель недостаточного потребления селена. Что интересно, это снижение было связано с усилившимся образованием перекиси водорода макрофагами вслед за стимуляцией зимозаном после 12 недель недостаточного потребления селена, что происходило одновременно со сходными процессами хемилюминесценции и снижением митогенеза клеток селезенки Т и В-клеточными митогенами после 8 недель недостаточного потребления селена . Макрофаги мышей подвергали воздействию липополисахарида (LPS), на что они реагировали повышенной экспрессией TXRND1, в то время как мРНК и экспрессия белка других селенопротеинов, в том числе энзимов глутатионпероксидазы, были менее затронуты, что может свидетельствовать о существенной роли TXRND1 в регулировании окислительно-восстановительного статуса макрофагов . Встраивание меченных радиоактивных изотопов селена в белок во время стимуляции LPS выявило то, что TRXND1 является единственным макрофагальным селенопротеином, индуцируемым LPS. У мышей специфическая для макрофагов абляция TRXND1 привела к очень большому снижению выработки VSIG4, белка группы B7, подавляющего активацию Т-клеток . Эти результаты указывают на связь между метаболизмом селена и передачей иммунных сигналов, а также идентификации TRXND1 в качестве и регулятора, и регулируемой цели макрофагальной сети генной экспрессии . Значительная связь между генотипами SEPS1–105 GA и AA и тиреоидитом Хашимото была обнаружена в исследовании роли полиморфизма в промоторной области селенопротеина S и гена SEPS для развития тиреоидита Хашимото . Также стоит отметить, что больные тиреоидитом Хашимото мужского пола являются носителями аллеля А в 3.94 раза чаще, чем женщины. Это было первое исследование, выявившее полиморфизмы селенопротеинов, связанных с риском развитии тиреоидита Хашимото.
источник: medach.pro
