Резюме
В статье подробно рассматриваются механизмы развития ожирения, а также эпидемиологические и патогенетические аспекты взаимосвязи ожирения и метаболических нарушений, включая сахарный диабет типа 2. В настоящее время на российском фармацевтическом рынке зарегистрирован препарат Редуксин Форте, представляющий собой фиксированную комбинацию сибутрамина и метформина в одной таблетке. Обобщены факты, свидетельствующие об эффективности и безопасности фиксированной комбинации сибутрамина и метформина в лечении не только ожирения, но и метаболического синдрома, сахарного диабета типа 2 или предиабета.
Ключевые слова:ожирение, сахарный диабет типа 2, сибутрамин, метформин, инсулинорезистентность, жировая ткань
Для цитирования: Аметов А.С., Пашкова Е.Ю., Рамазанова 3.Д., Дарсигова М.Н. Ожирение как неинфекционная эпидемия XXI века. Современные представления о патогенезе, рисках и подходах к фармакотерапии // Эндокринология: новости, мнения, обучение. 2019. Т. 8, № 2. С. 57-66. doi: 10.24411/2304-9529-2019-12007.
В настоящее время в мировом здравоохранении наблюдается парадокс – ежегодно миллионы людей умирают от болезней, развитие которых можно было предотвратить. Это объясняется разными причинами: действием факторов окружающей среды, образом жизни, генетической предрасположенностью, недостаточным вниманием к собственному здоровью, невысоким уровнем государственного регулирования медицинской помощи населению. Основными причинами большинства предотвратимых смертей являются сердечно-сосудистые заболевания, диабет, ожирение, хронические заболевания дыхательных путей, а также ряд инфекционных заболеваний. Поэтому актуальной парадигмой развития здравоохранения должно быть внедрение в клиническую практику принципов превентивной медицины [1].
Ожирение является наиболее известным и значимым фактором риска развития многих неинфекционных заболеваний (НИЗ). По данным многоцентрового (11 регионов РФ) наблюдательного исследования “Эпидемиология сердечно-сосудистых заболеваний и их факторов риска в регионах Российской Федерации” (ЭССЕ-РФ) с участием 25 224 человек в возрасте 25-64 года, распространенность ожирения в популяции составила 29,7% [2]. Причем с 2011 по 2015 г. заболеваемость ожирением среди взрослого населения возросла в 2,3 раза, а частота впервые поставленного диагноза с 2010 по 2016 г. – на 98,1% [3]. Понимание патогенетической взаимосвязи накопления избытка жировой ткани (ЖТ) с развитием и прогрессированием метаболических нарушений, а также своевременное воздействие на этот процесс могут стать ключевыми звеньями в предотвращении осложнений, снижении смертности и заболеваемости и повышении уровня здоровья населения в целом.
Причиной формирования многих НИЗ при ожирении является эндокринная и секреторная активность ЖТ. Выделяемые ею медиаторы (лептин, адипонектин, цитокины и др.) могут участвовать в системном и сосудистом воспалении, метаболизме глюкозы, повреждении печеночной ткани и др. При избытке калорий в ЖТ поступает до 90% всех жирных кислот, потребляемых с пищей, что приводит к ремоделированию адипоцитов: гипертрофии и гиперплазии с целью размещения растущего количества триглицеридов (ТГ). Гипертрофированные адипоциты менее чувствительны к действию инсулина [4], в них активно происходит липолиз. Образующиеся при этом свободные жирные кислоты (СЖК), взаимодействуя с TLR-4 – рецепторами, являющимися важным компонентом врожденного иммунитета, индуцируют экспрессию хемокинов, которые приводят к накоплению и активации макрофагов в ЖТ [5-7]. При ожирении активированные макрофаги М1-типа (классически активированные) стимулируют лейкоцитарную инфильтрацию на фоне увеличения Th-1-, Th-17-, CD8+-Т-клеток и уменьшения макрофагов М2-типа (альтернативно активированных), Th-1-, Th-17-, CD8+-Т-клеток [8-11]. Учитывая тот факт, что макрофаги способствуют гипертрофии адипоцитов, следует признать, что при ожирении имеет место порочный круг с положительной обратной связью: гипертрофированные адипоциты продуцируют хемокины и их рецепторы, которые инициируют рекрутирование моноцитов/макрофагов в ЖТ. Последние способствуют дальнейшей гипертрофии адипоцитов, часть из них гибнет, формируя иммунную память, а остальные вырабатывают белки адгезии и СЖК, в дальнейшем пролонгируя воспалительную реакцию [12] (рис. 1).
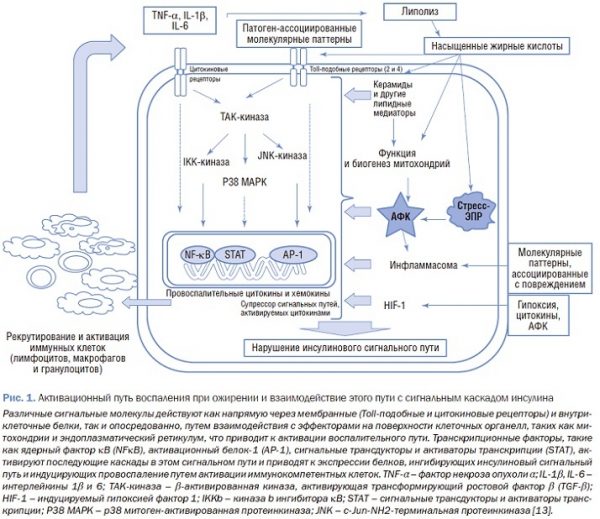
В то же время хроническое вялотекущее воспаление ЖТ считается одним из основных факторов патогенеза инсулинорезистентности, обусловленной ожирением.
В этом процессе, по всей видимости, участвует несколько механизмов. Во-первых, характерная для ЖТ гиперпродукция провоспалительных цитокинов может приводить к экспрессии супрессора цитокиновых сигналов-3, которая, в свою очередь, блокирует взаимодействие инсулинового рецептора с его субстратом, что способствует резистентности к инсулину [14]. Во-вторых, провоспалительные цитокины активируют многочисленные внутриклеточные киназы, такие как jun N-концевая киназа (JNK) и ингибитор κВ-киназы. Эти сериновые киназы ингибируют действие инсулина на различных уровнях. Увеличение циркулирующих СЖК ингибирует инсулиновую активность за счет серинового фосфорилирования субстрата рецептора инсулина и может приводить к инсулинорезистентности в скелетных мышцах и печени. Системный воспалительный ответ при ожирении способствует снижению массы функционирующих р-клеток и системной резистентности к инсулину, что приводит к сахарному диабету типа 2 (СД2) [15]. Избыток циркулирующих СЖК, образующихся в результате липолиза подкожной и висцеральной жировой клетчатки, также способствует развитию инсулинорезистентности в печени и скелетных мышцах, связанной с ингибированием передачи сигнала инсулина [16]. Кроме того, СЖК оказывают токсическое действие на панкреатические р-клетки (так называемый феномен липотоксичности), что приводит к выпадению первой фазы секреции инсулина, ингибированию экспрессии гена инсулина, ускорению апоптоза в р-клетках и активации окислительного стресса. Также СЖК подавляют способность инсулина ингибировать глюконеогенез, что сопровождается увеличением эндогенной продукции глюкозы. По всей видимости, липотоксичность является одной из основных причин снижения массы функционирующих р-клеток у пациентов с СД2 [17].
Ассоциированные с вышеописанными нарушениями гиперинсулинемия и гипергликемия, а также системные последствия патологической экспансии ЖТ в сочетании с активацией ренин-ангиотензин-альдостероновой системы определяют также патологию обмена липидов, протромботическое состояние, эндотелиальную дисфункцию. Все это в конечном итоге приводит к развитию множественных метаболических нарушений, повышению заболеваемости, снижению активности и ухудшению качества жизни больного.
Доказано, что снижение массы тела сопровождается повышением чувствительности тканей к инсулину, улучшением метаболизма липидов, устранением латентного воспаления и, соответственно, играет важнейшую роль в профилактике различных ассоциированных заболеваний и снижении риска осложнений.
В настоящее время доказано, что терапия ожирения может замедлить развитие предиабета [18, 19] и быть одним из ключевых факторов в лечении СД2. Так, уменьшение массы тела на 1 кг сопровождается снижением уровня гликированного гемоглобина (HbA1c) на 0,1% [20]. Некоторые исследования показали, что снижение массы тела на 10% сокращает риск развития СД2 в будущем на 80% [21]. В последних Стандартах медицинской помощи больным СД2 Американская диабетическая ассоциация рекомендует пациентам с предиабетом снижать массу тела на 7%, поскольку этот результат доказанно снижает риск развития диабета (уровень доказательности А) [22]. У пациентов с СД2 и ожирением небольшое и устойчивое снижение массы тела приводит к улучшению гликемического контроля и снижению доз сахароснижающих препаратов [23-25].
Уменьшение массы тела также сопровождается улучшением различных метаболических параметров: снижением систолического и диастолического артериального давления, уровней общего холестерина, ТГ и холестерина липопротеинов низкой плотности, повышением концентрации липопротеинов высокой плотности, снижением выраженности стеатоза и фиброза, выраженности гирсутизма, восстановлением менструального цикла и др. Таким образом, снижение массы тела особенно важно для повышения эффективности терапии и улучшения прогноза течения ассоциированных заболеваний [26].
В основе лечения ожирения лежит, безусловно, изменение образа жизни. По данным исследования Diabetes Remission Clinical Trial (DiRECT), снижение массы тела на 15 кг и более за 12 мес, достигнутое с помощью соблюдения гипокалорийной диеты (853 ккал/сут), способствовало достижению ремиссии СД2 (HbA1c <6,5% в течение как минимум 2 мес после отмены антидиабетических препаратов) у 86% участников программы [27].
Однако в реальной практике лишь небольшому количеству пациентов удается длительно придерживаться модифицированного образа жизни. В этой связи неотъемлемым этапом программы ведения больных с ожирением является назначение фармакотерапии.
Выбор медикаментозных препаратов для снижения массы тела, зарегистрированных для применения на территории РФ, ограничен всего тремя наименованиями:
1) сибутрамин;
2) орлистат;
3) лираглутид.
Сибутрамин селективно ингибирует обратный захват серотонина, норадреналина и дофамина в гипоталамусе, что в совокупности приводит к снижению аппетита и увеличению термогенеза [28]. Основной механизм действия сибутрамина направлен на формирование правильного пищевого поведения, которое позволяет не только эффективно снизить массу тела, но и удержать достигнутые результаты в дальнейшем. Так, показано, что через 8 мес после отмены терапии сибутрамином 79% пациентов сохранили сниженную массу тела. Сибутрамин и его метаболиты не влияют на высвобождение моноаминов, не ингибируют моноаминоксидазу, не обладают сродством к большому числу нейромедиаторных рецепторов, поэтому не вызывают привыкания, лекарственной зависимости и синдрома отмены, а следовательно, сибутрамин не снижает своей терапевтической эффективности на протяжении всего курса лечения [29-31].
Сложность и отсутствие полного понимания механизмов развития инсулинорезистентности диктуют необходимость целенаправленного воздействия на это патологическое состояние для предотвращения его стимулирующего влияния на формирование полиморбидной патологии. Основным препаратом, позволяющим скорректировать нарушения углеводного обмена, особенно на ранней стадии их развития, является метформин. В настоящее время доказано, что, помимо сахароснижающего действия, метформин оказывает ряд плейотропных эффектов, обусловливающих возможность применения препарата при метаболическом синдроме, ожирении, синдроме поликистозных яичников, неалкогольной жировой болезни печени и некоторых онкологических заболеваниях.
Так, в Британском проспективном исследовании сахарного диабета (United Kingdom Prospective Diabetes Study, UKPDS) было показано, что прием метформина способствует снижению риска сосудистых осложнений СД на 32%, смертности, связанной с СД, на 42%, общей смертности на 36%, риска инфаркта миокарда на 39%, инсульта на 41%, улучшению эндотелиальной функции и увеличению биодоступности оксида азота, усилению ответа на действие эндотелийзависимых вазодилататоров, уменьшению содержания прокоагуляционных и провоспалительных факторов, повышению уровня адипонектина, снижению глюкозотоксичности [23, 36].
Метформин оказывает ряд эффектов, которые позволяют оптимизировать терапию ожирения в отношении улучшения кардиометаболического прогноза и снижения рисков прогрессирования нарушений углеводного обмена.
В висцеральной ЖТ метформин подавляет адипогенез, способствуя улучшению композиционного состава тела. В исследовании с участием 41 пациента с ожирением (как с СД2, так и без нарушений углеводного обмена) было показано, что прием метформина в дозе 1500 мг/сут обеспечивает уменьшение объема висцерального жира за счет стимуляции окисления жиров и повышения адаптивного термогенеза [37].
Метформин не только снижает содержание провоспалительных цитокинов – интерлейкина-6 и фактора некроза опухоли а в сыворотке крови, но и модулирует поляризацию макрофагов в ЖТ, ингибируя количество провоспалительного М1-фенотипа и увеличивая содержание антивоспалительного М2-фенотипа [38].
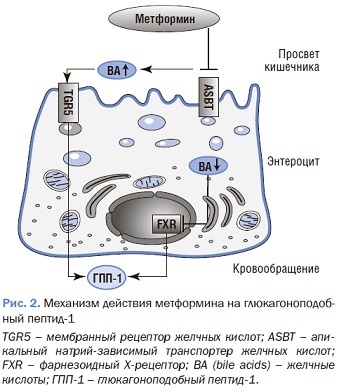 Метформин, стимулируя выработку фосфорилированной (активной) АМРК, подавляет продукцию грелина в желудке, снижая чувство голода [39]. Также метформин оказывает прямое и косвенное влияние на увеличение содержания глюкагоноподобного пептида-1 (ГПП-1), оказывающего ано-рексигенный эффект [40]. Механизм метформин-ассоциированного повышения уровня ГПП-1 до конца не изучен, но предполагается, что метформин как напрямую стимулирует выработку ГПП-1, так и увеличивает время его полураспада (рис. 2).
Метформин, стимулируя выработку фосфорилированной (активной) АМРК, подавляет продукцию грелина в желудке, снижая чувство голода [39]. Также метформин оказывает прямое и косвенное влияние на увеличение содержания глюкагоноподобного пептида-1 (ГПП-1), оказывающего ано-рексигенный эффект [40]. Механизм метформин-ассоциированного повышения уровня ГПП-1 до конца не изучен, но предполагается, что метформин как напрямую стимулирует выработку ГПП-1, так и увеличивает время его полураспада (рис. 2).
Ингибирующее действие метформина на апикальные натрий-зависимые транспортеры желчных кислот (ASBT) снижает реабсорбцию желчных кислот, что приводит к повышению их концентрации и стимуляции рецепторов TGR5 на секретирующих ГПП-1 аргентофильных L-клеток (см. рис. 2). Ингибирующее действие метформина на ASBT снижает внутриклеточную концентрацию желчных кислот в L-клетках, понижая активность рецептора FXR, стимулируя экспрессию и секрецию ГПП-1.
Есть данные о том, что метформин может потенцировать гипогликемическое действие ГПП-1 за счет повышения чувствительности тканей к этому инкретину [41].
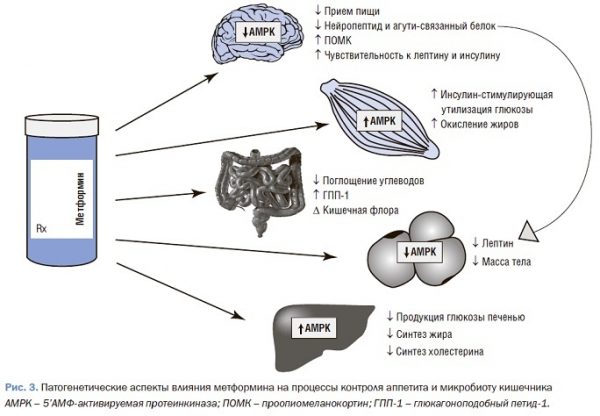
Также известны положительные эффекты метформина на кишечную микробиоту.
Обобщенные эффекты метформина на процессы контроля аппетита и микробиоту кишечника представлены на рис. 3.
Существует мнение, что комбинация метформина с рядом других ЛС, в частности с сибутрамином, может, с одной стороны, существенно расширить возможности достижения целевых уровней компенсации углеводного обмена у больных СД2, а с другой – обеспечить профилактику прогрессирования нарушений углеводного обмена у лиц без СД2. Совместное применение сибутрамина и метформина, воздействуя на разные звенья регуляции углеводного обмена и пищевого поведения, может обеспечить интенсификацию снижения массы тела и достижение основной цели лечения ожирения в разрезе превентивной медицины: улучшение кардиометаболических показателей, снижение риска осложнений и повышение качества жизни пациентов.
Имеются данные литературы о результатах комбинированного применения метформина и сибутрамина. Большинство из них посвящено использованию такой терапии для снижения массы тела у больных СД2. Тем не менее в последние годы появился ряд исследований, подтверждающих возможность применения этих препаратов при предиабете [42-44]. По нашим данным, прием комбинированной терапии в течение 6 мес привел к достоверному снижению массы ЖТ, концентрации СЖК на 20,3%, ТГ на 28,2%, лептина на 71,8%, глюкозы натощак на 12,9%, постпрандиальной глюкозы на 16% и гликированного гемоглобина на 7,5%. Через 24 нед лечения компенсация СД2 наблюдалась у 23,4% пациентов, субкомпенсация – у 72,8%. Таким образом, снижение массы тела на фоне комбинированной терапии Редуксином и метформином в течение 24 нед сопровождалось значимым улучшением углеводного обмена, снижением выраженности липотоксичности. Анализ состояния функции р-клеток островков поджелудочной железы у больных СД2 и ожирения на фоне терапии Редуксином показал, что секреция инсулина через 24 нед лечения достоверно увеличилась. Также у больных отмечалось достоверное повышение индекса функциональной активности р-клеток [35].
И.Г. Шувалова и И.В. Гребнева показали: длительный оптимальный метаболический контроль СД2 достигается при применении комбинированной терапии в дебюте заболевания, что является важной частью в лечении данного типа диабета, в профилактике макро- и микрососудистых осложнений заболевания [45]. F. Guerrero-Romero и соавт. [46] выполнили рандомизированное двойное слепое клиническое исследования с участием 27 взрослых пациентов с ожирением. Авторы оценивали влияние комбинированного и раздельного приема препаратов на чувствительность к инсулину. 3 группы пациентов принимали: а) сибутрамин и метформин, б) сибутрамин и плацебо, в) плацебо и метформин. Сибутрамин принимали утром (15 мг), метформин вечером (500 мг). Лечение и индивидуальный режим питания соблюдали в течение 90 дней. Чувствительность к инсулину была оценена в тесте на толерантность к инсулину до и после лечения, степень ожирения – по проценту жира согласно данным электрического биоимпеданса и липидного профиля.
После проведенного лечения во всех 3 группах значительно снизился индекс массы тела (ИМТ): при комбинированном приеме сибутрамина и метформина – с 35,4±3,2 до 31,6±2,9 кг/м2 (р=0,012); при приеме сибутрамина – с 34,6±4,1 до 31,1±3,7 кг/м2(р=0,008), метформина – с 32,0±2,6 до 30,3±2,5 кг/м2 (р=0,008). Применение комбинации сибутрамина и метформина способствовало значительному снижению уровня общего холестерина (р=0,017) [46]. Некоторые исследователи полагают, что более выраженного снижения массы тела можно достичь за счет комбинированного приема сибутрамина и метформина, имеющих разные механизмы действия. По данным R. Sari (2010), эффект применения комбинации метформина с сибутрамином по сравнению с приемом только сибутрамина может проявляться в снижении массы, уменьшении резистентности к инсулину, а также нормализации уровней лептина и уровня С-реактивного белка у тучных лиц с нормальной толерантностью к глюкозе. В этом аспекте исследователи сравнивали эффекты 12-месячного приема комбинации сибутрамина и метформина с использованием только сибутрамина в отношении вышеприведенных показателей у женщин с ожирением. В рандомизированном исследовании был показан более выраженный эффект применения комбинации препаратов [47].
Заключение
Таким образом, данные литературы свидетельствуют о потенциальной клинической эффективности и безопасности применения метформина в комбинации с сибутрамином в лечении ожирения, на фоне метаболического синдрома, а также СД2 и при наличии признаков предиабета, что обусловлено:
■ известным механизмом действия компонентов;
■ понятным режимом дозирования и удобным способом применения;
■ отсутствием сведений о повышении частоты нежелательных явлений и прогнозируемых побочных эффектов при комбинированном применении сибутрамина и метформина;
■ наличием данных об эффективности совместного применения сибутрамина и метформина у больных с факторами риска СД2, а также у пациентов с метаболическим синдромом;
■ комплексным воздействием на основные звенья патогенеза заболеваний, ассоциированных с ожирением.
Одним из основных препятствий для успешного лечения любого хронического заболевания является несоблюдение рекомендаций врача пациентом. Одновременный прием нескольких препаратов все шире признается как препятствие к эффективному лечению.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Литература
1. Тетенева Т.А., Куркин А.В., Богданова Е.Л. Превентивная медицина в России: тренды развития // АНИ: экономика и управление. 2017. Т. 6. № 1. 185-187.
2. Муромцева Г.А., Концевая А.В., Константинов В.В., Артамонова Г.В. и др. Распространенность факторов риска неинфекционных заболеваний в российской популяции в 2012-2013 гг. Результаты исследования ЭССЕ-РФ // Кардиоваскулярная терапия и профилактика. 2014. Т. 13. № 6. С. 4-11.
3. Здравоохранение в России 2017 : стат. сб. М. : Росстат, 170 с.
4. Аметов А.С., Прудникова М.А. Ожирение и сахарный диабет типа 2: современные аспекты фармакотерапии // Эндокринология: новости, мнения, обучение. 2016. № 4. С. 16-21.
5. Mathis D. Immunological goings-on in visceral adipose tissue // Cell. Metab. 2013. Vol. 17, N 6. P 851-859.
6. Mothe-Satney I., Filloux C., Amghar H., Pons C. et al. Adipocytes secrete leukotrienes: contribution to obesity-associated inflammation and insulin resistance in mice // Diabetes. 2012. Vol. 61, N 9. P 2311-2319.
7. Kurokaw J., Nagano H., Ohara O., Kubota N. et al. Apoptosis inhibitor of macrophage (AIM) is required for obesity-associated recruitment of inflammatory macrophages into adipose tissue // Proc. Natl. Acad. Sci. USA. 2011. Vol. 108, N 29. P. 12072-12077.
8. Yang H., Youm Y.H., Vandanmagsar B., Ravussin A. et al. Obesity increases the production of proinflammatory mediators from adipose tissue T cells and compromises TCR repertoire diversity: implications for systemic inflammation and insulin resistance // J. Immunol. 2010. Vol. 185, N 3. P. 1836-1845.
9. Feuerer M., Herrero L., Cipolletta D., Naaz A. et al. Lean, but not obese, fat is enriched for a unique population of regulatory T cells that affect metabolic parameters // Nat. Med. 2009. Vol. 15, N 8. P 930-939.
10. Rocha V.Z., Folco E.J., Sukhova G., Shimizu K. et al. Interferon-gamma, a Th1 cytokine, regulates fat inflammation: a role for adaptive immunity in obesity // Circ. Res. 2008. Vol. 103. P 467-476.
11. Bertola A., Ciucci T., Rousseau D., Bourlier V. et al. Identification of adipose tissue dendritic cells correlated with obesity-associated insulin-resistance and inducing Th17 responses in mice and patients // Diabetes. 2012. Vol. 61, N 9. P. 2238-2247.
12. Шварц В. Жировая ткань как эндокринный орган // Проблемы эндокринологии. 2009. Т. 55, № 1. С. 38-44.
13. Литвинова Л.С., Кириенкова Е.В., Мазунин И.О., Василенко М.А., Фаттахов Н.С. Патогенез инсулинорезистентности при метаболическом ожирении // Биомедицинская химия. 2015. Т. 61, № 1. С. 70-82.
14. Аметов А.С., Прудникова М.А. Хроническое воспаление в развитии сахарного диабета 2 типа // Сахарный диабет 2 типа. Проблемы и решения: учеб. пос. 3-е изд., перераб. и доп. М. : ГЭОТАР-Медиа, 2015.
15. Pitsavos C., Tampourlou M., Panagiotakos D.B., Skoumas Y et al. Association between low-grade systemic inflammation and type 2 diabetes mellitus among men and women from the ATTICA Study // Rev. Diabet. Stud. 2007. Vol. 4, N 2. P. 98-104.
16. Boden G. Fatty acid-induced inflammation and insulin resistance in skeletal muscle and liver // Curr. Diab. Rep. 2006. Vol. 6. P 177181.
17. Аметов А.С., Демидова Т.Ю., Стельмах М.В., Дэпюи Т.И. Взаимосвязь ожирения и сахарного диабета типа 2 в свете доказательной медицины // Эндокринология: новости, мнения, обучение. 2016. № 2. C. 38-50.
18. Tuomilehto J., Lindstrom J., Eriksson J.G. et al. Finnish Diabetes Prevention Study Group. Prevention of type 2 diabetes mellitus by changes in lifestyle among subjects with impaired glucose tolerance // N. Engl. J. Med. 2001. Vol. 344. P 1343-1350.
19. Knowler W.C., Barrett-Connor E., Fowler S.E. et al. Diabetes Prevention Program Research Group. Reduction in the incidence of type 2 diabetes with lifestyle intervention or metformin // N. Engl. J. Med. 2002. Vol. 346. P. 393-403.
20. Gummesson A, Nyman E, Knutsson M, Karpefors M. Effect of weight reduction on glycated haemoglobin in weight loss trials in patients with type 2 diabetes // Diabetes Obes. Metab. 2017. Vol. 19, N 9. P. 1295-1305.
21. Grams J., Garvey W.T. Weight loss and the prevention and treatment of type 2 diabetes using lifestyle therapy, pharmacotherapy, and bariatric surgery: mechanisms of action // Curr Obes Rep. 2015. Vol. 4, N 2. P. 287-302.
22. American Diabetes Association. Prevention or delay of type 2 diabetes: Standards of medical care in diabetes-2018 // Diabetes Care. Vol. 41, Suppl. 1. S51-S54.
23. UK Prospective Diabetes Study (UKPDS) Group. Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33) // Lancet. 1998. Vol. 352. P 837-853.
24. Goldstein D.J. Beneficial health effects of modest weight loss // Int. J. Obes. Relat. Metab. Disord. 1992. Vol. 16. P 397-415.
25. Pastors J.G., Warshaw H., Daly A., Franz M. et al. The evidence for the effectiveness of medical nutrition therapy in diabetes management // Diabetes Care. 2002. Vol. 25. P 608-613.
26. Диагностика, лечение, профилактика ожирения и ассоциированных с ним заболеваний (национальные клинические рекомендации). СПб., 2017.
27. Lean M.E.J. et al. Primary care-led weight management for remission of type 2 diabetes (DiRECT): an open-label, cluster-randomised trial // Lancet. 2018. Vol. 391. P. 541-551.
28. Hansen D.L., Toubro S., Stock M.J., Macdonald I.A., Astrup A. The effect of sibutramine on energy expenditure and appetite during chronic treatment without dietary restriction // Int. J. Obes. Relat. Metab. Disord. 1999. Vol. 23. P. 1016-1024.
29. Мкртумян А.М. и др. Показатели вазорегулирующей функции эндотелия у больных МС на фоне терапии Редуксином // Эффективная фармакотерапия в эндокринологии. 2008. № 4. С. 18-24.
30. Дедов И.И. и др. Роль нейтротрансмиттеров в регуляции энергетического гомеостаза и возможности медикаментозной коррекции его нарушений при ожирении // Ожирение и метаболизм, 2016. № 1. С. 9-15.
31. Логвинова О.В., Галиева М.О., Мазурина Н.В., Трошина Е.А. Место препаратов центрального действия в алгоритмах лечения экзогенно-конституционального ожирения // Ожирение и метаболизм. 2017. Т. 14, № 2. С. 18-23.
32. Аметов А.С. Отчет о программе Весна. Эффективное лечение ожирения – путь борьбы с Diabetes Mellipidus // Эффективная фармакотерапия. Эндокринология. Спецвып. 2013. С. 7-11.
33. Дедов И.И., Мельниченко Г.А., Романцова Т.И. Стратегия управления ожирением: итоги Всероссийской наблюдательной программы “ПримаВера” // Ожирение и метаболизм. 2016. Т. 13, № 1. С. 36-44.
34. Романцова Т.И., Полубояринова И.В., Роик О.В. Динамика состояния жировой ткани по данным МР-томографии у больных ожирением на фоне лечения ожирением // Ожирение и метаболизм. 2012, № 4. С. 39-43.
35. Аметов А.С. и др. Роль липотоксичности в достижении гликеми-ческого контроля у больных СД 2-го типа и ожирением // Медицинский совет. 2003, № 6. С. 84-91.
36. Смирнова О.В. Место метформина в современном лечении и профилактике сахарного диабета 2 типа // Сахарный диабет. 2010, № 3. С. 83-90.
37. Tokubuchi I., Tajiri Y., Iwata S. et al. Beneficial effects of metformin on energy metabolism and visceral fat volume through a possible mechanism of fatty acid oxidation in human subjects and rats // PLoS One. 2017. Vol. 12, № 2. P e0171293.
38. Jing Y., Wu F., Li D. et al. Metformin improves obesity-associated inflammation by altering macrophages polarization // Mol. Cell. Endocrinol. 2018. Vol. 461. P. 256-264.
39. Gagnon J., Sheppard E., Anini Y. Metformin directly inhibits ghrelin secretion through AMP-activated protein kinase in rat primary gastric cells // Diabetes Obes. Metab. 2013. Vol. 15, N 3. P 276-279.
40. DeFronzo R.A. et al. Once-daily delayed-release metformin lowers plasma glucose and enhances fasting and postprandial GLP-1 and PYY: results from two randomised trials // Diabetologia. 2016. Vol. 59. P 16451654.
41. Bahne E. et al. Involvement of glucagon-like peptide-1 in the glucose-lowering effect of metformin // Diabetes Obes Metab. 2016. Vol. 18, N 10. P 955-961.
42. Андрианова О.Л., Камаева Э.Р., Аминева Л.Х., Мирсаева Г.Х., Ибрагимова Л.А. Эффективность лечения ожирения у женщин репродуктивного возраста // Вестник новых медицинских технологий. Электронное издание. 2015. Т. 9. № 4. С. 35.
43. Батрак Г.А. Эффективность комбинированной терапии сибутра-мином и метформином у пациентов с абдоминальным типом ожирения // Вестник Ивановской медицинской академии. 2015. Т. 20. № 3. С. 59-60.
44. Рыженкова Е.М., Левченко В.Г., Герус А.Ю., Брызгалина С.М. Опыт применения редуксина мет при абдоминальном ожирении у женщин с синдромом поликистозных яичников // Актуальные вопросы медицины в современных условиях : сборник научных трудов по итогам Международной научно-практической конференции. 2016. С. 168-172.
45. Шувалова И.Г., Гребнева И.В. Оптимизация лечения сахарного диабета типа 2 в дебюте заболевания // Эндокринология: новости, мнения, обучение. 2015. № 4. С. 76-81.
46. Guerrero-Romero F., Rodriguez-Moran M., Perez-Fuentes R. et al. Prediabetes and its relationship with obesity in Mexican adults: the Mexican Diabetes Prevention (MexDiab) Study // Metab. Syndr. Relat Disord. 2008. Vol.6, N 1. P 15-23.
47. Sari R., Esin Eray, Ozdem S. et al. Comparison of the effects of sibutramine versus sibutramine plus metformin in obese women // Clin. Exp. Med. 2010. Vol. 10. P 179-184.
References
1. Teteneva T.A., Kurkin A.V., Bogdanova E.L. Preventive medicine in russia: trends of development. Azimut nauchnykh issledovaniy: ekonomika i upravlenie [Azimuth of Scientific Researches: Economics and Management]. 2017; 6 (1): 185-7. (in Russian)
2. Muromtseva G.A., Kontsevaya A.V., Konstantinov V.V., Artamonova G.V., et al. The prevalence of non-infectious diseases risk factors in Russian population in 2012-2013 years. The results of ECVD-RF. Kardiovaskulyar-naya terapiya i profilaktika [Cardiovascular Therapy and Prevention]. 2014; 13 (6): 4-11. (in Russian)
3. Healthcare in Russia 2017: statistical collection. Moscow: Rosstat, 170 p. (in Russian)
4. Ametov A.S., Prudnikova M.A. Obesity and type 2 diabetes: modern aspects of pharmacotherapy. Endokrinologiya: novosti, mneniya, obuchenie [Endocrinology: News, Opinions, Training]. 2016; (4): 16-21. (in Russian)
5. Mathis D. Immunological goings-on in visceral adipose tissue. Cell Metab. 2013; 17 (6): 851-9.
6. Mothe-Satney I., Filloux C., Amghar H., Pons C., et al. Adipocytes secrete leukotrienes: contribution to obesity-associated inflammation and insulin resistance in mice. Diabetes. 2012; 61 (9): 2311-9.
7. Kurokaw J., Nagano H., Ohara O., Kubota N., et al. Apoptosis inhibitor of macrophage (AIM) is required for obesity-associated recruitment of inflammatory macrophages into adipose tissue. Proc Natl Acad Sci USA. 2011; 108 (29): 12072-7.
8. Yang H., Youm Y.H., Vandanmagsar B., Ravussin A., et al. Obesity increases the production of proinflammatory mediators from adipose tissue T cells and compromises TCR repertoire diversity: implications for systemic inflammation and insulin resistance. J Immunol. 2010; 185 (3): 1836-45.
9. Feuerer M., Herrero L., Cipolletta D., Naaz A., et al. Lean, but not obese, fat is enriched for a unique population of regulatory T cells that affect metabolic parameters. Nat Med. 2009; 15 (8): 930-9.
10. Rocha V.Z., Folco E.J., Sukhova G., Shimizu K., et al. Interferon-gamma, a Th1 cytokine, regulates fat inflammation: a role for adaptive immunity in obesity. Circ Res. 2008; 103: 467-76.
11. Bertola A., Ciucci T., Rousseau D., Bourlier V., et al. Diabetes. 2012; 61: 2238-47.
12. Schwarz V. Adipose tissue as an endocrine organ. Problemy En-docrinologii [Problems of Endocrinology]. 2009; 55 (1): 38-44. (in Russian)
13. Litvinova L.S., Kirienkova E.V., Mazunin I.O., Vasilenko M.A., Fat-takhov N.S. Insulin resistance pathogenesis in metabolic obesity. Biomed-itsinskaya khimiya [Problems of Medical Chemistry]. 2015; 61 (1): 70-82. (in Russian)
14. Ametov A.S., Prudnikova M.A. Chronic inflammation in development of a diabetes mellitus 2 types. In: Diabetes mellitus 2 types. Problems and decisions: Manual. 3rd ed., processed and added. Moscow: GEOTAR-Media; 2015. (in Russian)
15. Pitsavos C., Tampourlou M., Panagiotakos D.B., Skoumas Y., et al. Association between low-grade systemic inflammation and type 2 diabetes mellitus among men and women from the ATTICA Study. Rev Diabet Stud. 2007; 4 (2): 98-104.
16. Boden G. Fatty acid-induced inflammation and insulin resistance in skeletal muscle and liver. Curr Diab Rep. 2006; 6: 177-81.
17. Ametov A.S., Milovanova O.A., Prudnikovа M.A., Depyui T.I. Diabetic neuropathy in patients with type 2 diabetes: role of chronic inflammation. Endokrinologiya: novosti, mneniya, obuchenie [Endocrinology: News, Opinions, Training]. 2016; (2): 38-50. (in Russian)
18. Tuomilehto J., Lindstrom J., Eriksson J.G., et al. Finnish Diabetes Prevention Study Group. Prevention of type 2 diabetes mellitus by changes in lifestyle among subjects with impaired glucose tolerance. N Engl J Med. 2001; 344: 1343-50.
19. Knowler W.C., Barrett-Connor E., Fowler S.E., et al. Diabetes Prevention Program Research Group. Reduction in the incidence of type 2 diabetes with lifestyle intervention or metformin. N Engl J Med. 2002; 346: 393-403.
20. Gummesson A., Nyman E., Knutsson M., Karpefors M. Effect of weight reduction on glycated haemoglobin in weight loss trials in patients with type 2 diabetes. Diabetes Obes Metab. 2017; 19 (9): 1295-305.
21. Grams J., Garvey W.T. Weight loss and the prevention and treatment of type 2 diabetes using lifestyle therapy, pharmacotherapy, and bariatric surgery: mechanisms of action. Curr Obes Rep. 2015; 4 (2): 287-302.
22. American Diabetes Association. Prevention or delay of type 2 diabetes: Standards of medical care in diabetes-2018. Diabetes Care. 2018; 41 (Suppl. 1): S51-4.
23. UK Prospective Diabetes Study (UKPDS) Group. Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). Lancet. 1998; 352: 837-53.
24. Goldstein D.J. Beneficial health effects of modest weight loss. Int J Obes Relat Metab Disord. 1992; 16: 397-415.
25. Pastors J.G., Warshaw H., Daly A., Franz M., et al. The evidence for the effectiveness of medical nutrition therapy in diabetes management. Diabetes Care. 2002; 25: 608-13.
26. Diagnosis, treatment, prevention of obesity and associated diseases (National clinical guidelines). St. Petersburg, 2017. (in Russian)
27. Lean M.E.J., et al. Primary care-led weight management for remission of type 2 diabetes (DiRECT): an open-label, cluster-randomised trial. Lancet. 2018; 391: 541-51.
28. Hansen D.L., Toubro S., Stock M.J., Macdonald I.A., Astrup A. The effect of sibutramine on energy expenditure and appetite during chronic treatment without dietary restriction. Int J Obes Relat Metab Disord. 1999; 23: 1016-24.
29. Mkrtumyan A.M., et al. Indicators of vazoreguliruyushchy function of an endothelium at patients with a metabolic syndrome against the background of therapy by Reduksin. Effektivnaya farmakoterapiya v endokri-nologii [Effective pharmacotherapy in endocrinology]. 2008 (4): 18-24. (in Russian)
30. Dedov 1.1., Troshina E.A., Mazurina N.V., Galieva M.O., Logvinova O.V. The role of neurotransmitters in regulation of energy homeostasis and possibility of drug correction of its disturbances in obesity. Ozhirenie i metabolizm [Obesity and Metabolism]. 2016; (1): 9-15. (in Russian)
31. Logvinova O.V., Galieva M.O., Mazurina N.V., Troshina E.A. The place of central-acting drugs in the algorithms of treatment of primary obesity. Ozhirenie i metabolizm [Obesity and Metabolism]. 2017; 14 (2): 18-23. (in Russian)
32. Ametov A.S. Report on the program spring. Effective treatment of obesity – a way of fight against Diabetes Mellipidus. Effektivnaya farma-koterapiya v endokrinologii [Effective pharmacotherapy in endocrinology]. 2013; Special Issue: 7-11. (in Russian)
33. Dedov 1.1., Mel’nichenko G.A., Romantsova T.I. The strategy of obesity management: the results of All-Russian observational program “Primavera”. Ozhirenie i metabolizm [Obesity and Metabolism]. 2016; 13 (1): 36-44. (in Russian)
34. Romantsova T.I., Poluboyarinova I.V., Roik O.V. Dynamics of adipose tissue changes measured by MRI in obese patients during Reduxin treatment. Ozhirenie i metabolizm [Obesity and Metabolism]. 2012; (4): 39-43. (in Russian)
35. Ametov A.S., et al. The role of lipotoxicity in achieving glycemic control in patients with type 2 diabetes and obesity. Meditsinskiy Sovet [Medical Council]. 2013; 6: 84-91. (in Russian)
36. Smirnova O.V. The role of metformin in the modern strategy of treatment and prevention of type 2 diabetes mellitus. Sakharni diabet [Diabetes Mellitus]. 2010; (3): 83-90. (in Russian)
37. Tokubuchi I., Tajiri Y., Iwata S., et al. Benefi cial eff ects of metformin on energy metabolism and visceral fat volume through a possible mechanism of fatty acid oxidation in human subjects and rats. PLoS One. 2017; 12 (2): e0171293.
38. Jing Y., Wu F., Li D., et al. Metformin improves obesity-associated inflammation by altering macrophages polarization. Mol Cell Endocrinol. 2018; 461: 256-64.
39. Gagnon J., Sheppard E., Anini Y. Metformin directly inhibits ghrelin secretion through AMP-activated protein kinase in rat primary gastric cells. Diabetes Obes Metab. 2013; 15 (3): 276-9.
40. DeFronzo R.A., et al. Once-daily delayed-release metformin lowers plasma glucose and enhances fasting and postprandial GLP-1 and PYY: results from two randomised trials. Diabetologia. 2016; 59: 1645-54.
41. Bahne E., et al. Involvement of Glucagon-like Peptide-1 in the Glucose-lowering effect of Metformin. Diabetes Obes Metab. 2016; 18 (10): 955-61.
42. Andrianova O.L., Kamaeva E.R., Amineva L.Kh., Mirsaeva G.Kh., Ibragimova L.A. Effective treatment of obesity in women of reproductive age. Vestnik novykh meditsinskikh tekhnologiy. Elektronnoe izdanie [Journal of New Medical Technologies. eJournal]. 2015; 9 (4): 35. (in Russian)
43. Batrak G.A. The efficacy of combined therapy by sibutramin and metformine in patients with abdominal obesity type. Vestnik Ivanovskoy meditsinskoy akademii [Bulletin of the Ivanovo Medical Academy]. 2015; 20 (3): 59-60. (in Russian)
44. Ryzhenkova E.M., Levchenko V.G., Gerus A.Yu., Bryzgalina S.M. Experience with the use Reduxine met when abdominal obesity in women with polycystic ovary syndrome. In: Topical issues of medicine in modern conditions Collection of scientific papers on the results of the international scientific-practical conference. 2016: 168-72. (in Russian)
45. Shuvalova I.G., Grebneva I.V. Optimization of diabetes mellitus type 2 treatment in a disease onset. Endokrinologiya: novosti, mneniya, obuchenie [Endocrinology: News, Opinions, Training]. 2015; (4): 76-81. (in Russian)
46. Guerrero-Romero F., Rodriguez-Moran M., Perez-Fuentes R. et al. Prediabetes and its relationship with obesity in Mexican adults: The Mexican Diabetes Prevention (MexDiab) Study. Metab Syndr Relat Disord. 2008; 6 (1): 15-23.
47. Sari R., Esin Eray, Ozdem S., et al. Comparison of the effects of sibutramine versus sibutramine plus metformin in obese women. Clin Exp Med. 2010; 10: 179-84.
