Развитие человечества характеризуется целенаправленной эволюцией, приводящей к повышению эффективности экономических и социальных процессов, обеспечивающих более высокий уровень жизни членов общества. При этом прогресс необратимо влияет не только на социально-экономическое развитие, но и на окружающую среду, что может приводить к определенным вызовам и угрозам. Среди неблагоприятных антропогенных факторов обычно выделяют [1]:
- разбалансировку планетарной экосистемы и катастрофические изменения природно-климатических условий среды обитания человечества;
- тотальное загрязнение окружающей природной среды;
- истощение запасов многих природных ресурсов, включая энергетические, биологические, водные и другие ресурсы;
- наличие огромного арсенала ядерных вооружений, способного многократно уничтожить Землю;
- демографический взрыв, связанный с быстрым и неконтролируемым ростом численности населения, особенно в развивающихся странах;
- быстрое старение населения экономически развитых государств мира;
- нарастающую нелегальную миграцию, приводящую к трансформации исторически сложившихся социальных, этнических, религиозных и прочих устоев.
Интенсификация антропогенного воздействия способствует пробуждению дремлющих инфекций. В связи с этим пристальное внимание специалистов вызывают природно-очаговые инфекции, возбудители которых являются сочленами естественных экосистем и могут циркулировать без участия человека, однако способны в любую минуту реализовать свой эпидемический (а нередко и пандемический) потенциал. С другой стороны, изменение структуры труда, в частности снижение доли физического труда и появление большого количества профессий, связанных с сидячим образом жизни, глобальное изменение режима и привычек питания, характеризующееся повышенным употреблением полуфабрикатов, высококалорийной пищи и повышение употребления сахара, гиподинамия, связанная в том числе с развитием транспортной системы, и другие факторы, например изменения микробиома человека, способствовали глобальной распространенности ожирения (метаболический синдром) как неинфекционной пандемии.

Рис. 1. Взаимосвязь ожирения, сердечно-сосудистого континуума и тяжелого течения COVID-19 (адаптировано по [8]) ССЗ – сердечно-сосудистые заболевания; СД2 – сахарный диабет 2-го типа; ИР – инсулинорезистентность.
Рубеж 2019-2020 гг. вошел в историю как чрезвычайная ситуация, связанная с пандемией новой коронавирусной инфекции. Имеющиеся эпидемиологические мировые данные о протекании COVID-19 позволяют выделить ожирение как важнейший прогностический фактор риска развития тяжелого течения этого заболевания, критических состояний и смерти [7, 8]. Понимание этиопатогенетической взаимосвязи избытка жировой ткани с развитием осложненного течения COVID-19 актуализирует необходимость разработки комплексных программ, направленных на лечение ожирения и изменение образа жизни, а также акцентирует внимание на наиболее высокой уязвимости данной категории пациентов и необходимости персонифицированного подхода в лечении больных с новой коронавирусной инфекцией.
За счет секреторной активности жировой ткани и ассоциированного хронического воспаления ожирение потенцирует множественные метаболические нарушения, приводя к развитию сердечно-сосудистых заболеваний и неблагоприятных сердечно-сосудистых исходов, которые, в свою очередь, ухудшают прогноз пациентов с коронавирусной инфекцией (рис. 1) [9].

Рис. 2. Частота выявления тяжелого течения COVID-19 у пациентов с метаболическим синдромом по сравнению с совокупным населением [13] * ИТ – интенсивная терапия; ДИ – доверительный интервал.
Эти данные коррелируют с результатами других исследований. Анализ опубликованных C.M. PetriLLi и соавт. данных пациентов в возрасте до 60 лет в Нью-Йорке показал, что у людей с ИМТ 30-34,9 и >35 кг/м2 в 1,8 раза и в 3,6 раза соответственно выше шансы попасть в ОРИТ при заболевании COVID-19 в сравнении с пациентами с ИМТ <30 кг/м2 [14].
Обсуждаемая в научных кругах прямая связь между тяжелым течением COVID-19, протромботической диссеминированной внутрисосудистой коагуляцией и большой частотой венозной тромбоэмболии также позволяет обратить внимание на ожирение и ассоциированное с этим состоянием повышение рисков тромбозов [15].
Британские ученые предложили вероятные механизмы влияния ожирения на тяжесть течения COVID-19. Это снижение защитного кардиореспираторного резерва и нарушение иммунной регуляции, за счет которых заболевание прогрессирует, вплоть до развития критического состояния и органной недостаточности [16].
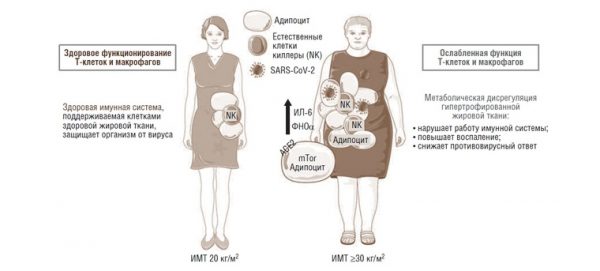
Рис. 3. Ожирение и индуцированное вирусом гипервоспаление (адаптировано по [20])
Таким образом, баланс между про- и противовоспалительными механизмами имеет решающее значение для поддержания гомеостаза легочной ткани. Нарушение одного или нескольких регуляторных элементов либо их отсутствие, предположительно, может способствовать “цитокиновому шторму” в легких или в других тканях (например, жировой), где существует аберрантная активация цитокинов (рис. 3) [20].
В гипертрофированной жировой ткани повышаются активность иммунных клеток и секреция цитокинов, адипокинов, хемокинов, которые сами выделяют провоспалительные молекулы, включая ИЛ-6, ФНОа, нейтрофилы, B1, B2, NK, врожденные лимфоидные клетки – это приводит к гипервоспалению и повышению риска развития “цитокинового шторма”.
Изучение динамики “цитокинового шторма” показало, что ИЛ-6 поддерживает активацию нескольких цитокинов в течение многих дней после первоначального иммунного ответа [21]. В рандомизированном многоцентровом исследовании показано, что COVID-19 ИЛ-6 был сильным независимым предиктором летальных исходов. Жировая ткань человека – главный источник ИЛ-6 и его рецептора ИЛ-6К [22], поэтому она способна обеспечивать резервуар для активации ИЛ-6 и каскадной передачи сигналов при вирусной инфекции. Распространение вируса из пораженных органов в окружающую их жировую ткань может занять несколько дней с последующим длительным выделением вируса, что способствует отсроченному “цитокиновому шторму” с повреждением тканей у больных COVID-19. Таким образом, доказана ключевая роль ИЛ-6 в опосредовании ответа острой фазы и его значение как прогностического биомаркера при сепсисе и различных острых повреждениях органов [12]. В этой связи для лечения COVID-19 было предложено ингибирование ИЛ-6, и ожидаются результаты испытаний тоцилизумаба [21].
У пациентов с ожирением может наблюдаться интенсивное выделение вируса, что приводит к риску заражения других людей, особенно когда несколько членов семьи имеют избыточную массу тела. Все эти наблюдения указывают на потенциально неблагоприятную взаимосвязь вируса с иммунным ответом организма при ожирении. Иммунологическая дисрегуляция усиливается при эндокринных и метаболических нарушениях (нарушение чувствительности к инсулину, метаболизма липидов и жирных кислот) [23]. Дисфункции лимфоцитарной и макрофагальной систем связаны с ожирением, резидентные миелоидные и лимфоидные клетки в жировой ткани многочисленны [24]. Увеличение количества различных Т-лимфоцитов памяти в жировой ткани также может активировать аберрантные иммунные ответы с более широким повреждением ткани при заражении вирусом. SARS-CoV-2 провоцирует патологический иммунный ответ у пациентов с тяжелым течением COVID-19, характеризующимся снижением количества циркулирующих T-лимфоцитов памяти, а также снижением уровня T-хелперов. Исследователи полагают, что дисфункция иммунного ответа у субъектов с ожирением усиливает влияние SARS-CoV-2 на функцию Т-клеток [24].
Ключевую роль в патогенезе осложнений COVID-19 может играть активация системы ренин-ангиотензина (РАС), поскольку есть данные о том, что попадание вируса в клетки опосредовано ангиотензин-превращающим ферментом II (АПФ II). Экспрессия АПФ II происходит в клетках эндотелия, гладкомышечных клетках, в ацинарных клетках поджелудочной железы и почечном канальцевом эпителии, а также в адипоцитах [25-27]. В жировой ткани мишенями для вирусов могут служить как сами адипоциты (H1N1, грипп типа A и аденовирус), так и стромальные клетки (Adenovirus 36, CMV), эндотелиальные клетки (SARS-CoV), макрофаги (грипп A, SARS-CoV, аденовирус36, ВИЧ) и лимфоциты (SARS-CoV, ВИЧ) [18, 27-29]. Несмотря на то что содержание SARS-CoV-2 в крови было обнаружено только у небольшого количества пациентов [30], нельзя исключать его гематогенное распространение в жировой ткани, учитывая очень высокое сродство вируса к рецептору на клетках-мишенях.
Альтернативные пути распространения SARS-CoV-2 в жировой ткани включают локальный выход вируса из инфицированных органов в окружающие жировые клетчаточные пространства в средостении, эпикарде, паранефрии, сальнике. Наконец, общий вирусный тропизм к эпителию легких и жировой ткани уже был показан при инфицировании вирусом H5N1 [31]. В исследовании H.E. Maier было показано, что у инфицированных гриппом людей с ожирением на 42% увеличивается время до элиминации вируса, и это может быть связано с увеличением площади висцеральной жировой ткани [17].
При сходном тропизме SARS-CoV-2 к жировой ткани пациентов с COVID-19, страдающих ожирением, существует вероятность длительной персистенции вируса в жировой ткани с расширенной активацией локальных предварительно активированных иммунных систем и путей передачи цитокиновых сигналов.
Одним из патогенетических механизмов ожирения является инсулинорезистентность, которая впоследствии может приводить к нарушению функции β-клеток, развитию нарушений углеводного обмена, в том числе к сахарному диабету, который напрямую связан с более тяжелым течением коронавирусной инфекции [32]. Комплексная регуляция метаболизма, необходимая для сложных клеточных взаимодействий и эффективной защиты организма пациента, нарушается, приводя к функциональному дефициту. Вирус SARS-CoV-2 способен разрушать β-клетки поджелудочной железы, проникая в них посредством взаимодействия с АПФ II. Наконец, COVID-19 часто сопровождается гипокалиемией, что связано с подавлением легочного АПФ II, снижением деградации ангиотензина II и затем повышением секреции альдостерона. Гипокалиемия, в свою очередь, может ухудшить контроль гликемии у пациентов с сахарным диабетом 1-го и 2-го типа [33].
Стоит отметить, что большое количество данных получено на основании анализа течения COVID-19 у пожилых пациентов, у которых ввиду возраста развивается саркопения при одновременном увеличении относительного содержания жировой ткани в организме. Люди более старшего возраста аналогично молодым людям с ожирением имеют меньший кардиореспираторный резерв, чтобы справиться с инфекцией COVID-19. Более того, известно, что у пожилых людей с возрастом происходит снижение защитных функций иммунной системы, а это также может влиять на динамику течения и исходы вирусной инфекции. Важно, что при морбидном ожирении (ИМТ >40 кг/м2) лечение, реабилитация и уход за пациентами ОРИТ часто осложняется ввиду трудностей при транспортировке, переворачивании, использовании визуализирующих методов исследования и т.п. [16]. Таким образом, пациенты с повышенным ИМТ требуют особого внимания как наиболее подверженные риску тяжелых исходов коронавирусной инфекции.
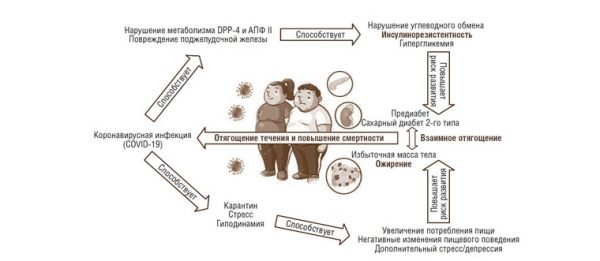
Рис. 4. “Порочный круг” COVID-19, ожирения и других нарушений углеводного обмена
Проведение национальных карантинных мероприятий во время текущей пандемии приводит к повышению гиподинамии и уровню стресса и, в свою очередь, оказывает негативное влияние на изменение пищевого поведения населения, замыкая порочный круг и способствуя повышению массы тела. По данным итальянского исследования “Пищевые привычки и изменение образа жизни во время пандемии COVID-19”, в котором приняли участие 3533 человек в возрасте от 12 до 86 лет, 34,4% респондентов отмечали усиление аппетита, 40,3% – незначительную прибавку массы тела, 8,3% -значительную прибавку [34].
Понимание взаимоотягощающего влияния ожирения и COVID-19 определяет необходимость превентивных мер, направленных на уменьшение рисков не только неблагоприятных исходов коронавирусной инфекции, но и развития, и прогрессирования хронических заболеваний, а также снижения общего иммунного ответа организма (рис. 4).
Одним из необходимых шагов для достижения этой цели является снижение массы тела.
Лечение ожирения
Терапевтическое воздействие должно базироваться на постановке реалистичных целей в отношении снижения массы без вреда для здоровья и удержания достигнутой. Мотивационные беседы с пациентами с ожирением должны включать разъяснение хронического характера этого заболевания, важности формирования здорового пищевого поведения и необходимости ведения дневника питания для осознания и визуализации своих ошибок и прогресса. Подход к лечению ожирения должен быть комплексным и включать изменение характера питания, сокращение размеров порций, калорийности еды и напитков, отказ от приема пищи непосредственно перед сном, избегание эпизодов компульсивного переедания [35].
Мероприятия, направленные на изменение образа жизни пациента, могут быть дополнены лекарственной терапией не только ожирения, но и сопутствующих заболеваний. Медикаментозная терапия показана пациентам с ИМТ >30 кг/м2 или с ИМТ >27 кг/м2 при наличии сопутствующих заболеваний. Известно, что больные могут отвечать или не отвечать на лекарственную терапию. Критерием ответа на лечение является потеря массы на 5% у пациентов без диабета и >3% у больных диабетом после 3-месячного курса лекарственной терапии. В противном случае препарат следует отменить. Эти препараты противопоказаны детям, беременным и кормящим женщинам. При неэффективности консервативной терапии ИМТ >40 или 35 кг/м2 и наличии ассоциированных с ожирением заболеваний можно рассмотреть вопрос о проведении бариа-трических хирургических вмешательств [36].
На современном рынке доступно очень мало лекарств для фармакотерапии ожирения. В странах Евросоюза одобрены 3 препарата: лираглутид 3 мг, орлистат, налтрексон/бупропион. В США разрешены для применения 5 препаратов: орлистат, лираглутид 3 мг, налтрексон/бупропион, лоркасерин, фентермин/топирамат [35]. Для клинического применения в Российской Федерации одобрены орлистат, лираглутид 3 мг и сибутрамин, в том числе в форме фикисрованной комбинации с метформином [36].
Лираглутид является аналогом глюкагоноподобного пептида-1. Это инкретин (кишечный гормон), который выделяется в подвздошной кишке в ответ на прием пищи. Он стимулирует центры насыщения и подавляет центры аппетита в гипоталамической области, снижает моторику желудка, что также ускоряет наступление насыщения. Стимулирует глюкозозависимую секрецию инсулина. Препарат инъекционный и его продолжительность действия cоставляет около 24 ч. Используется для лечения диабета 2-го типа в дозе 0,6-1,8 мг/сут. Дозировка 3 мг была доступна на российском рынке для лечения ожирения.
Наиболее частым нежелательным явлением при назначении лираглутида является тошнота (до 15%). Использование препаратов группы лираглутида также связано с риском развития панкреатита. При подозрении на панкреатит прием лираглутида необходимо немедленно отменить. В ходе клинических исследований были сообщения о появлении симптомов и признаков почечной недостаточности и дегидратации у больных, которые принимали лираглутид, а также о развитии некоторых видов рака. Пациенты, которые получают лираглутид, должны быть проинформированы о риске обезвоживания в связи с неблагоприятными побочными реакциями со стороны желудочно-кишечного тракта и о необходимости соблюдения мер предосторожности, чтобы избежать гиповолемии [36, 37].
Орлистат является мощным и селективным ингибитором липазы поджелудочной железы, уменьшает всасывание жира в кишечнике. Препарат существует в дозировках 60 и 120 мг/сут. Его принимают перед каждым приемом пищи, содержащим жиры. Результат приводит к умеренной потере массы тела, большей, чем при сравнении с плацебо. Основным побочным эффектов является стеаторея, так как невсосавшиеся в кишечнике жиры выводятся с калом. Последнее обстоятельство может привести к дефициту жирорастворимых витаминов, поэтому целесообразно назначение с орлистатом курса поливитаминов [36].
Сибутрамин представляет собой ингибитор обратного захвата нейромедиаторов серотонина (53%), норадреналина (54%) и дофамина (16%), вследствие чего возрастает концентрация этих медиаторов в синаптическом пространстве. Из-за такого двойного механизма действия препарат оказывает влияние на обе стороны энергетического баланса, т.е. усиливая и пролонгируя чувство насыщения, уменьшает поступление энергии за счет снижения количества потребляемой пищи и увеличивает ее расход вследствие усиления термогенеза [38]. Стоит отметить, что сибутрамин является единственным из представленных в Российской Федерации лекарственных средств для лечения ожирения, влияющих на термогенез. Усиление термогенеза на фоне применения сибутрамина устраняет характерное при снижении массы тела замедление скорости основного обмена, что вносит дополнительный вклад в достижение отрицательного энергобаланса [39]. Активация бурой жировой ткани способствует окислению липидов и повышению утилизации глюкозы. Связанное с этим снижение массы повышает возможности восстановления метаболического здоровья. Снижение массы тела сопровождается увеличением концентрации в сыворотке крови липопротеинов высокой плотности и снижением количества триглицеридов, общего холестерина, липопротеинов низкой плотности, мочевой кислоты, глюкозы и гликированного гемоглобина (у пациентов с сахарным диабетом 2-го типа) [39].
В качестве начальной дозы сибутрамин назначают по 10 мг утром 1 раз в день, независимо от приема пищи. При снижении массы тела за 1-й месяц лечения менее чем на 2 кг следует увеличить дозу до 15 мг при условии приемлемой переносимости. Препарат противопоказан больным с неконтролируемой артериальной гипертензией, ишемической болезнью сердца, декомпенсированной хронической сердечной недостаточностью, аритмиями, цереброваскулярными заболеваниями (транзиторными нарушениями мозгового кровообращения, инсультом), при тяжелых поражениях печени и почек, которые часто встречаются при морбидном ожирении, в случае одновременного приема или спустя менее 2 нед после отмены ингибиторов моноаминооксидазы либо других препаратов, действующих на центральную нервную систему. Нежелательные побочные явления: запор, сухость во рту, бессонница, головная боль, потливость, – имеют преходящий характер, чаще проявляются в 1-й месяц лечения, слабо выражены и обычно не требуют отмены лечения. Следует отметить, что подобные побочные проявления в целом характерны для большинства препаратов центрального действия, используемых при лечении ожирения в мировой практике.
Терапия ожирения сибутрамином требует обязательного врачебного контроля. Оценка артериального давления (АД) и частоты пульса необходима у всех больных до начала лечения, далее с 1-го по 3-й месяц лечения – каждые 2 нед, с 4-го по 6-й месяц – ежемесячно, с 6-го по 12-й месяц – каждые 3 мес. Препарат отменяют при повторяющихся на 2 визитах подряд учащении пульса более чем на 10 в минуту, повышении АД более чем на 10 мм рт.ст., а также, если оно превышает 140/90 мм рт.ст. при ранее компенсированной артериальной гипертензии, если прогрессируют одышка, боли в груди или отеки суставов. Предиктором успешного снижения и долговременного удержания массы тела является потеря более 2 кг за 1-й месяц лечения или >5% исходной массы за 3 мес [36].
Учитывая, что сибутрамин является препаратом центрального действия, он способствует формированию здорового пищевого поведения, снижению суточной калорийности употребляемой пищи и удержанию достигнутой массы тела.
Отличительной особенностью терапии сибутрамин-содержа-щими препаратами является положительное влияние на модификацию пищевого поведения, что способствует сохранению достигнутых результатов снижения массы. Показано, что через 8 мес после отмены терапии сибутрамином 79% пациентов смогли сохранить сниженную массу тела. Сибутрамин и его метаболиты не влияют на высвобождение моноаминов, не ингибируют моноаминооксидазу, не обладают сродством к большому числу нейромедиаторных рецепторов, поэтому не способствуют развитию привыкания, лекарственной зависимости и синдрома отмены, а следовательно, сибутрамин не снижает своей терапевтической эффективности на протяжении всего курса лечения [42].
