Аннотация
В последние годы отмечается стремительный рост распространенности заболеваний почек у пациентов с ожирением. Наряду с сердечно-сосудистыми и эндокринологическими осложнениями, одним из последствий ожирения является повышение скорости клубочковой фильтрации (СКФ), гломеруломегалия (увеличение объема почечных клубочков) и развитие внутриклубочковой гипертензии. У пациентов с сахарным диабетом 2-го типа (СД2) клубочковая гиперфильтрация приводит к развитию атипичных структурных изменений почек и прогрессированию терминальной стадии почечной недостаточности (ТСПН). Протеинурия у больных СД2 повышает риск и ухудшает прогноз течения хронической болезни почек (ХБП) и ТСПН.
Для замедления прогрессирования ХБП традиционно применяются блокаторы ренин-ангиотензин альдостероновой системы (РААС), хотя эффект препаратов этой группы снижается со временем. Напротив, длительный и стойкий эффект в улучшении течения и прогноза протеинурии и поддержании целевых значения СКФ оказывает немедикаментозная терапия – снижение калорийности рациона и массы тела или бариатрическая хирургия.
Ключевым предиктором ожирения является увеличение индекса массы тела (ИМТ), который рекомендуется использовать вместе с дополнительными показателями, например, распределением жировой ткани и количеством мышечной массы. Важную роль в патогенезе эктопического накопления липидов в почках, развитии системного воспаления и повышения образования активных форм кислорода (АФК), активации РААС и повреждению тубулоинтерстиция играют нарушения метаболизма жирных кислот и холестерина.
Введение
Термин диабетическое ожирение («Diabesity») был введен в текущем десятилетии для обозначения группы пациентов (в частности, пожилых), страдающих СД и ожирением. Эти коморбидные состояния служат причиной развития хронической болезни почек (ХБП) (1–7). По данным ВОЗ, с 1975 г. количество людей, страдающих ожирением (индекс массы тела, ИМТ ≥30 кг/м2) увеличилось в три раза. В 2016 г. в мире насчитывалось 1.9 миллиардов людей с лишним весом и 650 миллионов – с ожирением, что составляет 39% и 13% (13% мужчин и 15% женщин) взрослого населения планеты, соответственно.
Распространенность ожирения варьирует в разных этнических группах. Так, среди европейцев ожирением страдает 22% населения, среди латиноамериканцев – 33.6%, афроамериканцев – 36.1% и азиатов – 9.8% (8). В последние годы проблема детского ожирения становится все более острой: около 38 миллионов детей младше 5 лет имеют лишний вес, а среди детей в возрасте 5–19 лет этот показатель достигает 340 миллионов. Ожидается, что к 2030 году более половины населения США будет страдать ожирением (9).
Ожирение как глобальная эпидемия оказывает значительное влияние на бюджет здравоохранения многих развитых стран, в том числе из-за развития сопутствующих хронических заболеваний. Протеинурия, субклиническое воспаление и прогрессирующий фиброз, сопровождающие нефропатию у пациентов с ожирением, приводят к повреждению почечной ткани и развитию хронических заболеваний почек.
Для количественной оценки степени ожирения в клинической практике традиционно используют индекс массы тела (10). Однако одни и те же значения индекса могут соответствовать разной степени полноты, в зависимости от морфологических, физиологических и биохимических особенностей пациента. По этой причине ИМТ считается приблизительным показателем и его рекомендуют применять в сочетании с дополнительными диагностическими методами.
В обзоре рассмотрены современные методы клинической диагностики ожирения, патогенез ХБП, почечной недостаточности и дислипидемии, а также потенциальные терапевтические мишени в лечении заболеваний почек у пациентов с ожирением.
Ожирение – фактор риска развития диабетической нефропатии
Ожирение: определение и эпидемиологический анализ
Согласно данным ВОЗ, нормальными считаются значения ИМТ в диапазоне от 20 до 25 кг/м2. При ожирении I степени ИМТ превышает 30 кг/м2. Значения ИМТ от 25 до 30 кг/м2 соответствуют избыточной массе тела, от 30 до 34.9 – ожирению I степени, от 35 до 39.9 и ≥40 кг/м2 – ожирению II и III степени, соответственно (11, 12).
Ученые из Университета Колумбии показали, что значения ИМТ положительно коррелируют с риском развития ХБП: вероятность развития заболевания увеличивается пропорциональной повышению ИМТ. Так, в период с 1986 по 1990 г. вероятность развития ХБП составляла 0.2%, с 1996 по 2000 – 2%, и к 2001–2015 гг. достигла 2.7% (12). Кроме того, у 56% пациентов была выявлена протеинурия, а у 44% протеинурия сопровождалась прогрессированием хронической почечной недостаточности (11, 12). Несмотря на то, что у жителей Азии в среднем значения ИМТ ниже, чем у европейцев, даже небольшое повышение ИМТ в этой популяции способствует значительному увеличению риска развития ХБП (12).
Однако ИМТ следует считать приблизительным критерием, так как он не учитывает характер распределения жировой ткани и количество мышечной массы (13, 14). Так, рост значений ИМТ может быть обусловлен набором мышечной массы, а абдоминальное ожирение в большей степени, чем бедренно-ягодичный (нижний) тип ожирения повышает риск ХБП (15).
Дополнительными критериями оценки избыточного веса и наличия абдоминального ожирения являются окружность талии (ОТ) и отношение окружности талии к окружности бедер (ОБ), а также толщина кожно-жировой складки (КЖС) трицепса, которые, по сравнению с ИМТ, являются более точными предикторами ХБП. Значения ОТ >102 см или >88 см и ОБ 0.9 или 0.8 для мужчин и женщин, соответственно, являются сильными предикторами риска развития диабетического ожирения и ХБП (15, 16).
Ожирение и хроническая болезнь почек
В последнее десятилетие ожирение стало одной из наиболее серьезных социоэкономических проблем общественного здравоохранения. Так, считается, что уже практически невозможно достигнуть показателей распространенности избыточного веса, которые наблюдались в конце XX века.
Ошибочно считать, что ожирение – проблема развитых стран (17). Распространенность ожирения также стремительно растет в странах Азии, где еще в конце прошлого века избыточный вес встречался гораздо реже, чем в Европе и Америке, развивающихся странах с низким уровнем доходов (18, 19, 20) и в группах с низким социально-экономическим статусом.
Гломерулопатия, ассоциированная с ожирением, служит одним из ключевых факторов риска развития и прогрессирования ХБП. Как показывают данные клинических исследований, диабетическая нефропатия наблюдается более чем у трети (33%) пациентов с СД (n=620), и в 27% случаев сочетается с «недиабетическими» заболеваниями почек (12, 21).
Патогенез ожирения – сложный многокомпонентный процесс, который реализуется через взаимодействие генетических факторов и факторов внешней среды: рациона питания, уровня физической активности и др. (Рис. 1). Так, описаны 150 генетических локусов, связанных с развитием ожирения и СД2 (22). Полиморфизм гена FTO (fat-mass and obesity-associated gene), расположенного на 16-й хромосоме и ассоциированного с жировой массой и ожирением, объясняет ~7% фенотипической вариабельности ИМТ (23). Несмотря на долгую историю изучения эпигенетических маркеров ожирения, выявление тканевых маркеров все еще остается предметом современных исследований (24). Для более глубокого понимания патогенеза ожирения необходимы знания о механизмах нарушения энергетического обмена и ключевых факторах риска. Так, регулярное употребление сукрозы или фруктозы повышает риск развития метаболического синдрома, ожирения и СД2, ревматических заболеваний, артериальной гипертензии (АГ) и ХБП (25–28). Другими важными предикторами развития ожирения и сопутствующих хронических заболеваний являются сидячий образ жизни и низкий уровень физической активности (29), когнитивные факторы (30) и психоэмоциональный стресс (31), генетические мутации (32), дисбактериоз кишечника (33) и присутствие аденовирусной инфекции (напр., аденовирус человека 36, AD-36) (34). Дополнительным звеном патогенеза ХБП у пациентов с ожирением является уменьшение количества функционирующих нефронов (35).
В последние годы наблюдается стремительный рост числа детей и подростков, имеющих лишний вес. Кроме того, повышение риска развития ХБП, АГ и СД2 во взрослом возрасте наблюдается у недоношенных детей и детей, родившихся с задержкой внутриутробного развития. Согласно данным эпидемиологических исследований, наиболее сильное влияние на риск развития заболеваний почек оказывает сочетание нескольких факторов риска – низкой массы тела при рождении, недостаточного питания в детстве и ожирения подростковом возрасте (36).
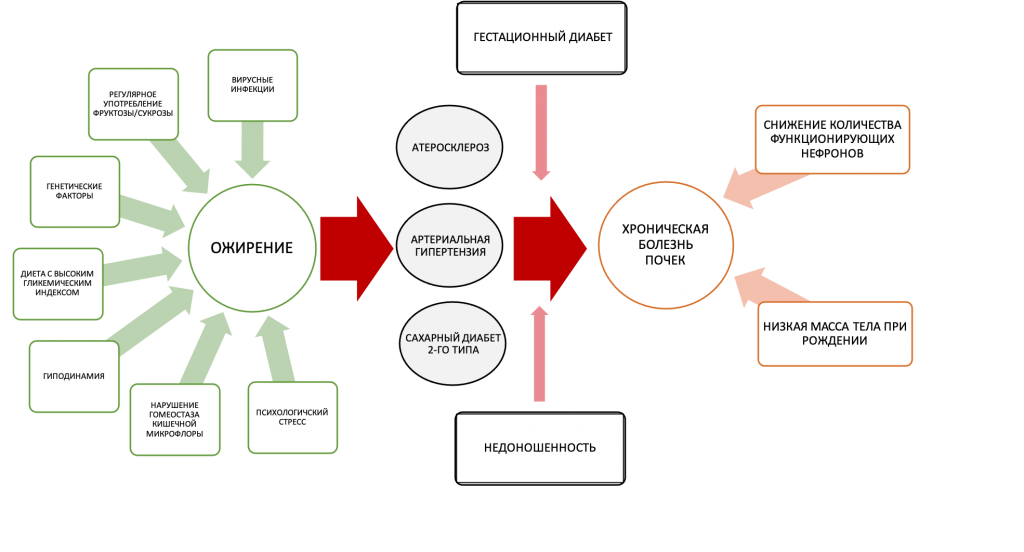
Рисунок 1. Компоненты патогенеза ожирения и хронической болезни почек: генетические (эпигенетические) факторы и факторы внешней среды. Главные факторы риска хронической болезни почек, ассоциированных с ожирением: артериальная гипертензия, атеросклероз и сахарный диабет 2-го типа; дополнительные факторы риска: гестационный диабет и снижение количества функционирующих нефронов [адаптировано из Stenvinkel et al. (2)].
Повреждение почек, вызванное гиперлипидемией
Вклад гиперлипидемии в прогрессирование повреждения почек
Избыток эктопического висцерального жира служит предиктором развития инсулинорезистентности (37) и нефропатии (38). Отложение липидов в мезангиальных клетках почечных клубочков приводит к деструктивным изменениям рецепторного аппарата и, как следствие, нарушению биохимических и физиологических процессов (38). На важную роль патологического отложения липидов в прогрессирующем снижении сократительной активности мезангиальных клеток указывают результаты исследований in vitro. Субклиническое воспаление у больных СД2 способствует усилению атерогенного действия гиперлипидемии, дисрегуляции липидного обмена и морфологическим изменениям гломерулярных клеток – подоцитов, эндотелиальных и мезангиальных клеток – и их рецепторного аппарата (39).
Повышение уровня триглицеридов служит важным клиническим маркером нарушений почечной гемодинамики, сопровождающихся альбуминурией, увеличением образования оксида азота (NO) и повышением уровня воспаления (39, 40). В результате гидролитического расщепления триглицеридов образуются глицерол и свободные (неэтерифицированные) жирные кислоты (НЭЖК). Последние присутствуют в крови в связанном с альбумином виде. Альбуминурия и гиперактивация макропиноцитоза в подоцитах в ответ на повышение уровня НЭЖК приводят к нарушению функциональной активности и структурной целостности клеток (40, 41). Увеличение отношения уровня не связанных к связанным с альбумином НЭЖК положительно коррелирует с концентрацией ангиопоэтин-подобного белка 4 (ANGPTL4). Последний проявляет ингибирующее действие по отношению к липопротеидной липазе, что приводит к увеличению уровня триглицеридов и протеинурии (40, 41).
Согласно исследованиям Moorhead с соавт. (42, 43), ассоциированные с ожирением гиперлипидемия и альбуминурия тесно взаимосвязаны между собой и оказывают прямое влияние друг на друга (Рис. 2), образуя систему обратной связи. Наряду с повреждающим действием на мезангиальные клетки и подоциты, отложение липидов приводит к активации TGF-β/Smad3-опосредованного тубулоинтерстициального фиброза и гломерулосклероза. Кроме того, триглицериды, накапливаясь в цитоплазме в виде липидных капель (42, 44), нарушают ряд важных биохимических процессов в клетке, в частности окисление жирных кислот.
Таким образом, нарушение липидного обмена является важным звеном патогенеза заболеваний почек (45), однако клеточные механизмы развития почечного тубулоинтерстициального фиброза до сих пор мало изучены. Как показывают данные секвенирования нового поколения, ХБП часто сопровождается нарушениями процесса β-окисления жирных кислот и повышением уровня воспаления (45).
Процесс β-окисления жирных кислот является важным звеном энергетического обмена эпителиальных клеток проксимальных канальцев нефронов. Так, при ХБП показано снижение уровня свободных жирных кислот, накопление триглицеридов и увеличение риска дислипидемии. Среди молекулярных агентов, участвующих в активации провоспалительных сигнальных каскадов и подавлению окисления жирных кислот, наиболее хорошо изучены провоспалительный цитокин TGF-β и внутриклеточный сигнальный белок SMAD. В ответ на действие TGF-β происходит связывание SMAD с регуляторными элементами PPARγ коактиватора и промотора 1α (PGC1α; 45). Фактор транскрипции PGC1α участвует в регуляции митохондриального биогенеза и экспрессии мРНК генов карнитин-пальмитоилтрансферазы (CPT1) – скорость-лимитирующего фермента в реакции β-окисления жирных кислот. Вместе компоненты сигнального пути TGFβ-SMAD-PGC1α выступают в роли ключевых медиаторов метаболизма свободных жирных кислот и провоспалительных сигнальных каскадов, а активация сигнального пути TGF-β/Smad3 приводит к снижению экспрессии PGC1-α и нарушению метаболизма жирных кислот.
Наряду с компонентами сигнального пути TGFβ-SMAD-PGC1α, важную роль в патогенезе нарушений процесса β-окисления жирных кислот играют печеночная киназа-бета 1 (Lkβ1) и АМФ-активируемая протеинкиназа (AMPK), а также другие сигнальные молекулы, участвующие в развитии воспаления. В модели экспериментальной гиперлипидемии добавление пальмитата в культуры клеток вызывало повышение экспрессии Smad3 и снижение уровня PGC1-α, и, как результат, развитие митохондриальной дисфункции (46).
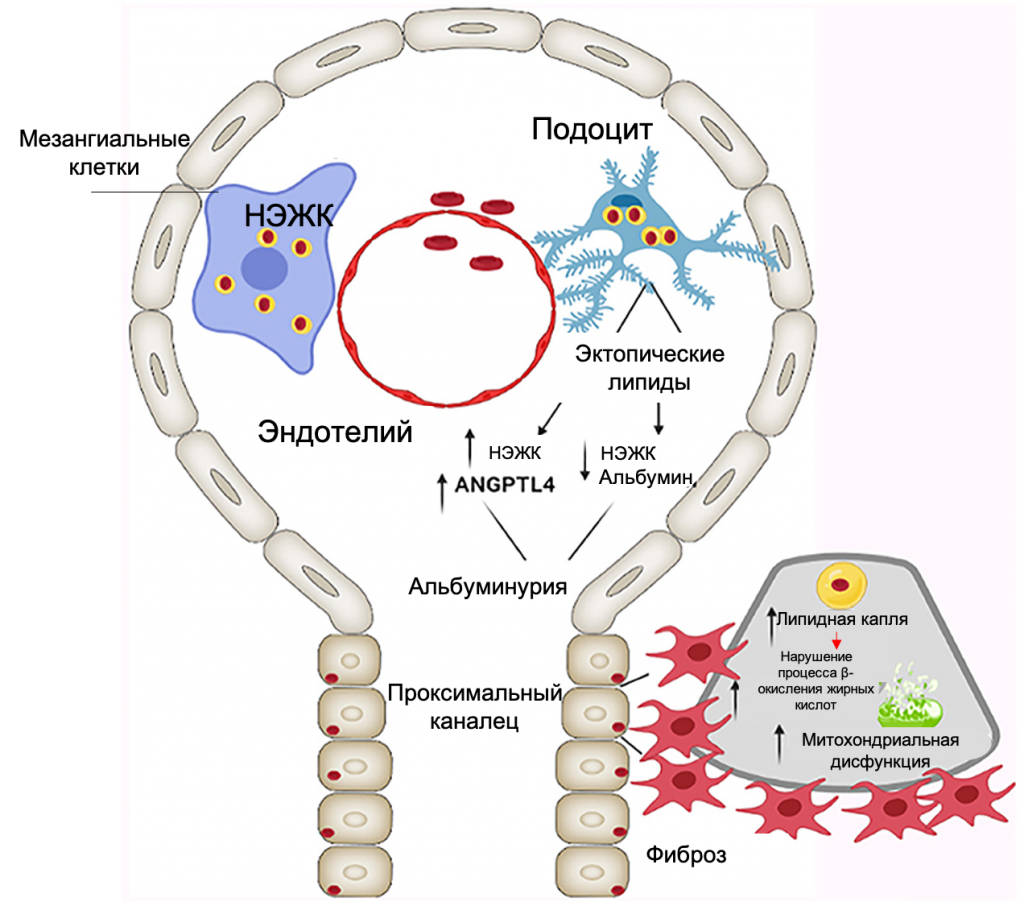
Рисунок 2. Схематическое изображение эффекта увеличения эктопических жировых отложений на функциональную активность и структурную целостность гломерулотубулярного аппарата, патогенез альбуминурии, митохондриальной дисфункции и тубулоинтерстициального фиброза. НЭЖК – неэтерифицированные жирные кислоты; ANGPTL4 – ангиопоэтин-подобный белок 4 [адаптировано из D’Agati et al. (12)].
Периваскулярное отложение липидов в ткани почек вызывает развитие инсулинорезистентности и нарушению инсулиновой сигнализации в эпителиальных клетках проксимальных канальцев (12, 47). Инактивация гена инсулинового рецептора в эпителии проксимальных канальцев мышей стимулирует повышение метаболизма триглицеридов и почечного глюконеогенеза, ведущих к развитию гипергликемии (12, 47).
Одним из важнейших механизмов развития гипергликемии при СД является гиперактивация глюкозных транспортеров и повышение абсорбции глюкозы в почках. Натрий-глюкозный контранспортер (SGLT2) участвует в метаболизме ~80% глюкозы, а ~20% образуются эндогенно в процессе глюконеогенеза (48). Увеличение глюконеогенеза в почках (~40%) и экспрессии мРНК SGLT2 (~36%) у пациентов с СД рассматривается как компенсаторный механизм снижения нагрузки на эпителиальные клетки проксимальных канальцев (50).
Инсулин является важным регулятором образования глюкозы в почках. Активация почечного глюконеогенеза при СД (12) может приводить к развитию глюкозурии (48) и компенсаторному повышению максимального порога транспорта глюкозы (TmG; 48), способствуя развитию гипергликемии и инсулинорезистености (51).
Насыщенные и ненасыщенные жирные кислоты оказывают разнонаправленное влияние на патогенез ХБП. Как упоминалось выше, эктопическое накопление липидов в клетках почек – подоцитах, мезангиальных клетках, эпителиальных клетках проксимальных канальцев и макрофагах – способствует повышению уровня воспаления и оксидативного стресса, митохондриальной дисфункции и развитию почечного фиброза. Наиболее выраженное атерогенное действие оказывают насыщенные жирные кислоты. Преобладающими компонентами липидных капель в просветах нефронов являются диацилглицерол, ацетил-КоА, церамиды и сфинголипиды. Для диабетической нефропатии характерно эктопическое накопление в паренхиме почек насыщенных жирных кислот и их производных – пальмитата, церамида, насыщенных НЭЖК, которые участвуют в механизме активации протеинкиназы С (PKC) и вызывают нарушение функций митохондрий (52, 53). Известно, что липотоксический эффект пальмитиновой кислоты реализуется посредством снижения экспрессии стеароил-КоА-десатуразы-1 (SCD-1) – ключевого фермента в механизме липотоксического поражения почек (54) и цитотоксичности, ассоциированной с нарушениями липидного обмена (55). Прогрессирование ХБП также сопровождается снижением уровня полиненасыщенных жирных кислот (ПНЖК), что объясняет терапевтический эффект приема добавок омега-3 ПНЖК на течение и прогноз заболеваний почек, который реализуется через снижение активности процесса липогенеза при участии белка-1, связывающего регуляторный элемент стерола (SREBP-1; 56).
Продолжение следует…
