Роль нарушений липидного обмена в патогенезе ХБП
Липидный обмен является центральным звеном в патогенезе почечной недостаточности. Основные липиды мембран гломерулярных клеток – фосфолипиды – представляют более половины массы всех липидов мембран; содержание триглицеридов и свободных жирных кислот в составе липидного бислоя составляет 20% и 10%, соответственного. Источником энергии для нормального метаболизма почек является АТФ. В связи с низким гликолитическим потенциалом клеток проксимальных канальцев, окисление жирных кислот служит основным источником энергии. В плазме крови большая часть жирных кислот связаны с альбумином, поэтому для обеспечения энергетических потребностей клетки необходимы свободные жирные кислоты. Транспорт и накопление свободных жирных кислот в тканях обеспечивается действием транслоказы жирных кислот (CD36; 57–59). Дополнительный вклад в транспорт свободных жирных кислот в тканях вносят микроворсинки апикальных мембран эпителиальных клеток проксимальных канальцев.
Дисрегуляция процессов окисления и синтеза жирных кислот или повышение их связывания белком CD36 приводит к снижению уровня триацилглицеридов (57). Синтез жирных кислот и триацилглицеридов контролируется белком SREBP-1 (58, 60). Увеличение экспрессии SREBP-1 на фоне высокожировой диеты (ВЖД) или у трансгенных мышей связано с повышением содержания липидов в клетках проксимальных клубочков и развитием ХБП (Рис. 3; 61). Кроме того, избыточная экспрессия SREBP играет важную роль в повреждении мезангия, усилении оксидативного стресса, повышении количества депозитов иммунных клеток и уровня провоспалительных цитокинов (TNF-α, IL-1β, интерферон-γ), а также синтез TGF-β и факторов роста эндотелия сосудов (VEGF). В частности, повышается экспрессия белков внеклеточного матрикса, что является пусковым механизмом формирования гломерулосклероза, тубулоинтерстициального фиброза и протеинурии (62). Роль SREBP-1 в регуляции воспалительного ответа опосредована его влиянием на синтез и высвобождение IL-1β, активность генов макрофагов, связанных с обменом жирных кислот. Кроме того, SREBP-1 способен индуцировать образование NLRP1a-инфламмасомы, напрямую связываясь с промотором гена NLRP1a (63). Таким образом, образуется «замкнутый круг»: повышение экспрессии SREBP вызывает активацию воспалительного ответа, что приводит к еще большему накоплению жирных кислот, усилению воспалительной реакции и окислительного стресса.
Помимо высокожирового рациона, гипергликемии и накопления насыщенных жирных кислот, повышение синтеза SREBP-1 и усиление активности сигнального пути TGF-β/Smad – главных индукторов формирования почечного фиброза – наблюдается в ответ на действие вазоактивных пептидов, в частности ангиотензина II (58, 64). Примечательно, что у SREBP-1-нокаутных мышей патофизиологические изменения почек минимальны (65).
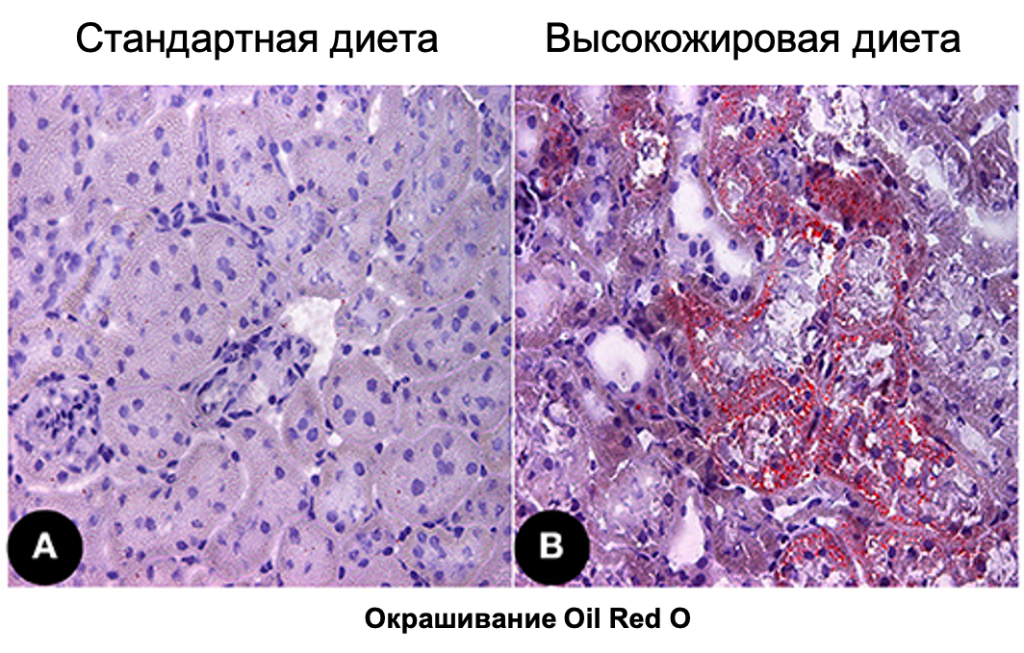
Рисунок 3. Накопление липидов в корковом слое почки у мышей с диабетической нефропатией, ассоциированной с ожирением. Микрофотография препарата коркового вещества почки здоровых мышей (A) и мышей с ожирением (B). Окрашивание: масляный красный (Oil red O).
Дисрегуляция обмена холестерина
Нарушение баланса между процессами синтеза и распада или усиление поглощения и снижение оттока холестерина в клетках приводит к его избыточному накоплению. Важную роль в регуляции метаболизма холестерина играет белок SREBP-2 (66, 67). У мышей с ожирением, индуцированным ВЖД, повышение экспрессии SREBP-2 связано с увеличением аккумуляции холестерина в гломерулярных клетках и нарушениями функций почек (68–70). И наоборот, избыточное накопление холестерина при ожирении, СД или старении служит индикатором гиперэкспрессии SREBP-2.
Данные последних исследований указывают на важную роль провоспалительных цитокинов в подавлении активности рецепторного белка SCAP-SREBP-2-LDL (SREBP cleavage-activating protein-SREBP-2-Low density lipoprotein receptor) и фермента 3-гидрокси-3-метилглутарил-КоА-редуктазы (71). Дополнительным патогенетическим механизмом повреждения клеток является повышение уровня окислительного стресса и стресса эндоплазматического ретикулума (ЭПР), и, как следствие, высвобождения SREBP-2 из ЭПР ER (72). Кроме того, конечные продукты гликирования (КПГ) посредством механизма окислительного стресса способны стимулировать спонтанную транслокацию SCAP из ЭПР в структуры аппарата Гольджи, индуцируя гликозилирование и активацию SREBP-2, и, как результат, повышение синтеза холестерина и нарушение функций почек (69).
Роль нарушений обмена липопротеинов высокой плотности в патогенезе заболеваний почек
В норме липопротеины высокой плотности (ЛПВП) проявляют антиатерогенное действие, способствуя оттоку окисленных липидов из липопротеинов низкой (ЛПНП), промежуточной (ЛППП) и очень низкой (ЛПОНП) плотности и защищают клетки от повреждающего действия медиаторов воспаления. Гиперлипидемии, ассоциированной с нефротическим синдромом, сопутствует выраженное снижение не только содержания ЛПВП в крови (73), но и соотношения холестерина ЛПВП к общему холестерину (74).
Снижение уровня холестерина ЛПВП является важным клиническим признаком ХБП и ТСПН. Так, у пациентов с ТСПН наблюдается повышение уровня окисленного холестерина ЛПВП, оказывающего провоспалительное действие, и его связывания с альбумином, фосфолипазой A2 и сывороточным амилоидом A1 (Apo-A1; 75).
Принимая во внимание патофизиологический эффект гиперлипидемии на функцию почек, можно предположить, что увеличение уровня ЛПВП в плазме крови будет способствовать замедлению прогрессирования ХБП. Однако, как показывают данные экспериментальных исследований, терапевтический потенциал холестерина ЛПВП определяется в большей степени качественным составом частиц ЛПВП. Например, усиление катаболизма Apo-A1 в почках при ХБП приводит к снижению доли плавучих и повышению количества мелких плотных частиц ЛПВП (76), обладающих большим провоспалительным потенциалом, что, вероятно, связано с подавлением активности ферментов, ассоциированных с ЛПВП – параоксоназы 1 (PON1), синтазы оксида (NOS) и лецитин-холестерин-ацилтрансферазы (LCAT; 77, 78), – и, как следствие, снижением коэффициента этерификации и нарушением обратного транспорта холестерина (78). В частности, у пациентов, находящихся на гемодиализе, снижается отток холестерина из макрофагов с помощью ATP-связывающего кассетного транспортера (ABCA-1; 78) и, как следствие, антиатерогенное действие ЛПВП. Однако повышенное накопление липидов в клетках почек крыс в модели нефрэктомии наблюдается независимо от уровня экспрессии ABCA-1 (71), что исключает прямую роль ABCA-1 в структурных изменениях частиц ЛПВП при ХБП. С другой стороны, окислительное повреждение ApoA-1 при ХБП снижает аффинность связывания ЛПВП с белком ABCA-1, что приводит к снижению захвата и дисрегуляции обратного транспорта холестерина и индукции атерогенеза. Наряду с гипоальбуминемией, нарушение транспорта холестерина, связанного с альбумином, является одной из главных причин снижения уровня холестерина ЛПВП при ТСПН (79). Помимо этого, подавление экспрессии PON1 и глутатионпероксидазы (GPX; 78, 80, 81) у пациентов с ХБП и ТСПН, особенно находящихся на гемодиализе, приводит к снижению антиоксидантной и противовоспалительной активности ЛПВП (80) и повышению уровня провоспалительных цитокинов (TNF-α, IL-6, and IL-1β). Важный вклад в потенциацию провоспалительного каскада при ТСПН вносит повышение уровня сывороточного амилоида А1. В норме ЛПВП участвуют в подавлении развития системного воспаления посредством контроля уровня циркулирующих в крови эндотоксинов и сывороточного амилоида А1 (5, 82, 83), стимулирующих синтез и высвобождение провоспалительных цитокинов (5, 82, 83). Таким образом, противовоспалительные свойства холестерина ЛПВП находятся в обратной зависимости от активности сывороточного амилоида А1, а снижение активности частиц ЛПВП и развитие окислительного стресса вносят решающий вклад в развитие системного воспаления и повреждения почек (84, 85).
Роль воспаления, ассоциированного с ожирением, в патогенезе хронической болезни почек
В норме частицы ЛПВП связывают и утилизируют эндотоксин с участием печеночных ферментных комплексов. Хроническая эндотоксемия (86) и ассоциированное изменение гомеостаза кишечной микрофлоры при ХБП (87) снижают устойчивость организма к бактериальным инфекциям и способствуют развитию системного воспаления (88). Хроническое воспаление, в свою очередь, повышает задержку жидкости в организме и инициирует нейрогормональные нарушения, ведущие к гиперактивации симпатической нервной системы, повышению уровня глюкокортикоидов и провоспалительных цитокинов (89). Вместе бактериальные инфекции, ассоциированные с эндотоксемией, эндотелиальная дисфункция, окислительный стресс, снижение иммунной функции, ожирение и генетические факторы способствуют повышению уровня воспаления и лежат в основе патогенеза ХБП (2, 78).
Например, уровни С-реактивного белка, пентраксина-3 (PTX3) и IL-10, а также соотношение IL-6/IL-10 положительно коррелируют со степенью прогрессирования почечной недостаточности при ожирении (90). Хроническое воспаление также усугубляет течение саркопении, а в сочетании с гипергликемией может вызывать повышение уровня ангиотензина II (Ang II) и, как следствие, приводить к эндотелиальной дисфункции и фиброзу (91).
Нарушение регуляции ренин-ангиотензин-альдостероновой системы при ожирении
Как известно, РААС играет важную роль в контроле системного артериального давления и водно-электролитного баланса (92). Компоненты РААС присутствуют в различных тканях и органах – мозге, сердце, почках. В частности, белок-предшественник ангиотензина I (Ang I) ангиотензиноген (AGT) локализуется в эпителии проксимальных канальцев, а ангиотензин-превращающий фермент (АПФ), катализирующий превращение ангиотензина I в ангиотензин II, в большом количестве присутствует в эпителии проксимальных и дистальных канальцев и собирательных трубочках (93). В синтезе, хранении и секреции ренина – фермента, катализирующего расщепление ангиотензиногена с образованием Ang I, – участвуют миоэпителиальные клетки юкстагломерулярного комплекса, расположенные в стенках артериол почечных клубочков. Таким образом, в почечной ткани локализуются все элементы РААС, необходимые для образования Ang II. Связывание Ang II с рецептором ангиотензина 1 типа (AT1) вызывает вазоконстрикцию сосудов почки и образование альдостерона в клубочковой зоне коры надпочечников.
Вместе с повышением уровня артериального давления, увеличением обхвата талии и снижением холестерина ЛПВП высокий уровень альдостерона при ожирении служит предиктором развития эндотелиального окислительного стресса и сердечно-сосудистых нарушений (95; 96). Помимо этого, известно, что жировая ткань также является источником провоспалительных цитокинов, включая TNF-α и IL-6 – важнейших элементов в механизме секреции альдостерона и патогенезе инсулинорезистентности (93). С другой стороны, активация РААС может усиливать накопление липидов в жировой ткани (93). Так, у мышей с ожирением наблюдается избыточная экспрессия ангиотензиногена в адипоцитах (97, 98), а инактивация гена AGT, наоборот, предотвращает развитие ожирения на фоне ВЖД (93, 98). Кроме того, применение ингибиторов РААС позволяет добиться снижения экскреции ангиотензиногена с мочой (urinary angiotensinogen, UAGT), а подавление активности AT1 – уменьшения уровня экскреции альбумина (99, 93). Таким образом, применение блокаторов РААС может служить эффективным методом снижения АД и прогрессирования почечной недостаточности, ассоциированных с ожирением.
Изменения гемодинамики почек
Важным биологическим маркером протекания патофизиологических процессов в почках является динамика эффективного почечного плазмотока (ЭПП). Однако связь между повышением ЭПП (на 9–33%) и патогенезом заболеваний почек подтверждается лишь в некоторых исследованиях (12, 100–102). Дополнительно для пациентов с ожирением показано увеличение фильтрационной фракции на 9–29% (101, 103, 104), причем патологические изменения гемодинамики почек возникают преимущественно при ожирении I степени (ИМТ<30 кг/м2; 12, 102). Важно отметить, что при ожирении амплитуда увеличения ЭПП ниже, чем рост значений СКФ, что отражает разный вклад процессов вазодилатации и вазоконстрикции афферентных и эфферентных артериол, соответственно, в развитие почечной недостаточности. В силу сложности расчета разницы транскапиллярного гидравлического давления и коэффициента ультрафильтрации у людей, ЭПП и СКФ остаются наиболее широко используемыми, хоть и непрямыми индикаторами изменений почечной гемодинамики (105).
Важным звеном патогенетического механизма развития системной АГ на начальных стадиях ожирения является вазодилатация афферентных артериол, которая вызывает увеличение транскапиллярного гидравлического давления (104, 105), СКФ и гиперфильтрации (105). Как показывают данные клинических исследований, снижение ИМТ (с 48 кг/м2 до 32 кг/м2) после перенесенной бариатрической операции связано с улучшением показателей СКФ и ЭПП, снижением альбуминурии и нормализацией клиренса альбумина, что указывает на эффективность снижения массы тела как терапевтического метода уменьшения риска развития и прогрессирования нефропатии, ассоциированной с ожирением (103).
Терапия нефропатии, ассоциированной с ожирением
Немедикаментозные методы (снижение веса с помощью коррекции рациона питания или бариатрической хирургии) и фармакологическая терапия (блокаторы/антагонисты РААС и SGLT-2, агонисты рецептора GLP-1) оказывают выраженный ренопротективный эффект при нефропатии/гломерулопатии, ассоциированной с ожирением.
Ингибиторы ренин-ангиотензин-альдостероновой системы
Наиболее распространенными фармакологическими агентами, используемыми для снижения активности РААС, являются ингибиторы АПФ и ренина и антагонисты АТ 1-рецепторов ангиотензина и рецепторов альдостерона. Так, у пациентов с ожирением введение ингибиторов АПФ приводит к 30–80% снижению протеинурии (12, 106, 107), а эффективность ингибитора АПФ рамиприла у пациентов с ожирением выше, чем у людей с нормальным ИМТ (108). Данные клинических исследований демонстрируют высокую эффективность длительного применения (от 1 года) ингибиторов АПФ в снижении прогрессирования ХБП в ТСПН (109), причем величина эффекта прямо пропорциональна значениям ИМТ, что указывает на большую чувствительность пациентов с ожирением к терапии ингибиторами РААС. Однако по мере набора веса и прогрессирования ожирения долгосрочная эффективность ингибиторов РААС снижается (108–110), что ограничивает терапевтическое применение этой группы препаратов.
Альтернативным методом поддержания функции почек является использование антагонистов рецепторов минералокортикоидов (МКР), активация которых способствует развитию морфофункциональных нарушений в ткани почек. Так, введение антагонистов МКР снижает скорость прогрессирования метаболического синдрома и осложнений, связанных с ожирением (111), в том числе заболеваний почек (112). Помимо этого, краткосрочный прием ингибитора МКР спиронолактона на фоне терапии блокаторами АПФ у пациентов с ожирением значительно снижает альбуминурию и уровень артериального давления (113), а нестероидные антагонисты МКР третьего поколения (напр., финеренон или эплеренон) позволяют предотвратить прогрессирование ХБП и снизить риск сердечно-сосудистых осложнений (114, 115).
Снижение веса и изменение рациона питания
Как показывают результаты нерандомизированных проспективных (12) и рандомизируемых контролируемых клинических исследований (116), нефармакологические методы терапии заболеваний, ассоциированных с ожирением, оказывают длительный и стойкий эффект. У пациентов с диабетическим ожирением диета с низким гликемическим индексом в сочетании с умеренной физической активностью (ИМТ 30–38 кг/м2 ) способствовала выраженному снижению ИМТ и протеинурии (116, 117), но не СКФ, причем величина эффекта была прямо пропорциональной уровню снижения массы тела (12, 118). Так, снижение массы тела на 4% было связано с 30% снижением уровня протеинурии, а потеря 6–10% веса – с более чем 70% (12, 118, 119).
Помимо снижения массы тела и уровня протеинурии, диета с низким гликемическим индексом или гипокалорийная диета способствуют улучшению показателей артериального давления, уменьшению выраженности гиперлипидемии и инсулинорезистентности и нормализации уровня глюкозы в крови натощак (117, 120). Кроме того, изменение рациона питания и достижение обхвата талии <102 см способствует снижению риска сердечно-сосудистых осложнений и улучшению эндотелиальной функции у мужчин, страдающих ожирением (121).
Бариатрическая хирургия
Данные клинических исследований указывают на более высокую по сравнению с коррекцией рациона питания эффективность бариатрической хирургии в снижении скорости прогрессирования заболеваний почек и нефропатии у пациентов с диабетическим ожирением (122–124). В частности, показано снижение уровня СКФ и альбуминурии или протеинурии, а также выраженное улучшение уровня артериального давления, системного воспаления и биомаркеров липидного обмена спустя 1–5 лет после проведения бариатрической операции (124–126). Однако бариатрическая хирургия может вызывать ряд послеоперационных осложнений, включая нефролитиаз, оксалатную нефропатию и острую почечную недостаточность (127), а также пневмонию, незапланированную реинтубацию и послеоперационные легочные осложнения, особенно у пациентов с ХБП (128).
Так, риск развития послеоперационных осложнений увеличивается по мере прогрессирования ХБП с 4.6% у пациентов с нормальной функцией почек и стадией 1 ХБП до 9.9% при ХБП 5 стадии, поэтому неверно утверждать, что бариатрическая хирургия является наиболее эффективной стратегией снижения риска развития и прогрессирования ХБП и ТСПН (129).
Агонисты глюкагонподобного пептида-1
В настоящее время наиболее эффективным методом лечения заболеваний почек, ассоциированных с ожирением, считается применением ингибиторов РААС (109). Однако со временем терапевтическое действие этой группы препаратов значительно снижается, что делает актуальным поиск альтернативных подходов к профилактике и лечению нефропатии при ожирении.
Доказан высокий терапевтический потенциал антигипергликемических препаратов (129). Например, агонисты глюкагонподобного пептида-1 (GLP-1) дулаглутид (Trulicity®), эксенатид замедленного высвобождения (Bydureon®), эксенатид (Byetta®), семаглутид (Ozempic®, Rybelsus®), лираглутид (Victoza®) и ликсисенатид (Adlyxin®) замедляют прогрессирование заболеваний почек и улучшают показатели СКФ и уровень альбуминурии (130). Помимо повышения чувствительности к инсулину, агонисты GLP-1 участвуют в регуляции экскреции альбумина, повышают ЭПП, снижают активность элементов РААС и натрий-водородного обменника (NHE3), стимулируя натрийурез и диурез, и улучшают показатели почечной гемодинамики. Кроме того, агонисты GLP-1 способны подавлять образование и секрецию хиломикронов в кишечнике, оказывая положительное влияние на клиренс липидов. Однако препараты этой группы плохо переносятся пациентами с ТСПН, поэтому требуется больше клинических исследований для понимания механизма действия агонистов GLP-1 и спектра их терапевтического применения (130).
Агонисты рецепторов GLP-1 оказывают выраженный гиполипидемический эффект и включены в официальные рекомендации Американской диабетической ассоциации по лечению гипергликемии у пациентов с СД2 и сердечно-сосудистыми заболеваниями. Их применение рекомендуется в случае, если терапия метформином не позволила достигнуть целевых уровней гликемии (131). Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (United States Food and Drug Administration, FDA) одобрило применение агонистов рецепторов GLP-1 в комбинации с другими препаратами (например, инсулин гларгин/эксанитид, Soliqua 100/33 или инсулин деглудек/лираглутид, Xultophy 100/3.6) (131–133).
Таблица 1. Данные клинических исследований гипогликемических препаратов в терапии заболеваний почек у пациентов с сахарным диабетом II типа
| Исследование | Воздействие | Испытуемые | Критерии исхода | Исход |
| AWARD-7 | Дулаглутид 0.75–1.5 мг vs инсулин гларгин | N=57752% мужчин,
средний возраст – 65 лет, длительность терапии – 52 недели |
Изменение СКФ и соотношения альбумин/креатинин в разовой порции мочи относительно исходных значений | Снижение СКФ; эффективность дулаглутида в контроле гликемии у пациентов с ХБП сопоставима с эффективностью инсулина гларгин |
| LEADER | Лираглутид 0.6–1.8 мг vs плацебо | N=934054% мужчин,
средний возраст – 64 года, медиана времени наблюдения – 3.84 лет |
Альбуминурия, увеличение уровня креатинина в крови, СКФ<45 мл/мин/1.73 м2, необходимость заместительной почечной терапии или смерть | Снижение вероятности развития хронической альбуминурии и риска неблагоприятного исхода |
Ингибиторы натрий-глюкозного котранспортера
В большинстве случаев ожирение сопутствует СД2 (т.е. «диабетическое ожирение»), значительно повышая риск кардио-ренальных осложнений (131). В современной литературе коморбидность ожирения и СД обозначается терминов «диабетическое ожирение» («diabesity»).
Набор веса является основным побочным эффектом большинства гипогликемических препаратов (инсулин, сульфонилмочевина, глиниды, тиазолидиндионы), что может снижать эффективность терапии при диабетическом ожирении. Блокаторы SGLT-2 селективно и обратимо связываются с натрий-глюкозным котранспортром в эпителии проксимальных канальцев, вызывая снижение реабсорбции и повышение экскреции глюкозы. Кроме того, препараты этой группы снижают соотношение инсулин:глюкагон, повышая активность процесса липолиза. По этой причине ингибиторы SGLT-2 представляют единственный класс гипогликемических препаратов, способствующих снижению массы тела (131). Так, показано, что применение ингибиторов SGLT-2 в течение 6–12 месяцев позволяет добиться снижения массы тела на 3.2–3.9 кг (134), а использование ингибитора SGLT-2 дапаглифлозина в комбинации с метформином в течение 24 недель приводит к снижению обхвата талии на 1.7 см (134). У жителей Японии на фоне длительной терапии (24 недели) ипраглифлозином наблюдается выраженное снижение количества висцерального жира и интрагепатического отложения липидов (131).
Важно подчеркнуть, что для достижения максимальной эффективности препаратов этой группы рекомендуется их использованием в комбинации с немедикаментозными (например, снижение массы тела) или фармакологическими (например, в сочетании с агонистами рецепторов GLP-1) методами (131, 135). Так, например, эффективность ингибитора SGLT-2 дапаглифлозина в снижении массы тела и контроле уровня гликемии у больных СД2 на фоне терапии метформином (DURATION-8) значительно повышается при его комбинации с агонистом рецепторов GLP-1 эксенатидом (136). Рядом других исследований показана способность ингибиторов SGLT-2 снижать скорость прогрессирования заболеваний почек при диабетическом ожирении, вероятно, посредством снижения гидростатического давления в капиллярах почечных клубочкового капиллярного и альбуминурии (135, 137).
Ингибиторы SREBP
Появляется все больше данных, связывающих избыточную экспрессию SREBP-1 – важнейшего регулятора синтеза холестерина – при гиперлипидемии с активацией синтеза провоспалительных цитокинов и профибриногенных факторов роста, и, как следствие, развитием тубулоинтерстициального фиброза (65, 138). Для снижения уровня экспрессии SREBP-1, уменьшения аккумуляции липидов, уровня воспаления и риска фиброза при ожирении применяются агонисты фарнезоидного рецептора Х (FXR; 130, 139) и агонисты рецептора витамина D (VDR; 67). Применение VDR совместно с изменением рациона питания у старых мышей снижает экспрессию и активность SREBP-2 в почках (12, 63, 67), предотвращая накопление холестерина и улучшая функцию почек (67). Помимо этого, описан механизм противовоспалительного действия ангиопоэтина посредством LDLr-SREBP2-SCAP сигнального пути (1–7) и его роль в снижении прогрессирования заболеваний почек на фоне ожирения и ВЖД (140).
Альтернативные терапевтические стратегии
Альтернативной стратегией предотвращения избыточного накопления липидов в клетках является индукция окисления жирных кислот посредством активации PPARα. Известно, что снижение экспрессии PPARα и активности ферментов, участвующих в процессе β-окисления жирных кислот, в материалах биопсии почек пациентов с ожирением, служат предикторами развития нефропатии и СД (45). С другой стороны, агонист PPARα фенофибрат способствует снижению прогрессирования заболеваний почек у мышей с ожирением (141) и мышей линии db/db в модели СД (142), а элафибранор – снижению прогрессирования альбуминурии и уровня СКФ. Таким образом, длительное применение агонистов PPARα может рассматриваться в качестве эффективной стратегии для профилактики и терапии заболеваний почек, ассоциированных с ожирением (143).
Высокую эффективность в снижении скорости прогрессирования повреждения почек демонстрируют ингибиторы печеночного Х-рецептора (LXR), которые играют важную роль в регуляции обратного транспорта холестерина, что объясняет их антиатерогенное и противовоспалительное действие (144, 145). Известно, что LXR повышает отток холестерина в гломерулярных клетках (146). При нефропатии, ассоциированной с диабетическим ожирением, наблюдается снижение экспрессии мРНК LXR и других ферментов, участвующих в обратном транспорте холестерина (147), однако биологические механизмы, лежащие в основе этого процесса, до сих пор мало изучены. Например, известно, что хроническое воспаление вызывает снижение уровня экспрессии LXR в почках (148). В модели СД2 у мышей показано, что использование антагонистов LXR уменьшает аккумуляцию холестерина клетками почек, оказывает противовоспалительное действие и снижает скорость прогрессирования заболеваний почек (149), однако примечательно, что инактивация гена LXR у мышей линии LXR α/β−/− не предотвращает развитие диабетической нефропатии (150), что может быть связано с высоким уровнем системного воспаления, окислительного стресса и аккумуляции холестерина (150).
Повышение уровня экспрессии гена LXR подавляет активность компонентов РААС (151) и приводит к снижению транспорта натрия через эпителиальный натриевый канал (ENaC; 152) и CFTR-опосредованного транспорта хлора (cystic fibrosis transmembrane conductance regulator (CFTR)-mediated chloride transporter) в собирательных трубочках (153). Введение LXR агониста циклодекстрина в модели диабетической нефропатии мышей (BTBR ob/ob) способствует улучшению функциональной активности почек (154).
Таким образом, результаты экспериментальных исследований указывают на важную роль LXR в поддержании гомеостаза и функции почек.
Заключение
Ожирение является независимым фактором риска заболеваний почек, а развитие сопутствующих патологий – артериальной гипертензии, атеросклероза и СД2 – усиливает повреждающее действие ожирения. Повышение значений ИМТ коррелирует с повышением СКФ, ЭПП и реабсорбции натрия в почечных канальцах, что вместе способствует развитию гломерулярной гипертензии. Протеинурия и альбуминурия – распространенные последствия хронической гипергликемии при ожирении, которые вызывают повреждение гломерулярных клеток и в 1/3 случаев приводят к ТСПН. Дополнительные патогенетические факторы – гестационный диабет, уменьшение количества функционирующих нефронов и массы почечной ткани – в сочетании социоэкономическими факторами в значительной мере определяют риск формирования структурных и функциональных изменений, ведущих к развитию заболеваний почек, ассоциированных с ожирением.
Эктопическое накопление липидов в подоцитах вследствие нарушения метаболизма свободных жирных кислот и холестерина провоцирует развитие и прогрессирование альбуминурии, оксидативного стресса и тубулоинтерстициального фиброза и является важным звеном патогенетического механизма повреждения почек при ожирении. Помимо этого, избыточное накопление липидов в почках связано с формированием инсулинорезистентности. Липопротеины высокой плотности принимают участие в транспорте холестерина и оказывают противовоспалительное и антиоксидантное действие. Нарушение липидного гомеостаза и снижение уровня ЛПВП при ожирении служат пусковым механизмом развития гиперлипидемии и прогрессирования заболеваний почек. По этой причине гиполипидемическая терапия, в частности использование ингибиторов РААС, может рассматриваться в качестве эффективного способа снижения риска возникновения и прогрессирования ХБП. Дополнительным методом фармакологической терапии для снижения риска нефропатии, ассоциированной с ожирением, является применение антагонистов SREBP или агонистов PPARα и GLP-1RA и ингибиторов SGLT-2.
Наиболее длительный и стойкий профилактический и терапевтический эффект в отношении заболеваний почек при ожирении оказывают немедикаментозные методы –снижение веса посредством изменения образа жизни и питания или с помощью бариатрической хирургии, – а также их сочетание с фармакологической терапией, хотя в настоящее время накоплено недостаточно данных о долгосрочной эффективности бариатрической хирургии на прогноз и течение ХБП.
Повреждение почек при ожирении – длительный многокомпонентный процесс, включающий множество взаимосвязанных биохимических элементов. Для более глубокого понимания патогенеза заболеваний почек, ассоциированных с ожирением, требуется проведение большего количества клинических исследований, направленных на изучение отдельных компонентов и уровней патогенетического механизма развития коморбидных заболеваний и их взаимоусиливающего влияния друг на друга.
Таблица 2. Клинические исследования заболеваний почек, ассоциированных с ожирением и сахарным диабетом (источник: ClinicalTrials.gov)
| Воздействие | Объект исследования | Заболевание | Первичный исход | Вторичный исход |
| Снижение уровня потребления соли | Человек | Альбуминурия | Снижение уровня альбумина в моче спустя 12 недель диеты с низким содержанием соли | Снижение уровня натрия в моче, изменение артериального давления |
| 3.6 г бутирата натрия, 6 капсул 2 раза в день в течение 12 недель | Человек | Сахарный диабет, альбуминурия | Снижение уровня хронического воспаления кишечника | Изменение соотношения / креатинин и СКФ |
| Диета с низким содержанием натрия | Человек | Хроническая болезнь почек, альбуминурия | Изменение соотношения альбумин/креатинин | Изменение уровня альбумина в моче, СКФ и артериального давления |
| SGLT2 ингибиторы: дапаглифлозин 5-10 мг или эмпаглифлозин 10 мг или канаглифлозин 100 мг 1 раз в день | Человек | Диабетическая нефропатия | Снижение уровня альбуминурии, СКФ, уровней нефрина, TGF-бета-1, IL-6, TNF-альфа | Изменение уровня мочевой кислоты, альдостерона, ренина, ангиотензина |
| Антагонисты минералокортикоидных рецепторов: спиронолактон 25 мг в день в течение 6 недель; амилорид 5 мг в день в течение 6 недель | Человек | Хроническая болезнь почек, альбуминурия | Снижение уровня окислительного стресса, уровня F2-изопростанов в моче и альбуминурии | Изменение уровня калия в крови и СКФ |
| Циклосиликат циркония-натрия LOKELMA® 5 мг, порошок для приготовления суспензии | Человек | Сахарный диабет II типа, повреждение почек | Изменение соотношения альбумин/креатинин | Изменение СКФ, уровня натрия и калия в моче |
| Сульфонилуреаза vs гипогликемические препараты нового поколения | Человек | Диета при сахарном диабете II типа, функциональные нарушения работы почек, альбуминурия | Динамика показателей метаболизма глюкозы, приверженности лечению, осложнений сахарного диабета | Изменение чувствительности к инсулину |
| Диета, имитирующая голодание, пищевая добавка Эндокаликс: 4 капсулы в день в течение 3 месяцев | Человек | Диабетическая нефропатия, альбуминурия, сахарный диабет II типа, нарушение метаболизма глюкозы, микроальбуминурия | Изменение индекса микрососудистой дисфункции по сравнению с плацебо | Изменение соотношения альбумин/креатинин, уровня гепараназы, моноцитарного хемотаксического фактора-1 (MCP-1) и гепарансульфата в моче |
| Куркумин, 3 капсулы по 30 мг 1 раз в день в течение 6 месяцев | Человек | Хроническая болезнь почек | Изменение показателей функции почек (СКФ, альбуминурии) через 24 недели приема куркумина по сравнению с исходными значениями | Изменение уровня гликированного гемоглобина, улучшение гликемического контроля и функции почек |
| Поведенческая терапия: занятия со специалистом (coaching DASH group) или самостоятельные занятия (self-shopping DASH group) | Человек | Хроническая болезнь почек, артериальная гипертензия | Динамика альбуминурии | Изменение систолического артериального давления |
