О.В. Васюкова, Ю.В. Касьянова*,
П.Л. Окороков, О.Б. Безлепкина
Национальный медицинский исследовательский центр эндокринологии, Москва, Россия
Миокины были открыты в начале 2000-х гг. и представляют собой белки, синтезируемые скелетными мышцами при их сокращении [1]. Обладая аутокринными и паракринными эффектами, а также возможностью при определенных концентрациях оказывать системное действие через собственные рецепторы в мышцах, жировой ткани, печени, поджелудочной железе, сердце, костной ткани, иммунных клетках и клетках головного мозга, миокины обеспечивают метаболическое взаимодействие между данными органами, тканями и имеют широкий спектр физиологических эффектов.
В настоящее время известно более 1000 миокинов, относящихся к различным структурно-функциональным группам (цитокины, хемокины, семейство простагландинов и др.).
Часть миокинов, помимо клеток скелетной мышечной ткани, синтезируется и секретируется адипоцитами, в связи с чем выделяют миокины и адипомиокины. Соответственно, последние могут оказывать как отрицательное метаболическое воздействие, выступая в роли провоспалительных адипокинов при ожирении, так и положительное, повышаясь в ответ на физические упражнения.
Известно, что ожирение в сочетании с низким уровнем физической активности приводит к избыточному накоплению висцеральной жировой ткани и развитию метаболических осложнений. Патогенетической основой данных изменений является развитие системного воспаления, характеризующегося клеточной инфильтрацией, фиброзом, изменениями микроциркуляции, сдвигом секреции адипокинов и метаболизма в жировой ткани, а также накоплением в крови таких неспецифических маркеров воспаления, как С-реактивный белок, фибриноген, лейкоциты, уровень которых отражает выраженность процесса [2, 3], приводящего к развитию инсулинорезистентности в периферических тканях [4].
Однако повышающиеся в ответ на физическую нагрузку миокины могут уравновешивать провоспалительные эффекты адипокинов. При сокращении мышечные волокна экспрессируют ирисин, интерлейкин-6, фактор роста фибробластов 21 и др., которые оказывают свое воздействие не только локально в мышцах, но и в органах-мишенях, уменьшая развитие воспаления.
Миокины опосредуют связь между мышцами и печенью, жировой тканью, поджелудочной железой, головным мозгом, другими органами. Современные исследования демонстрируют активное участие миокинов в регуляции процессов липолиза, глюконеогенеза, секреции инсулина бета-клетками поджелудочной железы, активации термогенеза [5–7].
Известно, что малоподвижный образ жизни связан с развитием ожирения, сахарного диабета 2 типа, сердечно-сосудистых заболеваний, остеопороза и ранней смертностью, а регулярные физические нагрузки способствуют профилактике данных состояний [8].
В настоящее время активно изучаются молекулярные механизмы этих взаимодействий, и предполагается, что именно миокины являются основным патогенетическим звеном, обеспечивающим положительное влияние физических упражнений на здоровье.
Адаптируясь к механическим, нервным и гуморальным воздействиям, скелетная мускулатура играет решающую роль в обеспечении физической активности, расходовании энергии и утилизации глюкозы [9]. Физические упражнения и анаболические гормоны, такие как инсулин, инсулиноподобный фактор роста 1, гормон роста и тестостерон, увеличивают массу скелетных мышц. И наоборот, гиподинамия, развивающаяся вследствие нервно-мышечных заболеваний, старения, хронических заболеваний (почечная недостаточность, дыхательная недостаточность, тяжелый сахарный диабет, гиперкортицизм и др.) приводит к дефициту и атрофии мышц (рис. 1).
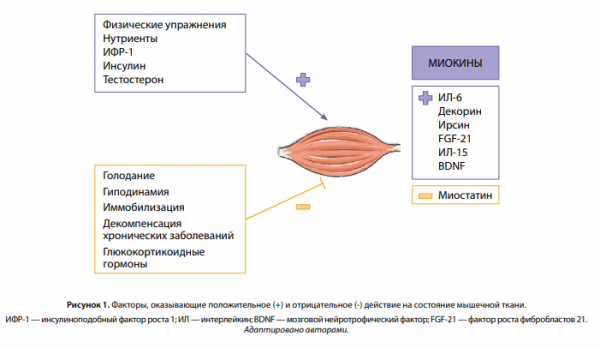
Таким образом, мышечная ткань вовлечена в тесное взаимодействие с различными органами и системами, что, с одной стороны, дает понимание патогенетических основ положительного влияния физической нагрузки на организм в целом и профилактику различных ассоциированных с гиподинамией заболеваний, а с другой — возможность узнать молекулярные механизмы развития метаболических осложнений.
Но вместе с тем до настоящего времени остается неясным, как и почему уровни провоспалительных адипокинов, с одной стороны, повышаются в состоянии ожирения, а с другой — оказывают благотворное воздействие на организм после физической нагрузки.
Кроме этого, список предполагаемых миокинов продолжает расти, однако специфические физиологические и патологические эффекты этих молекул у человека малоизучены. Остаются вопросы, является ли скелетная мышца основным или единственным источником данного миокина, как регулируется его локальная и системная концентрация, существуют ли биологические различия между видами и какие конкретные сигнальные механизмы опосредуют биологические эффекты миокина в различных органах.
И в то же время несомненно, что лучшее понимание действия миокинов может определить новые методы лечения ожирения, сахарного диабета, сердечно-сосудистых и других заболеваний.
В данном обзоре представлены основные эффекты известных на сегодняшний день миокинов, а также рассмотрены их изменения при разных состояниях у людей.
Продолжение следует
