Л.А. Луговая, Т.А. Некрасова,
Л.Г. Стронгин, Н.Г. Беляева*
Приволжский исследовательский
медицинский университет
Обоснование
Симптомы поражения мышц, связанные с приемом статинов (СПМ-СПС), занимают одно из лидирующих мест среди нежелательных реакций данного класса препаратов [1] и наблюдаются почти у трети больных [2, 3].
Среди факторов риска СПМ-СПС упоминается гипотиреоз, но данные о его роли неоднозначны: в большинстве работ изучали недиагностированный гипотиреоз [4–6], вопрос же о безопасности статинов при компенсированной тиреоидной недостаточности остается открытым.
В итоге одни рекомендации не содержат ограничений по приему статинов при гипотиреозе [7], по умолчанию позволяя назначать их без предварительной оценки компенсации, другие же, напротив, вводят такие ограничения, и тоже независимо от статуса компенсации (инструкция к розувастатину в дозировке более 40 мг).
О возможной акселерации пагубного влияния статинов на мышечную ткань в условиях гипотиреоза позволяют задуматься некоторые теоретические предпосылки. В первую очередь, это возможность кумуляции статинов за счет замедления метаболизма при тиреоидном дефиците [8]; патогенетическое сходство в механизмах воздействия на мышцы обоих факторов, включая митохондриальную дисфункцию [9, 10]; способность статинов ингибировать селенопротеины, необходимые для синтеза тиреоидных гормонов [11], что неоднократно описывалось в
клинических разборах [12, 13].
Среди немногих исследований, так или иначе затрагивающих проблемы приема статинов при гипотиреозе, четыре работы говорят о повышении риска СПМ-СПС на фоне гипотиреоза в 1,57–1,7 раз [14–17]. В половине работ речь шла о высоких дозах статинов и недиагностированном гипотиреозе [16, 17]; часть из них были ретроспективными и не изучали маркеры мышечного поражения. Ни одно из исследований не подразумевало генотипирования по гену SLCO1B1*5 (c.521T>C), которое в современных условиях используют для прогнозирования СПМ-СПС (С-аллель в SLCO1B1*5 (c.521T>C), повышает риск СПМ-СПМ при генотипе ТС – в 4, а при генотипе СС – в 17 раз [18]).
Таким образом, до настоящего времени недостаточно изучен ряд вопросов, касающихся применения статинов в условиях гипотиреоза, включая оценку вероятности и путей развития СПМ-СПС на фоне невысоких доз статинов и компенсированного гипотиреоза, в их взаимосвязи с маркерами мышечного поражения и результатами генотипирования. Планирование и проведение подобных исследований имеет важное теоретическое значение и полезно с практической точки зрения, в свете прогнозирования осложнений и выбора оптимальной терапии для лиц с компенсированным гипотиреозом и показаниями к приему статинов.
Цель
Изучить характер нарушений мышечного метаболизма на фоне приема статинов при компенсированном гипотиреозе.
Методы
Дизайн исследования
Поведено одномоментное (поперечное) обсервационное одноцентровое контролируемое нерандомизированное исследование с включением 120 женщин, представленных тремя группами по 40 человек.
Формирование групп происходило параллельно, до достижения запланированного количества пациентов, и подразумевало сплошной характер наблюдения. Основная группа больных, принимавших статины на фоне гипотиреоза (1-я группа), сравнивалась с двумя группами контроля, включая принимавших статины без гипотиреоза (2-я группа) и не принимавших статины с гипотиреозом (3-я группа).
Критерии соответствия
В исследование включали женщин с гипотиреозом в стадии медикаментозной компенсации продолжительностью не менее 6 мес, принимающих (1-я группа) или не принимающих статины (3-я группа), а также пациенток без гипотиреоза, принимающих статины (2-я группа). Компенсированным гипотиреоз считали при содержании тиреотропного гормона (ТТГ) в крови в диапазоне 0,5–5,0 мЕд/л. Больные принимали аторвастатин, симвастатин или розувастатин в невысоких дозировках в течение 6–24 мес, что в целом соответствует периоду возникновения СПМ-СПС [19].
Критериями исключениями были высокие дозы статинов (аторвастатин, симвастатин более 40 мг, розувастатин более 20 мг), гипотиреоз в стадии декомпенсации, сахарный диабет, наследственные миопатии в анамнезе, а также оперативные вмешательства и травмы в течение последних 6 мес.
Продолжительность исследования
Исследование начато в декабре 2015 г. и продолжалось до октября 2017 г. Группы больных набирались параллельно, с 2015 по 2017 г. В рамках поперечного исследования все пациентки обследовались однократно.
Описание медицинского вмешательства
Основой исследования было определение симптомов мышечного поражения с помощью стандартных опросников, а также биохимических маркеров мышечных нарушений и полиморфизма гена SLCO1B1* 5 (c.521T>C) посредством забора образцов крови для проведения соответствующих манипуляций в клинической лаборатории.
Основной исход исследования
Оценивали характер мышечных симптомов, интенсивность мышечной боли и слабости, тиреоидный статус (ТТГ, свободная фракция тироксина (св.Т4)), содержание липидов в крови (общего холестерина (ХС), липопротеинов высокой плотности (ЛПВП), липопротеинов низкой плотности (ЛПНП), триглицеридов (ТГ)), маркеров мышечного поражения (активность креатинфосфокиназы (КФК), лактатдегидрогеназы (ЛДГ), концентрацию миоглобина крови), определяли генотип SLCO1B1* 5 (c.521T>C).
Дополнительные исходы исследования
Исследованы особенности показателей мышечного метаболизма в зависимости от наличия гипотиреоза и/или терапии статинами, изучена взаимосвязь между развитием СПМ-СПС у больных гипотиреозом и степенью компенсации тиреоидной недостаточности. Определяли пороговое значение концентрации ТТГ, при превышении которого значительно увеличивается вероятность возникновения симптомов поражения мышц, связанных с подъемом КФК, у больных компенсированным гипотиреозом.
Методы регистрации исходов
Помимо проведения общеклинического обследования, включающего общий осмотр, сбор анамнеза, жалоб и пальпацию щитовидной железы у всех оценивали краткий опросник боли (КОБ) [20] и краткий опросник слабости (КОС) [21].
Проводилось исследование тиреоидного статуса, ряда биохимических показателей, генотипирование в клинико-диагностических лабораториях на базах кафедры эндокринологии и внутренних болезней ФГБОУ ВО «ПИМУ» Минздрава России.
Концентрацию ТТГ и св.Т4 определяли у всех больных с гипотиреозом (1-я и 3-я группы); во 2-й группе для исключения тиреоидной недостаточности оценивали содержание ТТГ. Исследование проводили иммунохемилюминисцентным иммуноферментным методом с реагентами Siemens Immulite 2000 Systems (Великобритания) на анализаторе Immlite 2000TM (Великобритания).
Исследование липидного спектра (ХС, ЛПВП, ЛПНП, ТГ), а также определение ЛДГ проведены на автоматическом анализаторе Furuno-CA-180 (Япония) с реагентами DiaSys (Германия).
Анализ креатинфосфокиназы (КФК) выполнен ферментативным способом на автоматическом анализаторе ВА 400 (Испания) с реагентами фирмы BioSystems (Испания). Титр миоглобина крови исследовали ручным способом в плашке с реагентами «ДС-ЭРИТРО-МИОГЛОБИН» (Россия).
Генотипирование по аллельному варианту гена SLCO1B1*5(c.521T>C) осуществляли путем полимеразной цепной реакции с флуоресцентной схемой обнаружения продуктов в режиме реального времени (Real Time) «SNP-ЭКСПРЕСС»-РВ. Для оценки полиморфизма использовали диагностический набор «Мутация SLCO1B1» ООО Научно-производственная фирма «Литех».
Этическая экспертиза
Исследование одобрено локальным этическим комитетом ГБОУ ВПО «НижГМА» Минздрава РФ (протокол №13 от 05.10.15).
Статистический анализ
Статистическая обработка данных проведена в программах Statistica 6.0 и MedCalc. Количественные данные описывались посредством среднего и его стандартного квадратичного отклонения (M±SD).
Характер распределения в выборках оценивали с помощью критерия Колмогорова–Смирнова. По результатам проверки на нормальность распределение значений всех сравниваемых признаков во всех сравниваемых группах было нормальным. Сравнение количественных показателей двух независимых групп проводилось с использованием U-критерия Манна–Уитни; показателей трех независимых групп и более – с использованием H-критерия Краскела–Уоллеса. Качественные данные сравнивали с помощью метода Хи-квадрат и двустороннего точного критерия Фишера. Корреляционный анализ проводили методом Спирмена. Взаимосвязь описательных характеристик групп, а также уменьшение их числа осуществляли путем факторного анализа по методу главных компонент. Для определения связи концентрации ТТГ с клинико-лабораторными изменениями со стороны мышц использовали ROC-анализ. Относительный риск развития СПМ-СПС у пациентов при наличии компенсированного гипотиреоза считали с помощью таблиц сопряженности программы MedCalc. Порог статистической значимости измерений принимался как р<0,05.
Результаты
Объекты (участники) исследования
Обследовано 120 женщин, составивших три группы по 40 человек. Первая группа представлена пациентками, принимающими статины на фоне гипотиреоза. Вторая – пациентками без гипотиреоза, принимающими статины. Третья – пациентками с гипотиреозом, не принимающими статины. Все больные с гипотиреозом были медикаментозно компенсированы.
В 1-й и 3-й группах значимо не различалась концентрация ТТГ (2,7±1,26 и 2,5±1,31 мЕд/л, р=0,47) и св.Т4 (14,5±2,74 и 14,7±2,75 пмоль/л, р=0,92), принимаемые дозы левотироксина (64,4±27,23 и 77,2±33,73 мкг/сут, р=0,12), средняя длительность гипотиреоза, составившая 6,8 и 6,4 лет (р=0,75). Структура причин гипотиреоза была также близка (p>0,05): преобладал
аутоиммунный тиреоидит (92,5 и 87,5% пациенток 1-й и 3-й групп), при небольших долях послеоперационного (5 и 12,5%) и кордарон-индуцированного гипотиреоза (2,5 и 0% больных). Во 2-й группе гипотиреоз исключали путем определения концентрации ТТГ, который в среднем составил 2,0±0,95 мЕд/л.
Назначение статинов и их дозирование в 1-й и 2-й группах проводилось лечащими врачами-кардиологами для вторичной профилактики сердечно-сосудистых заболеваний (ССЗ). Применяли аторвастатин (62,5 и 75,0% в 1-й и 2-й группе), симвастатин (7,5 и 5,0%) и розувастатин (30,0 и 20,0%); не различались дозы статинов и длительность их приема (12,3±6,9 мес и 11,1±8,6 мес, p>0,05 во всех случаях ).
Как видно из табл. 1, группы были сопоставимы по возрасту, индексу массы тела (ИМТ), частоте острых нарушений мозгового кровообращения (ОНМК) в анамнезе (р>0,05).
Пациенты 1-й и 2-й групп не различались и по частоте ССЗ (р>0,05), но в 3-й группе реже отмечались ишемическая болезнь сердца (ИБС) (p<0,01), постинфарктный кардиосклероз (ПИКС) (p=0,05) и гипертоническая болезнь (ГБ) (p=0,01), что закономерно с учетом включения в нее больных без статинотерапии. Группы были сходны по частоте сопутствующей патологии, включая вертеброгенные синдромы, варикозную болезнь вен нижних конечностей и полинейропатии (p>0,05).
 Основные результаты исследования
Основные результаты исследования
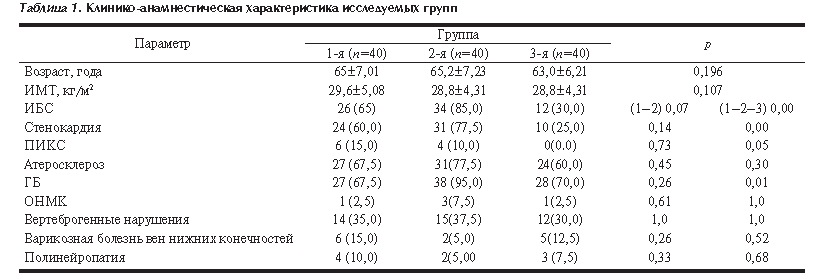
При анализе опросников КОБ и КОС установлено, что пациентки 1-й группы, имевшие оба способствующих мышечным поражениям фактора (прием статинов, гипотиреоз), чаще жаловались на мышечную боль, чем женщины в группах контроля с одним фактором риска (67,5, 27,5 и 32,5% в 1-й, 2-й и 3-й группах, р=0,0006), характеризовались тенденцией к большей частоте жалоб на слабость (77,5, 55,0 и 55,0%; р=0,056, см. рис. 1).
По лабораторным данным, пациентки 1-й и 2-й групп характеризовались близкой степенью коррекции липидного обмена (табл. 2), судя по сопоставимым показателям концентрации общего ХС, ЛПВП, ЛПНП и ТГ (р>0,05).
В свою очередь, в 3-й группе отмечена значимо большая концентрация общего ХС, ЛПНП и ТГ, ввиду отсутствия статинотерапии (р<0,05).
При сочетании статинотерапии и гипотиреоза в наибольшей степени менялись биохимические маркеры мышечных поражений, особенно КФК (167,2±108,82, 120,9±68,25 и 114,0±51,60 Ед/л в 1-й, 2-й и 3-й группах соответственно; р=0,012). По ЛДГ и миоглобину межгрупповых различий не было (р>0,05), но в 1-й группе средний титр миоглобина превышал норму (73,6, 59,2 и 54,8 соответственно). Активность ЛДГ в среднем оставалась в пределах референсных значений (366,4, 357,8 и 352,0 Ед/л соответственно).
 Все 120 женщин генотипировались по SLCO1B1*5 (c.521T>C), межгрупповых различий частоты генотипов ТТ, ТС, СС не было (р>0,05). Следовательно, особую выраженность мышечных симптомов у больных 1-й группы нельзя связать со случайным попаданием в нее большего количества генетически предрасположенных к СПМ-СПС пациенток.
Все 120 женщин генотипировались по SLCO1B1*5 (c.521T>C), межгрупповых различий частоты генотипов ТТ, ТС, СС не было (р>0,05). Следовательно, особую выраженность мышечных симптомов у больных 1-й группы нельзя связать со случайным попаданием в нее большего количества генетически предрасположенных к СПМ-СПС пациенток.
Итак, можно констатировать, что проведение статинотерапии больным с компенсированным гипотиреозом, безусловно, способствует коррекции липидного обмена и в этом смысле является эффективным.
В то же время ее безопасность требует уточнения, с учетом большей частоты клинических и биохимических симптомов мышечных поражений в основной группе относительно контроля, при той же степени наследственной предрасположенности к СПМ-СПС по результатам генотипирования.
На следующем этапе работы проводился корреляционный анализ; с учетом выявленных взаимосвязей предполагалось оценить возможные патогенетические механизмы возникновения мышечных симптомов в основной и контрольных группах наблюдения.
В 1-й группе боль в мышцах имела прямую корреляционную связь с биохимическими маркерами мышечного поражения (КФК R=0,45, р=0,004, ЛДГ R=0,44, р=0,005, миоглобин R=0,30, р=0,057), что указывало на органические изменения мышц, а также с длительностью статинотерапии (R=0,35, р=0,026) и наличием С-аллеля гена SLCO1B1 (R=0,35, p=0,028).
Напротив, в обеих контрольных группах боль была достоверно и прямо взаимосвязана лишь с выявлением сопутствующей патологии, особенно вертеброгенных нарушений и варикозной болезни.
Полученные данные подтверждают, во-первых, большую выраженность мышечных поражений, и, во-вторых, особо значимый патогенетический вклад в их развитие, у принимавших препараты данного класса больных с компенсированным гипотиреозом.
Кроме того, по результатам корреляционного анализа, для всего контингента больных с компенсированным гипотиреозом была характерна слабая, но статистически значимая прямая корреляционная связь ТТГ с наличием мышечной боли (R=0,25, p=0,03) и с активностью КФК (R=0,25, p=0,028).
Это указывало, что по крайней мере у части больных полнота компенсации гипотиреоза может оказывать определенное влияние на выраженность нарушений мышечного метаболизма.
Для уточнения патогенетической значимости описанных взаимосвязей применили ROC-анализ, с целью установить «порог отсечения» концентрации ТТГ, при превышении которого угроза развития мышечных болей, ассоциированных с подъемом КФК, достоверно возрастает.
При построении ROC-кривых в 1-й группе не было найдено искомой точки отсечения и приемлемую статистическую модель построить не удалось (диагностическая чувствительность модели – 89,5%, специфичность – 38,1%, p>0,05). В 3-й группе, напротив, ROC-анализ выявил порог ТТГ в 2,86 мЕд/л (рис. 2), превышение которого предсказывало мышечные поражения у больных с компенсированным гипотиреозом со специфичностью 100%, чувствительностью – 65,7%, при площади под кривой 0,777 (хорошее качество модели) и р<0,001.
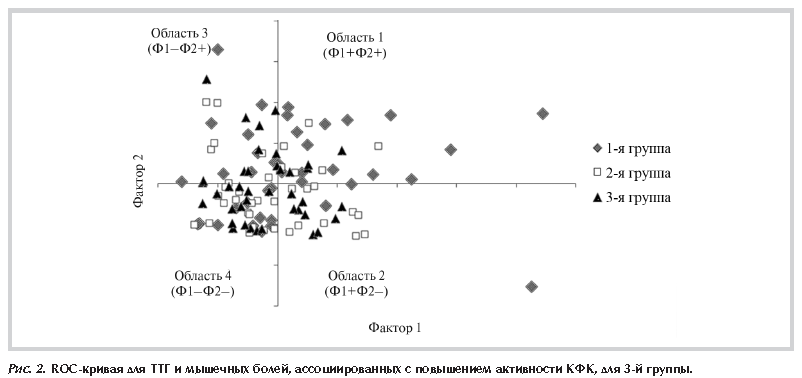
Таким образом, при гипотиреозе без статинотерапии значимо увеличена частота мышечных симптомов и активность КФК при значениях концентрации ТТГ выше 2,86 мЕд/л. Отсутствие возможности построить аналогичную статистическую модель для принимающих статины пациентов может быть связано с особо весомым вкладом побочных эффектов статинов в развитие у них мышечных нарушений, что маскирует действие других негативных факторов и снижает их относительную значимость.
На следующем этапе было проведено сравнение групп пациентов с гипотиреозом, принимающих и не принимающих статины, в зависимости от выявленного порогового значения концентрации ТТГ, представленное в табл. 3.

Видно, что для пациентов с гипотиреозом, принимающих статины, не характерны значимые различия между подгруппами с разным значением концентрации ТТГ по частоте мышечных симптомов и активности ферментов (р>0,05). В тоже время в контрольной группе, напротив, среди лиц с высокой концентрацией ТТГ достоверно чаще возникают жалобы на боли в мышцах (р=0,02), повышена активность ЛДГ (р=0,03) и содержание миоглобина в крови (р=0,03).
Указанные различия между подгруппами внутри 1-й и 3-й групп наблюдения, в целом, подтверждают данные корреляционного и ROC-анализа, о важном вкладе концентрации ТТГ в развитие мышечных поражений у больных с компенсированным гипотиреозом без статинотерапии.
Кроме того, представленные в табл. 3 данные показывают, что межгрупповые различия между пациентами, принимающими и не принимающими статины, возникают в основном за счет подгрупп с относительно низкой концентрацией ТТГ.
По-видимому, в 1-й группе прием статинов имеет доминирующие влияние на мышечные поражения при концентрации ТТГ ниже 2,86 мЕд/л, что проявляется большей, по сравнению с контролем, частотой развития болевого синдрома (64 и 17%; р=0,001), повышением активности КФК (р=0,01) и концентрации миоглобина (р=0,045). Отсутствие же аналогичных различий между подгруппами с большой концентрацией ТТГ может отражать тот факт, что при увеличении содержания ТТГ начинает возрастать роль гипотиреоидного компонента, и это несколько нивелирует вклад статинов в развитие мышечных изменений.
 На следующем этапе работы была уточнена количественная оценка риска СПМ-СПС у больных с компенсированным гипотиреозом с помощью факторного анализа, позволяющего объединить и сократить число характеризующих исследуемые группы параметров. В результате анализа было выделено 2 фактора. Первый фактор (Ф1+) характеризовался повышением маркеров мышечного поражения (активность КФК, ЛДГ и концентрация миоглобина в крови), второй (Ф2) – мышечной болью, слабостью и наличием С-аллеля в гене SLCO1B1*5 (c.521T>C).
На следующем этапе работы была уточнена количественная оценка риска СПМ-СПС у больных с компенсированным гипотиреозом с помощью факторного анализа, позволяющего объединить и сократить число характеризующих исследуемые группы параметров. В результате анализа было выделено 2 фактора. Первый фактор (Ф1+) характеризовался повышением маркеров мышечного поражения (активность КФК, ЛДГ и концентрация миоглобина в крови), второй (Ф2) – мышечной болью, слабостью и наличием С-аллеля в гене SLCO1B1*5 (c.521T>C).
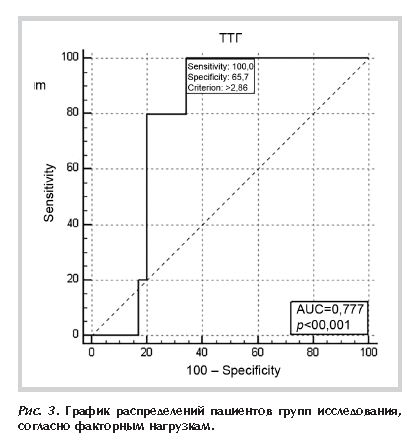
Совокупность положительных значений обоих факторов (Ф1+, Ф2+) была охарактеризована как «угроза СПМ-СПС». В результате подсчета факторных нагрузок для каждого пациента было определено, что положительные значения обоих факторов, и, соответственно, «угроза СПМ-СПС», чаще определялся в группе пациентов, принимающих статины на фоне гипотиреоза, в отличие от групп сравнения (40%, 15% и 12,5% пациентов 1-й, 2-й и 3-й групп соответственно; р=0,02), что наглядно представлено на рис. 3.
Конечным шагом являлся расчет угрозы возникновения СПМ-СПС, что было осуществлено с помощью программы MedCalc. В результате количественного сравнения пациентов, имеющих «угрозу СПМ-СПС», в группе пациентов, принимающих статины на фоне гипотиреоза и принимающих статины пациентов без гипотиреоза, было определено, что наличие компенсированного гипотиреоза увеличивает угрозу развития СПМ-СПС в 2,7 раз.
Нежелательные явления
Проведение использованных в исследовании медицинских манипуляций не вызывало нежелательных явлений у обследуемых лиц.
Обсуждение
Резюме основного результата исследования У пациентов, принимающих статины на фоне компенсированного гипотиреоза, чаще возникают жалобы на мышечную боль, которые нередко ассоциируются с увеличением маркеров мышечного поражения, а также с наличием С-аллеля в гене SLCO1B1* 5 (c.521T>C). При компенсированном гипотиреозе вероятность развития болевого мышечного синдрома, ассоциированного с подъемом активности КФК, возрастает при концентрации ТТГ выше 2,86 мЕд/л. Наличие у пациентов компенсированного гипотиреоза повышает угрозу развития СПМ-СПС в 2,7 раза.
Обсуждение основного результата исследования
В настоящее время не существуют однозначного мнения в отношении безопасности применения статинов у больных гипотиреозом.
Мнение о гипотиреозе как о факторе риска СПМ-СПС относится к недиагностированному, а следовательно, некомпенсированному гипотиреозу [16].
Однако, исходя из некоторых новых данных, можно предположить, что гипотиреоз даже в состоянии компенсации может способствовать развитию мышечных поражений на фоне приема статинов.
В рамках настоящего исследования проводилась проверка данной гипотезы, получившей свое подтверждение.
Пациенты, имеющие гипотиреоз и принимающие статины, достоверно чаще имели мышечную боль и слабость, чем больные с одним фактором риска мышечных поражений (принимали статины или имели гипотиреоз). Только в основной группе боль ассоциировалась с подъемом мышечных ферментов (КФК, ЛДГ и миоглобина крови), имела прямую корреля-ционную связь с длительностью статинотерапии и с носительством С-аллеля гена SLCO1B1*5, что указывает как на большую тяжесть мышечных изменений, так и на особый вклад статинов в их развитие.
С помощью факторного анализа было определено, что угроза развития СПМ-СПС увеличивается при наличии компенсированного гипотиреоза в 2,7 раза.
При этом в нашем исследовании не отмечалось драматических событий при использовании малых и средних доз статинов на фоне компенсированного гипотиреоза, а мышечные симптомы у больных в основном были умеренными. Соответственно, нет оснований считать компенсированный гипотиреоз противопоказанием для назначения статинов. В то же время инициация терапии требует контроля активности КФК не только до, но и, желательно, в первые месяцы после начала приема препарата.
Повышение угрозы развития СПМ-СПС в основной группе возможно ввиду взаимного усугубления, акселерации мышечных расстройств в условиях сочетания приема статинов и компенсированного гипотиреоза. В последнее время появились данные о возможных минимальных метаболических изменениях у пациентов с гипотиреозом даже в состоянии компенсации [22], с чем согласуются и некоторые результаты настоящего исследования. В этом плане характерно, что для больных с компенсированным гипотиреозом была найдена «точка отсечения» концентрации ТТГ, равная 2,86 мМЕ/л, при превышении которой достоверно росла вероятность мышечных поражений.
В группе «гипотиреоз+статины» превышение порогового значения концентрации ТТГ не играло столь весомой роли, вероятнее всего, в связи со значимым дополнительным негативным влиянием статинов на мышечную ткань, маскирующим иные патогенетические воздействия.
Ограничения исследования
Ограничением исследования являлась одномоментность исследования, а, следовательно, невозможность динамического наблюдения за пациентами, в том числе за мышечными симптомами и маркерами мышечного поражения в случае отмены статинов, как подразумевается в соответствии с алгоритмом Naranjo.
Заключение
Компенсированны гипотиреоз не является противопоказанием для статинотерапии. Однако наличие даже компенсированного гипотиреоза у пациентов, принимающих статины, увеличивает угрозу развития симптомов поражения мышц, связанных с приемом статинов, и требует дополнительного мониторинга клинико-биохимических параметров мышечного метаболизма (особенно активности КФК).
Дополнительная информация
Источник финансирования. Проведение настоящего исследования осуществлено на личные средства коллектива авторов.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Участие авторов: Л.А. Луговая – сбор и обработка материала, анализ полученных данных, написание текста; Т.А. Некрасова – анализ полученных данных, статистическая обработка данных; Л.Г. Стронгин – концепция и дизайн исследования; Н.Г. Беляева – написание текста. Все авторы внесли значимый вклад в проведение исследования и подготовку статьи, прочли и одобрили финальную версию до публикации.
Список литературы смотрите здесь.
