 О.В. Рожкова1,2, О.В. Ремнева1,2, Н.И. Фадеева1 ,
О.В. Рожкова1,2, О.В. Ремнева1,2, Н.И. Фадеева1 ,
Ю.В. Кореновский1 , С.Д. Яворская1
1 ФГБОУ ВО «Алтайский государственный медицинский университет» МЗ РФ; Россия,
2 КГБУЗ «Алтайский краевой клинический перинатальный центр “ДАР”»; Россия
Введение / Introduction
Гестационный сахарный диабет (ГСД) – междисциплинарная проблема, которая находится в зоне пристального внимания врачей акушеров-гинекологов, эндокринологов и неонатологов, его частота по данным мировой литературы колеблется от 4 до 20 % [1, 2]. Современные критерии его диагностики, одобренные Всемирной организацией здравоохранения (ВОЗ), были разработаны на основании определения уровня гликемии, выше которого увеличивается частота формирования перинатальных осложнений [3]. Однако механизмы формирования неблагоприятных перинатальных исходов, связанных с повышенным уровнем глюкозы в крови матери, сложны и индивидуальны. В их основе лежат нарушения процессов как секреции инсулина, так и изменение чувствительности тканей к инсулину [4]. Как известно, ожирение является состоянием инсулинорезистентности, которое во время беременности усугубляется влиянием гормонального фона самой беременной и фетоплацентарного комплекса – прогестероном, кортизолом, плацентарным лактогеном [5]. Нарушение обмена веществ на фоне ожирения в виде дислипидемии, гипопротеинемии и гипергликемии приводит к дисморфогенезу плаценты, обуславливающему нарушение транспорта основных субстратов роста и развития к плоду, а также к состоянию хронической гипоксии, которые лежат в основе формирования перинатальных осложнений, в первую очередь гипоксически-ишемических поражений центральной нервной системы (ЦНС) [6].
Поражения ЦНС у плода при сахарном диабете (СД) происходят за счет метаболически-гипоксических расстройств в результате дисфункции плаценты. Помимо этого, в патогенезе антенатального поражения нервной системы играет роль эндотелиальная дисфункция, обусловленная гипергликемией [7]. При различных формах СД выявляются аутоантитела к инсулину, которые ингибируют нейротрофин – фактор роста нервной ткани у плода [8]. На фоне дисфункции плаценты, возникающей при сочетании ГСД и ожирения, провоцируется выработка плацентой провоспалительных цитокинов, которые внутриутробно активируют состояние системного воспалительного ответа, в том числе и на уровне нервной ткани плода [9, 10].
В раннем неонатальном периоде основным осложнением у новорожденного от матери с ГСД являются неврологические расстройства [11]. Однако они не всегда проявляются в раннем неонатальном периоде, а как правило, гораздо позже в форме нарушений моторики, афазии, пониженной или повышенной активности, негармоничной задержки психомоторного развития, а также различных когнитивных проблем [12].
Предложен ряд методов прогнозирования развития перинатальных осложнений при ГСД, самыми распространенными из которых являются анамнестические [13]. Ультразвуковая диагностика при знана методом выявления маркеров диабетической фетопатии [14]. В качестве лабораторных критериев, прогнозирующих перинатальную патологию, используется определение в биологических жидкостях циркулирующих биохимических маркеров – семейства матриксных металлопротеиназ и их тканевых ингибиторов, ксантина, гипоксантина, адреномедуллина, белка S100B, активина А, нейронспецифической енолазы (НСЕ) и др. [15].
Нейронспецифическая енолаза – фермент, отражающий функциональные и деструктивные изменения в мембранах клеток мозга [16, 17]. Этот фермент находится в цитоплазме нейронов. В результате воздействия повреждающего фактора происходит гибель нервных клеток, в результате чего НСЕ обнаруживается в биологических жидкостях. Определение активности НСЕ у новорожденных детей в первые часы жизни обладает высокой диагностической значимостью. В исследовании А.Ю. Морозова с соавт. показано, что при спонтанных родах в доношенном сроке беременности содержание НСЕ в сыворотке крови новорожденных от здоровых матерей несколько выше, чем при абдоминальном родоразрешении, что может объясняться влиянием гипоксии плода при маточных сокращениях в родах [18]. В крови доношенных новорожденных, которым внутриутробно диагностирована асимметричная задержка плода, отмечается повышение нейронспецифических белков, что объясняется влиянием хронической гипоксии на ткань головного мозга [19].
При антенатальном повреждении нервной ткани уровень НСЕ повышается в крови плода, а затем, как следствие, и в моче. При выделении мочи в амниотическую жидкость следует предположить возможность диагностики антенатального повреждения нервной системы у плода путем установления активности этого фермента в околоплодных водах еще до начала родовой деятельности [20].
Цель исследования: выявление факторов риска ГСД и предикторов перинатальных поражений ЦНС при сочетании ГСД и ожирения у матери.
Материалы и методы / Materials and Methods
Дизайн исследования / Study design
Исследование выполнено на клинической базе кафедры акушерства и гинекологии с курсом ДПО КГБУЗ «Алтайский краевой клинический перинатальный центр» в 2 этапа. Основную группу составили 150 беременных, у которых диагностирован ГСД. В контрольную группу вошли 100 беременных без нарушений углеводного обмена. Дизайн исследования представлен на рисунке 1.
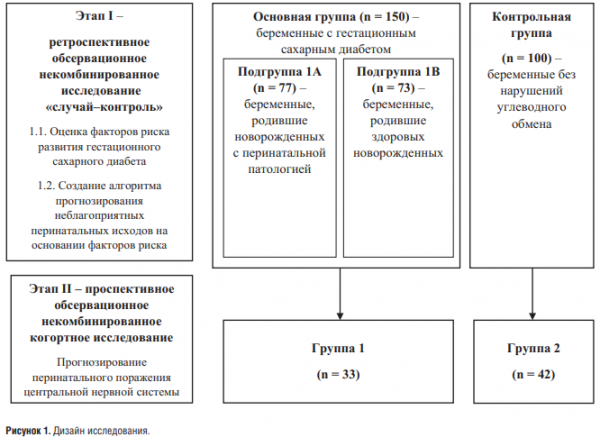
На этапе I проведено ретроспективное обсервационное некомбинированное исследование по типу «случай–контроль», куда включены 250 пар «мать–новорожденный». Для оценки влияния факторов риска на формирование перинатальной патологии основная группа (n = 150) разделена на подгруппы 1А и 1В методом кластеризации. Факторными признаками для проведения кластеризации и выделения малых групп послужили данные исходов для новорожденных. К подгруппе 1А (n = 77) отнесены беременные с ГСД, новорожденные которых постнатально имели неблагоприятные перинатальные исходы, связанные с влиянием материнской гипергликемии: рождение ребенка массой тела более 90-го перцентиля для своего гестационного возраста, развитие диабетической фетопатии, наличие дыхательных расстройств, потребовавших лечения в отделении реанимации и интенсивной терапии, ранняя неонатальная гипогликемия, неонатальная желтуха. У 50,6 % новорождённых подгруппы 1А диагностировано перинатальное поражение ЦНС, послужившее поводом для их перевода на второй этап лечения. К подгруппе 1В (n = 73) отнесены беременные с ГСД, новорожденные которых выписаны из родовспомогательного учреждения без перинатальных осложнений. Контрольную группу составили 100 беременных без нарушений углеводного обмена.
На этапе II с целью оценки влияния гипергликемии матери на формирование поражения ЦНС у плода, а также возможного раннего его прогнозирования проведено одноцентровое проспективное обсервационное некомбинированное когортное исследование. В ходе исследования проведено сравнение концентрации НСЕ в амниотической жидкости доношенных плодов у беременных с диагностированным ГСД (n = 33) и у беременных без нарушений углеводного обмена (n = 42) до начала родовой деятельности при проведении планового кесарева сечения или при проведении программированных родов. Группы наблюдения были сопоставимы по возрасту, социальному статусу, способам родоразрешения (р > 0,05).
Критерии включения и исключения / Inclusion and exclusion criteria
Критерии включения: доношенный срок беременности; информированное согласие беременной на исследование.
Критерии исключения: многоплодная беременность; врожденные пороки развития плода; мертворождаемость; соматическая патология матери в стадии декомпенсации; тяжелая преэклампсия.
Этические аспекты / Ethical aspects
Проведение настоящего исследования было разработано в соответствии с Хельсинской декларацией Всемирной ассоциации «Этические принципы проведения научных медицинских исследований с участием человека» с поправками 2000 г. и Правилами клинической практики в Российской Федерации, утвержденными Приказом Минздрава России № 266 от 19.06.2003. Все лица, участвовавшие в исследовании, добровольно подписали информированное согласие на участие в исследовании. Проект научно-исследовательской работы был утвержден и одобрен локальным этическим комитетом ФГБОУ ВО «АГМУ» Минздрава России (протокол № 11 от 21.11.2017), соответствовал этическим стандартам локального биоэтического комитета. Исследования у детей не проводили.
Методы исследования / Study methods
Для определения факторов риска ГСД и их влияния на формирование перинатальной патологии плода проведена оценка наследственного, акушерско-гинекологического анамнеза и соматического здоровья. Для характеристики соматического статуса беременных считали абсолютное количество экстрагенитальных заболеваний, выявленных у каждой беременной. Индекс массы тела (ИМТ) рассчитывали по формуле: ИМТ = вес (кг)/рост2 (м2).
Уровень гликемии определяли в венозной крови матери. Для диагностики ГСД использовали критерии, регламентированные в клинических рекомендациях (протоколе) «Гестационный сахарный диабет, диагностика, лечение, послеродовое наблюдение» Минздрава России от 17.12.2013 [21]. До начала родовой деятельности в амниотической жидкости у беременных основной и контрольной групп в качестве маркера повреждения нервной ткани у плода определяли активность НСЕ энзиматическим колориметрическим методом с использованием набора реактивов NSE-ИФА-БЕСТ РУ № РЗН 2015/2531 (Вектор-Бест, Россия) и вертикального фотометра Multiscan (Labsystem, Финляндия). Амниотическую жидкость в объеме 5 мл отбирали посредством амниотомии при проведении программированных родов и плановом кесаревом сечении.
Статистический анализ / Statistical analysis
При проверке количественных показателей на соответствие закону нормального распределения с помощью критерия Шапиро–Уилка, анализа гистограммы распределения данных, показателей асимметрии и эксцесса установлено отличие от нормального распределения, в связи с этим количественные данные представляли с помощью медианы (Me) и нижнего и верхнего квартилей [Q1 –Q3 ]. Для сравнения независимых переменных использовали U-критерий Манна– Уитни. Категориальные переменные описывали с указанием абсолютных значений и процентных долей. Группы сравнивали с помощью критерия χ2 Пирсона с поправкой на непрерывность (поправкой Йейтса). Различия показателей считали статистически значимыми при уровне p < 0,05.
На первом этапе исследования с целью определения количественной меры эффекта при сравнении относительных показателей определяли отношение шансов (ОШ). Для проецирования полученного значения на генеральную совокупность проводили расчет верхней и нижней границ 95 % доверительного интервала (95 % ДИ). Исходя из полученных данных, значимость взаимосвязи исхода и фактора считалась доказанной в случае нахождения ДИ за пределами границы отсутствия эффекта, принимаемой за 1. С целью изучения связи между явлениями, представленными количественными данными, распределение которых отличалось от нормального, использовали непараметрический метод – расчет коэффициента ранговой корреляции Спирмена. При расчете делался вывод о наличии статистической значимости и направленности взаимосвязи изучаемых количественных данных. Значения коэффициента корреляции (ρ) интерпретировали в соответствии со шкалой Чеддока.
Для комплексной оценки прогностической ценности отдельных факторов риска на формирование перинатальных осложнений при стратификации беременных с ГСД построено дерево классификации. Для этого использовали метод построения прогностической модели CHAID (англ. Chi Squared Automatic Interaction Detection). Разработан алгоритм, с помощью которого определялась принадлежность беременной к одному из узлов, а на основании отклика узла делался прогноз о степени риска формирования перинатальной патологии при ГСД.
Результаты и обсуждение / Results and Discussion
Факторы риска формирования перинатальной патологии при гестационном сахарном диабете / Risk factors of developing perinatal pathology upon gestational diabetes mellitus
При проведении однофакторного анализа были установлены клинико-анамнестические факторы риска, имеющие статистически значимое влияние на развитие ГСД. Беременные основной группы реже были в оптимальном репродуктивном возрасте (25– 35 лет) по сравнению с таковыми контрольной группы: 78,0 и 86,0 % (p = 0,01). Возраст беременной старше 35 лет увеличивал шансы формирования ГСД в 2,79 раза (ОШ = 2,79; 95 % ДИ = 1,21–6,41), но не увеличивал вероятность формирования перинатальной патологии (р = 0,11).
Одним из известных факторов риска развития ГСД является отягощенный наследственный анамнез [22]. У беременных основной группы родственники первой линии родства, страдающие сахарным диабетом 2-го типа (СД-2), выявлялись в 44,0 % против 17,0 % в группе беременных без нарушений углеводного обмена (p < 0,001). Шансы развития нарушений углеводного обмена во время беременности у женщин с отягощенным наследственным анамнезом увеличивались в 3,88 раза (95 % ДИ = 2,08–7,08).
Отягощенная наследственность по СД оказывает негативное влияние на формирование перинатальной патологии. У беременных с ГСД, имевших отягощенный наследственный анамнез, ее частота составила 63,6 %, тогда как при неотягощенном анамнезе – 34,2 % (р = 0,001). Наследственный анамнез увеличивал шансы формирования перинатальной патологии в 3,36 раза (95 % ДИ = 1,72–6,57).
Оценка паритета беременных сопоставляемых групп представлена в таблице 1. Как можно видеть, одним из факторов риска развития ГСД является отягощенный акушерский анамнез. При анализе паритета установлено, что пациентки с ГСД имели большее количество беременностей, чем женщины контрольной группы, причем у первых чаще встречались аборты и ранние репродуктивные потери. Отягощенный акушерский анамнез увеличивал шансы развития ГСД в настоящую беременность в 2,98 раза (95 % ДИ = 1,06–8,03).
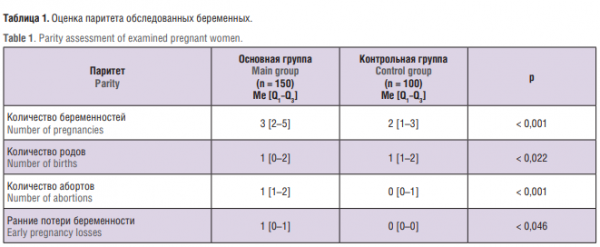
При оценке исходов предыдущих беременностей у пациенток основной группы частота рождения ребенка массой тела более 90-го перцентиля для своего гестационного возраста была выше (р = 0,022). При наличии в анамнезе родов крупным плодом шансы развития ГСД в последующую беременность увеличивались в 3,27 раза (ОШ = 3,27; 95 % ДИ = 1,073–9,98), а рождения крупного плода в настоящую беременность – в 7,92 раза (ОШ = 7,92; 95 % ДИ = 2,67–23,45).
Количество экстрагенитальных заболеваний, выявленных у пациенток основной группы (3 [3–5]), по сравнению с беременными, не имевшими нарушений углеводного обмена (1 [0–2]), было выше (р < 0,001). Следует отметить, что количество экстрагенитальных заболеваний, приходившихся на одну беременную среди родивших новорожденных с перинатальной патологией (подгруппа 1А), также было выше (4 [3–5]), чем у пациенток подгруппы 1В (3 [2–4]; р < 0,001).
Нами проведена оценка влияния экстрагенитальной патологии на развитие ГСД. Как показали результаты проведенного исследования, наличие ожирения значимо (р < 0,001) увеличивало частоту заболеваемости ГСД в 7,9 раза. Заболевания желчевыводящих путей (р = 0,003) и расстройства вегетативной регуляции работы сердца и сосудов (р < 0,001) увеличивали частоту развития ГСД в 7,1 и 5,38 раза соответственно.
Установлено, что беременные с ГСД, имевшие ожирение, чаще (р = 0,008) рожали детей с перинатальной патологией, чем беременные, имевшие нормальный вес до постановки на диспансерный учет: в подгруппе 1А частота ожирения среди беременных составила 62,4 %, а в подгруппе 1В – 42,4 % (р = 0,08). При наличии ожирения шансы формирования перинатальной патологии от матерей с ГСД увеличивались в 2,51 раза (95 % ДИ = 1,27–4,98).
ИМТ до беременности у пациенток основной группы был выше и составил 26,99 [23,78–33,51] кг/м2 , а в контрольной группе – 23,47 [21,13–26,78] кг/м2 (р < 0,05). Нами проведен корреляционный анализ между уровнем гликемии натощак и ИМТ у пациенток с ГСД. Установлена прямая связь слабой силы по шкале Чеддока (р = 0,015; rxy = 0,20). Также найдена прямая корреляционная связь умеренной силы между ИМТ и количеством экстрагенитальных заболеваний (р < 0,001; rxy = 0,377).
Оценка влияния ИМТ беременной на формирование макросомии плода представлена в таблице 2.
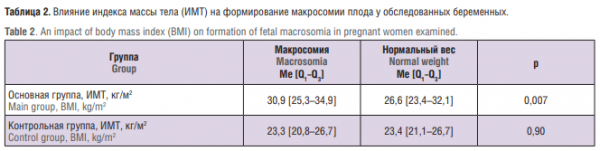
Как видно из таблицы 2, пациентки с ГСД, имевшие ожирение, чаще рожали детей с массой тела более 90-го перцентиля для своего гестационного возраста, чем женщины, родившие детей с нормальной массой тела (р = 0,007). У беременных без нарушения углеводного обмена зависимости развития макросомии плода от ИМТ не выявлено (р = 0,90).
Как видно из таблицы 2, пациентки с ГСД, имевшие ожирение, чаще рожали детей с массой тела более 90-го перцентиля для своего гестационного возраста, чем женщины, родившие детей с нормальной массой тела (р = 0,007). У беременных без нарушения углеводного обмена зависимости развития макросомии плода от ИМТ не выявлено (р = 0,90).
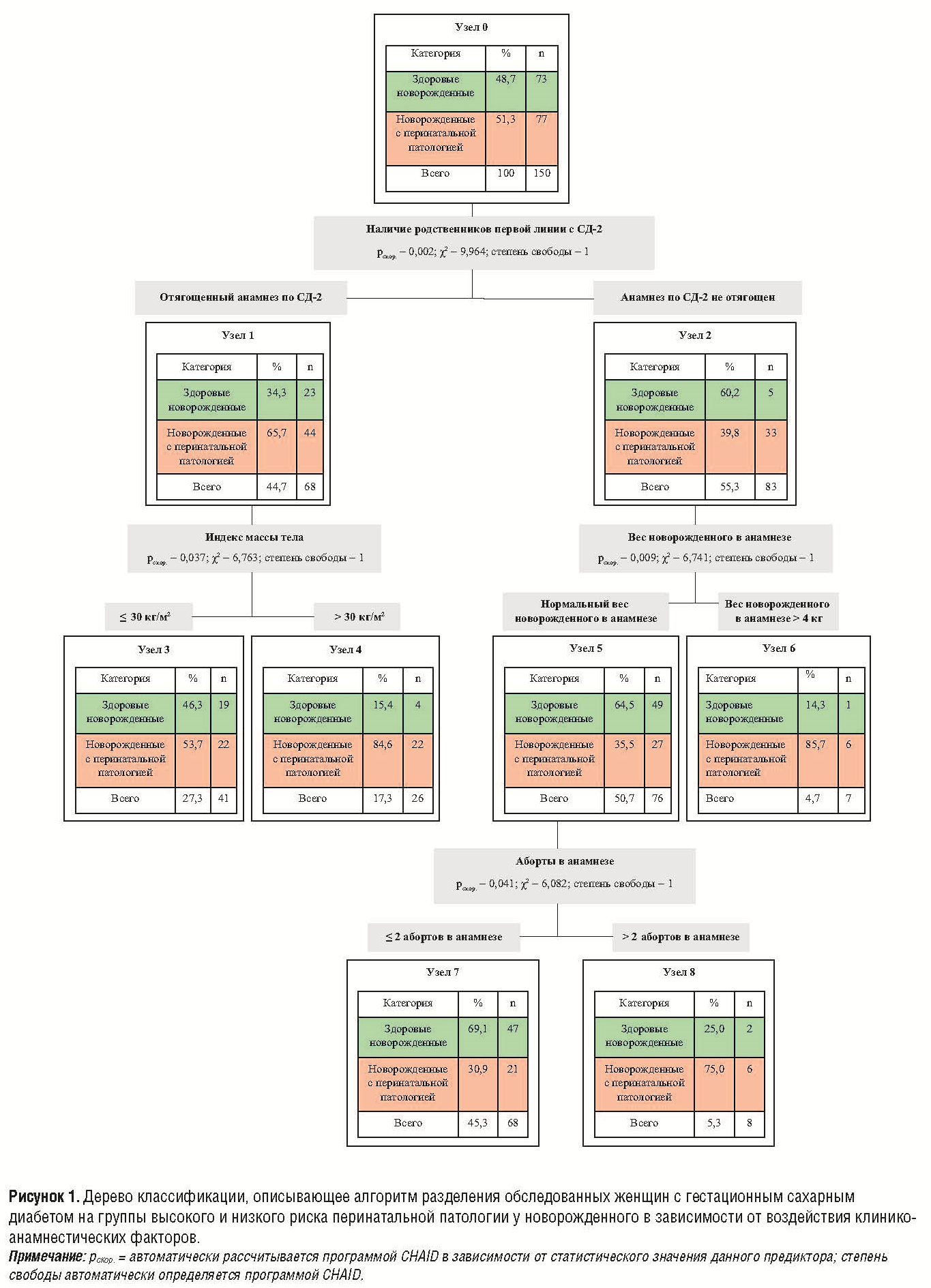
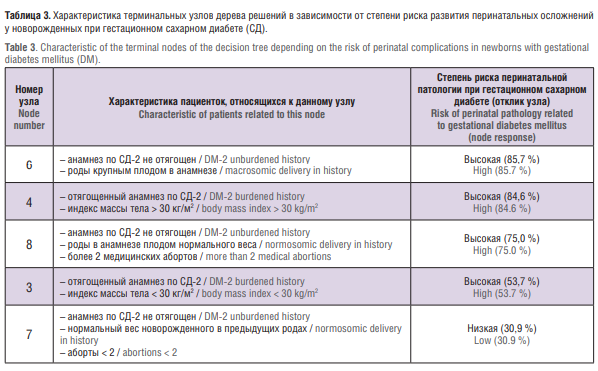
Учитывая ранее выявленные факторы риска, которые в нашем исследовании имели значимое влияние на формирование перинатальной патологии у беременных с ГСД, создан алгоритм прогнозирования перинатальных осложнений. С помощью метода CHAID было получено дерево классификации (рис. 2).
Разработанное нами дерево классификации разделило обследованных женщин на группы высокого и низкого риска. Всего было получено 5 терминальных узлов. Характеристики узлов представлены в таблице 3.
Наивысший риск развития перинатальной патологии имели беременные, относящиеся к узлам № 6 и № 4. Чувствительность разработанной прогностической модели составляла 72,4 %, специфичность – 64,4 %. Общий процент верных предсказаний составил 68,7 %.
Содержание биохимических маркеров перинатального поражения центральной нервной системы в амниотической жидкости при гестационном сахарном диабете / Level of amniotic fluid biochemical markers related perinatal central nervous system damage during gestational diabetes mellitus
В настоящее время в литературе отсутствуют данные о нормативах концентрации НСЕ в амниотической жидкости. С целью антенатального прогнозирования перинатального поражения ЦНС у плода нами проведен отбор амниотической жидкости до начала родов. При сравнении активности НСЕ в амниотической жидкости у беременных, которые не имели нарушений углеводного обмена, с таковой у пациенток с ГСД получены статистически значимые различия.
У плодов от матерей с ГСД уровень НСЕ в амниотической жидкости, отобранной в антенатальном периоде, был выше (4,89 нг/мл) по сравнению с таковым у плодов от матерей без ГСД (3,38 нг/мл; р = 0,002).
В ходе первого этапа исследования было установлено, что ожирение у матери является одним из факторов риска развития ГСД, а также увеличивает частоту неблагоприятных перинатальных исходов. Мы провели сравнительный анализ содержания НСЕ в амниотической жидкости беременных с ожирением с таковым у беременных, имевших нормальную массу тела: концентрация НСЕ в амниотической жидкости плодов от матерей с нормальной массой тела (4,22 [2,34–5,41] нг/мл) была ниже (р = 0,039), чем в амниотической жидкости плодов от матерей с ИМТ > 30 кг/м2 (5,40 [3,81–6,63] нг/мл).
При определении содержания НСЕ в группе беременных с ожирением, как имевших нарушение обмена углеводов (5,56 [3,37–6,24] нг/мл), так и с нормогликемией (4,81 [1,64–5,01] нг/мл), существенных различий получено не было (р = 0,962). У беременных с нормальной массой тела, но страдающих ГСД, уровень НСЕ в амниотической жидкости составил 4,86 [3,94–8,43] нг/мл, а при нормогликемии – 3,29 [1,49–4,89] нг/мл (р = 0,006). Интересно, что наибольшая концентрация НСЕ определялась в амниотической жидкости беременных с ГСД на фоне ожирения, а наименьшая – у беременных с нормальной массой тела и без нарушений углеводного обмена. Помимо влияния фактора ожирения на содержание НСЕ в амниотической жидкости, получена прямая статистически значимая корреляционная связь умеренной силы по шкале Чеддока (р = 0,005; rxy = 0,332) между уровнем НСЕ и количеством экстрагенитальных заболеваний в совокупности беременных как с ГСД, так и без нарушений углеводного обмена.
В настоящее время определение концентрации НСЕ в крови новорожденных широко используется для диагностики перинатального поражения ЦНС. В немногочисленных исследованиях, связанных с определением уровня НСЕ в амниотической жидкости, сделана попытка определить пороговые значения данного фермента, а также попытаться объяснить механизмы его повышения [23]. Нами впервые был предложен способ диагностики перинатального поражения ЦНС плода при ГСД путем определения концентрации НСЕ, получен патент на изобретение [24].
Заключение / Conclusion
Наиболее значимыми факторами риска развития ГСД являются: возраст матери старше 35 лет (ОШ = 2,79; 95 % ДИ = 1,21–6,41), отягощенная наследственность по СД-2 (ОШ = 3,88; 95 % ДИ = 2,08–7,08), осложненный абортами и ранними репродуктивными потерями акушерский анамнез (ОШ = 2,98; 95 % ДИ = 1,06–8,03), роды крупным плодом в анамнезе (ОШ = 3,27; 95 % ДИ = 1,073–9,98), ожирение беременной (ОШ = 7,9; 95 % ДИ = 3,6–17,4).
На формирование перинатальных осложнений у матерей с ГСД оказывает влияние отягощенная наследственность по СД-2 и наличие ожирения. Роды в анамнезе крупным плодом увеличивают вероятность формирования перинатальной патологии у беременной с ГСД в настоящую беременность.
Беременные с ожирением и отягощенной наследственностью по СД-2 имеют наибольшую частоту перинатальных осложнений (84,6 %). У беременных с ГСД, имеющих нормальный вес и неотягощенный анамнез, частота формирования перинатальной патологии невысока (30,9 %) и может быть обусловлена влиянием других факторов.
Концентрация НСЕ в амниотической жидкости доношенных плодов до начала родов в 1,68 раза выше при сочетании ГСД и ожирения (5,56 [3,37–6,24] нг/мл), чем у беременных с нормальным весом без нарушений углеводного обмена (3,29 [1,49–4,89] нг/мл).
