Аннотация
Сахарный диабет 2 типа (СД2) — глобальная эпидемия, представляющая серьезную проблему для здравоохранения. Улучшение метаболического контроля для достижения нормальной гликемии (если возможно) является очень эффективной стратегией в долгосрочном прогнозе и оправдывает раннее, эффективное, устойчивое и безопасное вмешательство. Достижения в понимании сложного патогенеза СД2 давали основу для развития методов cнижения уровня глюкозы с дополнительными механизмами действия, которые расширили возможности терапии и способствовали индивидуализации стратегии лечения. За последнее десятилетие было лицензировано несколько новых классов гипогликемических препаратов, включая агонисты рецепторов глюкагоноподобного пептида-1 (аГПП-1), ингибиторы дипептидилпептидазы-4 (ДПП-4) и ингибиторы котранспортера натрия/глюкозы-2 (SGLT2). Эти лекарственные средства можно использовать индивидуально или в комбинации с хорошо устоявшимся препаратами, такими как бигуаниды, производные сульфонилмочевины и тиазолидиндионы. Несмотря на то, что новые агенты обладают потенциальными преимуществами, включая низкий риск гипогликемии и помощь в контроле веса, их долгосрочная безопасность еще не установлена. В этом обзоре мы оцениваем фармакокинетику, фармакодинамику и профили безопасности (в том числе для сердечно-сосудистой системы) доступных в настоящее время препаратов для лечения гипергликемии у пациентов с СД2 в контексте патогенеза заболевания. Кроме того, мы кратко описываем алгоритмы лечения пациентов с СД2 и направления развития будущих видов терапии.
Ключевые моменты
- Более глубокое понимание сложного и многофакторного патогенеза СД2 позволило разработать несколько новых классов гипогликемических препаратов
- Метформин остается препаратом первой линии для пациентов с СД2, тогда как использование других хорошо известных агентов, таких как производные сульфонилмочевины, меглитиниды, пиоглитазон и ингибиторы α-глюкозидазы сильно зависит от региона
- Препараты, повышающие активность инкретина (ингибиторы ДПП-4), усиливающие активность эндогенного ГПП-1 (аГПП-1) или увеличивающие выведение глюкозы с мочой (ингибиторы SGLT2), имеют низкий риск гипогликемии и могут помочь в контроле веса
- При лечении СД2 может потребоваться использование двух или трех препаратов с различными режимами действия, а терапия инсулином необходима, если другие препараты не могут поддерживать адекватный гликемический контроль
- Гликемические мишени и выбор препаратов, снижающих уровень глюкозы, должны подбираться под потребности и обстоятельства пациентов индивидуально, чему могут способствовать будущие разработки фармакогеномики
- Хотя баланс пользы и рисков для разных препаратов варьирует между отдельными пациентами, ранний, эффективный и продолжительный гликемический контроль задерживает начало и снижает тяжесть связанных с гипергликемией осложнений
-
СД2 представляет собой глобальную эпидемию с предполагаемой распространенностью в 415 миллионов человек на 2015 год, которая, согласно прогнозам, возрастет до 642 миллионов человек к 2040 году (источник 1). СД2 за счет большого медицинского, экономического и социального значения [1-3], представляет собой серьезную проблему для системы здравоохранения во всем мире.
СД2 является сложным эндокринным и метаболическим заболеванием, в котором взаимодействие между генетическими и средовыми факторами создает гетерогенную и прогрессирующую патологию с различной степенью резистентности к инсулину и дисфункцией β-клеток и α-клеток поджелудочной железы, а также других эндокринных нарушений (Рис. 1) [4–14]. Инсулинорезистентность возникает из-за нарушения работы сигнальных путей на уровне рецептора инсулина и ниже. СД2 возникает, когда β-клетки больше не могут выделять достаточное количество инсулина для преодоления резистентности к инсулину [4,15–17]. Избыточный вес и ожирение являются основными факторами риска развития резистентности к инсулину [4, 5, 16, 18–20].
Гипергликемия является основной биохимической особенностью СД2, вызывающей окислительный и нитрозативный стресс, активацию воспалительных путей и эндотелиальную дисфункцию, а также вызывает микрососудистые осложнения и способствует сосудистым заболеваниям, являющимися основными причинами заболеваемости и смертности [21]. Результаты нескольких рандомизированных контролируемых исследований (РКИ) продемонстрировали краткосрочные и долгосрочные преимущества улучшения гликемического контроля в замедлении наступления и снижении тяжести осложнений диабета, в частности ретинопатии, нефропатии, нейропатии и сердечно-сосудистых заболеваний, а также смертности [22-25]. Достижение нормального (или почти нормального) уровня глюкозы в крови является основной целью лечения СД2. Для реализации этой цели доступны несколько стратегий: изменение образа жизни, включая изменение рациона питания, снижение веса и физическая активность, которые, к слову, остаются краеугольными камнями терапии, но из-за прогрессивного характера СД2 и трудности сохранения изменений образа жизни в долгосрочной перспективе большинство пациентов требуют пероральных методов лечения и (в конечном счете) инъекционных методов лечения [26].
В течение более чем четырех десятилетий были доступны только два класса пероральных препаратов для снижения уровня глюкозы: бигуаниды и производные сульфонилмочевины. Но за последние 20 лет было введено много вариантов лечения (Таб. 1) [26, 27]. В этом обзоре мы предлагаем оценку различных методов лечения гипергликемии у пациентов с СД2.
Гликемический контроль и цели в терапии СД2
Потребности в лечении и ответ на терапию сильно варьируются у пациентов с СД2, что отражает сложность и изменчивость патогенного процесса [28, 29], поэтому для каждого пациента решение должно осуществляться индивидуально, в зависимости от выбранной терапии и целевых значений уровня глюкозы. Рассматриваемые факторы включают возраст пациента, вес, продолжительность СД2, риск гипогликемии, риск сердечно-сосудистых заболеваний, сопутствующую терапию, наличие осложнений и сопутствующие заболевания в анамнезе. Другие аспекты, которые сложнее оценить в клинической практике, включают резервные возможности секреции инсулина, генетические факторы, которые могут влиять на терапевтическую реакцию, риск развития будущих осложнений и скорость прогрессирования заболевания [30].
Хорошо известны долгосрочные преимущества интенсивного гликемического контроля в вопросе снижения риска осложнений и смертности, особенно когда он производится сразу после диагностики у молодых пациентов без сопутствующих осложнений [22-25]. Однако интенсивность гликемического контроля не лишена рисков, таких как гипогликемия, увеличение веса и возможные сердечно-сосудистые осложнения и смертность у пациентов с высоким риском. Эти риски могут частично определять выбор медикаментов [22, 31-36], поэтому предпочтительным является индивидуальный подбор терапии [36]. Трудность заключается в идентификации пациентов, у которых риски, связанные с интенсивным гликемическим контролем, перевешивают преимущества. Строгий гликемический контроль не рекомендуется пожилым пациентам или пациентам с большой продолжительностью СД2 или с сердечно-сосудистыми заболеваниями [27, 36]. В руководствах обычно указывается целевой показатель HbA1c=7%, но для молодых пациентов с СД2 и без осложнений может быть подходящим более низкое целевое значение, а более высокое — разумным для пожилых или тяжелых пациентов с длительным течением и осложнениями.
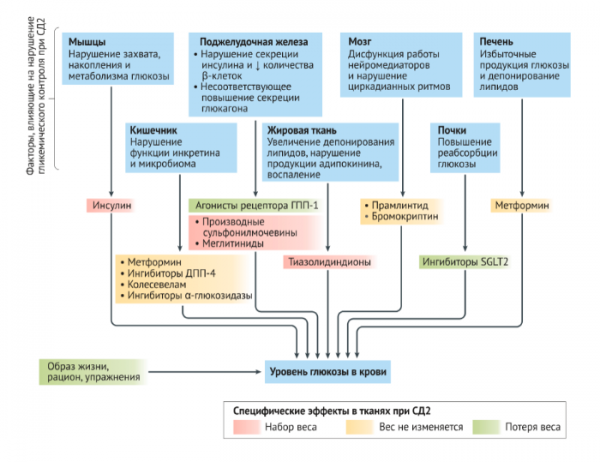
Рисунок 1 | Мишени гипогликемических препаратов.
На возникновение сахарного диабета 2-го типа оказывают влияние множество генетических факторов и факторов окружающей среды. Действие этих факторов реализуется путем повышения резистентности к инсулину с развитием недостаточности функции β-клеток поджелудочной железы. Избыточный вес и ожирение вносят вклад в резистентность к инсулину совместно с усиленной передачей воспалительных сигналов и нарушением липидного гомеостаза, часто задолго предшествующими появлению гипергликемии и повышающими риск сердечно-сосудистых заболеваний. Когда секреция инсулина уже недостаточна для преодоления резистентности к инсулину, снижение толерантности к глюкозе прогрессирует до СД2, что обычно сопровождается дисфункцией альфа-клеток поджелудочной железы, при которой повышается секреция глюкагона, уменьшается секреция и активность инкретиновых гормонов, таких как глюкагоноподобный пептид-1 (ГПП-1 ), после еды, изменяется микробиом кишечника и нарушается нейроналый контроль чувства голода-насыщения и суточная регуляция гомеостаза глюкозы. Инсулин, производные сульфонилмочевины и меглитиниды связаны с риском гипогликемии.
ДПП-4 — дипептидилпептидаза 4; SGLT2 — ингибиторы котранспортера натрия/глюкозы-2
Таблица 1. Краткое описание доступных на данный момент гипогликемических препаратов для пациентов с СД2.
Таблица 2. Прямые сравнительные исследования с аГПП-1
Бигуаниды
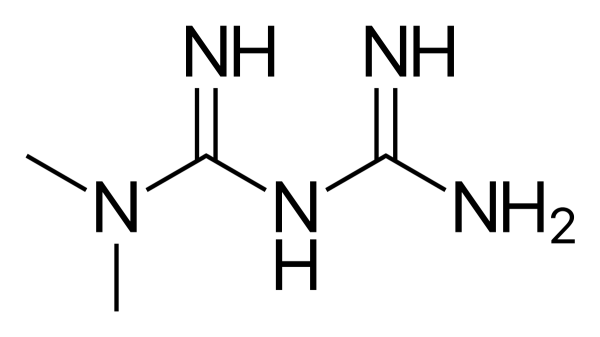 Единственным бигуанидом, используемым в клинической практике, является метформин (диметилбигуанид) [37]. Другие — фенформин и буформин — были изъяты из-за риска лактацидоза [38]. Бигуаниды были получены из богатой гуанидином травы Galega officinalis (Козлятник лекарственный), которая использовалась в традиционной европейской медицине [37, 39]. Метформин был введен в клиническую практику в Европе в 1957 году и в 1995 году в США и стал самым назначаемым препаратом для лечения СД2 во всем мире [37, 39].
Единственным бигуанидом, используемым в клинической практике, является метформин (диметилбигуанид) [37]. Другие — фенформин и буформин — были изъяты из-за риска лактацидоза [38]. Бигуаниды были получены из богатой гуанидином травы Galega officinalis (Козлятник лекарственный), которая использовалась в традиционной европейской медицине [37, 39]. Метформин был введен в клиническую практику в Европе в 1957 году и в 1995 году в США и стал самым назначаемым препаратом для лечения СД2 во всем мире [37, 39].
Механизм действия
Метформин поступает в клетки главным образом через транспортер органических катионов 1 (SLC22A1 или hOCT1) и оказывает множественные, независимые от инсулина эффекты, в зависимости от уровня препарата и метаболизма питательных веществ в разных тканях [28, 37, 40-42] (Рис. 2). При приеме препарата кишечник подвергается воздействию высоких концентраций метформина [42], который вмешивается в работу дыхательной цепи митохондрий на уровне комплекса I и тем самым увеличивает использование глюкозы в процессе гликолиза и производстве лактата; часть лактата может быть преобразована обратно в глюкозу в печени [43]. Оборот лактата-глюкозы вызывает потерю энергии, которая может способствовать эффекту нейтральности веса (отсутствие увеличения или потери веса), наблюдающегося у пациентов, получающих метформин [28, 42]. В печени метформин усиливает передачу сигналов инсулина, снижает действие глюкагона и уменьшает глюконеогенез и гликогенолиз [28]. Метформин может ингибировать митохондриальный окислительно-восстановительный челночный фермент глицерин-3-фосфатдегидрогеназу, изменяя редокс-статус гепатоцитов и приводя к снижению отношения АТФ/АМФ, печеночного глюконеогенеза, конверсии лактата и глицерина в глюкозу и активации АМФ-зависимой протеинкиназы (AMPK) [44]. Кроме того, терапия метформином приводит к сдвигу в сторону использования глюкозы относительно жирных кислот в качестве клеточного источника энергии в печени [37]. В мышцах метформин способствует инсулин-опосредствованному захвату глюкозы через транспортер глюкозы-4 (GLUT-4) [28].
Поскольку формы метформина с замедленным высвобождением имеют аналогичную эффективность при более низких дозах по сравнению с «обычными» формами, то, похоже, кишечник является основным местом действия метформина в терапевтических дозах [45]. Метформин может увеличивать уровень глюкагоноподобного пептида-1 (ГПП-1) даже при отсутствии нагрузки глюкозой и у лиц без СД2 [46-50] с помощью механизмов, которые могут включать ингибирование натрий-зависимых транспортеров желчных кислот, увеличивающих доступность желчных кислот для активации G-белок-связанных мембранных рецепторов желчных кислот (известных как TGR5), на энтероэндокринных L-клетках. По сравнению с плацебо метформин снижает активность дипептидилпептидазы 4-(ДПП-4) [46]. Метформин также увеличивает секрецию ГПП-1 в ответ на пероральную нагрузку глюкозой через пути, зависимые от мускариновых (M3) и пептидных рецепторов, высвобождающих гастрин (GRP-R) [47-51]. У мышей метформин стимулирует экспрессию рецептора ГПП-1 (РГПП-1) в β-клетках, опосредованную рецептором, активирующий пролиферацию пероксисом (PPARα) [49]. Влияние метформина на GLP-1 может способствовать его эффекту нейтральности веса и снижению выработки глюкозы в печени путем ингибирования секреции глюкагона [46-48]. Метформин также влияет на циркадный контроль метаболизма глюкозы в печени и мышцах [42]. Индуцированная метформином активация АМФ-зависимой протеинкиназы приводит к фосфорилированию казеинкиназы 1, что приводит к снижению циркадной составляющей mPer2, что увеличивает экспрессию циркадных генов CLOCK и BMAL1 и вызывает фазовый сдвиг в циркадном ритме у получавших метформин грызунов по сравнению с контрольными [52,53]. Результаты исследования с участием мышей показали, что метформин вызывает фазовый сдвиг вперед в печени, но фазовую задержку в мышцах [53], а эффекты метформина на суточный ритм у мышей блокируются выключением гена Prkaa2, кодирующего субъединицу АМФ-зависимой протеинкиназы α2 (источник 52).
Фармакокинетика
Пероральный прием метформина имеет биодоступность 40-60% и период полувыведения из плазмы 4-9 ч. Выделяется без изменений с мочой, главным образом, через канальцевую секрецию, а не посредством клубочковой фильтрации [28, 54]
Фармакодинамика
Метформин широко используется в качестве фармакотерапии первой линии у пациентов с СД2 из-за его эффективности, долговременной безопасности, низкого риска гипогликемии, эффекта нейтрального веса и благоприятного воздействия на сосудистые заболевания [36]. Лечение метформином обычно приводит к снижению уровня глюкозы в плазме натощак (ГПН) на 2-4 ммоль/л и HbA1c на 1-2% независимо от возраста, веса и продолжительности СД2 до тех пор, пока сохраняется остаточная функция β-клеток [28, 39]. В 10-летнем мониторинге, проводившимся в рамках проспективного исследования диабета в Великобритании (UKPDS) у пациентов, получавших метформин, значительно снижался риск любого осложнения, связанного с диабетом, на 21% (P=0,01), смерти от диабета на 30% (P=0,01) и инфаркта миокарда на 33% (P=0,005) по сравнению с пациентами с избыточным весом в группе традиционной терапии [23, 28, 55]. Метформин также может быть связан с уменьшением риска развития рака у пациентов с СД2, особенно рака простаты, поджелудочной железы и молочной железы [28, 42].
Прогрессивный характер СД2 может потребовать дополнительных методов, помимо метформина, снижения уровня глюкозы, включая инсулин [15, 36, 56]. Существует множество готовых комбинаций препаратов, включающих метформин.
Безопасность и побочные эффекты
Основными побочными эффектами лечения метформином являются неприятные ощущения в животе и другие желудочно-кишечные нарушения (диспептические расстройства), включая диарею [37]. При снижении дозы симптомы могут уменьшаться, но около 10% пациентов не могут переносить препарат в любой дозе [37], возможно, из-за вариантов строения hOCT1, которые приводят к повышенной концентрации метформина в кишечнике [57]. Риск непереносимости метформина (определяемой как прекращение приема метформина пациентом в течение первых 6 месяцев лечения) увеличивается за счет одновременного использования препаратов, которые ингибируют активность hOCT1 (включая трициклические антидепрессанты, циталопрам, ингибиторы протонной помпы, верапамил, дилтиазем, доксазозин, спиронолактон, клопидогрел, розиглитазон, хинин, трамадол и кодеин, (ОШ = 1,63, ДИ = 95% 1,22-2,17, P=0,001)), или наличием двух аллелей гена SLC22A1, связанных с уменьшенной функцией hOCT1, (ОШ = 2,41, ДИ = 95% 1,48-3,93, Р<0,001) [57].
Метформин противопоказан пациентам с прогрессирующей хронической болезнью почек (ХБП), с серьезными заболеваниями печени или состояниями, предрасполагающими к гипоксии или уменьшению перфузии тканей. Однако, наблюдательные исследования и исследования баз данных показывают, что некоторые преимущества метформина можно извлечь из его широкого терапевтического индекса [38, 58, 59], и тщательное внимание к дозе позволит использовать его даже у пациентов с сердечно-сосудистыми заболеваниями (включая умеренную или умеренную сердечную недостаточность [38, 60] и хроническую обструктивную болезнь легких [61]). Для обеспечения адекватного выведения необходимы корректировка дозы и мониторинг функции почек, в случае возникновения гипоксемии у пациента, терапию метформином следует прекратить [62, 63].
Результаты UKPDS показали, что, по сравнению с производными сульфонилмочевины и инсулином, у пациентов с ожирением и недавно диагностированным СД2 использование метформина было связано со значительным снижением частоты инфаркта миокарда, инсульта и смертности от других причин (на 39%, 41% и 36% соответственно) [64, 65]. UKPDS показало, что снижение частоты инфаркта миокарда и смертности также сохраняется в течение 10 лет терапии [23]. Последующий анализ баз данных привел подтверждающие доказательства этого эффекта [65]. Повышение уровня использования статинов и препаратов, защищающих почки, затрудняет оценку влияния метформина на сердечно-сосудистые заболевания [65], хотя для оценки этого эффекта на данный момент проводится несколько рандомизированных клинических исследований [65].
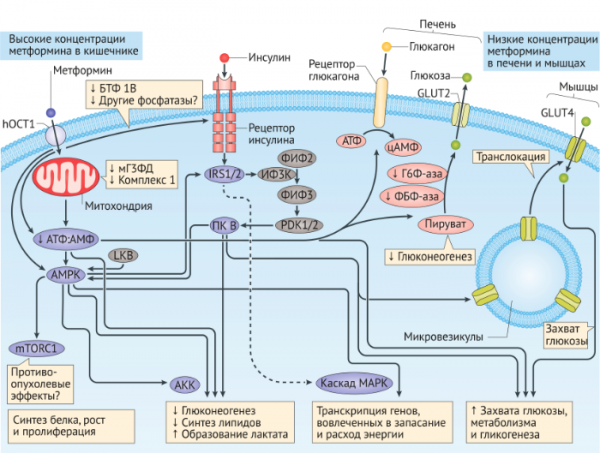
Рисунок 2 | Внутриклеточные изменения, вызываемые действием метформина.
Метформин вызывает изменения метаболизма нутриентов через инсулин-зависимые и инсулин-независимые эффекты, зависящие от концентрации препарата и активности инсулина в различных тканях. Кишечник подвергается воздействию высоких концентраций метформина, оказывающего здесь инсулин-независимые эффекты, в то время как низкие концентрации метформина в печени и мышцах вызывают эффекты, зависящие от инсулина. Метформин повышает чувствительность к инсулину, изменяя работу сигнальных путей на уровне инсулиновых рецептора или же ниже по внутриклеточному каскаду действия инсулина. Подавляя работу цепи переноса электронов в митохондриях и активируя 5’АМФ-зависимую протеинкиназу (AMPK), метформин может изменять метаболизм нутриентов и энергетический метаболизм независимо от инсулина.
AКК, ацетил-КоА карбоксилаза;ФБФ-аза, фруктозо-1,6-бифосфатаза; Г6Ф-аза, глюкозо-6-фосфатаза; GLUT, изоформы глюкозного транспортера; hOCT1, транспортер органических катионов 1; IRS, субстрат рецептора инсулина; LKB1, серин/треониновая протеинкиназа STK11; MAPK, митоген-активируемая протеинкиназа; mTOR, мишень рапамицина у млекопитающих; PDK, 3-фосфоинозитид-зависимая протеинкиназа; PI3K, фосфатидилинозитол-3-киназа; ФИФ2, фосфатидилинозитол-3,4-бифосфат; ФИФ3, фосфатидилинозитол-3,4,5-трифосфат; ПК B, протеинкиназа B; мГ3ФД, митохондриальная глицерол-3-фосфат дегидрогеназа.
источник: medach.pro
