Повреждение сетчатки, известное как «диабетическая ретинопатия», является общепризнанным осложнением уже на протяжении многих веков. За последнее десятилетие прогресс в технологии визуализации сетчатки и разработке новых методов лечения значительно улучшил клиническую оценку и результаты лечения пациентов с диабетической ретинопатией. Тем не менее, диабетический макулярный отек и пролиферативная диабетическая ретинопатия остаются основными причинами умеренной и серьезной потери зрения в большинстве развитых стран. В этой статье рассматривается и обсуждается мировое влияние диабетической ретинопатии последние изменения в клинической диагностике и лечении пациентов.
Диабет и диабетическая ретинопатия: мировые тенденции
В большинстве случаев ретинопатия развивается через 10–15 лет после того, как был диагностирован диабет. По мере роста заболеваемости диабетом все большее количество людей подвергаются риску ретинопатии, для диагностики и лечения которой требуются большие денежные ресурсы. Ожидается, что к 2045 году во всем мире 629 миллионов человек будут болеть сахарным диабетом. Распространенность диабета растет как в развивающихся, так и в развитых странах. В Китае распространенность диабета возросла с 1 % в 1980 году до 11,6 %, причем в 2013 году диагноз был поставлен 114 миллионам человек. В 2018 году предполагаемая распространенность диабета среди взрослых в Соединенных Штатах составила 10,2 % (26,8 миллионов случаев). В 2019 году заболевание стало причиной 4,2 миллионов смертей во всем мире, что обошлось здравоохранению США в 760 миллиардов долларов. Эффективная и точная диагностика диабетической ретинопатии, оценка риска и лечение имеют решающее значение, учитывая распространенность этой болезни. Во всем мире с 1990 по 2010 год нарушение зрения из-за диабетической ретинопатии увеличилось на 64 %, а слепота — на 27 %. К 2010 году диабетическая ретинопатия стала причиной 3,7 миллионов случаев нарушения зрения и более 833 000 случаев слепоты во всем мире, а заболевания глаз, связанные с диабетом, были пятой наиболее распространенной причиной потери зрения от умеренной или серьезной степени вплоть до необратимой слепоты. К счастью, недавний прогресс в диагностике, клинической оценке и лечении заболеваний глаз, связанных с диабетом, помогают уменьшить общую долю потери зрения в некоторых странах, особенно в тех, где имеются общенациональные программы скрининга диабетической ретинопатии.
Патогенез диабетической ретинопатии
Давность заболевания и степень гликемического контроля оказывают основное влияние на развитие диабетических осложнений (рис. 1). Однако известные факторы риска являются относительно неблагоприятными предикторами развития или прогрессирования ретинопатии, исследования генетических взаимосвязей вызвали разочарование. Фатальные для зрения осложнения обычно возникают из-за повышенной проницаемости сосудов сетчатки, осложнений, связанных с развитием неоваскуляризации сетчатки или передней камеры, а также выраженной васкулопатии сосудов центральной сетчатки. Были описаны различные механизмы, лежащие в основе диабетической ретинопатии. Противовоспалительные лекарственные средства, например, глюкокортикоиды, могут эффективно бороться с диабетическим макулярным отеком и снижать частоту осложнений пролиферативной диабетической ретинопатии, свидетельствуя о том, что воспаление может быть ключевым компонентом патогенеза. Также неизвестно, начинается ли диабетическая ретинопатия как васкулопатия или невропатия. Истончение внутренних слоев сетчатки предшествует клиническим признакам васкулопатий, связанных с диабетом. Кроме того, психометрическое тестирование показало, что нейроны начинают аномально функционировать еще до развития видимой васкулопатии, однако наличие нейропатии все еще нельзя считать предиктором развития васкулопатии. Ишемия сетчатки приводит к гипоксии тканей и проявляется в виде капиллярной непроходимости. Гипоксия является мощным индуктором экспрессии фактора роста эндотелиоцитов (VEGF), что приводит к повышению концентрации VEGF в стекловидном теле и сетчатке. VEGF является мощным регулятором процесса ангиогенеза и проницаемости сосудов. В экспериментальных животных моделях, ишемия сетчатки или введение VEGF в стекловидное тело могут вызвать сосудистые изменения, которые аналогичны диабетической ретинопатии, а ингибиторы VEGF могут блокировать процесс. По мере развития диабетической ретинопатии имеет место развитие некоторых аберрантных процессов, причем как параллельно друг другу, так и отдельно. Повышенная проницаемость сосудов сетчатки может вызвать утолщение макулярной зоны (диабетический макулярный отек) из-за присутствия в данной области интраретинальной и субретинальной жидкости (рис. 2). Диабетический макулярный отек является основной причиной потери зрения (часто определяемой как потеря трех или более строк по таблице проверки зрения, на которой одна линия равна пяти буквам-оптотипам; имеется в виду шкала Снеллена — аналог шкалы Сивцева, используемый в США — прим. ред.). Когда ишемия сетчатки распространяется шире, она может вызвать потерю зрения из-за дисфункции или гибели нервных клеток сетчатки, включая светочувствительные фоторецепторы сетчатки. Пролиферативная диабетическая ретинопатия может развиваться с явлением неоваскуляризации в диске зрительного нерва, радужной оболочке или в других местах по всей сетчатке; этот процесс и связанные с ним осложнения, такие как кровоизлияние в стекловидное тело, центральная ишемия сетчатки и тракционная отслойка сетчатки, являются основными причинами потери зрения у пациентов с диабетом.
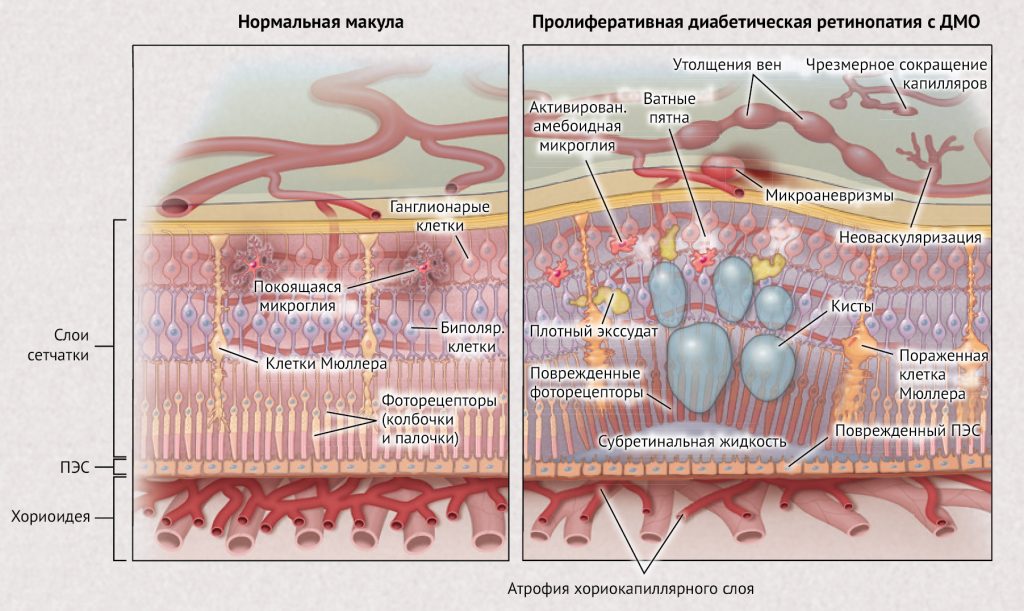
Рисунок 1 | Нормальная макула по сравнению с макулой с диабетическим макулярным отеком (ДМО) Нормальная архитектура сетчатки показана на левой панели. На правой панели показаны многие характерные признаки диабетической ретинопатии, в том числе микроаневризмы, венозные утолщения, неоваскуляризация сетчатки и так называемые «ватные пятна». Кисты, субретинальная жидкость, твердый экссудат и утолщения, прилегающие к центру ямки, свидетельствуют о наличии ДМО. ПЭС обозначает пигментный эпителий сетчатки.
Достижения в визуализации
В отличие от многих других органов и тканей, морфологические признаки сетчатки можно просмотреть непосредственно с помощью неинвазивной визуализации в кабинете офтальмолога. Исторически клиническая оценка степени диабетической ретинопатии основывалась на проведении стандартной цветной фоторегистрации сетчатки глаза, которая могла использоваться для визуализации приблизительно одной трети поверхности сетчатки (задней), и на флюоресцентной ангиографии, в ходе которой пациенту внутривенно вводили флюоресцентный краситель для оценки структуры и проницаемости сосудов. Более современная методика под названием сверхширокоугольная фоторегистрация глазного дна, позволяет оценить более 80 % поверхности сетчатки на одном изображении (см. рис. 3А и 3В). Морфологические признаки, зафиксированные на периферии сетчатки, которые не видны на стандартных фотографиях глазного дна, могут быть связаны с повышенным риском прогрессирования ретинопатии. Кроме того, с развитием все более сложных методов, таких как, например, оптическая когерентная томография (ОКТ) врачи могут неинвазивно оценивать структуры сетчатки как во фронтальном, (см. рис. 2А) так и в поперечном разрезе (рис. 2В), включая степень и местоположение утолщенного участка сетчатки и морфологические изменения в слое нервных волокон сетчатки, которые могут оказывать влияние на зрительные функции. Еще более современная технология, получившая название ОКТ-ангиография, позволяет осуществлять неинвазивную визуализацию и проводить морфологическую оценку перфузированных сосудов сетчатки (рис. 4). ОКТ-ангиография позволяет визуализировать движение кровяных клеток, которое в последующем используется для составления карты перфузии в трех слоях сосудов сетчатки. Учитывая повреждение сосудов микроциркуляторного русла сетчатки, которое происходит на ранних стадиях диабетической ретинопатии, количественное определение аномалий сосудистой сети сетчатки может быть очень информативным в контексте оценки прогрессирования диабетической ретинопатии. Однако этот метод не так уж легко использовать для оценки проницаемости сосудов или величины кровотока. Таким образом, флюоресцентная ангиография остается важным диагностическим методом для обнаружения просачивания (то есть повышенной проницаемости) сосудов. Другой сложный метод визуализации включает технологию адаптивной оптики. Этот метод может быть использован в сочетании со сканирующей лазерной офтальмоскопией, либо с ангиографией сетчатки с регистрацией кровотока. Благодаря измерению оптических дефектов глаза и использованию технологии деформируемых зеркал для коррекции возникающих аберраций во фронте волны, отраженной от глаза, адаптивная оптика неинвазивно приводит к пространственному разрешению сетчатки (вплоть до капилляров диаметром около 2 мкм), позволяющему визуализировать отдельные фоторецепторы и эритроциты. Вместе эти новые технологии позволяют неинвазивно произвести беспрецедентную оценку структуры сетчатки и патологических очагов в ней. Однако использование таких современных технологий визуализации может быть затруднено из-за отсутствия наработанной технологии, уверенности в надежности и технической сложности получения высококачественных изображений, а также из-за высокой стоимости данных процедур. По мере продвижения в опыте работы с современными технологиями визуализации, с приобретением опыта и большого числа данных, полученных с применением современных методов визуализации, искусственный интеллект (ИИ) вкупе с технологиями глубокого обучения будут применяться и к изображениям сетчатки, чтобы идентифицировать факторы, которые связаны с результатами ретинопатии. В частности, было показано, что подходы ИИ эффективны при выявлении ретинопатии на определенных стадиях, включая стадии, требующие направления к офтальмологу с целью осмотра сетчатки. Дополнительные усилия направлены на выявление особенностей изображения сетчатки, которые могут предсказать риск ухудшения ретинопатии и появления нежелательных реакций на лечение. Становится ясно, что, поскольку новые методы визуализации предоставляют более подробную и более обширную информацию, а компьютеризированные подходы анализируют эту информацию по-новому, вероятно, появятся открытия, которые позволят выявить самые ранние изменения в диабетической ретинопатии и предсказать прогрессирование или же регрессию заболевания.
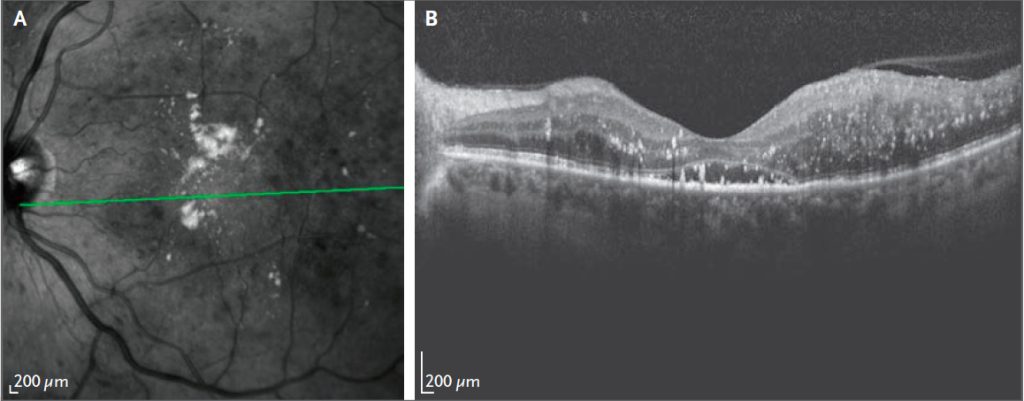
Рисунок 2 | Изображения сетчатки с центральным диабетическим макулярным отеком На изображении во фронтальной проекции на панели А в центральной макуле видны множественные твердые экссудаты (светлые пятна) и внутриретинальные кровоизлияния (темные пятна), что свидетельствует о диабетическом макулярном отеке. Зеленая линия указывает расположение изображения поперечного сечения на панели B, на котором виден выраженный отек сетчатки, рассеянные твердые экссудаты (белые пятна) и центральная субретинальная жидкость.
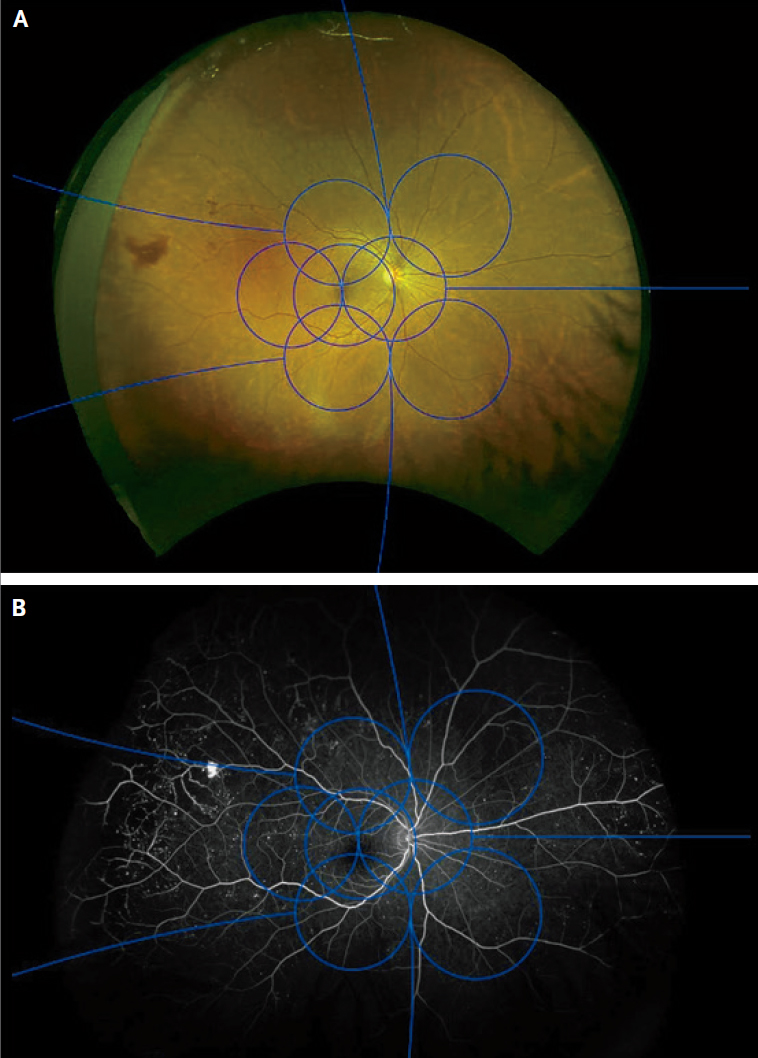
Рисунок 3 | Изображения глаза с диабетической ретинопатией в ультрашироком поле На панели A стандартные поля (синие кружки) ETDRS (Early Treatment of Diabetic Retinopathy Study — раннее лечение диабетической ретинопатии) накладываются на полное изображение сетчатки в ультрашироком поле. Слева можно видеть область кровоизлияния в стекловидное тело (красноватое пятно) в области за пределами полей ETDRS. На панели B показана сверхширокая флюоресцентная ангиограмма того же глаза. Флюоресцентный внутривенный краситель очерчивает перфузируемые сосудистую сеть сетчатки и сосудистые выбросы (микроаневризмы выглядят здесь как маленькие, яркие точки).
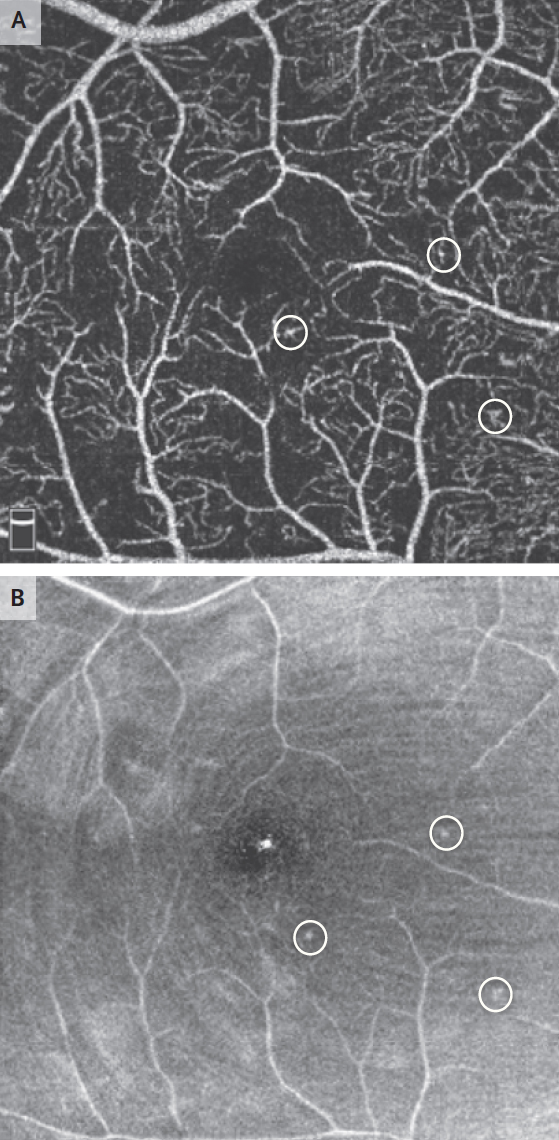
Рисунок 4 | ОКТ-ангиография макулы у 32-летней женщины с непролиферативной диабетической ретинопатией Центральная область сетчатки (фовеа) с аномальными сосудами (панель А). Широкая область неперфузии в окружающих областях (большие черные зоны). Кругами обведены три микроаневризмы. На изображении en face показаны микроаневризмы, обведенные кругом (Панель B).
