Клетки злокачественных опухолей изменяют свой метаболизм так, чтобы он отвечал нуждам, возникающим при неограниченной клеточной пролиферации. Растущие запросы приводят к изменению потребностей в энергии, биосинтетических предшественниках и промежуточных звеньях передачи сигналов. Как генетические программы, возникающие в результате канцерогенеза, так и транскрипционные и эпигеномные события важны для обеспечения необходимой метаболической активности раковых клеток. В последнее время появляются доказательства того, что факторы окружающей среды играют основную роль в формировании метаболизма клеток опухолей, а диета и питание являются ключевыми компонентами в его определении. В этом обзоре обсуждаются новые концепции в понимании метаболизма злокачественных клеток, а также то, как на него влияют диета и питание.
Метаболизм раковых клеток изменяется, чтобы удовлетворить биосинтетические, биоэнергетические и сигнальные потребности при неконтролируемой клеточной пролиферации. Изменения обмена веществ на молекулярном уровне были обнаружены почти 100 лет назад, когда Отто Варбург и его коллеги сообщили, что злокачественные клетки потребляли больше глюкозы, чем их аналоги в нормальных тканях, и предпочитали ферментировать ее, чтобы вырабатывать лактат вместо более энергетически эффективного окисления до CO2. В настоящее время широко известно, что в раковых клетках происходят также изменения в поглощении и обмене углеводов, липидов и аминокислот. Определенные питательные вещества, которые более активно усваиваются злокачественными клетками, сильно варьируют: в некоторых подгруппах опухолей изменяется метаболизм глюкозы, в других — метаболизм одноуглеродных соединений наряду с усилением зависимости от обмена аминокислот, а также многие другие пути.
Эти наблюдения используются в клинической практике в качестве методов визуализации, и в настоящее время являются предметом исследований, необходимых для разработки лекарственных средств (Stuani et al., 2019; Vander Heiden и DeBerardinis, 2017). Данные концепции были детально рассмотрены в обзорах, выходивших на протяжении многих лет (Weinberg and Chandel, 2015; Wolpaw and Dang, 2018).
Метаболизм злокачественных опухолей, как и все процессы, происходящие в живых организмах, включает в себя как генетические, так и связанные с окружением компоненты. Почти все онкогены и опухолевые супрессоры обладают способностью изменять обмен веществ клетки в той или иной форме (Vander Heiden and DeBerardinis, 2017). Мутации, которые влияют на сигнальные пути и транскрипционные программы, связывают некоторые элементы метаболических каскадов, изменяя экспрессию генов и их активность, например, путем посттрансляционных модификаций участвующих в обмене веществ ферментов и переносчиков. Данные процессы, связанные с возникновением опухоли, также регулируются факторами окружения, специфичными для пространственной ориентации в соответствующей ткани, такими как наличие факторов роста и цитокинов, тип межклеточных контактов. Помимо этих факторов, определяющих активность метаболических каскадов клетки, доступность питательных веществ, на которую непосредственно влияет тканевое окружение, играет главную роль в настройках метаболизма раковых клеток (Palm and Thompson, 2017; Zhu and Thompson, 2019). Она зависит как от метаболитов, высвобождаемых из окружающих клеток, так и от состава плазмы в сосудистой сети.
Уровень метаболитов в плазме крови определяется совокупностью физиологических процессов, в которую вносят вклад кишечник, печень, мышцы, поджелудочная железа и другие органы и ткани. Доступность питательных веществ в плазме изначально определяется потреблением пищи; концентрации метаболитов широко варьируются в зависимости от рациона (Mentch et al., 2015). Известно, что определенные виды диет могут влиять на определенные физиологические аспекты. Например, средиземноморскую диету связывают с увеличением продолжительности жизни. Западная же диета напротив, ассоциирована с ожирением, онкологическими заболеваниями и ишемической болезнью сердца. Интересно, что растительные рационы издавна изучались в контексте терапии рака (Gerson, 1978). И хотя существуют убедительные эпидемиологические доказательства, связывающие данные типы питания с болезнями, молекулярные механизмы, лежащие в основе этих эффектов, еще недостаточно изучены. Еще менее понятно то, как диета может формировать метаболические пути в организме, не говоря уже о влиянии на прогрессию или лечение злокачественных новообразований (Goncalves et al., 2019a; Kanarek et al., 2020; Lien and Vander Heiden, 2019). Текущие исследования центрального углеродного обмена, в котором участвуют углеводы, липиды и аминокислоты, дают представление о потенциальных путях воздействия на метаболизм раковых клеток. В данном обзоре обсуждаются результаты недавних исследований, которые расширяют понимание взаимосвязи диеты и онкологических заболеваний на молекулярном уровне, и предлагаются стратегии для терапевтических воздействий, направленных на эти механизмы.
Принципы и механизмы взаимосвязи диеты и метаболизма раковых клеток
Как упоминалось ранее, обмен веществ в раковых клетках сильно зависит от многих факторов окружения, включая кислотность среды в опухоли, состав популяций стромальных и иммунных клеток и механические свойства структуры опухоли. Эти особенности были рассмотрены в обзорах (Bi et al., 2020; Wolpaw and Dang, 2018). Особый интерес представляют питательные вещества микроокружения опухоли, которые определяют большую часть метаболизма опухолевых клеток (Chen et al., 2019; Tasdogan et al., 2020). Действительно, хотя опухолевый метаболизм крайне неоднороден и обусловлен анатомическим расположением, генетическими профилями и целым рядом других факторов, было показано, что у некоторых типов опухолей развивается метаболическая зависимость от определенных питательных веществ, таких как, например, глютамин и цистеин. Их доступность определяется доставкой нутриентов с плазмой из системного кровотока в опухолевые клетки (Muir and Vander Heiden, 2018). В связи с этим детерминанты доступности питательных веществ плазмы представляют особый интерес, так как они служат основной точкой контроля над метаболизмом опухоли и поддаются фармакологическим, физиологическим воздействиям и воздействиям соответствующего окружения.
Доступность питательных веществ контролирует клеточный метаболизм посредством множества механизмов. Одним из таких процессов является поглощение клетками питательных веществ из окружающей микросреды, которое строго регулируется кинетическими свойствами активных переносчиков, в том числе их константами Михаэлиса (Nelson and Cox, 2000). В физиологических условиях раковые клетки сталкиваются с концентрациями питательных веществ, которые находятся на на том же уровне, что и в соответствующих нормальных тканях или превышают их. Такое увеличение доступности нутриентов влияет на скорость их усвоения, которая затем распространяется на изменения характера поступления веществ в клетку через метаболическую сеть и нижестоящие пути (Palm and Thompson, 2017). Эта парадигма лучше всего иллюстрируется способностью печени определять высокие уровни глюкозы и реагировать на это усилением синтеза гликогена. Эта перестройка осуществляется, в частности, путем увеличения константы Михаэлиса печеночного транспорта глюкозы (5 мМ). При голодании концентрации глюкозы низкие (3 мМ), что позволяет ей обходить поглощение клетками печени и возвращаться в системный кровоток. Однако в состоянии сытости концентрация глюкозы в плазме возрастает (8 мМ), что приводит к пропорциональному усилению поглощения глюкозы (Mueckler and Thorens, 2013). Такое трехкратное увеличение поглощения глюкозы по сравнению с исходным уровнем приводит к синтезу гликогена и, таким образом, позволяет печени выполнять свою ключевую роль в поддержании гомеостаза глюкозы. Метаболом плазмы отражает потребление пищи в контексте индивидуальной метаболической гетерогенности, которая включает в себя такие факторы, как функция печени, состав кишечного микробиома, а также метаболизм в мышцах и жировой ткани (Zeevi et al., 2015). В новой, еще недостаточно изученной области исследований рассматривалось применение профилирования метаболитов в сочетании с диетическим мониторингом для прогнозирования изменений в циркулирующей плазме, возникающих в результате потребления тех или иных питательных веществ. Хотя общие тенденции питания отражаются в метаболоме плазмы, необходимы дальнейшие исследования, чтобы тщательно изучить детальные особенности рациона, включая отдельные продукты и их влияние на концентрацию метаболитов (Wittenbecher et al., 2015). Клиническая ценность изучения характера питания и связанных с ним изменений в обмене веществ подтверждается установленными взаимосвязями между определенными диетами и нарушением регуляции обмена веществ всего организма. Целая плеяда хронических состояний, связанных с метаболическим синдромом, таких как ожирение, инсулинорезистентность и гипергликемия, также ассоциированы с более высоким риском развития онкологических заболеваний и худшим прогнозом для пациента (Perry and Shulman, 2020). Связь ожирения с раком объясняется рядом механизмов, в том числе стрессом эндоплазматического ретикулума, развитием воспаления, нарушениями передачи сигналов, связанных с гормональной регуляцией и, возможно, измененным метаболизмом в результате возникновения колебаний уровня метаболитов в плазме (Iyengar et al., 2016; Ulrich et al., 2018). Гипергликемия также связана с повышенным риском развития рака и прогрессированием уже существующих онкологических заболеваний. Этот канцерогенный эффект может быть обусловлен системными эффектами инсулина / инсулиноподобного фактора роста 1 (ИФР-1), другими факторами роста, а также передачей сигналов в воспалительном каскаде и прямым поглощением глюкозы опухолевыми клетками, приводящим к эпигенетическим и биосинтетическим изменениям (Goncalves et al. al., 2018). Таким образом, роль опосредованных диетой изменений в системном обмене и их влияние на метаболизм опухоли (рис. 1) требуют дальнейшего изучения.
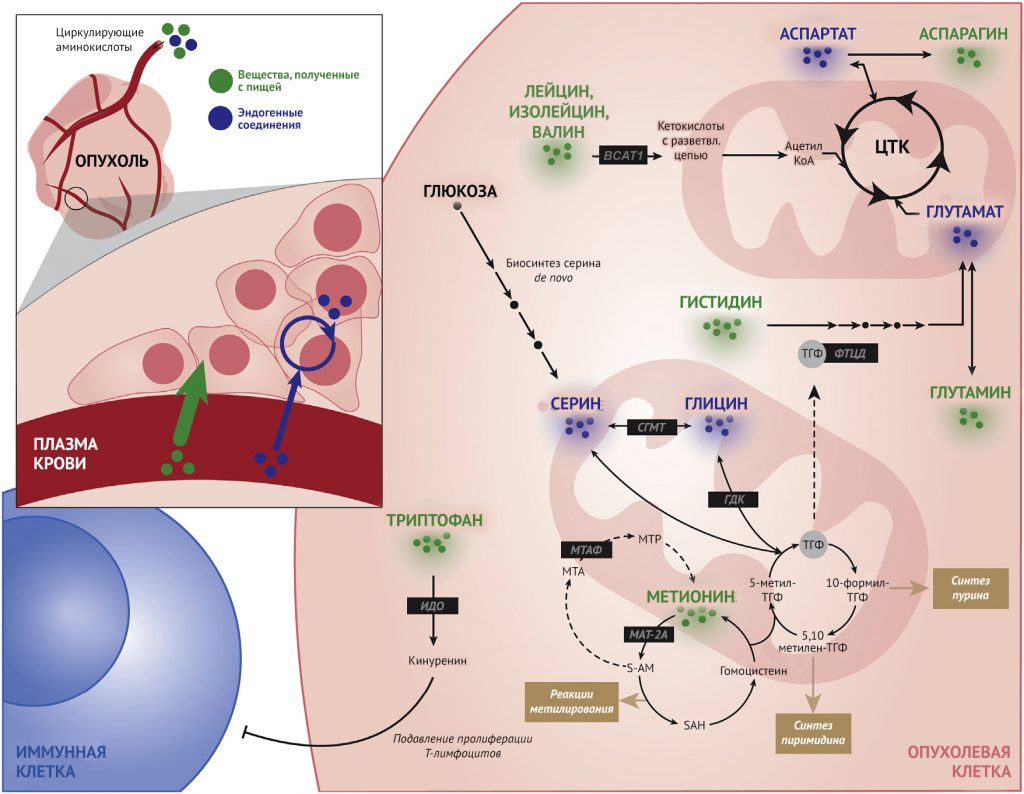
Рисунок 1 | Влияние особенностей диеты на метаболизм и доступность питательных веществ, которые, в свою очередь, воздействуют на метаболизм опухолевых клеток Известно, что время приема пищи, а также ее калорийность изменяют секрецию инсулина, которая, в свою очередь, влияет на поглощение глюкозы клетками. Снижение содержания глюкозы и повышение уровня кетоновых тел в состоянии кетоза, вызванного кетогенной диетой, связывают с угнетением гликолиза и усилением окислительных процессов в клетке. Данные факты говорят о том, что, хотя эти механизмы еще недостаточно понятны, определенные диеты могут играть важную роль в метаболизме раковых клеток.
