Наверное, еще с того момента, как первые наши прапрапредки обрели сознание, человек боялся смерти и искал пути ее предотвратить или отсрочить. Древний человек жаждал утешения в представлениях о загробном мире, позже алхимики пытались изобрести зелья, которые помогли бы достичь бессмертия. С развитием науки ученые стремились понять, как работает наша смертность на клеточном уровне и еще глубже – и можно ли серьезно изменить отмеренный человеку век. Именно о теломерах часто говорят как о некоем секрете долголетия, том самом волшебном рычаге в ДНК, который может прибавить один-два десятка лет к нашей жизни. Так ли это?
Что такое теломеры
ДНК эукариотов (организмов, все клетки которых имеют ядро – в отличие от прокариотов, такового не имеющих) состоит как из кодирующих, так и из некодирующих участков. Причем первых гораздо меньше, чем вторых. Это, впрочем, вовсе не странно, ведь многоклеточный организм – структура чрезвычайно сложная, и для его регуляции требуется очень много данных. Теломеры выполняют одну из таких регуляционных функций: они определяют возраст клетки. И здесь стоит уточнить: этот возраст – не то время, которое клетка просуществовала.
Сама по себе теломера – структура чрезвычайно простая. Это концевые участки хромосом, которые содержат в себе повторяющийся нуклеотидный паттерн. У большинства животных он выглядит как TTAGGG (буквы обозначают нуклеотиды: тимин, аденин, гуанин соответственно). Такие последовательности, как уже было написано выше, ничего не кодируют. Их роль можно назвать жертвенной. При каждом новом делении клетки ее генетический материал копируется. За это отвечает целый комплекс ферментов, которые расплетают, стабилизируют и воспроизводят нити ДНК, а также формируют затравки-праймеры. Центральную роль здесь играет ДНК-полимераза, которая синтезирует новую цепь нуклеиновой кислоты, используя существующую в качестве матрицы.
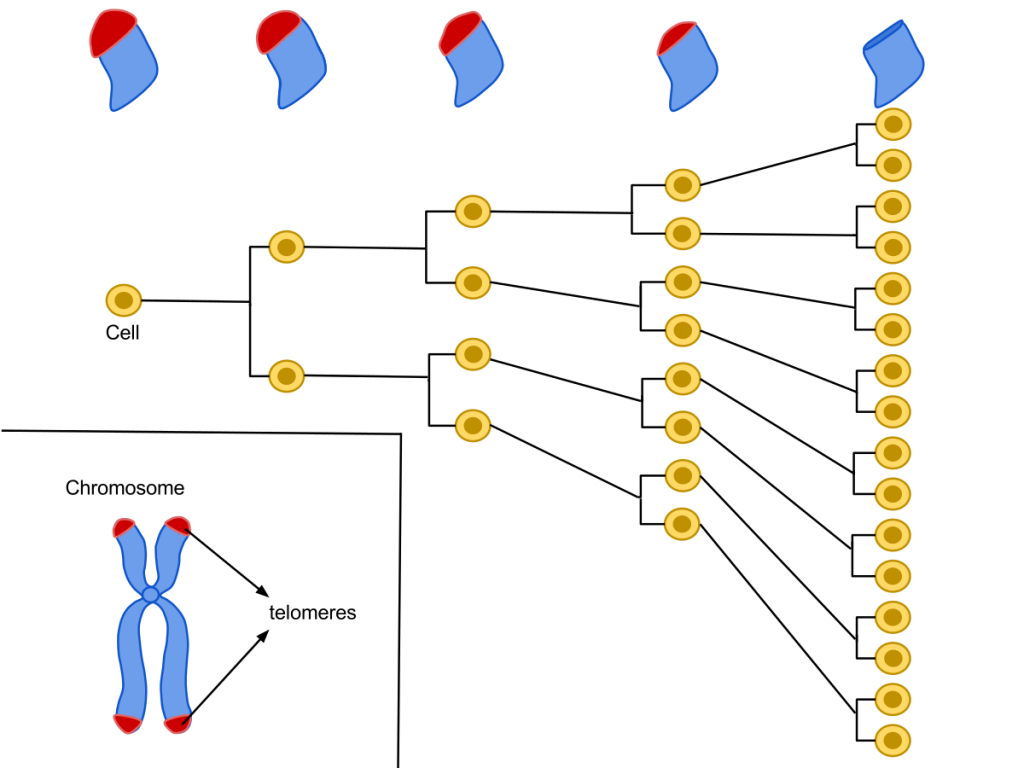
При каждом делении клетки длина теломерных последовательностей постепенно сокращается. По достижении предела Хейфлика клетка уже не может нормально делиться дальше. / ©Wikipedia
У ДНК-полимеразы существует одна особенность: она не способна синтезировать нить ДНК с самого конца. Это своего рода «не баг, а фича»: благодаря такой особенности фермента нити ДНК при каждом делении укорачиваются на определенную длину. Казалось бы, получающиеся при таком процессе клетки будут неполноценными с генетической точки зрения, ведь может теряться важная информация. Но, благодаря существованию теломер, этой потери до определенного момента не происходит: концевые последовательности ДНК смиренно уменьшаются в размерах, позволяя сохраниться генетическим данным, которые они обрамляют.
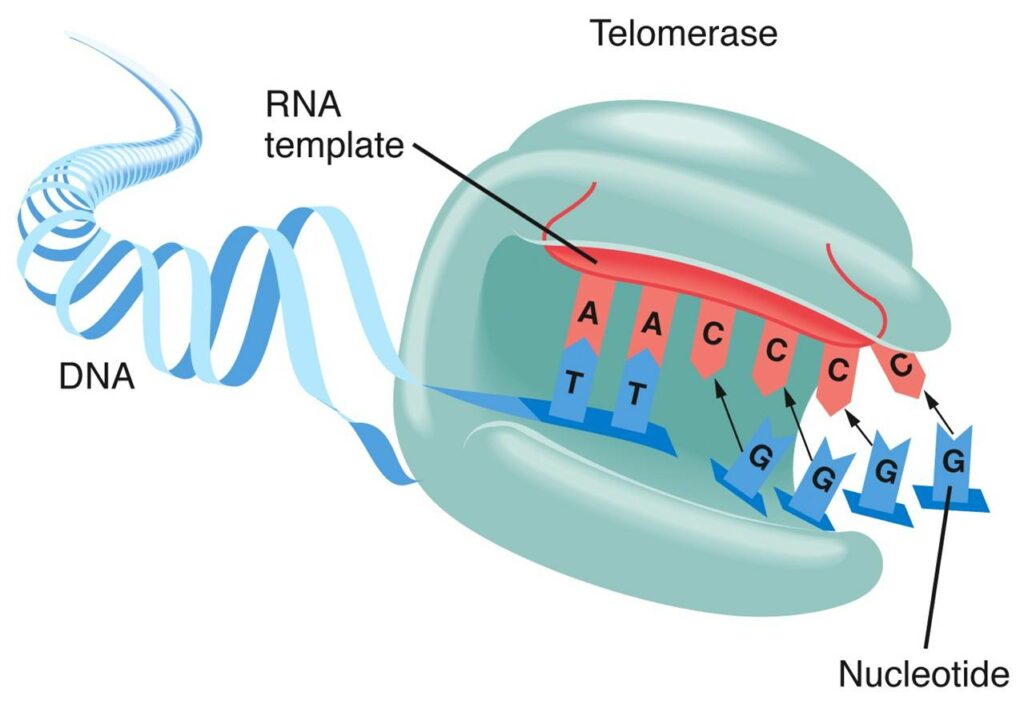
Фермент теломераза / ©lifesciencestoday.ru
Наилучшим кратким определением для теломер будет «обратный счетчик количества клеточных делений». Каждая клетка может пройти примерно через 50 делений: после этого теломеразная защита исчерпается, и это служит сигналом для начала апоптоза – запрограммированной клеточной смерти. Число в 50 делений называют «пределом Хейфлика» – в честь Леонарда Хейфлика, который этот лимит делений и открыл. Хейфлик со своим коллегой Полом Мурхедом поставил простой и наглядный эксперимент. Ученые в равных частях смешали фибробласты, взятые от мужчин и от женщин; при этом мужские клетки уже прошли 40 циклов делений, а женские – только десять. Роль контрольной группы играли чисто мужские фибробласты.
Когда клетки в контрольной культуре перестали делиться, Хейфлик с Мурхедом обнаружили, что смешанная культура уже не смешанная: все мужские фибробласты в ней погибли, остались лишь женские клетки. На основании этого Хейфлик и сделал свой вывод о жизненном лимите клеток человеческого организма.
Открытие теломеразы
Однако не всегда и не везде жизненный цикл клетки предопределен теломерами. Существует механизм, который позволяет сделать клетку фактически бессмертной, а имя ему – теломераза.
Существование теломеразы было предсказано еще в 1974 году как способ объяснить отсутствие старения у некоторых типов клеток – причем клеток как здоровых (стволовых), так и патологически измененных (например, клеток раковых опухолей). Предсказал существование этого фермента 45-летний советский ученый Михаил Оловников, назвав его тандем-ДНК-полимеразой. А уже через семь лет, в 1981 году, американка Элизабет Блекберн подтвердила теорию Оловникова, выделив этот фермент.
Вместе со своей аспиранткой Кэрол Грейдер Блэкберн выделила и очистила фермент, показав, что, кроме белков, в его состав входит еще РНК. К середине 1980-х ряд экспериментов показал, что у организмов с мутацией в теломеразных РНК происходит ускоренное укорачивание теломер, а клетки этих организмов развиваются очень медленно и в конце концов прекращают рост. Элизабет Блэкберн подтвердила этот феномен у тетрахимен (пресноводных инфузорий), Кэрол Грейдер – на клетках человека, а еще один американский ученый Джек Шостак – в культуре дрожжей. Этих троих ученых объединяет еще один факт: в 2009 году «за открытие того, как теломеры и фермент теломераза защищают хромосомы» они были удостоены Нобелевской премии.
Эти открытия перевернули взгляд на генетику старения. Многие ученые наперебой заявляли, что теломераза – ключ к вечной молодости, причем не просто отдельной клетки, а организма в целом. Однако дальнейшие события показали, что не все так просто – и один-единственный ключ всех дверей не откроет. Впрочем, об этом позже.
Болезни, связанные с теломерами и теломеразой
Дисфункция теломеразы и теломер приводит ко множеству патологических состояний и заболеваний. Большинство из них были описаны задолго до открытия «фермента бессмертия», в первой половине XX века. Например, при врожденном дискератозе из-за генных мутаций и связанных с ними дефектов TERT и TERC теломеры больных очень короткие. Это приводит к тому, что у большинства клеток нарушается нормальный цикл деления и возрастает нестабильность генома. А те немногие клетки, которые способны поддерживать активность фермента, довольно быстро превращаются в раковые. В результате три четверти больных дискератозом не доживают даже до 30 лет.
Пожалуй, самое известное заболевание, связанное с дефектами теломер, – детская прогерия, или же синдром Хатчинсона – Гилфорда. При этом заболевании происходит мутация гена LMNA, отвечающего за синтез ламина – белка, который входит в состав оболочки клеточного ядра. Дефектная форма ламина, так называемый прогерин, нарушает многие генетические процессы, в том числе сильно укорачивает теломеры. Детская прогерия наглядно показывает, как нарушение механизмов клеточного старения отображается на организме в целом. Больные уже в возрасте четырех-пяти лет выглядят как старички: птичье лицо, заостренный нос, дистрофические процессы в ногтях, волосах и зубах. Такие дети редко доживают хотя бы до совершеннолетия.
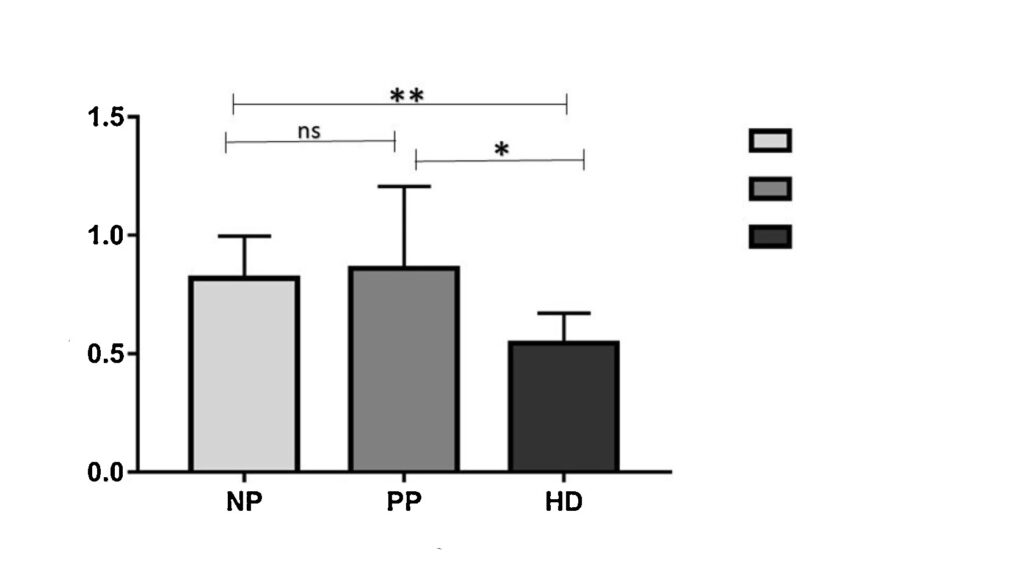
Сравнительная длина теломер у пациентов с негативным прогнозом по болезни Хантингтона, позитивным прогнозом по ней и диагностированным заболеванием / ©Wikipedia
Некоторые болезни влекут за собой дисфункцию теломер, что лишь еще сильнее подкашивает и без того слабый организм. Такова хорея Хантингтона – аутосомно-доминантное генетическое заболевание. Его причина кроется не в теломерах, а в гене, кодирующем белок хантингтин с неизвестной пока ученым функцией. Однако, помимо всего прочего, развитие хореи Хантингтона влечет за собой и сокращение длины теломер. Исследование, проведенное мексиканскими учеными, показало, что у больных с проявляющимися симптомами теломеры оказались примерно в полтора раза короче, чем у здоровых людей или у больных на ранней стадии.
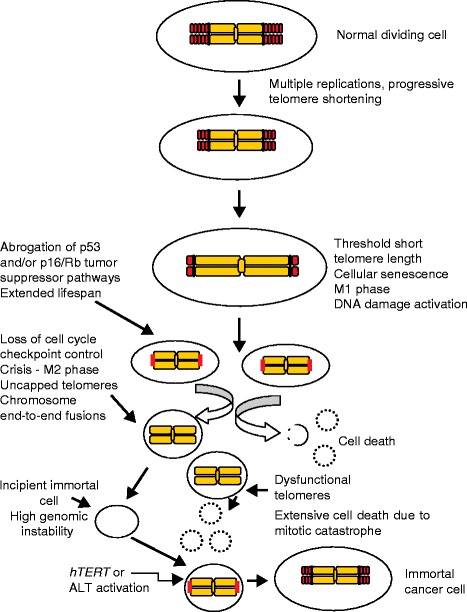
По мере сокращения длины теломер клетка может либо погибнуть нормальным путем, либо переродиться в раковую. / ©researchgate.net
Скорее всего, из-за накопления хантингтина в митохондриях там образуется больше активных форм кислорода, что приводит к развитию окислительного стресса и повреждению теломер. При этом мутантный белок блокирует ферменты, которые отвечают за репарацию ДНК, поэтому дефектные теломеры остаются укороченными.
Ну и, конечно, рассказывая о теломерах, нельзя обойти стороной онкологические заболевания. Причем в этом случае проблема уже не в слишком коротких, а чрезмерно длинных теломерах. Важный факт: чаще всего опухолевые структуры возникают именно в постоянно обновляющихся тканях, где теломеразная активность высока и в нормальном состоянии.
Этот факт наводит на мысль о том, что нормальное состояние нашего организма и то, как он стареет, – природная «золотая середина», способ соблюсти равновесие между слишком быстрым старением и превращением в массу постоянно пролиферирующих клеток. Изучение теломеразы в контексте рака неизбежно приводит к выводу о том, что большая длина теломер как таковая не ведет ни к вечной, ни хотя бы к продленной молодости.
Отличное подтверждение тому – мыши. В норме длина теломер у этих грызунов заметно длиннее, чем у людей: иногда в четыре-пять раз. У некоторых линий лабораторных мышей длина теломерных последовательностей вовсе может достигать 150 тысяч пар нуклеотидных оснований (у человека эта цифра обычно не превышает 15 тысяч пар). Во многом поэтому лабораторные мыши – популярный модельный объект для изучения механизмов формирования и лечения опухолей.
Механика «бессмертных кусочков»
Теломераза – не одна молекула, а сложный рибонуклеопротеиновый комплекс. Выражаясь более простым языком, совокупность белков и РНК. Главные компоненты этой совокупности – теломеразный РНК-компонент TERC и теломеразная обратная транскриптаза TERT. TERC – это последовательность нуклеотидов, содержащая специальный участок (ААУЦЦЦ), матрицу, на которой TERT синтезирует комплементарную нить ДНК. Присоединяясь к так называемому 3’-концу ДНК (со свободной гидроксильной группой), теломераза добавляет к нему последовательно по одному нуклеотиду.
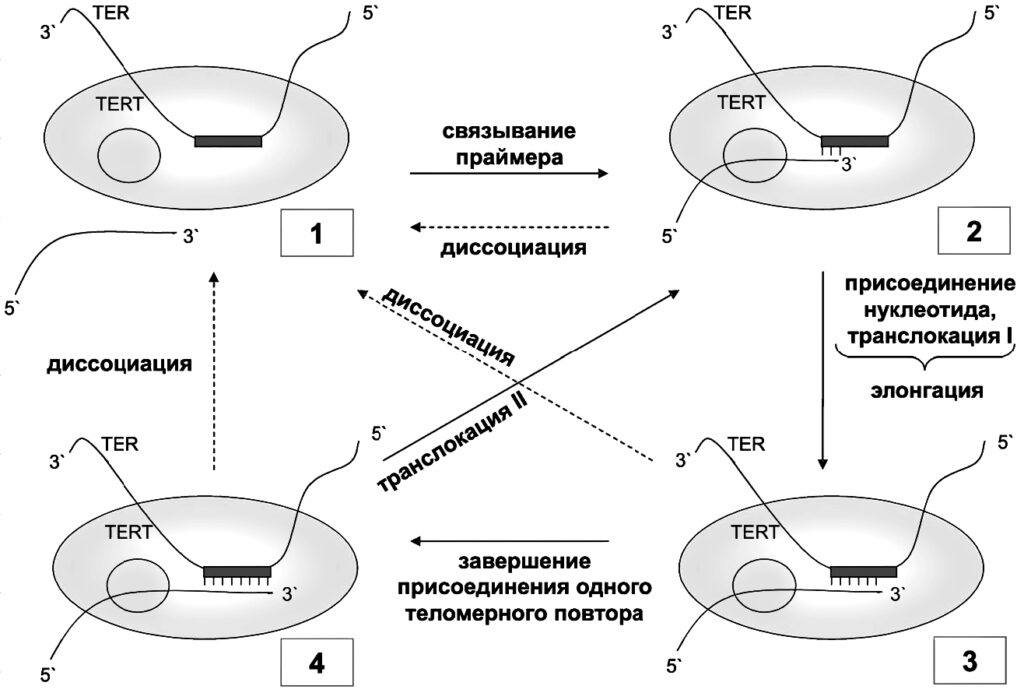
Два наиболее важных компонента теломеразного комплекса: РНК-матрица TERC и фермент обратная транскриптаза TERT
Этот матричный участок фланкируют (обрамляют) два элемента: 5’-матричный ограничивающий и 3’-матричный узнающий. 5’-элемент представляет собой двухцепочечный участок, расположенный непосредственно перед РНК-матрицей: он регулирует добавление нуклеотидов в ходе обратной транскрипции и, по-видимому, служит участком связывания с TERT. С помощью мутагенеза было показано, что для эффективного функционирования теломеразы важна не сама по себе нуклеотидная последовательность, а именно вторичная структура этого участка.
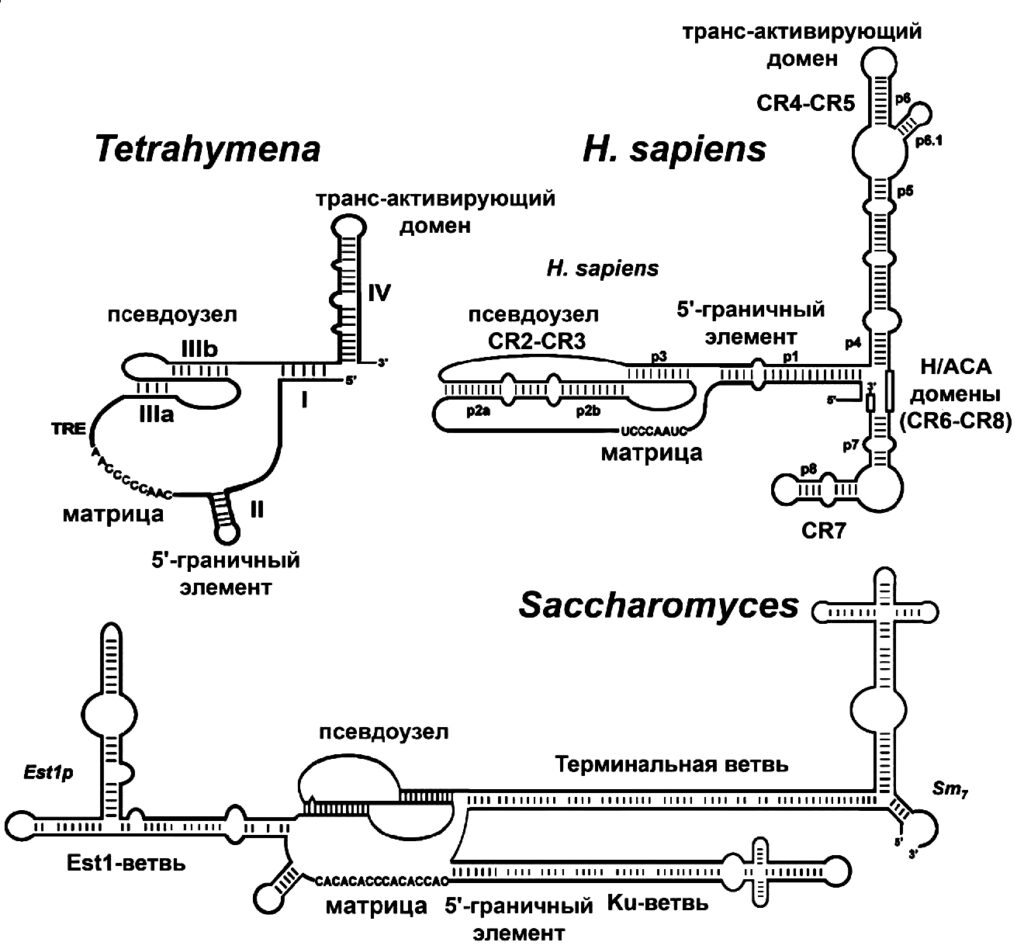
Вторичные структуры TER различных организмов: простейших Tetrahymena, млекопитающих, а также человека и дрожжей Saccharomyces / ©thepresentation.ru
3’-узнающий элемент –одноцепочечная структура, расположенная после матричного участка, которая позволяет концу матрицы занять место в активном центре теломеразы, стимулирует теломеразную активность, а также содержит участок связывания N-конца TERT-субъединицы.
Из элементов вторичной структуры теломеразной РНК наиболее интенсивно изучается псевдоузел, или же стабилизирующая шпилька. Изменения стабильности псевдоузла приводят к снижению активности теломеразы, что указывает на важную биологическую роль этого структурного элемента. Полученные за последнее время результаты изучения олигонуклеотидов, имитирующих элементы структуры псевдоузла TERС, подтвердили, что именно динамика третичной структуры псевдоузла играет важную роль в функционировании теломеразы.
Как мы уже писали выше, бессмертие всем клеткам организма не требуется. Соответственно, и теломераза не везде активна. TERC-компонент транскрибируется во многих клетках, но обратная транскриптаза в большинстве из них отсутствует. Полностью функциональный теломеразный комплекс можно найти в половых и стволовых клетках. Также активность теломеразы наблюдается в клетках, которые постоянно делятся (например, клетки кишечного эпителия и B-лимфоциты).
Как жить дольше и при чем тут «мышь Мафусаила»?
Неудивительно, что практически сразу после открытия теломеразу назвали ферментом бессмертия и начали искать способы с ее помощью если не повернуть старение вспять, то хотя бы максимально его замедлить. Когда теломеры в клетке укорачиваются до определенной критически малой длины, запускаются механизмы клеточного сенесенса и апоптоза – гибели клетки.
Логично, что многие ученые ухватились за мысль о том, что влияние на функцию теломер каким-то образом способно помочь продлить человеческую молодость. Как раз в 1980-е, когда существование теломеразы и ее роль в старении клеток были подтверждены, начали развиваться методы генной терапии. Были выделены отдельные гены, начали активно создаваться экспрессирующие векторы (генетические конструкции для переноса информации в клетку и ее последующего использования), а переносы генов у мышей и других лабораторных животных стали обычным делом.
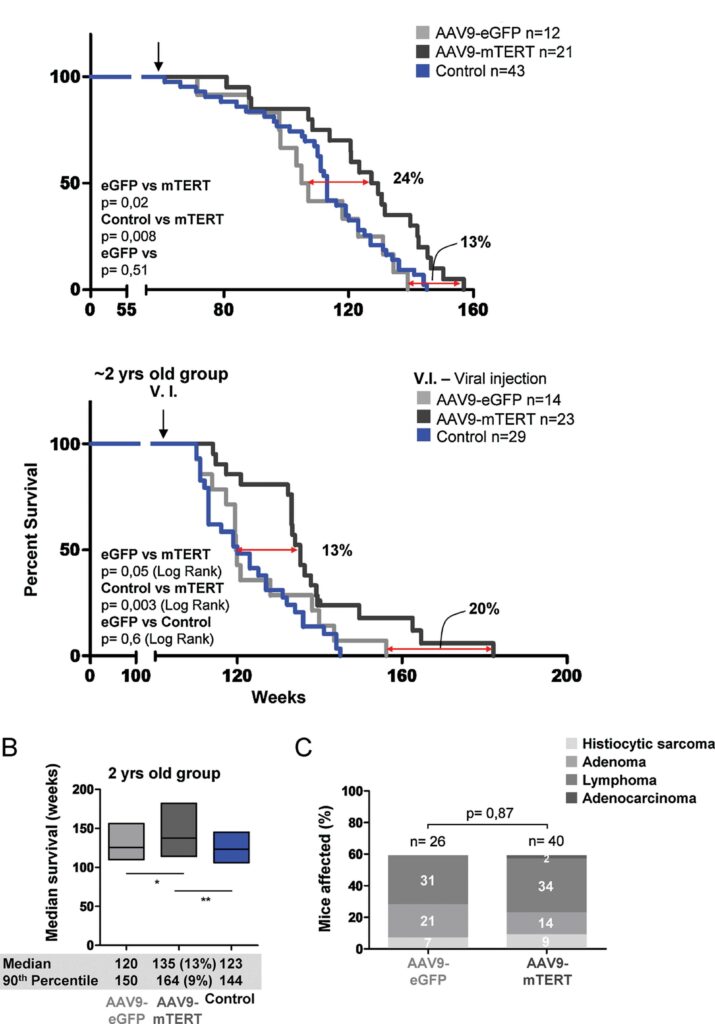
График выживаемости одно- и двухлетних мышей в опытах группы Бласко. Черным цветом показана выживаемость грызунов, получивших вирусный вектор с геном TERT, серым – вирусный вектор без соответствующего гена. Синий цвет – контрольная группа. / ©embopress.org
Применение методов генной терапии, направленных на теломеры, было вопросом времени. Впрочем, подобный подход вызывал множество опасений. ДНК – структура сложная, клетка в целом – еще сложнее. Риск того, что «пранк выйдет из-под контроля» очень высок. Почему бы не обратиться к проверенному методу – приему фармацевтических препаратов? Или обратиться к таким методам, как ограничение питания?
Да, подобными относительно тривиальными методами можно добиться серьезных результатов. Так, в 2004 году Стивен Спиндлер из Университета Риверсайда в Калифорнии смог при помощи ограничения калорийности питания группы мышей добиться того, что средняя продолжительность жизни грызунов составила 1356 дней, или же около 3,5 лет. И это действительно много – с учетом того, что обычно эти животные в среднем живут порядка двух лет.
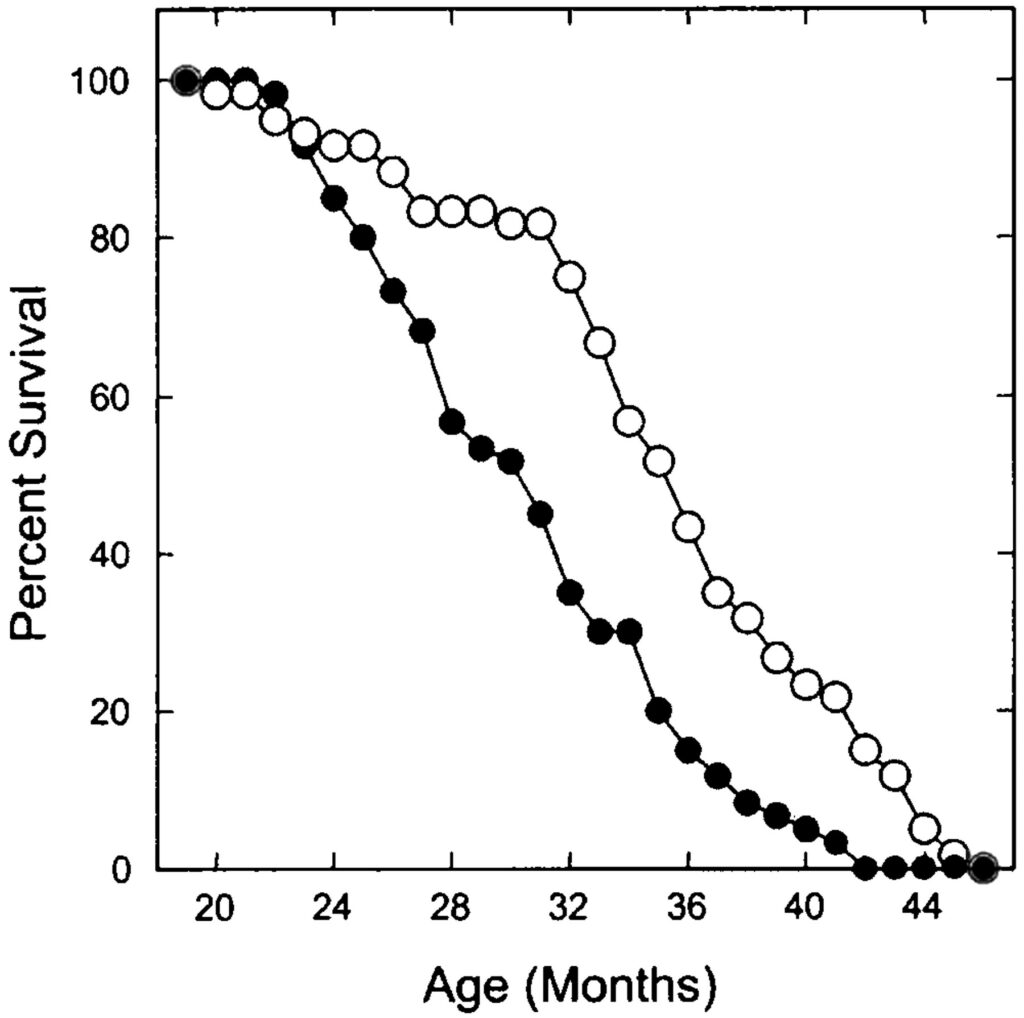
Процент выживаемости мышей в зависимости от возраста в опытах Спиндлера. Белые кружки – мыши, которые питались с ограничением калорий, черные кружки – контрольная группа мышей.
Стоит заметить, что Спиндлер работал с мышами далеко не с момента их рождения. Ученый взял 19-месячных животных (среднего возраста по человеческим меркам): применительно к людям это все равно что взять человека в возрасте слегка за 40 и обеспечить ему доживание до 90 лет.
Однако методы генетического редактирования, конечно, гораздо перспективнее по многим причинам. Во-первых, результаты, которых с их помощью можно добиться, более впечатляющие. Так, Анджей Бартке при помощи методов генетической модификации смог создать мышь, которая прожила 1819 дней – более пяти лет. За свою разработку Бартке и его подопытная получили специальный «приз мыши Мафусаила», названный так в честь библейского долгожителя.
Во-вторых, ограничение питания или прием медикаментов – работа на всю жизнь. А с редактированием генетической информации все просто: один раз поправил, что нужно, и живешь себе дальше. Ну и самое главное: у генной терапии более высокая степень направленности, чем у лекарств, которые проявляют большое количество побочных эффектов.
Нестрашный вирус продлевает жизнь грызунам
Но насколько бы ни был перспективнее подход прямого воздействия на гены, не стоит забывать о необходимости поиска золотой середины. Да, короткие теломеры и неактивная теломераза ведут к быстрому старению, но слишком активная теломераза – это высокие шансы заполучить раковую опухоль. Поэтому задача, стоящая перед учеными, которые занимаются вопросами омоложения и геронтологии, сформулирована так: как активировать работу теломеразного комплекса на ограниченном временном промежутке?
Определенных успехов в этом добилась группа ученых из Испанского национального центра изучения рака под руководством Марии Бласко. Взяв две группы мышей (одно- и двухлетнего возраста соответственно), исследователи вводили им при помощи инъекций ген обратной теломеразной транскриптазы TERT. В качестве векторной основы для попадания этого гена в геном модифицируемого организма был выбран аденоассоциированный вирус (AAV).
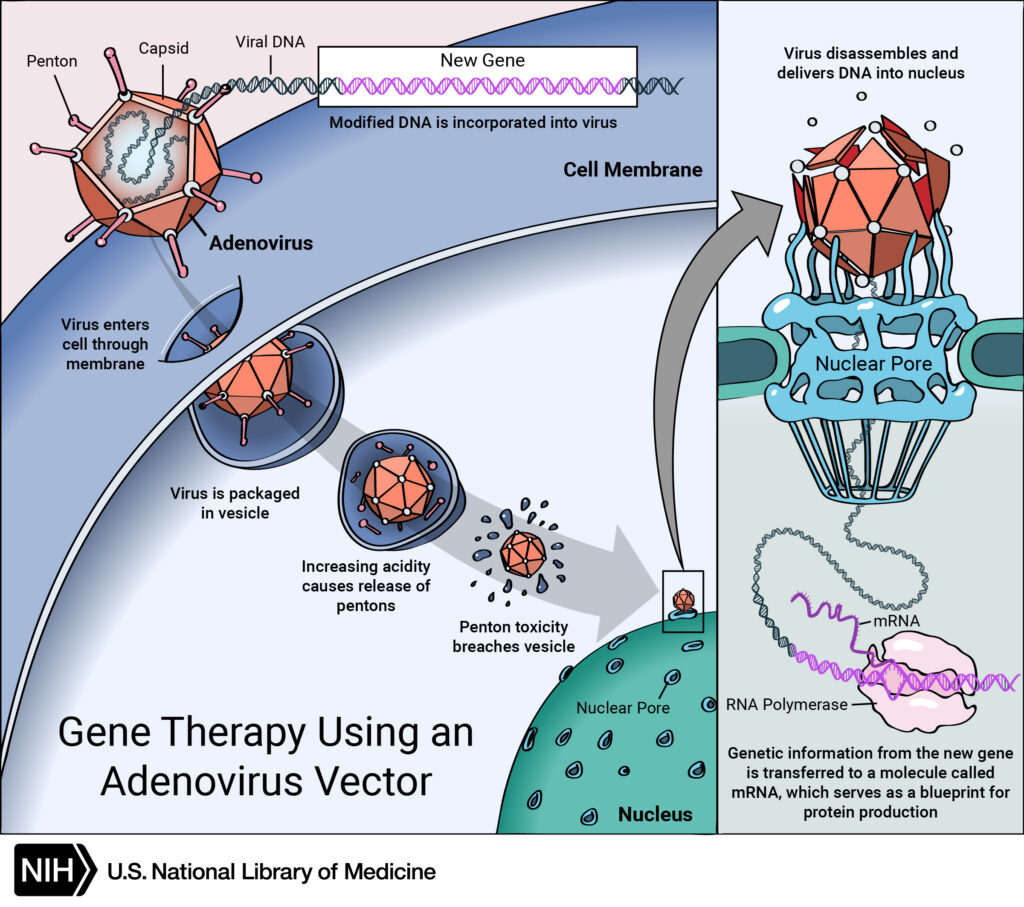
Aденоассоциированный вирус (AAV)
Продолжение следует…..
