Звучит жутковато, но не стоит пугаться: AAV нельзя назвать патогеном, он не вызывает никаких симптомов болезни и провоцирует очень слабый иммунный ответ. К тому же хотя этот вирус и внедряет свои гены в геном хозяина, но весьма предсказуемо, по специфическому сайту, а встраивание в случайные сайты происходит исчезающе редко.
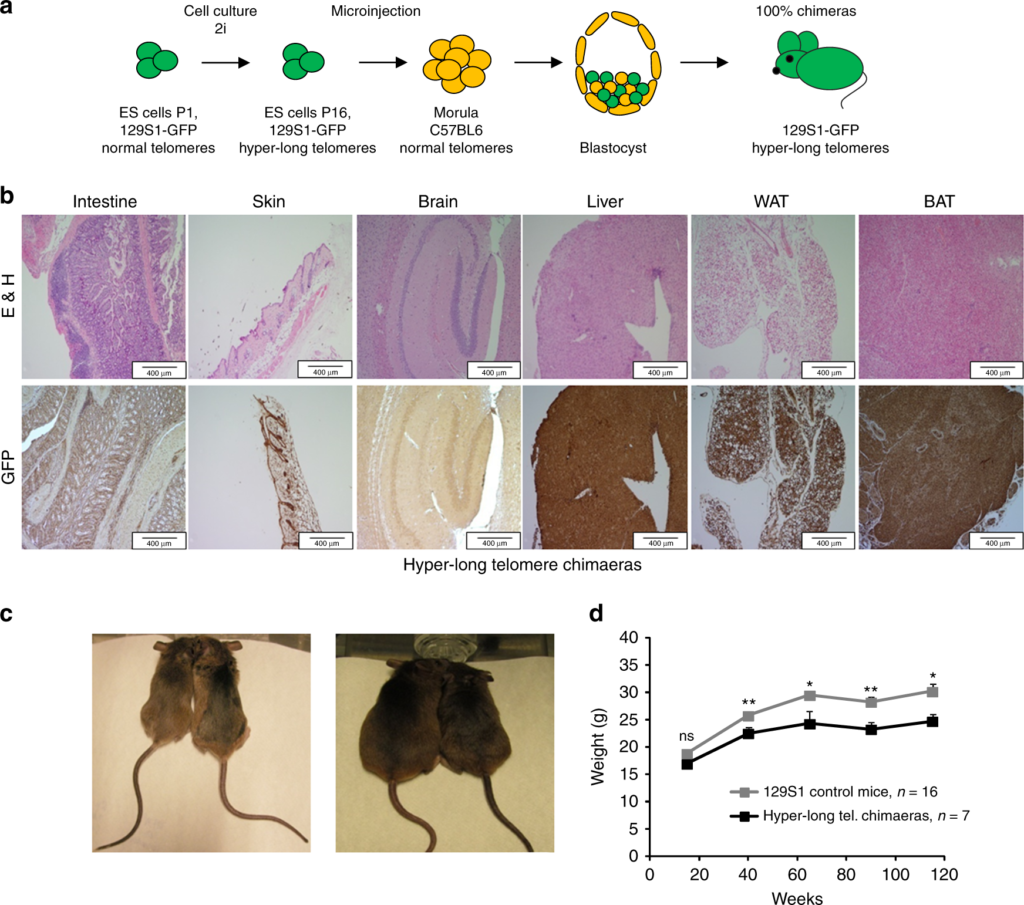
a – схема эксперимента: желтый – клетки обычной мыши, зеленый – флуоресцентные клетки с длинными теломерами; b – флуоресцентные клетки в тканях: верхний ряд – обычная мышь, нижний – мышь с длинными теломерами, красный цвет – окрашивание антителами к флуоресцентному белку; c – более стройная мышь с длинными теломерами рядом с контролем в возрасте 40 и 110 недель, d – динамика веса мышей, серый – контроль, черный – эксперимент. / ©nanonewsnet.ru
Такая терапия, как видно на изображении выше, увеличила продолжительность жизни грызунов на 24% для однолетних мышей и на 13% – для двухлетних. Это не настолько впечатляюще, как результаты, полученные Бартке и Спиндлером, но вполне значимо. Также важно, что в опытах Бласко у мышей, которые получили инъекцию AAV, не наблюдалось повышения онкогенной активности теломеразы по сравнению с контрольной группой животных.
Еще в одном интересном эксперименте ученым удалось «усовершенствовать» теломеры, не повышая при этом онкогенную активность в организме мышей. Испанские исследователи создали грызунов с удлинненными теломерами, воспользовавшись оригинальной методикой. Авторы обратили внимание на то, что наиболее высокая активность теломеразы наблюдается в стволовых клетках в первые дни существования зародыша, а затем постепенно снижается. Отбирая из зародышей стволовые клетки для выращивания в культуре и не давая им дифференцироваться, биологи добились того, что теломераза обеспечила этим клеткам теломеры вдвое длиннее, чем у обычных здоровых мышей.
Затем такие «суперклетки» вводили в зародыши обычных мышей. В результате ученые получили химерных грызунов: в их плаценте и зародышевых оболочках были клетки с короткими теломерами, а весь остальной организм мыши состоял из клеток с удлиненными за счет хвостовых последовательностей хромосомами. Последующие наблюдения показали, что у мышей-химер длина теломер в любом возрасте была хотя бы на четверть длиннее, чем у немодифицированных «ровесников». Притом теломераза в соматических клетках оставалась неактивной.
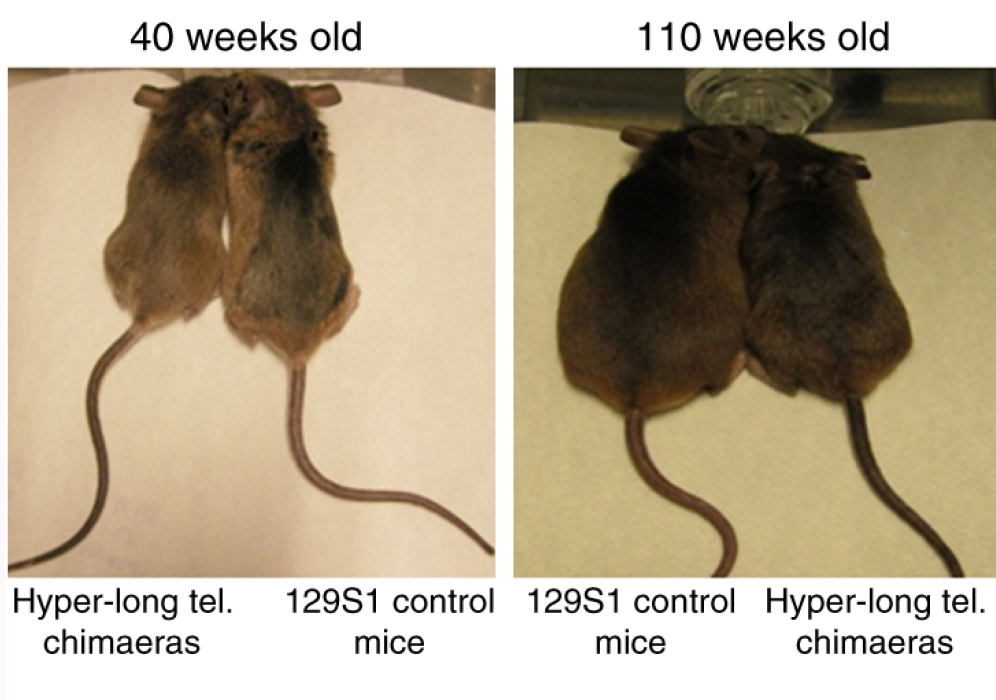
В опыте испанских ученых мыши с более длинными теломерами были стройнее своих собратьев с короткими концевыми последовательностями хромосом. / ©elementy.ru
Такие мыши-химеры были заметно стройнее своих обычных сородичей, в их крови было в несколько раз меньше так называемого плохого холестерина (липопротеинов низкой плотности). А еще модифицированные мыши жили дольше: их средняя продолжительность жизни увеличилась на 13% по сравнению с контрольной группой животных, а максимальная продолжительность – на 8%. К тому же они и раком болели реже, чем мыши из контроля!
Важный биохимический маркер – соматомедин
Конечно, теломераза – вовсе не единственная мишень генетической терапии, способная повлиять на процессы старения. Например, гормон роста, также известный как соматотропин. К подобной идее ученые пришли после того, как оказалось, что есть определенный уровень этого гормона в организме, который соответствует максимальной продолжительности жизни. Если уровень выше или ниже, то риск смерти от всех причин повышается.
Многочисленные эксперименты показали, что удобнее воздействовать не на сам соматотропин, а на один из его посредников – инсулиноподобный фактор роста-1, или же соматомедин. Это вещество секретируется в печени в ответ на стимуляцию соматотропиновых рецепторов этого органа и регулирует секрецию соматотропина и соматостатина.
Как показали опыты ученых из Гетеборгского университета, проведенные в 2012 году, оптимальный уровень соматомедина, обеспечивающий минимальный риск смертности от всех причин, колеблется в диапазоне 105-125 мг/мл. Практически к аналогичным выводам пришли исследователи из США двумя годами позже. Их работа показала, что у людей в возрасте от 50 до 65 лет именно при таком уровне ИФР-1 был отмечен наименьший риск смерти от всех причин.
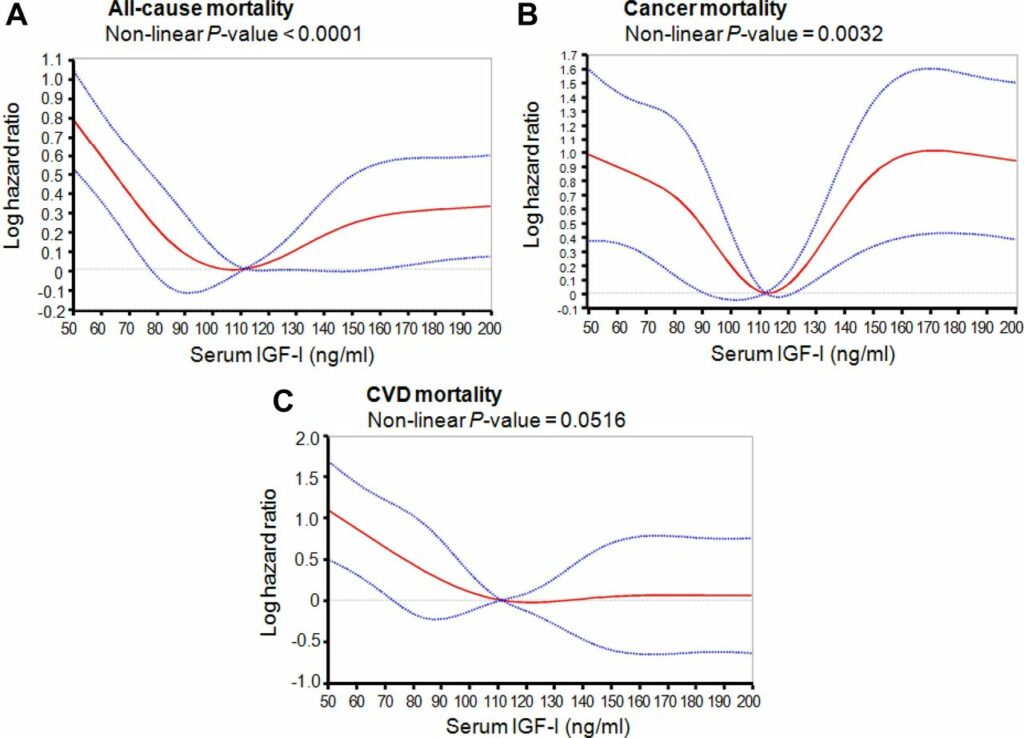
Взаимосвязь смертности от всех причин, от рака и сердечно-сосудистых болезней с уровнем соматомедина в крови / ©thehealthedgepodcast.com
Но повлиять напрямую на уровень медиатора в крови сложно, поэтому в качестве итоговой мишени выбрали ген рецепторов гормонов роста. Технология GHRKO (частичный нокаут генов гормона роста) была опробована на мышах в 2016-2017 годах; эксперименты показали, что продолжительность GHRKO-мышей примерно на треть выше, чем у мышей дикого типа. Кстати, примерно такие же результаты показали грызуны, которых специально держали на диете для снижения уровня соматомедина.
Еще один важный биохимический компонент, способный увеличить продолжительность жизни, – фактор роста фибробластов FGF-21. Эта молекула усиливает поглощение глюкозы адипоцитами, клетками жировой ткани. FGF-21 синтезируется в ответ на недостаток питательных веществ, чтобы помочь приспособиться к голоданию. Среди прочего FGF-21 блокирует гормоны роста, снижая концентрацию соматомедина.
Ну а что там у людей?
Впрочем, выше мы все время пишем о мышах да о мышах – а как же с увеличением срока жизни и отсрочкой старения у людей? Неужели не слышно ни о каких результатах? Тем более что бюджеты ведущих мировых организаций, изучающих борьбу со старением, исчисляются десятками миллионов долларов в год.
Почему-то методики, которые дают хорошие результаты у мышей (а также у других короткоживущих существ – вроде червей или мух), на приматах уже не работают. В частности, стоит упомянуть два довольно крупных исследования, которые стартовали в США в конце 1980-х. В них ученые исследовали влияние 30-процентного ограничения калорий в рационе на продолжительность жизни макак-резусов.
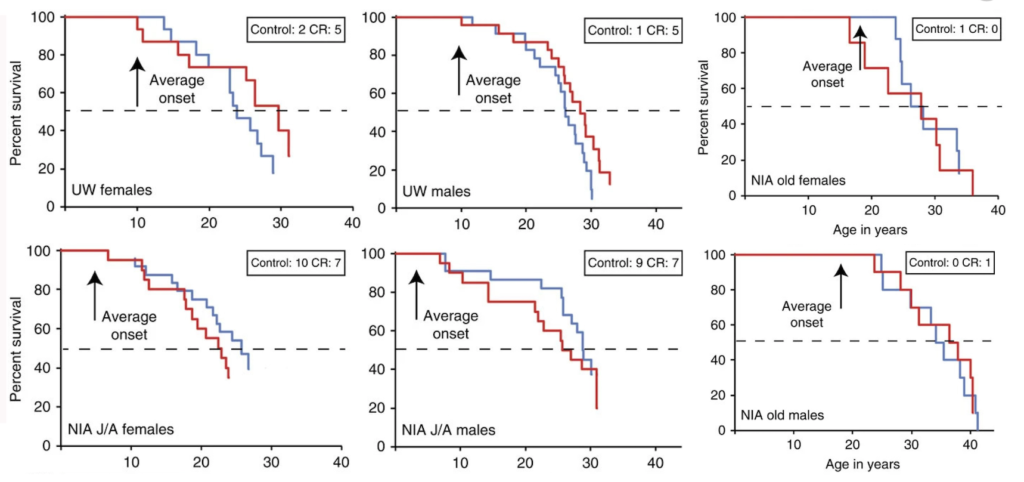
Процент выживаемости макак-резусов в зависимости от возраста подопытных животных. График красного цвета показывает животных, к которым применялось ограничение калорий, график синего цвета – обезьян из контрольной группы. / ©habr.com
В 2017 году по этим двум исследованиям была опубликована обзорная статья в Nature под названием Caloric restriction improves health and survival of rhesus monkeys («Ограничение калорий улучшило здоровье и выживаемость макак-резусов»). Но не ищите там ничего обнадеживающего и сверхъестественного: улучшение ограничивается пятью процентами.
А что насчет теломеразы? Пожалуй, самый известный эксперимент на эту тему – опыт, который американка Элизабет Пэрриш поставила… сама на себе. В 2015 году Пэрриш ввела себе два вектора на основе AAV: первый содержал ген теломеразы TERT, а второй – ген фоллистатина, стимулятора мышечного роста и антагониста миостатина (до этого фоллистатин успешно испытывали на людях с мышечной дистрофией). На подобное Пэрриш вдохновили результаты, полученные ранее группой Бласко на мышах.

Элизабет Пэрриш / ©futurecollector.com
Продолжение следует…
