Большая часть молекул глюкозы в клетках человека депонируется в форме высоко разветвленного полимера — гликогена («животного крахмала»). В паренхиме почек в физиологических условиях концентрации этого полисахарида очень низкие, близкие к следовым. Однако при гипергликемии количество гликогена значительно повышается. Морфологически в эпителии проксимальных канальцев обнаруживаются поражения Армани-Эбштейна. Они были впервые описаны Luciano Armanni в 1872 году и характеризуются более светлой цитоплазмой пораженных клеток за счет вакуолизации и накопления гликогена (рис. 1). Гистохимически гликоген обнаруживается с помощью PAS-реакции (Periodic Acid Shiff reaction, синоним – ШИК-реакция). Ее принцип — окисление гликольных групп в молекуле гликогена под воздействием йодной кислоты с образованием альдегидных соединений, легко реагирующих с реактивом Шиффа (фуксин-сернистая кислота) [1].
Накопление почечного гликогена на начальных этапах диабетической нефропатии отмечается непосредственно после приема пищи, когда уровень гликемии составляет около 24 ммоль/л. После 24-часового голодания, когда концентрации глюкозы в крови снижается до 7 ммоль/л, уровень гликогена сравним с таковым в «недиабетических» почках. Однако с прогрессированием заболевания уровень гликогена в почках уже не реагирует на однодневное голодание, оставаясь стабильно высоким.
Гликоген накапливается преимущественно в клетках толстой части восходящего колена петли Генле и дистальных извитых канальцев. Эти компартменты нефрона расположены после проксимальных канальцев и в значительной степени зависят от уровня метаболизма глюкозы как основного источника энергии, которая далее расходуется на работу АТФ-азы для обеспечения процессов реабсорбции. Именно в этом участке наблюдаются поражения Армани-Эбштейна (цитоплазматические включения гликогена), также отмечены случаи скопления гликогена в ядрах единичных клеток. У пациентов с длительным течением сахарного диабета поражению подвергаются также и проксимальные канальцы [2].
При стойкой гипергликемии происходит активация неферментативного гликозилирования белков — реакция химической конденсации белка с моносахаридом (глюкозой) с последующими изменениями этого соединения. Этот процесс приводит к резкому изменению свойств белков. Например, в интиме сосудов неконтролируемое гликозилирование белковых молекул обусловливает снижение эластичности сосудистой стенки (фактор ухудшения диабетической ангиопатии). Гликозилированный гемоглобин HbA1C, уровень которого повышен при сахарном диабете, при точном соответствии аминокислотного состава гемоглобину взрослого человека, обладает повышенным сродством к кислороду. Роль почечного гликогена в гликировании белков неоднозначна. С одной стороны, при стабильно высоком уровне гликемии запасание глюкозы лишает реакцию субстрата и несколько снижает уровень гликозилирования белков. Но при низком уровне глюкозы в крови почечный гликоген может служить источником новых молекул глюкозы [3].
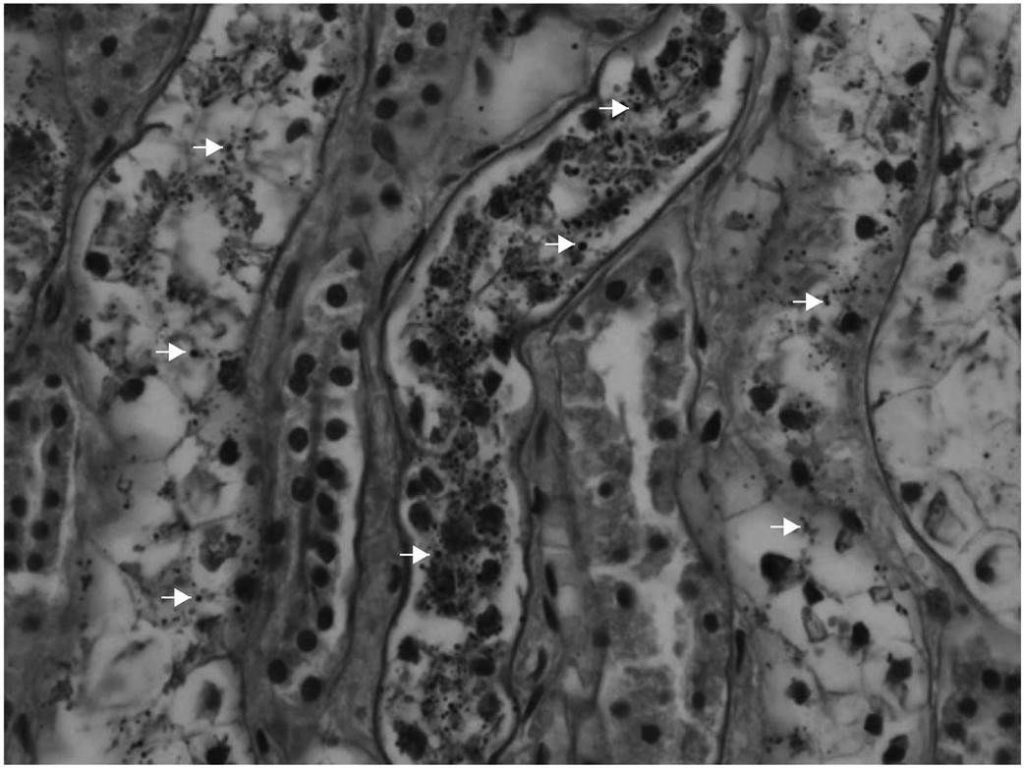
Рисунок 1. Морфологический паттерн гликоген-опосредованного повреждения почек.
Поражения Армани-Эбштейна появляются в виде PAS-позитивных цитоплазматических включений (белые стрелки на рисунке) в почечных эпителиоцитах, расположенных преимущественно в дистальных канальцах и толстой части восходящего колена петли Генле [1].
В накоплении гликогена играют роль дефекты ферментов, ответственных за его синтез и расщепление. При сахарном диабете отмечено повышение активности гликогенсинтазы, снижение активности гликогенфосфорилазы (фермент, обеспечивающий расщепление гликогена) и повышение уровня гликогенина (димерный белок, праймер для синтеза новых молекул гликогена с гликозилтрансферазной активностью), что в совокупности способствует запасанию гликогена. Регуляция концентрации этих молекул может стать значимым компонентом нефропротективной терапии. Обнаружено, что антифиброзный агент FT011 уменьшает экспрессию гликогенина, нарушая трансляцию на мРНК, что снижает уровень почечного гликогена при гипергликемии [4].
Значение гликогена в повреждении почечной паренхимы при сахарном диабете определяется его конформационными превращениями (рис. 2) [2]. Наличие большого количества ветвлений и небольшая длина цепочек (12–18 глюкозных остатков) в молекуле обеспечивает быстрое высвобождение концевых мономеров при распаде гликогена.
Образование более длинных цепочек глюкозы в гликогене снижает скорость его деградации, а наличие сверхдлинных цепей и вовсе приводит к его патологическому накоплению в клетках. Длинные цепи образуют нерастворимые двойные спирали, которые со временем осаждаются и теряют способность отщеплять накопленную глюкозу. Такие полимеры глюкозы называются полиглюкозанами и обнаруживаются при различных гликогенопатиях. Например, миоклонус-эпилепсия Лафоры, при которой мутации в генах лафорина и малина, участвующих в обмене гликогена, приводят к накоплению его в виде нерастворимого полиглюкозана — телец Лафоры. Болезнь Андерсена (амилопектиноз, гликогеноз IV типа) характеризуется недостаточностью амило-1,4:1,6-глюкантрансферазы (гликоген-ветвящего фермента), что также приводит к избыточному накоплению в различных тканях (печени, селезенке, лимфоузлах, в меньшей степени — в миокарде, слизистой оболочке кишечника) аномального полисахарида с амилопектиноподобной структурой, что повреждает клетки. Аналогичные перестройки молекулы гликогена рассматриваются как возможный механизм поражений Армани-Эбштейна крайней степени [5].
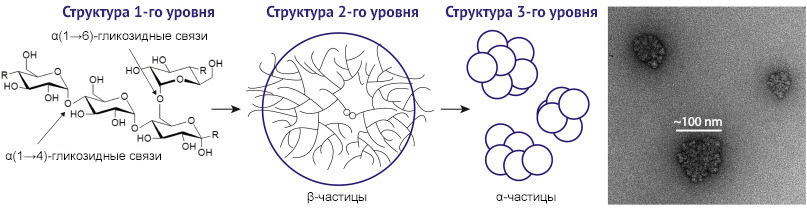
Рисунок 2. Три уровня структурной организации молекулы гликогена.
Первый уровень — α(1→4)-гликозидные связи между отдельными молекулами глюкозы в линейных участках. Эти связи образуют древовидную структуру с новыми точками ветвления, образованными α(1→6)-гликозидными связями. Удлинение гликогеновой цепи осуществляется ферментом гликогенсинтазой, разветвление — ферментом амило-1,4:1,6-глюкантрансферазой (гликоген-ветвящий или бранчинг фермент). В итоге формируется биологическая макромолекула из около 50000 остатков глюкозы — β-частица (2 уровень организации). β-частицы имеют схожую со сферической форму и выявляются внутри клеток с помощью электронной микроскопии (их диаметр около 20–30 нм). В некоторых тканях, таких как печень и миокард, обнаружен третий уровень структурной организации гликогена: β-частицы объединяются в более крупные и сложные α-частицы диаметром около 200 нм, что сопоставимо с размером небольшой лизосомы. Данные просвечивающей электронной микроскопии образца печени крысы: α-частицы молекул гликогена [2].
Накопление почечного гликогена играет определенную роль в патогенезе сахарного диабета. Изучается его значение как механизма компенсации гипергликемии и ее деструктивных эффектов как на системном, так и на органном уровне (уменьшение неферментативного гликозилирования белков). При этом гликогеновые включения (с измененной структурой макромолекулы гликогена) в цитоплазме и в отдельных случаях в ядрах клеток приводят к резкому прогрессированию диабетической нефропатии и терминальной хронической почечной недостаточности.
Список литературы:
1. Zhou C., Yool A.J., Byard R.W. Armanni–Ebstein lesions in terminal hyperglycemia. J Forensic Sci. 2017; 62: 921–925.
2. Sullivan M.A. et al. Glucose and glycogen in the diabetic kidney: Heroes or villains? EBioMedicine. Published online: August 10, 2019.
3. Ellingwood S. S. , Cheng A. Biochemical and clinical aspects of glycogen storage diseases. J Endocrinol. 2018;238(3):131-141
4. Lau X. et al. Attenuation of Armanni–Ebstein lesions in a rat model of diabetes by a new anti-fibrotic, anti-inflammatory agent, FT011. Diabetologia. 2013;56 (3):675-679.
5. Sullivan M.A. et al.Skeletal Muscle Glycogen Chain Length Correlates with Insolubility in Mouse Models of Polyglucosan-Associated Neurodegenerative Diseases. Cell reports. 2019;27(5):1334-44.
