А.А. Глибка1 *, Г.А. Мельниченко1 , М.С. Михина1 ,
Н.В. Мазурина1 , Г.Ю. Харкевич2
1 Национальный медицинский исследовательский центр эндокринологии, Москва, Россия
2 Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина, Москва, Россия
Актуальность
В 2018 г. James P. Allison и Tasuku Honjo была присуждена Нобелевская премия мира по медицине за открытие принципиально нового подхода в лечении злокачественных новообразований [1]. Противоопухолевый эффект данного вида иммунотерапии реализуется через блокирование контрольных сигнальных путей CTLA-4 (цитотоксический Т-лимфоцит-ассоциированный протеин 4), PD-1 (белок запрограммированной клеточной гибели-1) и PD-L1 (лиганд рецептора запрограммированной клеточной гибели-1), что приводит к усилению противоопухолевой активности иммунной системы и сопровождается улучшением показателей общей выживаемости при целом ряде опухолей [2].
Изучение механизмов регуляции иммунного контроля привело к созданию нового класса иммуноонкологических препаратов — ингибиторов контрольных точек иммунного ответа (immune checkpoint inhibitors; ИКТИО). Впервые ИКТИО были одобрены FDA в 2011 г. для лечения метастатической меланомы — анти-CTLA-4-моноклональное антитело (ипилимумаб). В 2014 г. были одобрены FDA два препарата из подгруппы анти-PD-1-моноклональных антител (ниволумаб и пембролизумаб), а уже в 2016 г. — три препарата из подгруппы анти-PD-L1-моноклональных антител (атезолизумаб, авелумаб и дурвалумаб). В РФ регистрация всех этих препаратов происходила в 2016–2019 гг. [3]. Спектр онкологических заболеваний, для которых одобрено использование ИКТИО, непрерывно увеличивается.
Использование данного типа противоопухолевой иммунотерапии сопровождается риском (через модуляцию Т-лимфоцитов) развития иммуноопосредованных нежелательных явлений (иоНЯ). Эндокринные иоНЯ по частоте выявления занимают 3-е место, уступая лишь поражениям кожи и желудочно-кишечного тракта [2, 4]. Более редкими видами иоНЯ являются поражение нервной системы, печени, легких и других органов. На сегодняшний день выделяется ассоциация между определенной подгруппой ИКТИО и пораженным органом эндокринной системы. Так, при использовании анти-CTLA-4-моноклонального антитела чаще встречаются гипофизиты (особенно у пожилых мужчин), а при лечении анти-PD-1-моноклональными антителами — дисфункции щитовидной железы. Такие иоНЯ, как сахарный диабет, гипопаратиреоз, поражение гонад, развиваются крайне редко, что не позволяет на данном этапе отследить их взаимосвязь с определенной подгруппой ИКТИО.
Все иоНЯ описываются в соответствии с классификацией CTCAE (Common Terminology Criteria for Adverse Events) от наиболее легкой степени (1) до крайне тяжелой (4) и регистрации летального исхода вследствие выраженного иоНЯ (5) [5]. Чаще встречаются эндокринные иоНЯ 1–2-й степени [2].
С учетом тяжести проявлений основного онкологического заболевания, стертой клинической картины иоНЯ [6, 7], быстро прогрессирующего течения (в отличие от классических аутоиммунных заболеваний эндокринной системы) [8], необратимости поражения [7, 8] и, в ряде случаев, жизнеугрожающего характера (например, гипофизит с развитием вторичной надпочечниковой недостаточности, микседематозная кома, тяжелый тиреотоксикоз, фульминантный сахарный диабет, адреналит) [6], необходимо своевременное выявление эндокринных иоНЯ. Полноценно назначенная терапия дает возможность продолжить иммунотерапию ИКТИО основного заболевания в полном объеме, а также улучшает качество жизни пациента [6, 9].
Далее представлен клинический случай пациентки, у которой развилось несколько иоНЯ после 3 внутривенных введений лекарственного препарата из подгруппы анти-PD-1-моноклональных антител (пембролизумаб) в качестве адъювантной иммунотерапии после удаления метастазов меланомы кожи левой стопы в паховых лимфоузлах (pT2aN1aM0 St IIIa, BRAF mut).
Описание случая
Пациентка О., 34 лет, поступила в стационар НМИЦ эндокринологии с жалобами на общую слабость, нестабильные показатели гликемии (от 2,9 до 17,0 ммоль/л), утомляемость, жажду, эпизоды гипогликемий (3–4 раза в неделю) и приливов.
Из анамнеза (anamnesis morbi) известно, что в 2018 г. при проведении педикюра выявлено пигментное образование в пяточной области в виде черного пятна с кровяными вкраплениями размером до 0,3 см. Данное образование не беспокоило, но постепенно увеличивалось в размерах.
В апреле 2019 г. пациентка заметила дефект тканей и кровоточивость (в утренние часы и во время ходьбы). В связи с онкологической настороженностью обратилась к врачу. При осмотре на коже стопы по внутренней поверхности определялось: экзофитное образование, многослойное, с наличием гиперкератоза, роговых масс, активно кровоточащее при удалении кератоза, край пигментирован (гемосидерин в мицелии), до 6 мм в диаметре. При цитологическом исследовании соскоба с поверхности образования кожи: кровь, роговые массы, немногочисленные нейтрофильные лейкоциты и лимфоциты, клетки многослойного плоского эпителия без атипии. Ввиду полученных данных (отсутствия опухолевых клеток в соскобе и типичной пигментной сети в образовании, наличия гиперкератоза и слоистости процесса, присутствия визуально гемосидерина в мицелии) процесс рассматривался как очаговый микоз, был рекомендован прием противогрибковых препаратов в течение 2 нед.
Однако в последующие месяцы был отмечен медленный рост экзофитного компонента образования. Летом 2019 г. выполнена тотальная биопсия фрагмента кожи левой стопы с изъязвлениями и некрозом с последующим гистологическим подтверждением меланомы кожи на медиально-подошвенной поверхности средней трети левой стопы: эпителиоидно- и невоклеточная узловая меланома кожи стопы со скудным пигментом, большим числом митозов, выраженной лимфоидной инфильтрацией (уровень инвазии по Кларку 3–4, толщина опухоли по Бреслоу — 1,2 мм), в краях резекции опухолевые клетки не определялись. Вторым этапом проведена реэксцизия послеоперационного рубца с комбинированной пластикой дефекта кожным лоскутом на сосудистой ножке и свободным кожным лоскутом из области верхней трети левого бедра, а также биопсия сторожевого лимфоузла. В 1 и 3 сигнальных лимфоузлах выявлен метастаз беспигментной, эпителиоидноклеточной меланомы с высокой митотической активностью (12 митозов на 1 мм2 ), 0,3 см в наибольшем измерении, без выхода за пределы капсулы в узлах. В опухоли также выявлена мутация BRAF с.1799Т>А (р.V600E).
По данным компьютерной томографии (КТ) органов грудной клетки, брюшной полости и малого таза, магнитно-резонансной томографии (МРТ) головного мозга, остеосцинтиграфии данных за отдаленные метастазы не получено.
Осенью 2019 г. пациентке начата адъювантная иммунотерапия ингибиторами контрольных точек иммунного ответа. Проведено три введения пембролизумаба 1 раз в 3 нед. Первое введение препарата (150 мг) пациентка перенесла удовлетворительно, однако начала ощущать нехватку воздуха (постоянно открывала окна для проветривания, выходила на свежий воздух, ночью спала только с открытыми окнами). После 2-го введения (200 мг) отметила ухудшение самочувствия через 16 сут: появились сильная головная боль, тошнота, перепады в аппетите (гипорексия, затем гиперорексия), изменение вкусовых ощущений (гипогевзия, затем гипергевзия), слабость, сонливость, переходящая в бессонницу, повышенная утомляемость, эпизоды раздражительности, сменяющиеся апатией. После 3-го введения пембролизумаба (200 мг) к усилившимся указанным ранее симптомам добавились следующие: сухость во рту и на кожных покровах, полидипсия, нарушение зрения, зуд во влагалище, трудности в концентрации внимания. Самостоятельно измерила гликемию — 15,3 ммоль/л. Иммунотерапия пембролизумабом отменена.
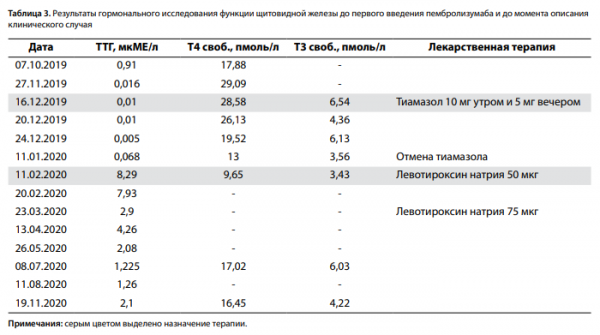
В декабре 2019 г. пациентка была госпитализирована в эндокринологический стационар областной больницы, где выставлен диагноз «сахарный диабет 1 типа» с учетом наличия кетонурии+++, уровней гликозилированного гемоглобина (НbА1с) — 7,5% и С-пептида — 0,01 нг/мл (1,1–4,4) и инициирована интенсифицированная базис-болюсная инсулинотерапия (инсулины гларгин и аспарт). Обучение пациентки не проводилось, несмотря на титрацию доз инсулина сохранялась выраженная гипергликемия до 18,0 ммоль/л, в связи с чем по месту жительства проведена смена инсулинов на деглудек и глулизин. В ходе госпитализации также выявлен тиреотоксикоз: тиреотропный гормон (ТТГ) 0,01 мкМЕ/мл, свободный тироксин (Т4 своб.) 28,58 пмоль/л, свободный трийодтиронин (Т3 своб.) 6,54 пмоль/л, антитела (АТ) к тиреопероксидазе (ТПО) 0,8 МЕ/мл (0–9,0), АТ к рец. ТТГ 0,45 МЕ/мл (0–1,75). УЗИ щитовидной железы: общий объем 12,9 см3 , структура однородная, эхогенность умеренно сниженная, при цветном допплеровском картировании (ЦДК) кровоток в паренхиме не изменен, узловых образований и увеличенных лимфоузлов не выявлено. Состояние было расценено как тиреотоксикоз, назначен тиамазол 10 мг утром и 5 мг вечером.
Тогда же проводилось контрольное обследование по поводу основного (онкологического) заболевания. КТ органов грудной клетки и брюшной полости с внутривенным контрастированием — без вторичной патологии. При УЗИ: в проекции левой пятки в области послеоперационного рубца определялся инфильтрат (26×46 мм) с эхонегативными включениями, рядом идентичный инфильтрат (до 17 мм). Мультиспиральная КТ левой стопы: в мягких тканях левой пяточной области участок уплотнения до 28×16×17 мм. Выполнена биопсия образования левой пяточной области: в мазках на фоне крови и бесструктурной субстанции фрагменты соединительной ткани, разрозненные немногочисленные мелкие мономорфные клетки мезенхимальной природы, вероятно, фибропластического ряда без признаков атипии — опухолевых элементов в пределах доставленного материала не обнаружены. УЗИ мягких тканей и периферических лимфоузлов: признаки незначительной гиперплазии левого пахового лимфоузла. Был рекомендован динамичный контроль.
В течение 1 мес пациентка принимала указанную дозу тиамазола, который затем был отменен: ТТГ 0,068 мкМЕ/мл (0,27–4,2), Т4 своб. 13,0 пмоль/л (10,8–22), Т3 своб. 3,56 пмоль/л (3,1–6,8), АТ к ТПО 13,26 МЕ/мл (0–34). УЗИ щитовидной железы: общий объем 11,15 см3 , структура однородная, с единичными фолликулами (до 15 мм), эхогенность обычная, увеличенных лимфоузлов шеи не выявлено.
В феврале 2020 г. обратилась в НМИЦ эндокринологии амбулаторно с жалобами на значительные колебания гликемии в течение дня (от 2,9 до 17,0 ммоль/л), также предоставила результаты анализов: ТТГ 8,290 мкМЕ/мл (0,27–4,2), Т4 своб. 9,65 пмоль/л (10,8–22), Т3 своб. 3,43 пмоль/л (3,1–6,8), АТ к ТПО 12 МЕ/мл (0–34) — состояние расценено как деструктивный тиреоидит, гипотиреоидная фаза. Пациентка была госпитализирована для дообследования, подбора необходимой терапии и обучения.
По данным анамнеза (anamnesis vitae) известно, что с раннего детства были трудности при плановой вакцинации (развитие аллергической реакции в виде кашля), затем постепенно развился астматический компонент на сырость (наблюдалась у пульмонолога). В 6 лет — аденоидэктомия; в 2006 г. — ДТП с переломом левой лодыжки (лечение — гипсовая повязка).
Аллергическая реакция на витамины группы С (дерматит); бытовую химию (контактный дерматит); цветение, пыль, сырость (ринит + астматический компонент).
Наследственность: у матери — гиперплазия эндометрия при менопаузе, ожирение 2 степени; у отца — хроническая венозная недостаточность (оперативное лечение); у бабушки (по отцу) — резекция щитовидной железы (по поводу зоба), ожирение 2 степени, гипертоническая болезнь (ГБ), ишемическая болезнь сердца (ИБС), инфаркт миокарда (ИМ), сахарный диабет (СД) 2 типа (диета), панкреатит (панкреонекроз — причина смерти); у дедушки (по отцу) — ГБ, ИБС, СД 2 типа (гликлазид + диета), панкреатит, ИМ (4 раза, причина смерти — обширный ИМ); у бабушки (по матери) — ГБ, хроническая сердечная недостаточность, острое нарушение мозгового кровообращения; у двоюродной сестры (по отцу) — рак яичника (односторонняя овариэктомия + химиотерапия), ремиссия более 5 лет; у двоюродного дедушки и бабушек (по отцу) — СД 2 типа.
Гинекологический анамнез — трое родов: 2003 г. — естественные роды (здоровый сын, 60 см, 4230 г); 2013 г. — естественные роды (здоровый сын, 57 см, 3960 г); 2016 г. — лапароскопическая аппендэктомия на сроке 22–23 недели, затем антенатальная гибель плода на сроке 28–29 недель, роды, мертворожденный сын (результаты гистологии — лейкоцитарный плацентит); абортов нет.
При осмотре вес 72 кг, рост 162 см, ИМТ 27,2 кг/м2 . В области послеоперационной раны (по медиальной поверхности свода левой стопы) — рубец бледно-розового цвета без признаков воспаления, с признаками приживления трансплантата. Менструальный цикл не нарушен, со слов. По органам и системам без особенностей.
При лабораторном обследовании: НbА1с 8,3%; гемоглобин 104 г/л (112–153); гематокрит 32,6% (35–46); эритроциты 3,76×1012 кл/л (3,8–5,2); С-пептид 0,01 нг/мл (1,1–4,4); ТТГ 2,493 мМЕ/л (1,1–4,4); креатинин 65,4 мкмоль/л (50–98) — скорость клубочковой фильтрации (СКФ) по формуле CKD–EPI 105,73 мл/мин/1,73 м2 ; Са общ. 2,3 ммоль/л (2,15–2,55); общий холестерин 4,7 ммоль/л (3,3–5,2); липопротеины низкой плотности (ЛПНП) 3,079 ммоль/л (1,1–3); липопротеины высокой плотности 1,143 ммоль/л (1,15–2,6); триглицериды 0,72 ммоль/л (0,1–1,7).
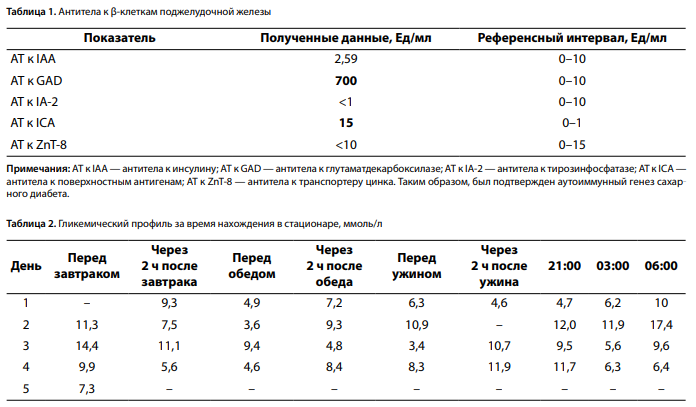
До момента госпитализации в НМИЦ эндокринологии аутоантитела к антигенам поджелудочной железы не исследовались, поэтому было принято решение о проведении серологического исследования крови для дифференциальной диагностики типа СД (табл. 1) [10].
Также пациентка была консультирована кардиологом. По данным ХМ-ЭКГ зарегистрировано: 18 000 одиночных мономорфных желудочковых экстрасистол (ST-T без диагностически значимой динамики), был рекомендован прием метопролола сукцината 25 мг утром.
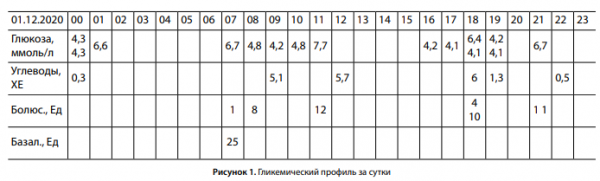
Во время госпитализации осуществлен подбор дозы продленного инсулина, а также углеводных коэффициентов и фактора чувствительности к инсулину, проведено индивидуальное обучение основным принципам достижения целевых показателей гликемии. Благодаря тщательному мониторингу гликемии (9 раз в сутки) выявлен феномен «утренней зари» и был дополнительно назначен инсулин глулизин в дозе 1 Ед (табл. 2).
Учитывая развитие СД [6, 8, 9, 13–15] как иоНЯ после терапии ИКТИО (в нашем случае пембролизумаба), было принято решение о кодировании СД по МКБ-10: Е13.9. Другие уточненные формы сахарного диабета без осложнений.
Итоговый диагноз сформулирован следующим образом: Сахарный диабет вследствие терапии ингибиторами иммунного ответа по поводу меланомы кожи. Деструктивный тиреоидит, гипотиреоидная фаза, медикаментозная компенсация. Меланома кожи левой стопы pT2aN1aM0 St IIIa. Иссечение от 17.07.2019 г., 21.08.2019 г. — реэксцизия послеоперационной раны на коже левой стопы с комбинированной пластикой дефекта (лоскутом на сосудистой ножке и свободным кожным лоскутом) с биопсией сторожевого лимфатического узла (БСЛУ). Состояние на фоне иммунотерапии пембролизумабом с 18.10.2019 г. — 3 сеанса. Мутация BRAF V600E. Анемия легкой степени тяжести. Индивидуальный целевой уровень HbA1c<6,5%.
При выписке из стационара пациентке было рекомендовано: инсулин деглудек 23–25 Ед в 8.00; инсулин глулизин 4–12 Ед (углеводный коэффициент: 1 ХЕ:2 ЕД перед завтраком, 1 ХЕ:1,5 Ед перед обедом, 1 ХЕ:1 Ед перед ужином, 1 ХЕ:1,5 Ед после 21.00; дополнительно 1 Ед в 5.00; ФЧИ (фактор чувствительности к инсулину) 2,5 ммоль/л/Ед); левотироксин натрия 50 мкг (контроль ТТГ через 4–6 нед); метопролола сукцинат 25 мг утром; осуществление самоконтроля гликемии не менее 4 раз в сутки; количественная оценка углеводов по системе «хлебных единиц»; описана регулярность динамического обследования, а также дообследование по выявленной анемии и дислипидемии.
Неоднократно была консультирована онкологами на предмет необходимости возобновления адъювантной терапии пембролизумабом — с учетом отсутствия прогрессирования основного онкологического заболевания принято решение о воздержании от применения ИКТИО.
В течение 1 мес принимала метопролола сукцинат 25 мг утром, затем еще через 1 мес повторно проведено ХМ-ЭКГ и зарегистрировано: 506 одиночных мономорфных желудочковых экстрасистол, 7 эпизодов бигеминии (ST-T без диагностически значимой динамики) — терапия отменена.
Через 4 мес после описанной нами госпитализации и через 7 мес после последней инфузии пембролизумаба у пациентки О. развилась витилигоподобная гипопигментация под нижней губой и в области промежности.
На момент написания клинического случая пациентка О. достигла околоцелевых показателей гликемии: НbА1с 7,5% (рис. 1).
Гипотиреоз медикаментозно компенсирован: ТТГ 2,1 мкМЕ/мл (0,27–4,2), Т4 своб. 16,45 пмоль/л (10,8–22), Т3 своб. 4,22 пмоль/л (3,1–6,8). Амбулаторно проводилась коррекция дозы левотироксина натрия (табл. 3 и рис. 2).
С целью лечения железодефицитной анемии осуществляется терапия пероральным железосодержащим препаратом: гемоглобин 120 г/л (120–180), гематокрит 34,1% (36–56), эритроциты 3,94×1012 кл/л (3,8–5,3); сывороточное железо 12,8 мкмоль/л (7–31).
Обсуждение
В описанном нами клиническом случае можно наблюдать гиперергический иммунный ответ, который привел к развитию нескольких иоНЯ с одномоментной манифестацией. Однако если в случае с витилиго при меланоме можно говорить о формировании хорошего ответа на ИКТИО (возможном увеличении чувствительности меланоцитов [2]), а значит, и увеличении общей и безрецидивной выживаемости [11], то причина развития эндокринных поражений неясна. Однако такая витилигоподобная депигментация отличается от классического витилиго (последнее локализуется в фотоэкспонированных участках, и наблюдается феномен Кебнера) [12].
Медиана дебюта эндокринных иоНЯ определяется в диапазоне 7–20 нед [6] от первого введения ИКТИО. У нашей же пациентки впервые выраженная гипергликемия была выявлена на 6-й неделе от начала иммунотерапии: перед каждым введением препарата проводился биохимический анализ крови и наблюдалась нормогликемия (5,0 ммоль/л). Одновременно с СД был диагностирован тиреотоксикоз. При этом до первого введения пембролизумаба функция щитовидной железы не была нарушена (ТТГ 0,91 мкМЕ/мл, Т4 своб. 17,88 пмоль/л).
Стоит отметить, что первой линией в лечении самых разнообразных иоНЯ является назначение глюкокортикоидов. Супрафизиологические дозы, необходимые для купирования побочного процесса, потенциально могут вызвать или усугубить уже имеющуюся гипергликемию. Поэтому оправданным является контроль глюкозы крови при каждом введении ИКТИО и лечении по поводу любого другого иоНЯ [6, 13]. Инициация инсулинотерапии у пациентов с иммуноопосредованным СД не вызывает сомнений, ведение осуществляется по принятым стандартам и клиническим рекомендациям [6].
Решение о назначении тиреостатиков таким пациентам, несмотря на лабораторно подтвержденный тиреотоксикоз, является правомочным при подтверждении болезни Грейвса [6]. Наиболее частым вариантом тиреоидной патологии при использовании ИКТИО является деструктивный тиреоидит с преходящим тиреотоксикозом [6, 8, 14], и целесообразным будет назначение терапии глюкокортикоидами.
Назначение тиреостатиков у таких пациентов (с лабораторно выявленным тиреотоксикозом) не рекомендуется [6] до проведения визуализирующих методов диагностики (УЗИ щитовидной железы, сцинтиграфия) и подтверждения развития болезни Грейвса: возможно усиление цитолитического процесса и усугубление тиреотоксикоза.
Перед назначением левотироксина натрия у пациентов, которым проводилась или проводится терапия ИКТИО, при наличии неспецифических симптомов (выраженная слабость, сонливость, рвота и пр.) или косвенных биохимических лабораторных данных (гипонатриемия, гипогликемия) желательно определение кортизола крови в утренние часы [6, 8, 9] для исключения первичной (крайне редкой) или вторичной (более частой при развитии гипофизита) надпочечниковой недостаточности. В описываемом случае признаков гипокортицизма не наблюдалось.
Сходный клинический случай был представлен Hakami в 2019 г. [13] — развитие СД 1 типа и гипотиреоза у 52-летнего мужчины на фоне монотерапии пембролизумабом. При этом впервые поражение щитовидной железы (тиреотоксикоз, ТТГ 0,09 мМЕ/л) развилось после второго введения препарата с последующим формированием стойкого гипотиреоза (АТ к ТПО отрицательные) после пятого введения пембролизумаба. СД с тяжелым диабетическим кетоацидозом развился через 2 нед после седьмой инфузии анти-PD-1-моноклонального антитела с характерной клинической картиной (тошнота, рвота, полиурия, полидипсия) и биохимическими параметрами (глюкоза 38,6 ммоль/л, кетоны 4,9 ммоль/л (<0,6), С-пептид <0,01 мкг/л (1,1–4,4), НbА1с 8,3%), но отрицательными серологическими показателями (исследовались АТ к GAD и AT к ICA). По достижении стабилизации состояния (проведение гормональной терапии), ввиду наличия метастазов и достижения хорошего ответа на препарат, терапия пембролизумабом была продолжена.
Использование 2 ИКТИО, направленных на разные мишени воздействия (ипилимумаб + анти-PD-1- или анти-PD-L1-моноклональное антитело), вызывает синергичный противоопухолевый ответ, а значит, и встречаться иоНЯ могут чаще [7, 13, 14]. Так, у другого 52-летнего пациента с метастатической меланомой [11] использовалась комбинированная схема иммунотерапии (ипилимумаб + ниволумаб). Было проведено три введения данных препаратов, после чего пришлось отменить ИКТИО, так как у пациента развился гипофизит с формированием гипопитуитаризма (дефицит ТТГ, ФСГ, ЛГ, ПРЛ, а также кортизола и тестостерона), несахарного и СД. При этом антитела к β-клеткам поджелудочной железы (исследовались АТ к GAD, AT к IA-2, AT к ZnT-8) были отрицательными, С-пептид 0,05 нмоль/л (0,4–1,5), НbА1с 7,7%.
Таким образом, с учетом вариабельности и специфичности клинических проявлений иоНЯ, каждый пациент должен быть информирован о признаках наиболее грозных эндокринных иоНЯ (гипофизита, СД, гипопаратиреоза), а также обращать внимание больных на необходимость информирования лечащего врача обо всех новых симптомах.
В отличие от тиреоидных поражений, которые могут развиваться с частотой до 50%, частота развития СД как иоНЯ крайне невелика [8]. Тем не менее следует помнить, что возможно развитие иоНЯ с поражением нескольких эндокринных желез одномоментно. Подобные клинические наблюдения должны детально анализироваться как с целью выявления возможных закономерностей, так и для создания практических рекомендаций для специалистов, сталкивающихся с данной проблемой в своей клинической практике.
Заключение
Возможное развитие иоНЯ при использовании терапии ИКТИО диктует необходимость более внимательного отношения к таким пациентам. Ввиду тяжести состояния клиническая картина может быть стертой, а значит, привести к несвоевременной диагностике эндокринопатий.
Эндокринные иоНЯ чаще соответствуют 1–2 степени по CTCAE, однако своевременно инициированная терапия не только предотвращает развитие осложнений, но и дает возможность продолжения иммунотерапии основного онкологического заболевания в полном объеме, что увеличивает общую и безрецидивную выживаемость.
Важным для практики является поиск генетических, серологических или биохимических маркеров, которые позволят прогнозировать развитие эндокринных иоНЯ, а также более полно понять механизмы влияния ИКТИО.