Аннотация
Обоснование. Одним из последствий ожирения для женского организма является снижение фертильности вплоть до бесплодия. Показано, что нарушение репродуктивной функции у больных ожирением может быть связано, в частности, со снижением овариального резерва.
Цель. Сравнить овариальный резерв у больных ожирением различной степени и женщин без ожирения репродуктивного возраста.
Материалы и методы. Обследовано 320 женщин молодого репродуктивного возраста (от 20 до 30 лет). Участницы были разделены на 4 равные группы (n=80) в зависимости от индекса массы тела (ИМТ): участницы без ожирения (ИМТ<30 кг/м2) и больные ожирением I–III степени в соответствии с критериями Всемирной организации здравоохранения. У всех больных на 2–3-й день менструального цикла определяли следующие маркеры овариального резерва: сывороточные уровни антимюллерова гормона (АМГ), ингибина В, фолликулостимулирующего гормона (ФСГ), лютеинизирующего гормона (ЛГ), эстрадиола, тестостерона и прогестерона, а также ультразвуковые параметры – количество антральных фолликулов и объем яичников.
Результаты. Статистически достоверно при сравнении параметров у женщин без ожирения и у больных ожирением различались уровень АМГ, тестостерона, объем яичников, а также количество антральных фолликулов. При этом по всем параметрам выявлены достоверные различия у женщин с разной степенью ожирения. В то же время даже у больных ожирением III степени параметры не выходили за референсные пределы.
Заключение. Для больных ожирением женщин молодого репродуктивного возраста характерно прогрессивное снижение показателей овариального резерва с увеличением степени ожирения, однако значения оцениваемых параметров даже у больных ожирением III степени остаются в пределах референсных значений. Для уточнения роли ожирения в снижении овариального резерва необходимо проведение крупных рандомизированных многоцентровых исследований с включением пациенток различных рас с оценкой влияния сопутствующих факторов.
ОБОСНОВАНИЕ
За последние несколько десятилетий бесплодие стало одной из глобальных медико-социальных и экономических проблем. Распространенность бесплодия в мире достигает 10–15% – одна пара из семи бесплодна [1]. Ожирение – также неинфекционная пандемия XXI века. С 1980 по 2013 гг. распространенность ожирения во всем мире выросла с 28% до 47%, на сегодняшний день избыточной массой тела и ожирением страдают 2,1 млрд людей во всем мире [2]. По данным наблюдательного исследования, проведенного в США в 2011–2012 гг., ожирением страдают 35% взрослого населения страны и 17% детей и подростков [3]. В Российской Федерации в настоящее время не менее 30% трудоспособного населения имеют превышение массы тела, из них 25% страдают ожирением. По данным ВОЗ от 2008 г., 59,8% взрослого населения (старше 20 лет) в России имели избыточный вес и у 26,5% выявлялось ожирение. Распространенность избыточной массы тела была ниже среди мужчин (56,2%) по сравнению с женщинами (62,8%). Доля мужчин и женщин с ожирением составила 18,6 и 32,9% соответственно [4].
Избыточный вес и ожирение негативно влияют на качество жизни и все сферы деятельности человека, приводя зачастую к развитию тяжелых сопутствующих заболеваний, потере трудоспособности и инвалидности. Одним из последствий ожирения для женского организма является снижение фертильности вплоть до бесплодия. Это связано с изменениями в оси гипоталамус-гипофиз-яичники, с качеством яйцеклеток и нарушенной функцией эндометрия. У больных ожирением вероятность наступления беременности снижена независимо от способа зачатия (естественное или разные варианты экстракорпорального оплодотворения) [5, 6].
Овариальный резерв – это количество яйцеклеток в обоих яичниках. Для определения овариального резерва принято определять сывороточный уровень фолликулостимулирующего гормона (ФСГ) и антимюллерова гормона (АМГ) на 2–3-й день менструального цикла. Снижение овариального резерва связано с уменьшением количества и потерей качества яйцеклеток и ассоциировано с плохим прогнозом исходов оплодотворения in vitro. Исследование АМГ особенно важно у молодых женщин, так как снижение овариального резерва часто пропускается врачами, в результате диагноз бесплодия становится неполным, а значит, не используются все возможные вмешательства для его лечения [1].
Ожирение приводит к нерегулярности, увеличению количества ановуляторных циклов. Показано, что нарушение репродуктивной функции у больных ожирением может быть связано, в частности, со снижением овариального резерва [7]. Целью настоящего исследования явилась сравнительная оценка овариального резерва у больных с различной степенью ожирения и здоровых женщин репродуктивного возраста.
ЦЕЛЬ
Сравнить овариальный резерв у больных ожирением различной степени и у женщин репродуктивного возраста без ожирения.
МЕТОДЫ
Дизайн исследования
Проспективное обсервационное одноцентровое исследование в параллельных группах.
Критерии соответствия
Для минимизации влияния дополнительных факторов, изменяющих овариальный резерв, в исследование были включены женщины европеоидной расы молодого репродуктивного возраста (от 20 до 30 лет включительно). Критериями исключения являлись: операции на органах малого таза, химиотерапия или лучевая терапия в анамнезе, опухолевидные образования яичников, синдром поликистозных яичников (СПКЯ), эндометриоз, диагностированное бесплодие, нарушения менструального цикла, беременность, прием гормональных препаратов, курение сигарет на момент включения или в анамнезе, злоупотребление алкоголем, наркомании и токсикомании. Все участницы ознакомились с информацией об исследовании, получили ответы на интересующие вопросы и подписали форму информированного согласия на участие в исследовании.
Условия проведения
Исследование проведено на базе одного центра ФГБУ «НМИЦ эндокринологии» Минздрава России, Москва, Россия.
Продолжительность исследования
Продолжительность набора участниц в исследование в соответствии с планом составила 12 мес, каждую участницу в рамках исследования обследовали дважды – на 2–3-й и на 21–23-й дни менструального цикла. Исследование проводилось в период с 2015 по 2019 гг.
Описание медицинского вмешательства
Всех участниц обследовали по единому протоколу: забор венозной крови натощак на 2–3-й и на 21–23-й дни менструального цикла для определения сывороточных уровней АМГ, ингибина В, ФСГ, ЛГ, эстрадиола, тестостерона (на 2–3-й дни цикла) и прогестерона (на 21–23-й дни цикла) методом усиленной люминесценции. На 2–3-й дни менструального цикла для оценки объема яичников и числа антральных фолликулов проводилось трансвагинальное ультразвуковое исследование (УЗИ) на ультразвуковом аппарате Hewlett Packard Image Point (США) с использованием вагинального датчика с частотой 3,5 МГц по общепринятой методике.
Основной исход исследования
Основными оцениваемыми параметрами в рамках исследования явились уровень АМГ и количество антральных фолликулов на 2–3-й день менструального цикла.
Дополнительные исходы исследования
Дополнительные оцениваемые параметры: уровни ингибина В, ФСГ, ЛГ, эстрадиола, тестостерона и объем яичников на 2–3-й дни менструального цикла, уровень прогестерона на 21–23-й дни менструального цикла.
Анализ в подгруппах
В зависимости от индекса массы тела (ИМТ) участницы (n=320) были разделены на четыре группы:
- группа А – женщины без ожирения (ИМТ <30 кг/м2);
- группа B – больные ожирением I степени (ИМТ 30–34,9 кг/м2);
- группа C – больные ожирением II степени (ИМТ 35–39,9 кг/м2);
- группа D – больные ожирением III степени (ИМТ ≥40 кг/м2).
В каждую группу было включено по 80 женщин.
Методы регистрации исходов
Уровни АМГ, ингибина В, ФСГ, ЛГ, эстрадиола, тестостерона, прогестерона определялись методом усиленной люминесценции. Для оценки объема яичников и числа антральных фолликулов проводилось трансвагинальное ультразвуковое исследование (УЗИ) на ультразвуковом аппарате Hewlett Packard Image Point (США) с использованием вагинального датчика с частотой 3,5 МГц по общепринятой методике. Референсные значения определялись на основании данных локальной лаборатории, а также с учетом рекомендаций Американской коллегии акушеров-гинекологов по определению овариального резерва 2015 г. [8] и Роттердамских критериев синдрома поликистозных яичников (СПКЯ) (для определения нормального объема яичника) [9].
Этическая экспертиза
Протокол исследования одобрен на заседании этического комитета ФГБУ «Национальный медицинский исследовательский центр эндокринологии» Минздрава России от 19 октября 2016 г. (протокол № 12).
Статистический анализ
Статистический анализ осуществлялся с помощью пакета программ Statistica 6.0 (StatSoftInc, США). Нормальность распределения признаков оценивалась с помощью критерия Шапиро–Уилка. При описании нормально распределенных переменных указывалось среднее и стандартное отклонение (M±s). Сравнение количественных показателей в разных группах осуществлялось при помощи критерия Манна–Уитни (для двух групп). Качественные показатели представлялись в виде абсолютного числа наблюдений. Различия считались статистически значимыми при p<0,05. По коэффициенту Спирмена оценивали силу связи между переменными (r). При значениях коэффициента r<0,3 связь считалась слабой и незначительной; при значениях r=0,3–0,7 – средней или умеренной; при значениях r>0,7 – значительной и сильной.
РЕЗУЛЬТАТЫ
Основные результаты исследования
Результаты обследования участниц исследования представлены в таблице 1.
Таблица 1. Результаты обследований женщин с нормальной массой тела (группа A) и больных ожирением (группы B, C, D)
| Характеристика | Группа A
(n=80) |
Группа B
(n=80) |
Группа C
(n=80) |
Группа D
(n=80) |
Референсные значения |
| Возраст, лет | 24,6±4,1 | 25,8±3,6 | 27,2±3,9 | 26,3±6,1 | Не применимо |
| ИМТ, кг/м2 | 23,1±4,5 | 33,2±2,6* | 37,9±1,8* | 42,4±2,3* | 18–24,9 |
| Окружность талии, см | 74,3±4,6 | 85± 5,1* | 96,0±8,5* | 107,2±11,8* | ≤ 80 |
| АМГ, нг/мл | 4,4±0,79 | 4,1±0,7* | 2,4±0,55* | 1,9±0,42* | 1–12,6 |
| Ингибин В, пг/мл | 104,6±25,1 | 96,3±20,1 | 96,7±17,8 | 108,2±23,9 | <273 |
| ФСГ, мМЕд/мл | 5,6±3,4 | 6,3±2,7 | 7,1±3,5 | 3,6±2,2 | 1,37–9,9 |
| ЛГ, мМЕд/мл | 6,3±2,2 | 7,6±1,4 | 5,9±1,8 | 6,4±1,5 | 1,68–15 |
| Эстрадиол, пмоль/л | 534±180,3 | 582±156,9 | 594±149,7 | 613±207,3 | 68–1269 |
| Тестостерон, нмоль/л | 0,65±0,13 | 0,73±0,18* | 1,5±0,38* | 1,8±0,33* | 0,52–1,72 |
| Прогестерон, нмоль/л | 1,7±0,8 | 1,9±0,53 | 1,4±0,2 | 2,1±0,41 | 0,3–2,2 |
| Объем яичников, см3 | 9,3±2,1 | 8,6±1,6* | 8,4±1,2* | 6,8±1,4* | ≤10 |
| Число антральных фолликулов | 22,5±6,9 | 18±5,2* | 12,3±3,8* | 7,6±2,4* | Минимум 3–10 |
* – p<0,05 при сравнении параметра у больных ожирением и у женщин с нормальной массой тела.
Благодаря жестким критериям включения/исключения, больные обеих групп сопоставимы по возрасту и главным факторам, влияющим на овариальный резерв. С учетом принципа деления больных на группы закономерно достоверно различаются ИМТ и окружность талии. На рисунке 1 наглядно представлены параметры, статистически достоверно различающиеся у женщин с ожирением и у здоровых женщин.
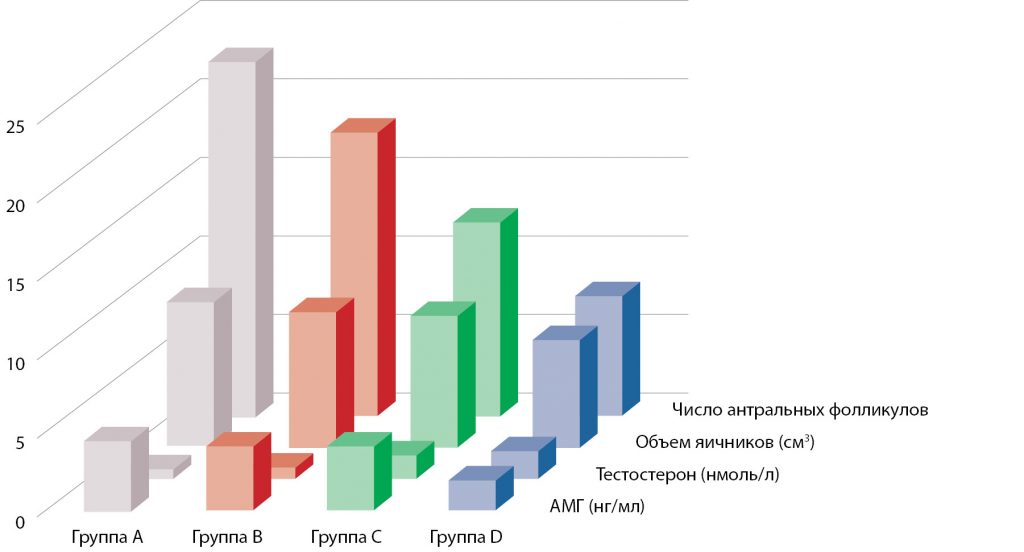
Рисунок 1. Достоверные различия параметров овариального резерва у больных ожирением разной степени (группы B, C, D) и у женщин с нормальным индексом массы тела (группа A).
Обращают внимание достоверные различия таких параметров овариального резерва у женщин с нормальной массой тела и у больных ожирением, как уровень АМГ (4,4±0,79 нг/мл в группе A против 2,4±0,55 и 1,9±0,42 нг/мл в группах C и D соответственно, p<0,05), тестостерона (0,65±0,13 нг/мл в группе A против 1,5±0,38 и 1,8±0,33 нг/мл в группах C и D соответственно; p<0,05), объем яичников (9,3±2,1 см3 в группе A и 6,8±1,4 см3 – в группе D, p<0,05; различий в объеме яичников между женщинами с нормальной массой тела и больными ожирением I и II степеней не отмечалось), а также количество антральных фолликулов (достоверные различия между значениями в группе женщин с нормальной массой тела и с каждой из групп пациенток, больных ожирением).
Кроме того, по ряду параметров отмечаются достоверные различия между больными с разной степенью ожирения. Так, получены достоверные различия в уровне АМГ у больных ожирением I степени (4,1±0,7 нг/мл в группе B) и у больных ожирением II и III степеней (2,4±0,55 и 1,9±0,42 нг/мл группах C и D соответственно) (p<0,05 при сравнении параметра в группе B и в группах C и D). Аналогично отличались уровень тестостерона (достоверно выше у больных ожирением II и III степеней по сравнению с больными ожирением I степени) и объем яичников (достоверно меньше у больных ожирением III степени по сравнению с больными ожирением I и II степеней, p<0,05). Количество антральных фолликулов достоверно прогрессивно уменьшалось с увеличением степени ожирения (p<0,05 при сравнении каждых двух смежных групп).
При анализе корреляционных связей ИМТ и параметров овариального резерва отмечается умеренная отрицательная связь с уровнем АМГ (r=-0,44, p<0,05) и объемом яичников (r=-0,36; p<0,05) и сильная отрицательная связь с количеством антральных фолликулов (r=0,84; p<0,05), а также умеренная положительная связь с уровнем тестостерона (r=0,62; p<0,05). При этом уровни таких маркеров овариального резерва, как ФСГ, ЛГ, ингибин В, эстрадиол, прогестерон, достоверно не отличались.
Нежелательные явления
В ходе проведения исследования нежелательных явлений не зарегистрировано.
ОБСУЖДЕНИЕ
Резюме основного результата исследования
У женщин с ожирением в репродуктивном периоде выявляется прогрессивное снижение показателей овариального резерва наряду с увеличением степени ожирения, однако значения оцениваемых параметров даже у больных ожирением III степени остаются в пределах референсных значений.
Обсуждение основного результата исследования
Более трети женщин репродуктивного возраста имеют ожирение, в связи с этим связь репродуктивного здоровья и ожирения является одной из актуальных проблем современного здравоохранения [10]. Результаты проведенных к настоящему времени исследований по данной проблеме противоречивы. Целью данного исследования являлось провести сравнительный анализ овариального резерва у женщин с ожирением различной степени и женщин в репродуктивном возрасте без ожирения. По данным проведенного нами исследования, при сравнении параметров у женщин без ожирения и у больных ожирением различались уровни АМГ, тестостерона, объем яичников, а также количество антральных фолликулов. При этом по всем параметрам выявлены достоверные различия у женщин с разной степенью ожирения. В то же время даже у больных ожирением III степени параметры не выходили за референсные пределы, что подтверждается данными зарубежных исследований. Так, Shaw et al. в рамках проспективного исследования «случай-контроль» при обследовании 135 женщин европеоидной расы моложе 45 лет, из которых 21 страдали ожирением, выявили отсутствие зависимости между ИМТ и уровнем АМГ (4,36 пмоль/л при ИМТ менее 25 кг/м2, 4,14 пмоль/л – при ИМТ от 25 до 29,9 кг/м2 и 4,57 пмоль/л – при ИМТ более 30 кг/м2) [11]. Та же группа ученых подтвердила полученные результаты в более крупном исследовании с участием 259 женщин моложе 45 лет. Средний уровень АМГ у больных ожирением (n=37) составил 3,46±2,79 нг/мл, в то время как у женщин без ожирения – 3,79±2,93 нг/мл [12]. Altaee et al. сравнили лабораторные и ультразвуковые параметры овариального резерва у страдающих ожирением и у здоровых молодых (21–35 лет) женщин. Было выявлено, что ожирение не влияло на значения АМГ, ФСГ и на количество антральных фолликулов, т.е. овариальный резерв не зависел от наличия ожирения [13]. По нашему мнению, это связано с тем, что в России термин «вторичные» поликистозные яичники в научной и клинической практике не используется. Однако исключение диагноза «синдром поликистозных яичников» не означает наличие диагноза «синдром хронической ановуляции», при котором уровень АМГ на верхней границе нормы или выше референсных значений. Именно разделение пациенток на группы: первичные/вторичные поликистозные яичники, по нашему мнению, помогло бы выявить истинное состояние маркеров овариального резерва у данной категории больных.
В то же время Freeman et al. показали отрицательную корреляционную зависимость между ИМТ и уровнем АМГ у женщин в позднем репродуктивном возрасте. В исследование вошли женщины европеоидной и негроидной расы (n=122, средний возраст 45,8±5,2 лет), у больных ожирением уровень АМГ оказался на 65% ниже, чем у женщин, не страдающих ожирением, при этом они не отметили зависимости уровня АМГ от расы [14]. Bernardi et al. обследовали 1654 женщин негроидной расы в возрасте от 23 до 35 лет. Было выявлено, что у больных ожирением уровень АМГ оказался на 23,7% ниже, чем у больных с ИМТ менее 25 кг/м2 (2,9 нг/мл против 3,8 нг/мл). В рамках данного исследования ИМТ на момент включения в исследование, ИМТ в возрасте 18 лет, самый высокий вес в течение жизни и уровень лептина отрицательно коррелировали с уровнем АМГ [15].
Противоречивые данные требуют накопления клинического материала, который позволит судить о влиянии ожирения на репродуктивную функцию. Особенностью нашего исследования является большой объем выборки (320 участниц, по 80 в каждой группе), включение однородной группы молодых женщин репродуктивного возраста (от 20 до 30 лет) с контролем основных факторов, влияющих, по данным литературы, на овариальный резерв. Мы включали только женщин европеоидной расы, не курящих, с анатомически сохранными яичниками без видимой при стандартном обследовании патологии и без тяжелых заболеваний и токсичных видов лечения в анамнезе. Единственным контролируемым параметром, по которому различались группы, был ИМТ. По результатам нашего исследования для больных ожирением характерно снижение овариального резерва по сравнению с женщинами без ожирения, при оценке по таким параметрам, как уровень АМГ, объем яичников, количество антральных фолликулов и уровень тестостерона. Особенностью нашего исследования является также анализ различий не только между столь разнородными группами, как больные с нормальной массой тела и больные ожирением, но и оценка различий в зависимости от степени ожирения.
Отличий между группами по таким параметрам, как концентрация ФСГ, ЛГ, прогестерона, не наблюдалось. Наши данные согласуются с результатами других авторов. Так, Parven et al. провели поперечное исследование, в которое вошли 52 больные бесплодием женщины в возрасте 20–35 лет, которых разделили на группы в зависимости от ИМТ, овариальный резерв определяли на основании уровня АМГ (нормальный ≥1,25 нг/л, сниженный <1,25 нг/л). Оказалось, что с увеличением ИМТ снижается овариальный резерв [16]. Аналогичную отрицательную корреляционную зависимость между ИМТ и уровнем АМГ показали Kriseman et al. [17], Jehan et al. [18].
Balkan et al. [19] оценивали овариальный резерв у больных метаболическим синдромом (одним из компонентов которого является ожирение) и у женщин, не страдающих метаболическим синдромом. В подгруппе молодых участниц (20–29 лет), больных метаболическим синдромом, отмечалось повышение уровня общего тестостерона, а также статистически значимое уменьшение объема яичников при нормальных уровнях ФСГ, ЛГ и количества антральных фолликулов (уровни ингибина В и АМГ в данном исследовании не оценивались). Уменьшение объема яичников у больных ожирением отметил Halawaty et al. (в исследование включались больные в пременопаузальном периоде, при этом другие параметры, характеризующие овариальный резерв, включая АМГ и ФСГ, не отличались между группами). В недавнем исследовании А.К. Дурмановой и соавт. также показано, что у женщин репродуктивного возраста с абдоминальным типом ожирения на фоне инсулинорезистентности и гиперинсулинемии снижается овариальный резерв яичников, ускоряются процессы старения репродуктивной системы [20]. Мы показали прогрессивное снижение количества антральных фолликулов с увеличением степени ожирения, уменьшение уровня АМГ и объема яичников, а также нарастание уровня тестостерона у больных ожирением III степени по сравнению с больными с менее выраженным ожирением.
Следует отметить, что, хотя у больных ожирением мы выявили достоверные изменения показателей, характеризующих овариальный резерв, клиническая значимость указанных изменений не ясна. Все отличающиеся от группы здоровых женщин параметры даже у больных ожирением III степени оставались в пределах нормы. В соответствии с рекомендациями Американской коллегии акушеров-гинекологов по определению овариального резерва 2015 г., пороговым значением АМГ предложено считать уровень 0,2–0,7 нг/мл [8], в то время как по нашим данным средний уровень АМГ у больных ожирением III степени молодых женщин составляет 1,9±0,42 нг/мл. То же относится к таким параметрам, как количество антральных фолликулов в яичниках и объем яичников (пороговые значения 3–10 и 6 см3 соответственно). Таким образом, по нашим данным, несмотря на то, что для больных ожирением характерны достоверно более низкие значения маркеров овариального резерва, он остается неизмененным по общепринятым критериям. Аналогичные результаты получены и другими авторами, показавшими снижение овариального резерва у женщин с ожирением по сравнению со здоровыми женщинами, однако данные параметры не выходили за пороговые значения для реактива [15]. В планах наших дальнейших исследований: сравнительный анализ овариального резерва у женщин с нарушениями жирового обмена при первичном/ вторичном синдроме поликистозных яичников.
Ограничения исследования
В нашем исследовании не проводился формальный расчет объема выборки, что допустимо в рамках неинтервенционного исследования. Жесткие критерии отбора участниц исследования уменьшают вероятность влияния на результат дополнительных вмешивающихся факторов, однако в реальной клинической практике дисменорея, прием гормональных контрацептивов, гинекологические операции в анамнезе, наряду с ожирением, могут существенно изменять овариальный резерв. Таким образом, экстраполяция результатов на общую популяцию пациенток молодого репродуктивного возраста некорректна.
ЗАКЛЮЧЕНИЕ
С увеличением степени ожирения у женщин отмечается прогрессивное снижение таких параметров овариального резерва, как уровень АМГ, объем яичников и количество антральных фолликулов, а также увеличение сывороточной концентрации тестостерона. Полученные данные свидетельствуют о тенденции к снижению овариального резерва у таких больных по сравнению с женщинами с нормальным ИМТ, причем наиболее выраженные изменения отмечаются в группе больных с ожирением III степени (достоверные отличия от параметров у больных ожирением II и III степени). Несмотря на снижение параметров овариального резерва у больных ожирением, изучаемые показатели остаются в референсных пределах даже в группе больных ожирением III степени. Для уточнения роли ожирения в снижении овариального резерва необходимо проведение крупных рандомизированных многоцентровых исследований с включением пациенток различных рас с оценкой влияния сопутствующих факторов.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источник финансирования. Работа выполнена в рамках Государственного задания «Сигнальные молекулы адипоцитов: геномные и постгеномные механизмы реализации физиологической и патологической функции жировой ткани при эндокринопатиях».
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Участие авторов. Григорян О.Р., Михеев Р.К. – сбор материала, написание текста рукописи; Андреева Е.Н., Дедов И.И. – идея, редактирование текста рукописи; Михеев Р.К. – статистический анализ данных, написание текста рукописи. Все авторы внесли значимый вклад в проведение исследования и подготовку статьи, прочли и одобрили финальную версию статьи перед публикацией.
Список литературы
↑1. Talmor A, Dunphy B. Female Obesity and Infertility. Best Pract Res Clin Obstet Gynaecol. 2015;29(4):498-506. https://doi.org/10.1016/j.bpobgyn.2014.10.014
↑2. Ng M, Fleming T, Robinson M, et al. Global, regional, and national prevalence of overweight and obesity in children and adults during 1980-2013: a systematic analysis for the Global Burden of Disease Study 2013. Lancet. 2014;384(9945):766-781. https://doi.org/10.1016/S0140-6736(14)60460-8
↑3. Ogden CL, Carroll MD, Kit BK, Flegal KM. Prevalence of Childhood and Adult Obesity in the United States, 2011-2012. JAMA. 2014;311(8):806. https://doi.org/10.1001/jama.2014.732
↑4. Разина А.О., Руненко С.Д., Ачкасов Е.Е. Проблема ожирения: современные тенденции в России и в мире // Вестник Российской академии медицинских наук. – 2016. – Т. 71. – №2. – C. 154-159. [Razina AO, Runenko SD, Achkasov EE. Obesity: Current Global and Russian Trends. Annals of the Russian Academy of Medical Sciences. 2016;71(2):154-159. (In Russ).] https://doi.org/10.15690/vramn655
↑5. Ramlau-Hansen CH, Thulstrup AM, Nohr EA, et al. Subfecundity in overweight and obese couples. Hum Reprod. 2007;22(6):1634-1637. https://doi.org/10.1093/humrep/dem035
↑6. van der Steeg JW, Steures P, Eijkemans MJC, et al. Obesity affects spontaneous pregnancy chances in subfertile, ovulatory women. Hum Reprod. 2007;23(2):324-328. https://doi.org/10.1093/humrep/dem371
↑7. Bellver J, Ayllón Y, Ferrando M, et al. Female obesity impairs in vitro fertilization outcome without affecting embryo quality. Fertil Steril. 2010;93(2):447-454. https://doi.org/10.1016/j.fertnstert.2008.12.032
↑8. Committee on Gynecologic Practice. Committee Opinion No. 618. Obstet Gynecol. 2015;125(1):268-273. https://doi.org/10.1097/01.AOG.0000459864.68372.ec
↑9. Franks S. Diagnosis of Polycystic Ovarian Syndrome: In Defense of the Rotterdam Criteria. J Clin Endocrinol Metab. 2006;91(3):786-789. https://doi.org/10.1210/jc.2005-2501
↑10. Flegal KM, Carroll MD, Kit BK, Ogden CL. Prevalence of Obesity and Trends in the Distribution of Body Mass Index Among US Adults, 1999-2010. JAMA. 2012;307(5):491. https://doi.org/10.1001/jama.2012.39
↑11. Shaw CM, Stanczyk FZ, Egleston BL, et al. Serum antimüllerian hormone in healthy premenopausal women. Fertil Steril. 2011;95(8):2718-2721. https://doi.org/10.1016/j.fertnstert.2011.05.051
↑12. Sahmay S, Usta T, Erel CT, et al. Is there any correlation between amh and obesity in premenopausal women? Arch Gynecol Obstet. 2012;286(3):661-665. https://doi.org/10.1007/s00404-012-2363-x
↑13. Altaee H, Al-Madfai ZAM, Alkhafaji ZH. Effect of obesity on ovarian reserve parameters in mid-reproductive age women. F1000Research. 2012;1(3):43. https://doi.org/10.12688/f1000research.1-43.v1
↑14. Freeman E, Gracia C, Sammel M, et al. Association of anti-mullerian hormone levels with obesity in late reproductive-age women. Fertil Steril. 2007;87(1):101-106. https://doi.org/10.1016/j.fertnstert.2006.05.074
↑15. Bernardi LA, Carnethon MR, de Chavez PJ, et al. Relationship between obesity and anti-Müllerian hormone in reproductive-aged African American women. Obesity. 2017;25(1):229-235. https://doi.org/10.1002/oby.21681
↑16. Parveen N, Sheikh S, Javed S. Relationship of body mass index with ovarian reserve status of infertile women measured by anti-mãœllerian hormone level. Pakistan J Physiol. 2014;10(1-2). Available from: http://www.pjp.pps.org.pk/index.php/PJP/article/view/547
↑17. Kriseman M, Mills C, Kovanci E, Sangi-Haghpeykar H, Gibbons W. Antimullerian hormone levels are inversely associated with body mass index (BMI) in women with polycystic ovary syndrome. J Assist Reprod Genet. 2015;32(9):1313-1316. https://doi.org/10.1007/s10815-015-0540-0
↑18. Jehan S, Syed S. Association of ovarian reserve with age, BMI and serum FSH level in subfertile women. J Pak Med Assoc. 2016;66(4):409-413. PMID:27122266
↑19. Balkan F, Cetin N, Usluogullari C, et al. Evaluation of the ovarian reserve function in patients with metabolic syndrome in relation to healthy controls and different age groups. J Ovarian Res. 2014;7(1):63. https://doi.org/10.1186/1757-2215-7-63
↑20. Дурманова А.К., Отарбаев Н.К., Кайырлыкызы А., и др. Овариальный резерв яичников и содержание адипокинов у женщин репродуктивного возраста с ожирением // Терапевтический архив. – 2016 – Т.88. – №10. – С.46-50. [Durmanova AK, Otarbayev NK, Kaiyrlykyzy A, et al. Ovarian reserve and adipokine levels in reproductive-aged obese women. Ter Arkh. 2016;88(10):46-50. (in Russ).] https://doi.org/10.17116/terarkh2016881046-50
