Прием белка и физическое функционирование
Влияние потребления большого количества белка на физическое функционирование организма (включая мышечную силу и повседневную активность) было оценено в кросс-секционных и долгосрочных популяционных исследованиях, а также в рандомизированных контролируемых исследованиях.
Популяционные исследования. Мышечная сила и общее физическое функционирование, включающее повседневную активность, были напрямую связаны с приемом белка в нескольких популяционных исследованиях. Однако эти ассоциации не были оценены на основе систематического подхода и из-за наличия негативных эффектов от низкого (менее 0,8 г/кг в сутки) приема белка в пище, куда более частых, чем положительных эффектов от большого (более 0,8 г/кг в сутки) или переставали быть статистически достоверными после исключения важных искажающих влияний, таких как избыточное отложение жира в туловище. Более того, высокое потребление белка не предупреждало и не ослабляло потерю мышечной силы, ассоциированную с возрастом, что оценивалось по силе схвата, и общего физического функционирования, оцениваемого тестом вставанием со стула и ходьбой с отсчетом времени.
Рандомизированные контролируемые исследования. Данные большинства рандомизированных контролируемых исследований, проводимых в ходе поддержания массы тела у испытуемых или в ходе снижения массы тела, индуцированного диетой, показали, что повышенное потребление белка более RDI со сроком до 2 лет не имеет положительных эффектов в плане поддержания мышечной силы или общего физического функционирования. В сравнении, данные некоторых рандомизированных контролируемых исследований, включающих два пилотных исследования, показали статически, но, предположительно, не клинически значимое благоприятное воздействие повышенного потребления белка в течение 10–24 недель на определенные показатели силы и физического функционирования.
Резюме. Данные из популяционных и рандомизированных контролируемых исследований не подтверждают клинически ощутимые благоприятные эффекты повышенного потребления белковой пищи (более 0,8 г/кг в сутки) на мышечную силу и общее физическое функционирование.
Гомеостаз глюкозы
Концентрация глюкозы в плазме крови регулируется балансом между печеночной и почечной продукцией глюкозы, всасыванием глюкозы в системный кровоток из кишечника и степенью поглощения глюкозы тканями. Инсулин это главный регулятор эндогенной продукции глюкозы и поглощения глюкозы периферическими тканями. Он подавляет эндогенную продукцию глюкозы напрямую за счет воздействия на гепатоциты и косвенно за счет ингибирования продукции глюкагона. К тому же, инсулин снижает выделение в кровь свободных жирных кислот за счет ингибирования липолиза триглицеридов в жировой ткани. Эндогенная продукция глюкозы и липолиз — очень чувствительные к воздействию инсулина механизмы, поэтому для их максимального подавления достаточны незначительные повышения уровня инсулина в крови выше базального уровня его секреции. Вдобавок, инсулин стимулирует захват глюкозы тканями, особенно мышечными, дозозависимым образом, но максимальный стимулирующий эффект инсулина с точки зрения захвата глюкозы тканями значительно превышает нормальный постпрандиальный подъем уровня инсулина в плазме. Лица с предиабетом или СД 2 типа имеют повышенную плазменную концентрацию глюкозы, то есть состояние, именуемое гипергликемией. За развитие этого патогенетического фенотипа ответственны несколько механизмов. Во-первых, продукция глюкозы печенью усиливается за счет гиперглюкагонемии. В дальнейшем возникает мультиорганная (в печени, жировой и мышечной тканях) инсулинорезистентность, которая характеризуется нарушенной инсулин-регулируемой супрессией печеночной продукции глюкозы, снижением липолиза в жировой ткани и нарушением поглощения глюкозы тканями. Когда эти эффекты сочетаются с недостаточным компенсаторным повышением инсулиновой секреции и снижением клиренса инсулина, гомеостаз глюкозы нарушается, возникает гипергликемия.
Употребление белка и метаболизм глюкозы. Употребление белка и последующее за ним повышение в плазме крови уровня аминокислот имеет сильное влияние на метаболизм глюкозы. Прием с пищей белка и аминокислот стимулирует секрецию как глюкагона, так и инсулина дозозависимым образом. Вдобавок, повышение плазменной концентрации аминокислот за счет инфузии как полной аминокислотной смеси, так и смеси из незаменимых аминокислот, нарушает действие инсулина (оценивалось с помощью гиперинсулинемического-эугликемического клэмпа) у здоровых людей. Секреция глюкагона в ответ на употребление белка в норме повышается с целью уменьшения избытка аминокислот и азотистых соединений в плазме крови за счет стимуляции катаболизма аминокислот и образования мочевины. Также стимуляция секреции глюкагона и продукции глюкозы печенью совместно с ингибированием инсулин-индуцированного снижения глюкозы предотвращают развитие гипогликемии. Однако соотношение инсулин/глюкоза зачастую выше после приема белка в сравнении с голоданием, а также зачастую выше после совместного приема белка и углеводов в сравнении с приемом только углеводов. Это возникает потому, что концентрация инсулина, но не глюкозы, повышается после употребления белка. Тип потребляемого белка влияет на степень усвоения и уровень аминокислот, проникающих в кровоток. Например, более быстрое и выраженное повышение концентрации инсулина в плазме крови, по сравнению с приемом казеина, было выявлено после приема молочной сыворотки. Тип белка, таким образом, является потенциально важным фактором метаболического ответа на прием белковой пищи.
Употребление белка, чувствительность к инсулину и гликемический контроль. Инсулинотропный эффект приема белка может помочь людям с СД 2 типа контролировать уровень глюкозы крови. Например, белковая «преднагрузка» перед приемом углеводов или их одновременный прием способствуют улучшению глюкозозависимой инсулиновой секреции и снизить постпрандиальную гипергликемию у лиц с СД 2 типа. У людей без СД 2 типа, однако, инсулиногенный эффект приема белковой пищи может быть вовлечен в патогенез инсулинорезистентности. Это подтверждается исследованиями, показывающими, что даже незначительное экспериментально индуцированное повышение плазменной концентрации инсулина у здоровых людей может вызывать инсулинорезистентность за нескольких дней, по-видимому, за счет уменьшения экспрессии инсулиновых рецепторов по типу снижающей регуляции и возникновения пострецепторных дефектов инсулинового сигналинга. Влияние длительной высокобелковой диеты на чувствительность к инсулину и уровень глюкозы плазмы у здоровых людей, лиц с ожирением и лиц с СД 2 типа до конца не ясно. Авторы нескольких систематических обзоров и метаанализов рандомизированных контролируемых исследований заключили, что невозможно определить эффекты высокобелковой диеты на чувствительность к инсулину и гликемический контроль по причине наличия возможных искажающих факторов (выбора пищи, композиции диеты, различий между характеристиками исследуемых в исследуемых и контрольных группах), а также различий в методах оценки чувствительности к инсулину. Исследование лиц с избытком массы тела и ожирение, в котором использовался гиперинсулинемический-эугликемический клэмп в сочетании со стабильной инфузией глюкозы, меченой изотопом, выявило, что потребление высокобелковой диеты (поддерживающей вес) в течение 6–18 недель послужило причиной развития незначительного, но статистически достоверного повышения базальной продукции глюкозы печенью и нарушения инсулин-зависимого снижения уровня гликемии после 6 недель. Через 18 недель статистически достоверной разницы не наблюдалось, но приверженность к диетическим рекомендациям после 6 недель была слабой, что могло повлиять на результаты.
Употребление белка в ходе снижения веса, индуцированного диетой, и метаболизм глюкозы. Повышение белкового питания в сочетании со снижением в диете потребления углеводов способствовало снижению веса и уменьшению суточной плазменной концентрации глюкозы и HbA1c у людей с ожирением и СД 2 типа, даже с минимальной (менее 5 %) потерей веса. Однако повышенное потребление белка с пищей без существенного снижения приема углеводов может снижать благоприятный эффект снижения массы тела на метаболизм глюкозы. Обнаружено, что повышение потребления белка с 0,8 до 1,2 г/кг в сутки за счет добавления белков молочной сыворотки в низкокалорийную, сбалансированную по наличию макронутриентов диету (49 % углеводов, 29 % жиров и 22 % белка против 43 % углеводов, 26 % жиров и 31 % белка) полностью препятствуют развитию положительного эффекта от 10 % потери веса на нарушении инсулин-регулируемого снижения гликемии (оценено с помощью гиперинсулинемического-эугликемического клэмпа). Неблагоприятный метаболический эффект избыточной по белку низкокалорийной диеты (50 % углеводов, 25 % жиров и 25 % белка против 50 % углеводов, 30 % жиров и 20 % белка) на чувствительность к инсулину, индуцированную потерей веса, был подтвержден другими исследователями, которые оценивали чувствительность к инсулину с помощью внутривенного глюкозотолерантного теста у женщин 18–65 лет с избытком массы тела или ожирением. Однако потеря веса поспособствовала снижению уровня инсулина плазмы натощак и уровня базальной продукции глюкозы (выраженного, как мкмоль глюкозы в минуту) одинаково в группах с высокобелковой и стандартной по количеству белка низкокалорийных диетах. В небольшом (n = 6 в группе) исследовании, проведенном на людях с СД 2 типа, выявлено, что низкокалорийная и высокобелковая диета (43 % углеводов, 32 % жиров и 27 % белка) в течение 8 недель препятствовала нормализации значений глюкозы плазмы натощак и чувствительности к инсулину (оценивалась с помощью гиперинсулинемического-эугликемического клэмпа), в отличие от наблюдаемых в контрольной группе с низкокалорийной и стандартной по содержанию белка диете (50 % углеводов, 30 % жиров и 20 % белка). К тому же, снижение уровня HbA1c в контрольной группе была статистически значимой, в отличие от группы с высокобелковой диетой.
Резюме. Эти данные показывают, что питание исключительно белковой пищей или добавление белка к углеводам стимулирует секрецию глюкагона и инсулина, что помогает метаболизировать аминокислоты. Прием белка также нарушает работу инсулина с целью предотвращения гипогликемии. Более того, повышенный прием белковой пищи в ходе снижения массы тела приводит к неблагоприятным метаболическим последствиям у здоровых людей и лиц с СД 2 типа.
Употребление белка и риск развития СД 2 типа
Данные серии больших популяционных исследований, включая Health ABC, Rotterdam, Nurses’ Health II and Health Professionals Follow-up, Мельбурнская Коллаборативная Когорта, MASALA, Инициатива по Здоровью Женщин, EPIC и ATBC показали, что высокобелковая диета была ассоциирована с повышенной распространенностью и повышенным риском развития предиабета и СД 2 типа. Риск развития СД 2 типа увеличивался на 20–40 % на каждые 10 г употребленного белка свыше 64 г в сутки и риск развития СД 2 типа у людей с наивысшим квартилем потребления белка был приблизительно в 2 раза выше, чем у лиц с самым низким квартилем. В некоторых, но не во всех исследованиях, отмечена корреляция развития предиабета и СД 2 типа с источником белка. В трех исследованиях высокое потребление животного белка, но не растительного, было ассоциировано с повышенным риском развития СД 2 типа. В четырех исследованиях было определено, что замена на 5 % калорий от овощей 5 % от животных белков снижало риск СД 2 типа приблизительно на 25 %. Однако авторы другого исследования определили, что замена 2 % калорийности, получаемой от белка углеводами, было ассоциировано со снижением риска развития СД 2 типа, вне зависимости от того, животные или растительные белки были заменены. Несоответствия между влиянием белков животного и растительного происхождения были исследованы в вышеописанных исследованиях и расценены, как различия в статистической мощности (малое количество людей потребляло большое количество растительных белков), имеют ли влияние типы белков сами по себе или биологически активные субстанции, соседствующие с потребляемыми растительными и животными белками, не выяснено. В исследовании, оценивающем плазменные концентрации глюкозы и гормонов, регулирующих уровень гликемии, после питания порциями, насыщенными животными белками и растительными белками, постпрандиальный метаболический профиль плазмы был в значительной мере различен, но более благоприятный после высокобелковой пищи животного происхождения, нежели растительного. Потребление большого количества растительного белка в сравнении с высоким потреблением животного белка было ассоциировано с более высоким уровнем плазменных концентраций глюкагона, инсулина и глюкозы.
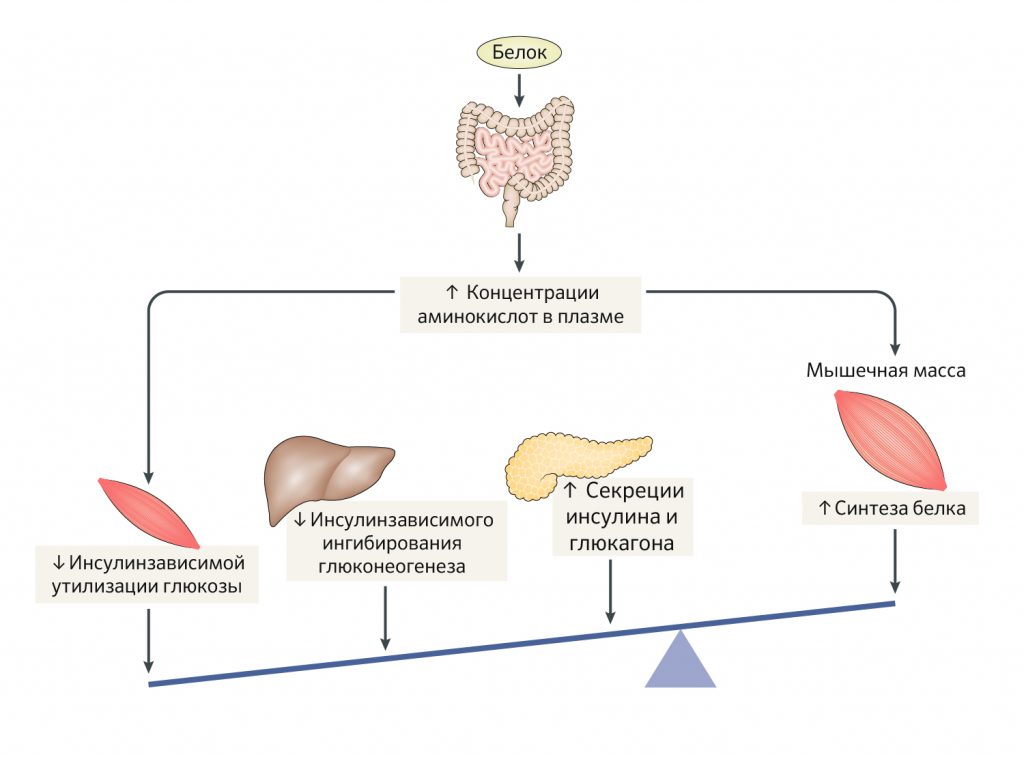
Рисунок 3 | Влияние поступающего с пищей белка на метаболизм глюкозы и синтез белка в мышцах.
Употребление белка и хроническая болезнь почек
В европейской популяции 45 лет и старше распространенность хронической болезни почек (ХБП), определяемая как расчетная скорость клубочковой фильтрации (СКФ) < 60 мл/мин / 1,73 м2, составляет 11 %. ХБП это независимый фактор риска кардиоваскулярной заболеваемости и смертности. Экспериментальные исследования на животных показали, что длительное воздействие высоких доз белка может вызывать клубочковую гиперфильтрацию и экспрессию провоспалительных генов — факторы риска прогрессии ХБП. Несколько исследований, проведенных в человеческой популяции, показали, что высокобелковая диета может вызывать протеинурию, которая также является независимым фактором риска нарушения почечной функции, однако не все ученые подтвердили эти данные. Исходя из этого, текущие рекомендации KDIGO (Kidney Disease: Improving Global Outcomes ) рекомендуют снижать потребление белка до менее чем 1,3 г/кг в сутки лицам с наличием риска развития ХБП и уменьшить прием белковой пищи до 0,6–0,8 г/кг в сутки пациентам с СД 2 типа или СКФ < 30 мл/мин / 1,73 м2. В интервенционном исследовании MDRD (The Modification of Diet in Renal Disease) было предложено, что ограничения в приеме белка могут уменьшить скорость нарушения почечной функции у пациентов с СКФ между 25 и 55 мл/мин / 1,73 м2. Остается нерешенным вопрос о том, влияет ли благоприятно ограничение белкового питания на состояние почечной функции у лиц с нормальной или незначительной сниженной СКФ. Более того, нет данных, утверждающих о наличии различий в ограничении белков животного или растительного происхождения.
Заключение
Повышенное потребление белка (более 0,8 г/кг в сутки) может повышать мышечную массу в ходе упражнений с сопротивлениями у молодых мужчин и в какой-то степени ослаблять потерю нежировой массы и мышечной массы у людей с ожирением, однако данные рандомизированных контролируемых исследований не подтверждают благоприятные эффекты высокобелковой диеты на общую нежировую массу или мышечную массу в ходе поддержания или набора веса, а также положительное влияние на физическое функционирование и повседневную активность.
За счет повышения уровней инсулина и глюкагона и нарушения работы инсулина на фоне высокобелковой диеты возникает повышение риска развития предиабета и СД 2 типа. Вдобавок, несмотря на снижение массы тела при белковом питании, отсутствие ограничения углеводов в диете неблагоприятно сказывается на метаболизме глюкозы. Однако у лиц с ожирением и СД 2 типа использование высокобелковой низкоуглеводной диеты улучшает постпрандиальные показатели гликемии и секреции инсулина, что может быть использовано в лечении данных состояний.
Повышенное потребление белка может нарушать функцию почек и ухудшать показатель СКФ у лиц с уже установленным диагнозом ХБП.
Таким образом, высокобелковая диета не является абсолютно безопасной, лишь отдельные строгие показания к данной диете имеют основания быть на сегодняшний день.
Источник:
Mittendorfer B., Klein S., Fontana L. A word of caution against excessive protein intake //Nature Reviews Endocrinology. – 2019. – С. 1-8
