Метаболизм и архитектура хроматиновых доменов
Количество метаболитов, регулирующих гистоновые модификации, должно находиться в равновесии. Их недостаток или избыток меняет паттерн модификации гистонов и других белков — в определенных местах генома или глобально, — влияя на архитектуру хроматиновых доменов и активность транспозонов. Давайте рассмотрим пару примеров такой регуляции для гетерохроматина: конститутивного, отмеченного H3K9me2/3; и факультативного, метка которого — H3K27me3.
Как утихомирить транспозоны при недостатке метаболитов метилирования?
Гетерохроматин, отмеченный ди- или триметилированием гистона H3 по девятому лизину (H3K9me2/3) — самый компактный тип хроматина. Его много на мобильных элементах генома, чтобы они помалкивали и не высовывались (то есть не экспрессировались). Значительная часть гистона H3, прежде чем попасть в такой хроматин, монометилируется по девятому лизину, а уже в нуклеосомах дополнительно ди- и триметилируется [12–14].
Что происходит с таким гетерохроматином при недостатке S-аденозилметионина (рис. 2)? Неудивительно, что метки H3K9me2/3 при этом становится меньше : ведь SAM — это источник метильных групп. Однако это компенсируется монометилированным вариантом этого же гистона, количество которого возрастает в том числе и на мобильных элементах генома, расположенных в гетерохроматине, что не дает им активироваться. Это очень важно, поскольку повышенная экспрессия транспозонов может вести к рекомбинации, мутациям и нестабильности генома — прямая дорога к заболеваниям, в том числе и раку.
На наших гистонах не хватает метильных групп. Пожалуйста, заплатите налоги!
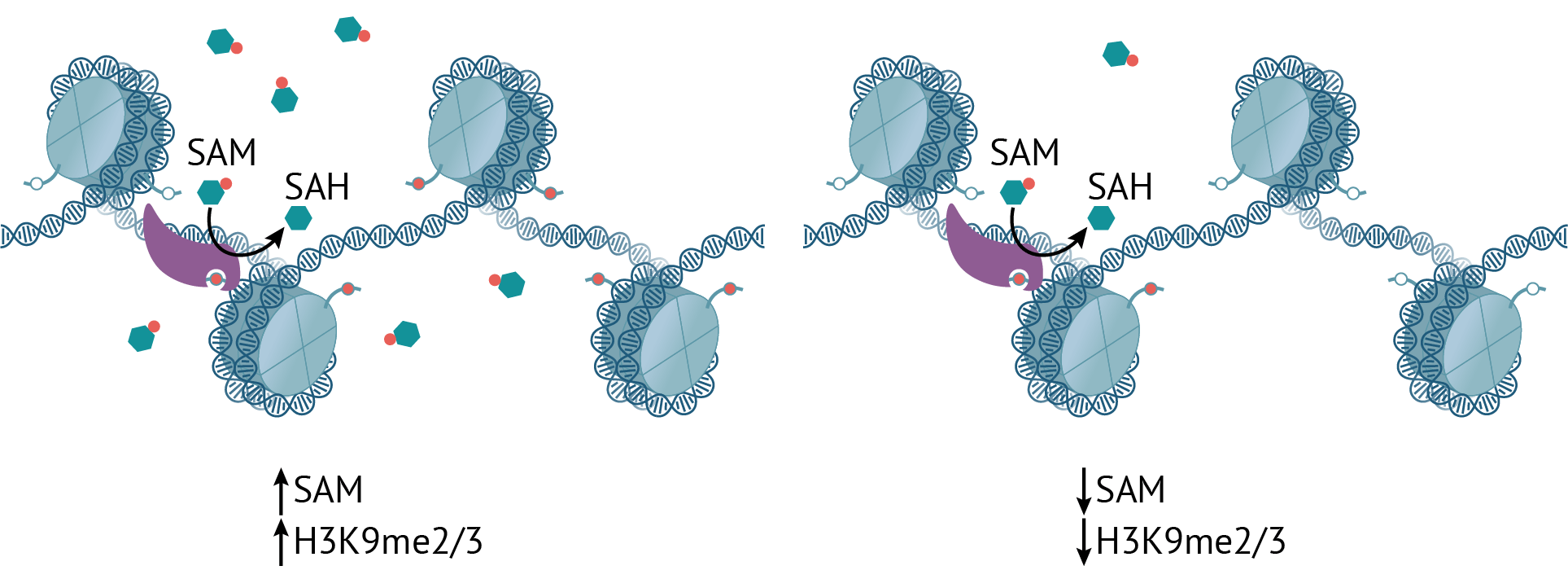
Рисунок 2. При избытке SAM метки H3K9me2/3 становится больше и наоборот. (Однако монометилирование стабильно сохраняется — это важно.)
иллюстрация Михаила Гурьева по [15]
Интересно, что сохранение монометилирования на гистонах нужно не только для подавления активности мобильных элементов, но и чтобы гистоны потом можно было ди- и триметилировать обратно, когда уровень SAM снова поднимется: вообще неметилированный H3K9 восстанавливается до уровня me2/3 крайней неохотно [15].
Метаболиты основных энергетических путей регулируют метку Polycomb
Теперь второй пример. Синтез важных энергетических молекул в клетке может усиливаться благодаря не только соединениям, непосредственно вовлеченным в дыхание, но и их предшественникам. Например, ɑ-кетоглутарат — одно из промежуточных веществ цикла Кребса — может синтезироваться из глутамата, а нарушения его уровня особенно критичны для варолиева моста, приводя к летальным опухолям (глиомам) у детей. В этих опухолях часто происходит гистоновая мутация лизина в метионин H3K27→H3M27 (но не во всех генах гистонов), что не позволяет остатку K27 триметилироваться под влиянием комплекса Polycomb. Более того, присутствие даже небольшого количества H3M27 ингибирует фермент, навешивающий метильные группы на H3K27, и глобально уровень метки падает почти до нуля.
Исследователи сравнили уровни метаболитов в клетках с нормальным гистоном H3 и мутантным H3K27→H3M27 (в клеточных культурах и прямо на пациентах). Выяснилась интересная вещь: при мутации повышались метаболиты гликолиза и цикла Кребса, а также уровень глутамина. Ученые попробовали вышибить клин клином: искусственно снизили метаболизм глутамина и эффективность некоторых стадий гликолиза и цикла Кребса. Что же оказалось? Уровень метки H3K27me3 на остатке лизина K27 (не весь он мутирует в метионин) повышался. А когда мышей с диффузной внутренней глиомой моста мозга кормили ингибиторами метаболизма, их выживаемость увеличивалась — рак отступал [16]. Следовательно, снижение уровня метки H3K27me3 при данной опухоли происходит не только из-за мутации, но и под влиянием сбоя в метаболизме. Более того, поправив метаболизм, можно и восстановить уровень H3K27me3, и подлечить глиому у мышей. Это потенциальный вариант терапии и для опухолей у детей.
База для химиотерапии: как метаболиты убивают раковые клетки, прицельно ингибируя репарацию и репликацию
Мы уже выяснили, что метаболиты могут влиять на гистоновые модификации, а, следовательно, на архитектуру хроматиновых доменов и на процессы, происходящие на хроматине (например, починку ДНК [3]). В частности, ɑ-кетоглутарат (метаболит цикла Кребса) служит кофактором для фермента гистонлизиндеметилазы, которая «сбривает» метильные группы с гистонов. Однако сбой в метаболизме может привести к накоплению не ɑ-кето-, а ɑ-гидроксиглутарата , что застопорит фермент и остановит репарацию ДНК. Последствия у этого могут быть самые тревожные: например, образование опухолей.
Мутации в ключевом ферменте метаболизма ɑ-кетоглутарата — изоцитратдегидрогеназе — могут привести к образованию другого продукта: ɑ-гидроксиглутарата. Схожая по химической структуре с «нормальным» метаболитом, эта молекула выступает уже не кофактором, а ингибитором гистондеметилазы, что повышает фон метильных меток H3K9me3 и ведет к остановке репарации. Помимо этого побочного продукта «сбойного» цикла Кребса, тот же эффект может дать накопление его нормальных метаболитов — сукцината и фумарата, — если мутированы какие-то ферменты, отвечающие за их превращения.
Как мы пояснили в сноске выше, ɑ-гидроксиглутарат, сукцинат и фумарат тормозят репарацию ДНК по образцу гомологичной цепи, ингибируя гистонлизиндеметилазу [17–19]. В результате уровень метки H3K9me3 в области повреждения ДНК остается постоянно высоким, в то время как в норме должен бы кратковременно подскочить сразу после разрыва. Этот «скачок» метилирования H3K9 служит сигналом для белков репарации — ну а когда этого сигнала нет, и репарация идет не так эффективно. А когда нет репарации, остается всего один шаг до мутаций и нестабильности генома, поскольку ошибки в ДНК не исправляются. Возможно, такой переключатель в метаболизме удастся использовать для лечения рака: многие лекарства от рака ингибируют репарацию раковых клеток, убивая их — так действуют некоторые виды химиотерапии [19].
Гидроксимочевина — препарат химиотерапии, назначаемый при многих видах рака, включая меланому и опухоли мозга. Оказывается, во многих раковых клетках не действует гомологичная рекомбинация , [20], а потому гораздо хуже работают репарационные механизмы. Это делает их уязвимыми для лечения гидроксимочевиной, воздействие которой в условиях выключенной репарации ведет к деградации новосинтезированной ДНК, мутациям и нестабильности генома раковых клеток.
В нормальных же клетках гомологичная рекомбинация работает, и новосинтезированная ДНК не деградирует. Конечно, раковые клетки не могут «не понимать» причин своей уязвимости, а потому в ответ на химиотерапию часто возникает резистентность — когда восстанавливается гомологичная рекомбинация, и «химия» перестает действовать.
А дело всё в том, что гидроксимочевина не только ингибирует репликацию. Помимо этого, она еще трансформирует метаболизм на накопление активных форм кислорода, запускающих каскады, приводящие к деградации новосинтезированной ДНК — но только в тех клетках, где нет гомологичной рекомбинации [21].
Влияние метаболизма на эпигеном половых клеток: метаболизм и наследование
Французский ученый Жан-Батист Ламарк постулировал, что приобретенные черты организмов могут передаваться последующим поколениям. Он приводил в пример жирафа, который объедает листья с высоких деревьев, и чья шея постепенно вытягивается в ряду поколений. Обычно ламаркизм противопоставляют общепринятому в биологии дарвинизму — согласно последнему, у жирафа длинная шея не потому, что она удлинилась и передалась по наследству, а потому что вследствие естественной изменчивости появляются особи с чуть более длинными шеями, которые и получают преимущество в конкурентной борьбе, а потому оставляют больше потомства, чем их короткошеие собратья, закрепляя удачный признак в поколениях. Но так ли был неправ Ламарк?
Нужно отметить, что ламаркизм довольно-таки распространен у микроорганизмов (хотя сами они об этом и не подозревают) — речь тут о горизонтальном переносе генов, играющем решающую роль в молекулярной эволюции микроорганизмов [22]. Похоже, отчасти он встречается и у эукариот, хотя его и не стоит понимать настолько буквально, как в примере с жирафом. Дело в том, что воздействие определенных веществ может поменять эпигеном половых клеток и оказать влияние на несколько последующих поколений [23]. Как именно осуществляется такое влияние?
В настоящее время изучено несколько основных «посредников» эпигенома, через которые метаболические влияния передаются потомству (рис. 3).
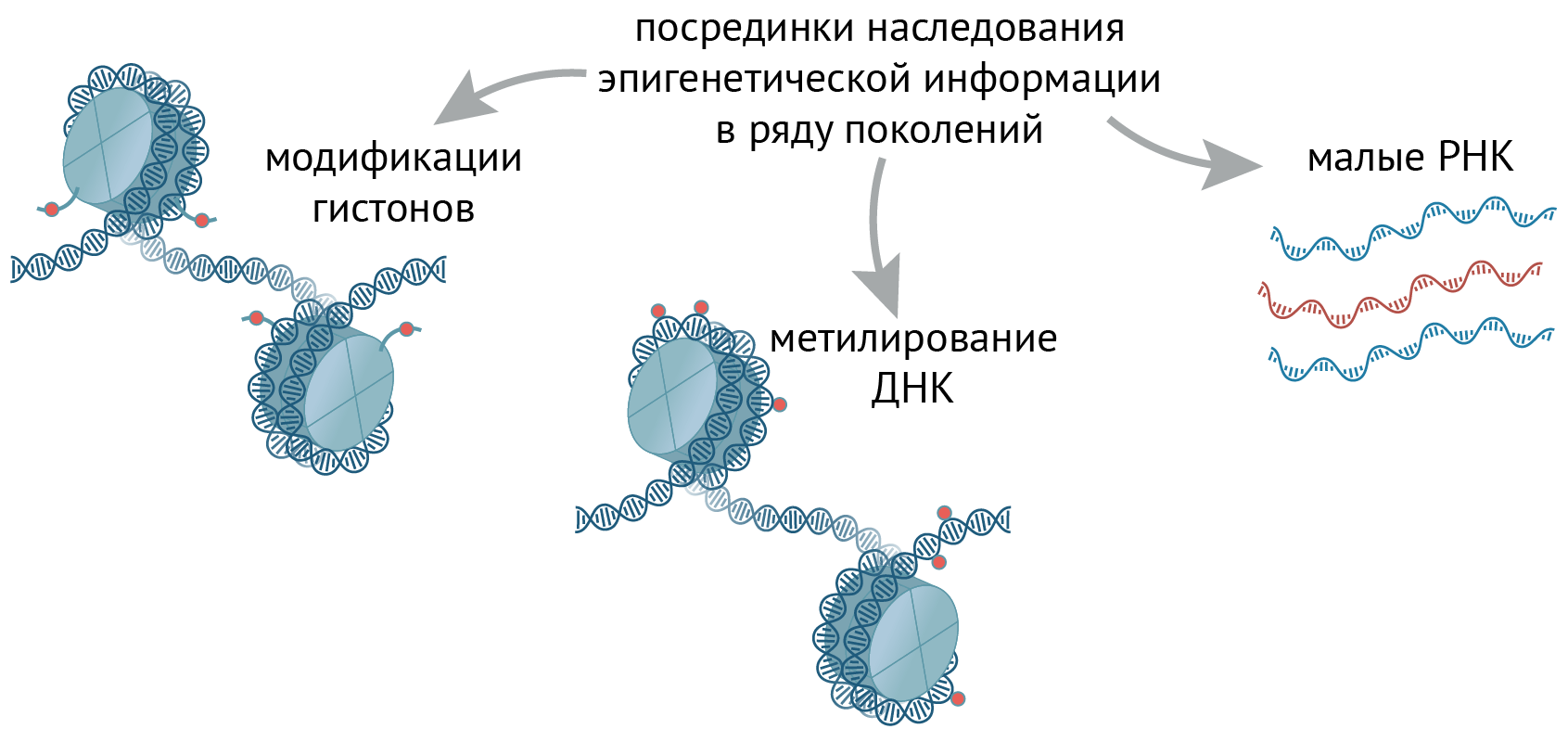
Рисунок 3. Посредники наследования эпигенетической информации в ряду поколений. Эпигенетическая информация может передаваться через модификации гистонов, метилирование ДНК или малые РНК.
иллюстрация Михаила Гурьева по [33]
Во-первых, это гистоны. Несмотря на то, что, например, в сперме большая часть гистонов заменяется другими «упаковочными» белками — протаминами, — 1–15% гистонов всё-таки там остается. Видимо, этого уже достаточно: надежно показано, что манипуляции гистоновыми модификациями в половых клетках оказывают влияние на несколько последующих поколений [23–26]. Как мы уже разобрали, метаболизм может напрямую влиять на модификации гистонов, и избыток или недостаток определенных метаболитов в половых клетках может оказывать влияние на потомство — но только если изменения произойдут в половых клетках; тот же эффект в клетках соматических не отразится на детях.
Например, уровень фолиевой кислоты — витамина, который рекомендуют принимать всем беременным, — влияет на количество S-аденозилметионина (донора метильной группы для метилтрансфераз) и, следовательно, на метилирование гистонов. Также у потомков самцов мышей, в рационе которых не хватало этого витамина, наблюдались аномалии развития скелета, дополнительно усиливавшиеся, если в сперматозоидах активировали деметилирование гистонов . Возможно, именно из-за метилирования гистонов беременным так необходима фолиевая кислота (особенно в первые 6 недель беременности — если ее не принимать, возникает риск врожденных пороков у плода) [27], [28].
Мало того: недостаток фолата снижает уровень метки H3K4me3 только на определенных участках — промоторах и энхансерах, важных для развития эмбриона и передающихся ему через половую клетку [29].
Во-вторых, это метилирование ДНК (рис. 3). С ним всё еще сложнее, чем с гистонами, которых мало остается в сперме. Дело в том, что есть два момента, когда метилирование практически полностью стирается, а потом «пишется» заново: один — во время развития половых клеток, а второй — в раннем развитии эмбриона (и мы рассказывали об этом в статье «Наследование и эпигеном» [2]). Метилирование ДНК в эмбриогенезе остается неизменным только в участках контроля импринтинга (УКИ — и они разные у разных полов) и некоторых повторяющихся элементах генома. Метилирование ДНК в половых клетках может меняться в ответ на определенные метаболические стимулы — например, избыток фталата меняет метилирование ретроэлементов LINE-1 [23], [30] (см. статью «Процессы и эпигеном» [3]).
В-третьих, стоит упомянуть малые РНК (рис. 3) (см. статью «Наследование и эпигеном» [2]). Даже несмотря на то, что у млекопитающих нет РНК-зависимой РНК-полимеразы (и малые РНК не могут копироваться независимо от генома), они влияют на хроматин, экспрессию генов и на фенотип последующих поколений, когда присутствуют в половых клетках. Более того: уровень малых РНК в половых клетках колеблется вслед за концентрациями метаболитов. Например, диета с высоким содержанием жира влияла на содержание некоторых микро-РНК и фрагментов тРНК в сперме самцов мышей и крыс, а еще вызывала нетолерантность их потомства к глюкозе [23], [31–33]. Механизмы влияния метаболизма на РНК могут быть самыми разными — от изменения транскрипции (например, воздействуя на транскрипционные факторы) до влияния на их биогенез и трансляцию [33].
Эпигеном половых клеток очень чувствителен к метаболическим стимулам, и то, как мы питаемся, занимаемся ли спортом, курим ли и употребляем алкоголь, с какими веществами сталкиваемся в течение жизни — всё это влияет на наше потомство. У крыс, например, если самкам перед оплодотворением давать задания на пространственное обучение, это повысит соответствующие навыки потомства женского пола. Получается, сигналы от нейронов каким-то образом достигают и половых клеток (возможно, в форме метаболитов) и перепрограммируют их [34], [35]. Бывает и такое.
Продолжение следует…
