Химики самые, самые…
Имей в виду, — сказали Льву все звери и птицы, — теперь, когда ты избран царем зверей и птиц, ты должен стараться быть самым смелым, самым сильным, самым мудрым и самым красивым!
— Нечего мне стараться! — ответил Лев. — Раз вы меня избрали царем зверей и птиц, значит, я и есть самый смелый, самый сильный, самый мудрый и самый красивый!
Василий Ливанов. Сказка «Самый, самый, самый, самый…»
Среди спортсменов более всего повезло, пожалуй, легкоатлетам, их результаты фиксируются в метрах или секундах, чаще в сантиметрах или долях секунды. В похожей ситуации оказываются тяжелоатлеты, их достижения оцениваются килограммами, т. е. имеется точная количественная мера. Казалось бы, такая же оценка существует и в игровых видах спорта, итоговый счет однозначно выявляет победителя (если это не ничья), однако постоянное вмешательство судий в ход игры часто приводит к тому, что горечь поражения сопровождается обвинениями в предвзятости судейства. Более трудная ситуация у фигуристов или, например, у гимнастов. Результат их выступлений определяет группа судей, выставляющих очки. Всегда существует вероятность, что кто-то окажется необъективным. Справедливости ради отметим, что фигурист, не освоивший обязательные элементы, предусмотренные программой соревнований, никогда не сможет занять призовое место. Таким образом, победить слабые участники не могут, зато среди наиболее достойных распределение мест нередко вызывает недовольство и после соревнований начинаются бурные обсуждения и обвинения в необъективности.
Перейдем к химикам: как определить самых лучших из них? Этот вопрос, очевидно, должна решать авторитетная комиссия, и она существует — Нобелевский комитет, который начиная с 1901 года ежегодно называет самых достойных. Нобелевская премия общепризнанно считается наивысшей оценкой деятельности ученого. Всегда ли она присуждается справедливо? Об этом поговорим позже.
Не следует думать, что современная химия ушла в высоконаучные дебри и понять существо работы может только высокопрофессиональный специалист. Часто ученый, получивший Нобелевскую премию, прикладывает специальные усилия, чтобы его работа была понятна широкому кругу читателей. Благодаря этому все интересующиеся имеют возможность ознакомиться с самыми лучшими работами последних лет. Кроме того, личность нобелевского лауреата и его путь к достигнутым результатам часто оказываются не менее интересными, чем сама работа.
Драма нобелевской химии
Незачем скорбеть о досаждающих нам переменах, ибо перемены — основа жизни.
Из уст маститых ученых часто можно слышать, что деление химии на органическую, неорганическую, полимерную, аналитическую весьма условно. Химия едина! Например, академик Ю.А. Золотов напоминает, что границы между смежными науками никогда не были четкими, потому что природа вообще не знает придуманного нами деления на дисциплины.
Это, безусловно, верно, но возникло деление химии на различные дисциплины не случайно и отказаться от него довольно трудно. Химику-органику совсем не просто читать монографию по геохимии или вникать в статью по химии металлических сплавов; совсем иной образ мыслей, другой язык, малознакомые экспериментальные методики и способы представления результатов. Специализация химика в определенном направлении совсем не мешает работе, скорее наоборот, помогает совершенствоваться. Обсуждать это вряд ли имело бы смысл, если бы не одна грустная деталь. Альфред Нобель в своем завещании упомянул химию, никак не разделяя ее на отдельные дисциплины, а вот к чему это привело — судите сами. С начала XXI в. премии за биохимические работы присуждались уже десять (!) раз!
Традиционно Нобелевскую премию считают индикатором высоких достижений, она отмечает заметные вехи в развитии науки, дает возможность каждому ученому повысить свои знания и эрудицию. В крупных научных центрах принято приглашать очередного лауреата выступить с лекцией, некоторые институты проводят специальные семинары для знакомства с содержанием премированной работы, но в последние годы эта традиция почти исчезла.
Все дело в том, что биохимия и ее современная ветвь — молекулярная биология — весьма специфичны. Не только круг изучаемых объектов, но и сам язык этой науки заметно отличается от того, к чему привыкли остальные химики. Традиционный язык химии — это химические формулы, благодаря которым химики всего мира легко понимают друг друга, но именно химических формул в работах по биохимии вы практически не увидите. Обычно состав молекулы полипептида (белка) изображают в виде слагающих эту молекулу аминокислот, обозначенных буквенными сочетаниями, например ЛЕЙ-АЛА-ФЕН-ГЛИ-АЛА-АЛА, но, скорее всего, вам придется разглядывать ленточки, полоски, жгутики и спирали.
Такой способ, помогающий изобразить структуру биополимеров, предложил в свое время американский биофизик Джейн Ричардсон. Это компактный и, безусловно, удобный (для биохимиков) способ записи, но весьма непривычный для большинства химиков. Потому знакомство с очередным достижением химии, отмеченным престижной премией, большинство химиков ограничивает чтением всего одного краткого сообщения, в котором сказано, за что именно присуждена эта премия (и не более того).
Понятно, что в сложившейся ситуации никак не виноваты сами биохимики, они делают свое трудное и интересное дело, не помышляя ни о каких премиях. «Обычные» химики тоже не виноваты; яркие звезды, загорающиеся на небосклоне химии (ферроцен, карборан, фуллерен) и создающие новые главы химической науки, появляются, к сожалению, не каждое десятилетие и, увы, непредсказуемо, что, кстати, делает научный поиск интереснее. Не только новые необычные соединения заслуживают награды. Если спросить самих химиков, то они назовут массу вполне достойных исследований, в том числе новых реакций и катализаторов.
Нобелевский комитет тоже не в чем упрекнуть: обычные люди никак не виноваты в том, что гораздо большее впечатление на них производят те биохимические работы, которые открывают способы лечения таких заболеваний, как болезнь Паркинсона, болезнь Альцгеймера, некоторые онкологические заболевания.
Преимущественное внимание членов Нобелевского комитета к биохимическим работам усиливается дополнительно следующим обстоятельством. Все лауреаты Нобелевских премий прежних лет имеют право номинировать кандидатов на эту премию (предлагать кандидатуры для очередного рассмотрения). Среди них с каждым годом все больше биохимиков, и, естественно, они предлагают к номинированию тех ученых, работы которых им хорошо знакомы и достоинства которых им известны.
Именно эта ситуация позволила Роалду Хофману (лауреат Нобелевской премии 1981 года по химии) с грустью отметить, что решение о присуждении Нобелевских премий принимает весьма ограниченное число людей, у которых собственное представление о том, что такое химия, и которое вовсе не представляет собой результат единодушия мирового сообщества химиков. Хофман отмечет, что не согласен, например, с тем, что молекулярная биология и биохимия — это часть химии. Впрочем, добавляет Хофман, премии достаются действительно прекрасным работам в этой области, которыми он искренне восхищается.
Можно предположить, что подобная проблема зреет и в недрах других дисциплин: физики тоже, скорее всего, готовы посетовать на то, что астрофизика с ее нейтринной астрономией, рентгеновскими телескопами и исследованиями космического излучения постепенно захватывает монополию на премии.
Впрочем, есть выход — ввести новые номинации так, как это было сделано в 1969 году, когда начали присуждать Нобелевские премии по экономике (не упомянутой в завещании А. Нобеля), но это, к сожалению, не нам решать.
Отложим на время наши переживания, связанные с тем, что обычная химия оказалась в тени набирающей силу биохимии, и познакомимся поближе с некоторыми работами, тем более что многие из них настолько эффектны, что могут произвести впечатление даже на людей, далеких от науки.
Вначале отдадим дань уважения современному лидеру в мире Нобелевских премий, т. е. биохимии.
Одна молекула и семь нобелевских лауреатов
В истории химии случались события, по своему драматизму напоминавшие штурм неприступной вершины, на которую пытались взойти одновременно независимые группы альпинистов по различным маршрутам. Все это сопровождалось обстановкой состязания — кто взойдет на вершину первым.
Речь пойдет о синтезе инсулина — событии, ставшем заметным достижением в химии. Точно так же, как перед штурмом вершины альпинисты создают базовые, промежуточные и штурмовые лагеря, синтез инсулина был хорошо подготовлен, но не теми, кто вышел на покорение вершины, а основательными работами исследователей-предшественников. Можно уверенно сказать, что создание исходного плацдарма впечатляет не меньше, чем последующий штурм. Развитие химии инсулина напоминает приключенческий роман, получивший в наши дни совершенно неожиданное продолжение, которое совершенно не могли предугадать покорители этой вершины. Инсулин по праву можно назвать популярнейшей молекулой ХХ в.: с исследованиями этого соединения связаны имена семи (!) нобелевских лауреатов.
Белок, спасающий жизнь
В середине ХХ в. инсулин был одним из наиболее интенсивно изучаемых веществ. Причина в том, что удалось объяснить происхождение одного из тяжелейших заболеваний — сахарного диабета. Болезнь возникает, когда в организме недостаточно гормона инсулина (гормоны — это вещества, которые регулируют определенные биологические механизмы). Инсулин запускает процессы, обеспечивающие вход глюкозы в клетки, а также стимулирует внутриклеточные механизмы, позволяющие усваивать глюкозу.
При недостатке инсулина глюкоза не расходуется клетками, она накапливается в крови и начинает через почки поступать в мочу. Повышенный уровень глюкозы в крови и ее выведение с мочой приводят к похудению, чрезмерному мочеотделению, постоянному ощущению сильной жажды и голода. Организм старается компенсировать дефицит калорий, которые он теряет с мочой в виде глюкозы, и начинает использовать жировые запасы и тканевые белки (главным образом мышечные). Возникают утомление, сонливость, тошнота, все это завершается состоянием комы и при отсутствии лечения — смертью.
Сахарный диабет встречается среди населения всех стран и у представителей всех рас. Самое раннее описание этого заболевания было сделано примерно 3000 лет назад в Древней Индии. Более подробные симптомы болезни (обильное мочеотделение, чрезмерная жажда и потеря веса) были описаны в I в. н. э., болезнь получила свое название от греческого слова diabetes, что означает «протекание» (имеется в виду чрезмерное мочеотделение).
Планомерное изучение этого заболевания длилось не одно столетие. В XVII в. английский врач Т. Уиллис обратил внимание, что моча у пациентов с такими симптомами имеет сладковатый вкус (проделать подобный анализ может только истинный ученый). Картина начала проясняться после опытов французского физиолога Клода Бернара (1813–1878), он наблюдал собак с удаленной поджелудочной железой. Его опыты продолжили в 1889 году немецкие физиологи Йозеф фон Меринг и Оскар Минковский: они удаляли хирургически поджелудочную железу у собак и затем наблюдали у них резкий подъем концентрации глюкозы в крови и моче, а также наличие симптомов сахарного диабета. Таким образом, они экспериментально доказали связь между поджелудочной железой и сахарным диабетом.
Некоторые физиологи начали высказывать предположение, что поджелудочная железа вырабатывает вещество, которое способствует усваиванию в организме глюкозы. В 1916 году немецкий физиолог Шарпи-Шафер назвал это неизвестное пока вещество инсулином (от лат. insula — островок, поскольку отчетливо наблюдаемые группы клеток поджелудочной железы к этому моменту именовали островками Лангерганса). Это было только предположение, которое впоследствии полностью подтвердилось.
В 1921 году трое канадских исследователей: профессор физиологии Джон Маклеод (рис. 5.1) из Университета Торонто, Канада, врач-хирург Фредерик Бантинг (рис. 5.2) и врачфизиолог Чарлз Герберт Бест (рис. 5.3) сумели выделить инсулин из поджелудочной железы подопытных животных. Первые же опыты по введению полученного препарата собакам с удаленной поджелудочной железой показали, что уровень сахара в крови животных резко снижается и общее состояние улучшается.
11 января 1922 года (знаменательный факт в истории мировой медицины) инсулин был введен первому пациенту — 14-летнему Леонарду Томпсону, страдавшему тяжелой формой диабета (рис. 5.5). Успех был потрясающим! Измученный худой мальчишка, весивший 29,5 кг, которому оставалось жить несколько месяцев, стал поправляться на глазах (рис. 5.4). За 24 часа содержание сахара в крови снизилось в четыре раза.

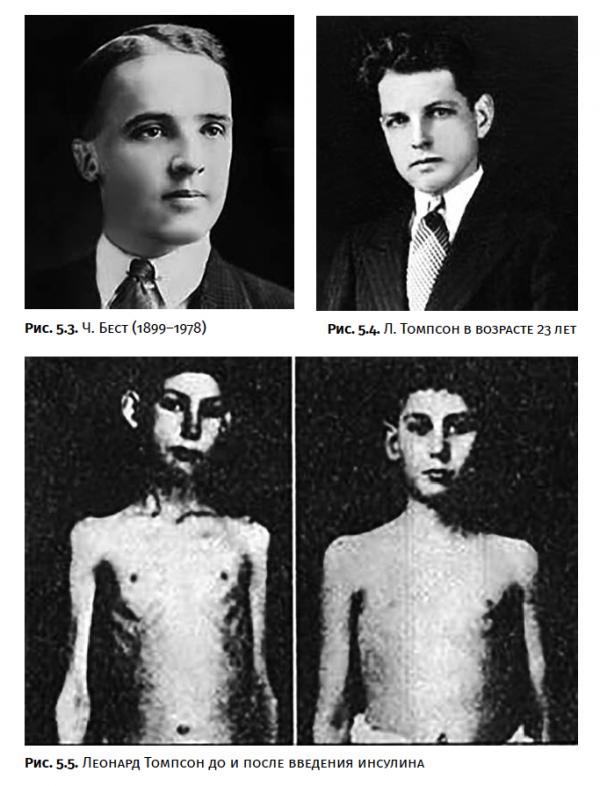
Затем были проведены аналогичные испытания еще на нескольких пациентах. Возникло новое направление в медицинской науке — гормонотерапия. В 1923 году Дж. Маклеод и Ф. Бантинг были удостоены Нобелевской премии по физиологии и медицине «За открытие инсулина». Третий участник этой работы — Ч. Бест не оказался в списке лауреатов, и Бантинг отдал ему половину полученных денег (жест, достойный истинного ученого).
В 1926 году было налажено серийное производство инсулина, многие тысячи больных сахарным диабетом, ранее обреченных на смерть, были спасены и смогли вести нормальную жизнь, необходимо было лишь регулярно вводить лекарство.
Несмотря на то что способ лечения был найден, диабет и в настоящее время относят к серьезным заболеваниям, а больным людям требуется исключительно внимательное отношение. Например, в Же невской конвенции по обращению с военнопленными (была принята ООН 12 августа 1949 года) специально отмечено, что непосредственной репатриации (возвращению на родину) подлежат люди с тяжелыми болезнями обмена веществ, такими, например, как сахарный диабет, требующий лечения инсулином.
От медицины — к химии
Ранее упомянутые физиологи Маклеод и Бантинг использовали для лечения больных экстракт поджелудочной железы животных, однако химиков всегда интересовало, как именно устроено то или иное соединение. Впервые инсулин в кристаллическом виде сумел выделить в 1926 году Дж. Абель, и именно благодаря работам Абеля удалось наладить его промышленное производство. Абель также определил состав инсулина: оказалось, что он представляет собой белковую молекулу. Начиная с этого момента исследования инсулина из медицины переходят в область химии, точнее в руки биохимиков.

Все предыдущие работы подготовили решающий этап, позволивший выяснить, как устроена молекула, привлекавшая внимание столь большого числа исследователей. Решить эту задачу удалось английскому биохимику Фредерику Сенгеру (рис. 5.6), которому в 1958 году была присуждена Нобелевская премия «За работы по структуре протеинов, особенно инсулина». Вначале он разработал способ, позволявший установить природу концевой группы в белковой молекуле путем обработки в щелочной среде динитрофторбензолом (впоследствии этот метод стал классическим). Далее Сенгер буквально разобрал на части молекулу инсулина и определил состав полученных аминокислот с помощью самых современных методов — электрофореза, разработанного А. Тиселиусом (нобелевский лауреат 1948 года), и хроматографии, усовершенствованной А. Мартином и Р. Сингом (нобелевские лауреаты 1952 года). Однако установить, из каких аминокислот собрана белковая молекула, — лишь половина дела, притом менее сложная. Главное — выяснить их последовательность в цепи. Сенгер разработал продуманный план, по которому с помощью специально подобранных ферментов (биологические катализаторы) он проводил расщепление цепи в различных заранее намеченных участках на небольшие отрезки, а потом сопоставлял их состав. Работа представляла собой безупречное сочетание логики и экспериментального мастерства. Свой метод Сенгер довел до совершенства, со временем его методика стала общим принципом при исследовании структуры белков.
Попутно отметим, что Сенгер на этом не остановился. Применив похожие логические построения, а также несколько изменив методику и используемые реагенты, он сумел установить последовательность фрагментов в структуре знаменитой двойной спирали ДНК. За эти исследования в 1980 году Сенгеру (совместно с У. Гилбертом и П. Бергом) была присуждена Нобелевская премия «За вклад в определение последовательности оснований в нуклеиновых кислотах». Таким образом, на сегодня Сенгер — единственный дважды нобелевский лауреат по химии.
Никто в то время не мог предположить, что эти исследования ДНК позволят со временем открыть новую страницу в химии инсулина, но об этом речь пойдет несколько позже.
Американский биохимик Винсент дю Виньо (рис. 5.7), в течение нескольких лет изучавший инсулин, узнав о работах Сенгера по расшифровке структуры, решил воспользоваться его методикой и пошел дальше: не только установил строение двух гормонов (вазопрессина и окситоцина), но и сумел их синтезировать. Фактически он был первым, кто сумел синтезировать природные полипептиды. Эта его работа была отмечена Нобелевской премией в 1955 году, в итоге он получил премию на три года раньше Сенгера, чьи идеи помогли ему добиться столь великолепного результата. Работы дю Виньо фактически открыли дорогу синтезу инсулина. Впрочем, молекула инсулина была более сложной, чем два полученных им соединения, кроме того, в то время еще не были разработаны способы, позволяющие связать две полипептидные цепи дисульфидными мостиками, т. е. перемычками –S–S–.
Тем временем изучение инсулина продолжалось. Исследование его лечебных свойств позволило установить, что цинковый комплекс из нескольких молекул — Zn-инсулин — обладает более длительным лечебным действием. Строение этого комплекса оказалось очень сложным (он содержит почти 800 атомов), поэтому были привлечены физико-химические методы анализа. В 1972 году английский биофизик Д. Кроуфут-Ходжкин (рис. 5.8), лауреат Нобелевской премии 1964 года («За определение с помощью рентгеновых лучей структур биологически активных веществ»), установила структуру этого необычайно сложного комплекса.

Упрощенный язык биохимиков
Прежде чем мы рассмотрим строение молекулы инсулина, познакомимся вкратце с тем, как биохимики изображают молекулы белков. Все белки представляют собой полимеры, цепи которых собраны из фрагментов аминокислот. Аминокислоты — это органические соединения, содержащие в своем составе (в полном соответствии с названием) аминогруппу NH2 и органическую кислотную, т. е. карбоксильную, группу СООН. В образовании белков участвуют только такие аминокислоты, у которых между аминогруппой и карбоксильной группой всего один углеродный атом. В общем виде они могут быть представлены формулой H2N–CH(R)–COOH. Группа R, присоединенная к атому углерода (тому, который находится между аминогруппой и карбоксильной группой), определяет различие между аминокислотами, образующими белки. Эта группа может состоять только из атомов углерода и водорода, но чаще содержит помимо С и Н различные функциональные группы. Из всего многообразия существующих аминокислот (теоретически количество возможных аминокислот не ограничено) в образовании белков участвуют в большинстве случаев только 20 аминокислот, называемых фундаментальными. Для «строительства» инсулина природа использовала 16 аминокислот (из допустимых 20).
Большинство названий сложилось исторически, для их обозначения широко применяют трехбуквенные сокращения: глицин — ГЛИ, аланин — АЛА и т. д. В международной практике их обозначают с помощью латинских трехбуквенных сокращений: например, глицин — Gly, аланин — Ala и др.
Белковая молекула образуется в результате последовательного соединения аминокислот, при этом карбоксильная группа –COOH взаимодействует с аминогруппой –NH2 соседней молекулы, в результате образуется пептидная связь –CO–NH– и выделяется молекула воды. На рисунке 5.9 показано последовательное соединение аланина, валина и глицина.
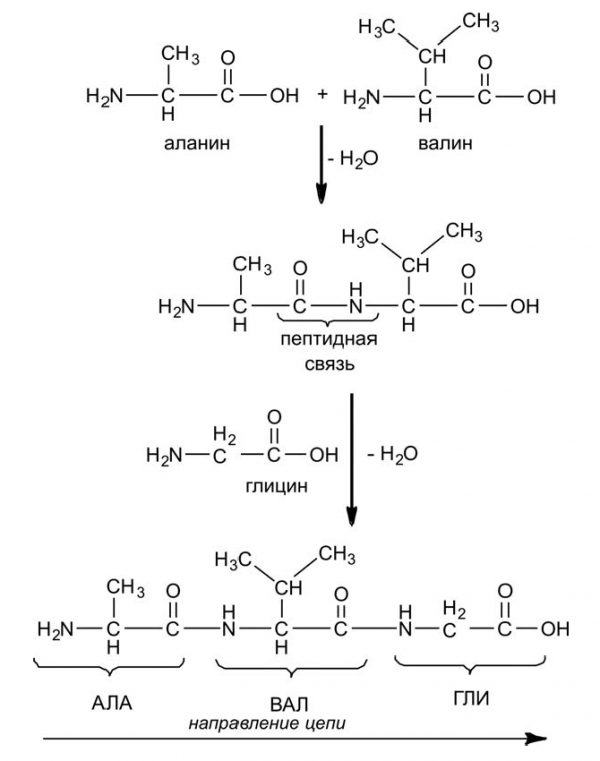
Из этой схемы следует, что при любом количестве соединяемых аминокислот на одном конце возникшей цепочки обязательно будет находиться аминогруппа –NH2, а на другом — карбоксильная группа –C(O)OH. Таким образом, вместо структурной формулы мы можем использовать сокращенное обозначение получившегося соединения: АЛА-ВАЛ-ГЛИ. Поскольку количество аминокислот, используемых природой, всего 20, то подобные сокращения позволяют компактно записать формулу любого белка и никакой неясности при этом не возникает.
Молекула инсулина, как установил Ф. Сенгер, состоит из 51 аминокислотного остатка (это один из самых короткоцепных белков) и представляет собой две соединенные между собой цепи неодинаковой длины. На рисунке 5.10 показан порядок чередования аминокислотных фрагментов, обозначенных трехбуквенными сокращениями.
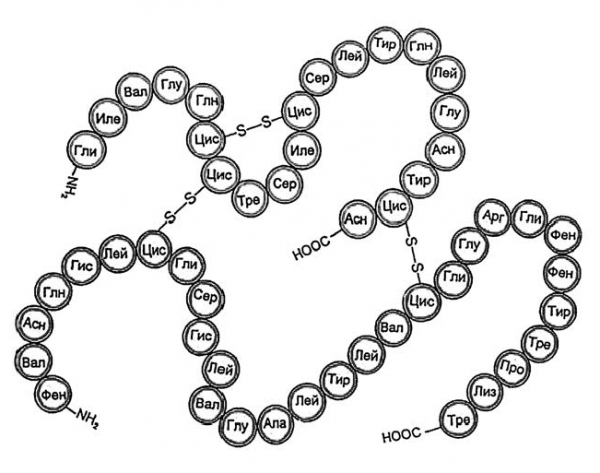
Обратите внимание: содержащиеся в цепи остатки аминокислоты цистеина (сокращенное обозначение ЦИС) образуют дисульфидные мостики –S–S–, которые связывают две полимерные молекулы и, кроме того, образуют перемычку внутри одной цепи. При таком компактном изображении белковой молекулы символы химических элементов используют только для обозначения дисульфидных мостиков и концевых групп (NH2 и COOH).
Для сравнения рассмотрите структурную формулу инсулина в виде объемной шаростержневой модели (рис. 5.11).
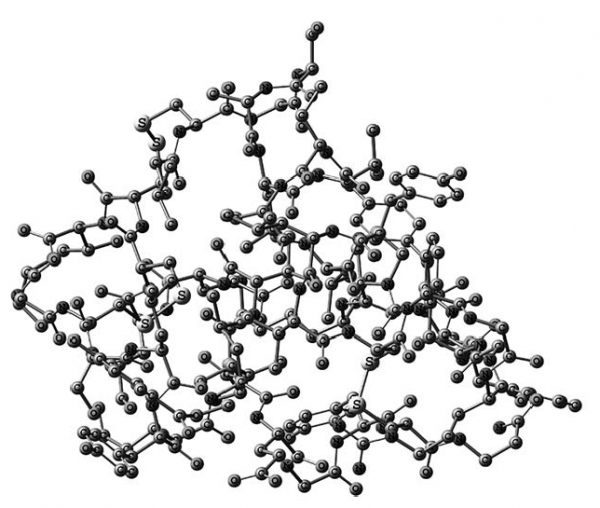
Согласитесь, что биохимики выбрали компактный и необычайно удобный способ изображения белковых молекул.
От демонтажа — к сборке
Казалось бы, после того как установлена структура молекулы, синтезировать ее заново не составит большого труда. Если какая-либо деталь собрана на резьбовых соединениях, то разобрать и собрать ее несложно, нужны лишь отвертка или гаечный ключ. Но если изделие представляет собой отливку или это сварное изделие, то разобрать (разрезать или распилить), а затем собрать его вновь совсем не просто. В этом случае разборка и сборка (по способам решения) совершенно разные задачи.
Основная трудность при сборке белковой молекулы — добиться, чтобы необходимые аминокислоты соединялись строго в намеченном порядке. Так как каждая аминокислота может реагировать не только с другой аминокислотой, но и сама с собой, то в итоге может получиться молекула, не имеющая ничего общего с тем, что синтезирует живой организм.
К моменту, когда решался вопрос о синтезе инсулина, было разработано несколько соответствующих методик. Чтобы аминокислота, которую необходимо присоединить к растущей цепи, не реагировала сама с собой, ее реакционноспособные концы (аминогруппу NH2 и карбоксильную группу СООН) блокировали специальным образом: карбоксильную группу переводили в n-нитрофениловый эфир NO2C6H4O–, а со стороны аминогруппы присоединяли карбоксибензильную группу –C(O)CH2C6H5. Такая блокированная с двух сторон молекула не может реагировать сама с собой, но зато она может реагировать со свободной аминогруппой, находящейся на конце растущей цепи, при этом «левая» блокировка удаляется в виде NO2C6H4OН (рис. 5.12).
На схеме (рис. 5.13) показано, что к растущей цепи, имеющей на конце фрагмент аланина (АЛА), присоединяется молекула глицина (ГЛИ), в результате растущая цепь удлиняется на одно звено. Однако теперь на конце цепи разместилась блокирующая карбоксибензильная группа –C(O)CH2C6H5. Из показанной выше схемы следует, что цепь наращивают аминокислотой со стороны «аминного хвоста» этой цепи, который оказался теперь заблокированным. Следовательно, нужно сделать этот «аминный хвост» реакционноспособным, т. е. перевести его в активную форму, что осуществляли обработкой бромоводородом с уксусной кислотой, блокировка при этом удаляется в виде Br-CH2C6H5 по схеме (рис. 5.13).
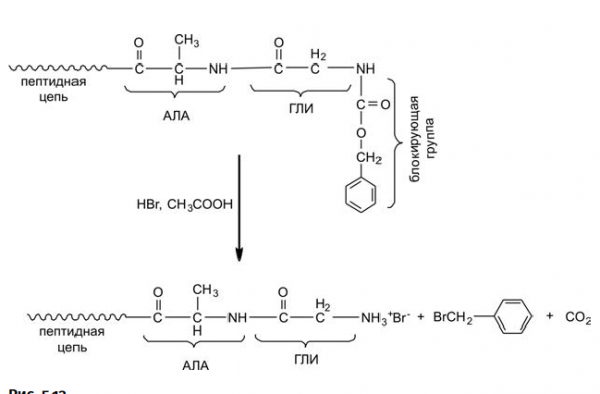
В результате аминогруппа на конце цепи (она показана в виде аммониевой соли с HBr) вновь готова реагировать с очередной аминокислотой (естественно, тоже содержащей блокирующие группы). Параллельно были разработаны и другие методы сборки полиамидных цепей.
Штурм вершины
К полному синтезу инсулина в 1962 году приступили практически одновременно три группы исследователей: группа Катосоянниса из Питтсбурга, США (рис. 5.14), группа Г. Цана из Аахена, Германия (рис. 5.15), а также группа китайских химиков из Шанхая и Пекина. Все три группы действовали по весьма похожим стратегиям: собрали отдельно короткую и длинную цепь из заготовленных фрагментов, а затем соединяли обе цепи дисульфидными мостиками.

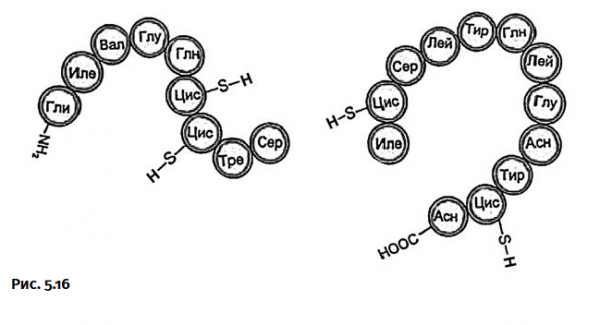
Короткую цепь все три группы химиков монтировали одинаково, из одних и тех же двух блоков (рис. 5.16).
Длинную цепь составляли из четырех фрагментов, однако перед синтезом необходимо было решить, из каких именно блоков ее следует собирать, и потому длинную цепь мысленно «разрезали», но места разреза каждая группа намечала по-своему. Различия возникли из-за того, что неодинаковы были и методы соединения блоков, и методы промежуточной защиты, используемые каждой из групп.
Естественно, на последнем этапе у всех авторов получились одинаковые молекулы. Приблизительно год ушел на создание исходных блоков. Подстегиваемая обстановкой соревнования аахенская группа интенсифицировала работу и в декабре 1963 года сообщила об успешном синтезе инсулина. Эта группа буквально вырвала первенство у питтсбургских химиков, которые сообщили об успешном результате в марте 1963 года. Окончательный выход чистого продукта колебался в пределах 0,02–0,07%. У китайских химиков выход был несколько выше (1,2–2,5%), но, разумеется, о производстве инсулина по таким методикам не могло быть и речи.
Синтез инсулина стал убедительной победой классической синтетической химии. Несмотря на низкий выход продукта, все признавали, что была проделана выдающаяся работа, которая позволила изменить образ мышления химиков, сформулировать новые принципы сборки больших молекул, отработать стратегию синтеза и подобрать оптимальные методики. Все это заметно повысило общий уровень органической химии. Однако истинного триумфа не получилось: почти одновременно с успешным завершением этих работ появилась принципиально иная, более совершенная методика сборки белковых молекул.
Главное — закрепить хвост
Профессор Рокфеллеровского университета из Нью-Йорка Роберт Меррифилд (рис. 5.17), занимаясь химией белков, высказал оригинальную идею: первую аминокислоту можно закрепить одним концом на некой нерастворимой поверхности (носителе). Затем следует присоединить к другому ее концу следующую аминокислоту, при этом нежелательные побочные продукты и промежуточные реагенты, не вступившие в реакцию, можно будет вымывать из реакционного сосуда после каждой стадии, а растущий полипептид, прикрепленный к носителю, останется при этом незатронутым. Молекулы растущих полипептидов будут подвешены «за хвост» к твердой поверхности носителя, а когда процесс синтеза завершится, конечный полипептид можно отделить от носителя.

Меррифилду удалось реализовать эту идею в 1965 году. Первую аминокислоту присоединяют к нерастворимому полимерному гелю (сшитый полистирол) с введенными в него хлорметильными группами –CH2Cl, которые способны реагировать с группами СООН аминокислоты. Чтобы взятая для реакции аминокислота не прореагировала сама с собой и не присоединилась своей H2N-группой к подложке, аминогруппу этой кислоты предварительно блокируют объемистым заместителем — [(С4Н9)3]3ОС(О)-группой. После того как аминокислота присоединилась к полимерной подложке, блокирующую группу удаляют и в реакционную смесь вводят другую аминокислоту, у которой также предварительно заблокирована H2N-группа. В такой системе возможно только взаимодействие H2N-группы первой аминокислоты и группы –СООН второй кислоты, которое проводят в присутствии катализаторов (солей фосфония). Далее всю схему повторяют, вводя третью аминокислоту.
На последней стадии полипептидные цепи отделяют от полистирольной подложки действием HBr в присутствии трифторуксусной кислоты F3CCOOH. Меррифилд не только экспериментально проверил эффективность метода, но и сконструировал аппарат, который практически автоматизировал пептидный синтез. Это устройство представляло собой контейнер для аминокислот и реагентов, а также реакционный сосуд с автоматическими впускным и выпускным клапанами и программным механизмом, который регулировал последовательность процессов и длительность каждой стадии.
Часто иной подход к решению задачи заметно облегчает достижение результата. С помощью сконструированного аппарата Меррифилд и его коллеги синтезировали инсулин всего за 20 дней (притом с выходом в десятки процентов), в то время как «первопроходцы» — аахенская, питтсбургская и шанхайская группы — затратили на это больше года.
В 1984 году Меррифилд был удостоен Нобелевской премии «За развитие методологии твердофазного химического синтеза».
Призовем на помощь природу
Во время проведения всех описанных выше работ химиков не оставляла мысль, что те задачи, которые ученые решают с таким трудом, природа решает легко и исключительно аккуратно. Синтез белков в живых организмах проходит в мягких условиях, быстро и без образования побочных продуктов. До определенного момента химики могли лишь с удивлением и интересом наблюдать подобные «синтезы», однако стремительное развитие биохимии позволило активно вмешаться в эти процессы, в том числе открыть принципиально новый способ синтеза инсулина.
Вначале отметим, что Ф. Сенгер (установивший структуру инсулина) сумел определить также последовательность фрагментов в структуре знаменитой двойной спирали ДНК, за что и был удостоен второй Нобелевской премии. Эта работа позволила биохимикам перейти к следующему этапу — встраивать в генетический код ДНК заранее намеченные фрагменты. Основная идея состояла в том, чтобы в ДНК некоторых бактерий включать гены высших организмов. В результате бактерии приобретают способность синтезировать соединения, которые прежде могли синтезировать только высшие организмы. Подобную технологию называют «генной инженерией».
В 1981 году канадский биохимик Майкл Смит (рис. 5.18) был приглашен в научные соучредители новой биотехнологической компании «Зимос». Один из первых контрактов фирмы был заключен с Датской фармацевтической компанией «Ново Нордиск», которая просила разработать технологию процесса производства человеческого инсулина в дрожжевой культуре. В результате совместных усилий способ был разработан, в 1982 году инсулин, полученный по новой технологии, поступил в продажу. В 1993 году за цикл работ в этой области М. Смит (совместно с К. Муллисом) удостоился Нобелевской премии. В настоящее время инсулин, получаемый методом генной инженерии, практически вытеснил инсулин животных.

Чьи работы важнее?
Итак, мы познакомились с четырьмя способами получения инсулина: из поджелудочной железы животных (группа Д. Маклеода), многоступенчатым синтезом (группа Г. Цана), автоматизированной сборкой (Р. Меррифилд), методом генной инженерии (М. Смит). Оставим в стороне медицинские проблемы, сосредоточим внимание на химии. У вас могло сложиться впечатление, что работы М. Смита сделали ненужными все предшествующие исследования. На самом деле это не так, все методы неразрывно связаны, ни один из этапов исследований нельзя выбросить. Инсулин, выделенный из поджелудочной железы животных, позволил Ф. Сенгеру определить его структуру, а без этого никакой последующий синтез невозможен. Группа Цана разработала химические приемы сборки цепей и способы промежуточной блокировки функциональных групп, которыми воспользовался Меррифилд при создании автоматической установки синтеза. Работы Смита, по существу, опирались на весь предшествующий опыт, накопленный при изучении инсулина. При синтезе некоторых короткоцепных гормонов автоматическая установка Меррифилда оказалась предпочтительнее генной инженерии. Обобщая, можно сказать, что все этапы, которые мы рассмотрели, — это естественный, традиционный и, если не бояться торжественных слов, величественный путь науки.
Полностью читайте:
Левицкий М. Карнавал молекул. Химия необычная и забавная / Михаил Левицкий. [; Научный редактор Михаил Никитин] — М.: Альпина нон-фикшн, 2019. — 542 с.
источник: nplus1.ru
