 Макарова Е.Л., Терехина Н.А., Падруль М.М.
Макарова Е.Л., Терехина Н.А., Падруль М.М.
Макросомия является важной проблемой акушерства на современном этапе в условиях пандемии ожирения населения. Крупный плод способствует развитию акушерских и перинатальных проблем. Практикующему специалисту важно прогнозировать это состояние у беременной.
Цель работы – разработка способа прогнозирования макросомии у беременных с ожирением. В сыворотке крови 180 женщин репродуктивного возраста определяли содержание лептина, растворимого рецептора лептина, высчитывали индекс свободного лептина. Выявлен дисбаланс адипокинов в сыворотке крови женщин при различных степени и типе ожирения. В сыворотке крови беременных с ожирением лептин и растворимый рецептор лептина находятся в обратной корреляции друг к другу. При андроидном типе морбидного ожирения (III степень) отмечаются самые высокие показатели лептина и самые низкие показатели растворимого рецептора лептина, при этом индекс свободного лептина превышает 500 ед., что характеризует лептинорезистеность. Разработан способ прогнозирования макросомии при ожирении у беременных. При значении индекса свободного лептина >500 ед. у беременных с андроидным типом ожирения прогнозируется формирование макросомии. Риск развития макросомии у беременных с андроидным типом ожирения в 2,7 раза выше, чем у женщин с нормальной массой тела. Способ прогнозирования макросомии у беременных с ожирением может быть использован для стратификации риска осложнений для матери и плода.
В России, как и во всем мире, увеличивается количество женщин с ожирением. Это заболевание матери является предиктором серьезных проблем для плода. На фоне метаболических сдвигов формируется генетическое детерминирование состояний, коморбидных с ожирением, – сахарный диабет, гипертензия, заболевания печени. Гипертрофия адипоцитов при ожирении сопровождается усилением выработки лептина, при этом возникает компенсаторная резистентность рецепторов в гипоталамусе к центральному действию лептина, что в последующем, по механизму обратной связи, приводит вновь к гиперлептинемии [1]. Лептин, воздействуя на рецепторы в гипоталамусе, гиппокампе и стволе мозга, регулирует потребление пищи, термогенез, расход энергии, метаболизм липидов и глюкозы. Известно, что секрецию лептина также стимулируют свободные жирные кислоты, эстрогены, фактор некроза опухоли. При нарушенной чувствительности рецепторов, которая всегда выражена при гиперлептинемии у людей с ожирением, формируется резистентность к этому гормону. При ожирении дисбаланс лептина приводит не только к изменениям в липидном обмене у матери, но и к серьезным последствиям для здоровья плода, в первую очередь к формированию больших размеров плода относительно срока гестации, метаболическим расстройствам. В настоящее время авторы называют многие причины, приводящие к макросомии [2, 3]. Изучение роли адипокинов в патогенезе формирования крупного плода является актуальным, это может позволить прогнозировать данное состояние и минимизировать перинатальные риски.
Цель – разработать способ прогнозирования макросомии у беременных с ожирением.
Материал и методы
В исследование включены 180 женщин репродуктивного возраста. Все пациентки были разделены на группы: группа сравнения A (n=34) – беременные с нормальной массой тела, основная группа В (n=126) – беременные с избыточной массой тела и ожирением, группу контроля (К) составили небеременные с нормальной массой тела (n=20). В группе В диагноз ожирения устанавливали на основании индекса массы тела (ИМТ), который рассчитывали как отношение массы (в килограммах) к росту в квадрате (в метрах). Все беременные с ожирением по ИМТ были разделены на 4 подгруппы. Дополнительно в каждой подгруппе устанавливали тип ожирения с помощью расчетного коэффициента К, который высчитывали как отношение окружности талии к окружности бедер в сантиметрах (в сроке 10-13 нед беременности). При K<0,85 определяли гиноидный тип ожирения (ГТО), при K≥0,85 – андроидный (висцеральный) тип ожирения (АТО) (табл. 1).
Таблица 1. Характеристика исследуемых групп женщин
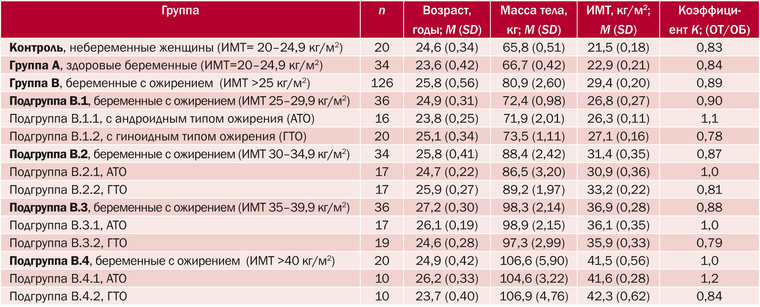
Примечание. ИМТ – индекс массы тела; ОТ/ОБ – объем талии/объем бедер; АТО – андроидный тип ожирения; ГТО – гиноидный тип ожирения.
От каждой женщины получено информированное персонифицированное согласие на участие в исследовании. Содержание лептина и растворимого рецептора лептина в сыворотке крови определяли методом иммуноферментного анализа (ELISA) на автоматическом анализаторе Alisei (Италия), с использованием тест-систем BioVender (Германия), согласно инструкции производителя. Каждой женщине рассчитывали индекс свободного лептина (ИСЛ) как отношение содержания лептина (нг/мл) к растворимым рецепторам лептина (нг/мл), расчетный показатель умножали на 100 [4]. Чувствительность тканей к лептину оценивали по ИСЛ, лептинорезистентность фиксировали при ИСЛ >500 ед. Статистический анализ данных выполняли в Центре “Биостатистика” с помощью статистических пакетов Statistica 10.0 и SPSS-21. Статистически значимыми считали различия данных при p<0,05. Результаты представлены в виде: n – количество в группе; Ме – медиана, 25 и 75 процентили – межквартильный размах; М – среднее; SD – стандартное (среднеквадратичное) отклонение. Проверку на нормальность распределения проводили с помощью критериев Колмогорова-Смирнова и Шапиро-Уилка. При нормальном распределении выборки для сравнения средних величин использовали критерий Стьюдента, а при отличии от нормального – критерий Манна-Уитни. Корреляционный анализ при нормальном распределении выборки осуществляли с помощью коэффициента Пирсона, при несимметричном – коэффициента Спирмена. Расчет относительного риска (Relative risk, RR) проводился с использованием четырехпольных таблиц сопряженности. При значениях RR>1 делали вывод о том, что фактор повышает частоту исходов (прямая связь). При проведении частотного анализа использовали тест Пирсона χ2. Анализ взаимосвязи макросомии, выступающей в роли качественного зависимого признака, с подмножеством изучаемых количественных признаков проводился с использованием модели логистической регрессии с пошаговым включением предикторов. Результат оценки уравнения логистической регрессии представлен коэффициентами регрессии, достигнутым уровнем значимости и оценкой показателя согласия (Concordant).
Результаты
Содержание лептина в сыворотке крови здоровых беременных оказалось в 1,5 раза выше 15,63 [12,55-17,7] нг/мл, чем у небеременных женщин – 9,81 [7,9-11,73] нг/мл. При сочетании беременности с ожирением содержание лептина еще более значимо повышалось, и среднее значение составило 60,53 [36,05-85,01] (рис. 1).
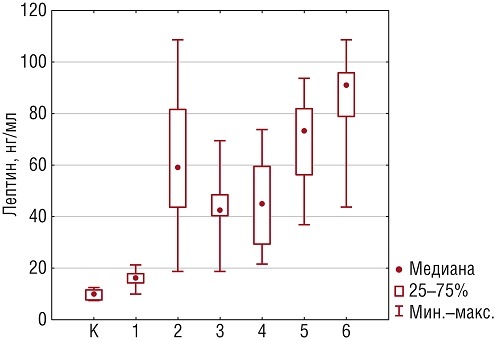
Рис. 1. Содержание лептина в группах женщин, нг/мл К – группа контроля; 1 – группа сравнения А (беременные с ИМТ 20-24,9 кг/м2); 2 – основная группа В (беременные с ИМТ >25 кг/м2); 3 – подгруппа В.1 (ИМТ=25-29,9 кг/м2); 4 – подгруппа В.2 (ИМТ=30-34,9 кг/м2); 5 – подгруппа В.3 (ИМТ=35-39,9 кг/м2); 6 – подгруппа В.4 (ИМТ >40 кг/м2). Здесь и на рис. 2-4: ИМТ – индекс массы тела.
Обнаружена прямая высокая корреляционная зависимость ИМТ и содержания лептина у пациенток повышенного питания (r=+0,798; p=0,0001) (рис. 2). При избыточной массе тела содержание лептина составило 40,25 [26,39-54,11] нг/мл; при I степени ожирения – 45,72 [29,52-61,92] нг/мл; при II степени ожирения – 68,89 [51,76-86,02] нг/мл. Самый высокий показатель выявлен у женщин с III степенью ожирения – 85,58 [68-103,16] нг/мл. Установлены достоверные межгрупповые различия в содержании лептина в сыворотке крови при делении беременных на подгруппы по ИМТ (В.1, В.2, В.3, В.4) в сравнении с беременными с нормальной массой тела из группы А (pa–b1=0,001; pa–b2=0,002; pa–b3=0,005; pa–b4=0,0001).
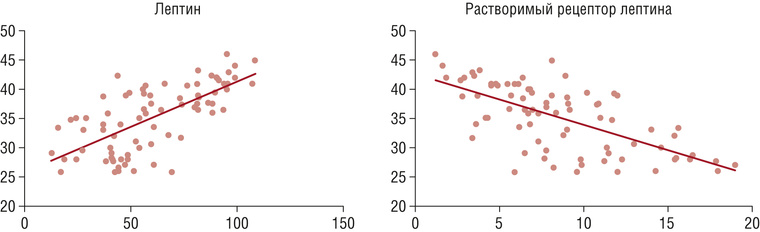
Рис. 2. Корреляционная взаимосвязь содержания лептина (нг/мл) в сыворотке крови беременных – ось Х и ИМТ (кг/м2) – ось Y; содержание растворимых рецепторов лептина (нг/мл) – ось Х и ИМТ (кг/м2) – ось Y
При делении пациенток по типу ожирения в подгруппах оказалось, что содержание лептина в каждой из подгрупп было выше при АТО, чем при гиноидном. Показатели составили при избытке массы тела: 42,19 [38,16-46,22] нг/мл в сравнении с 31,03 [26,7-35,34] нг/мл (p<0,01), при I степени ожирения – 52,86 [46,96-58,76] нг/мл в сравнении с 50,05 [45,08-55,02] нг/мл (р>0,05); при II степени – 76,24 [72,05-80,43] нг/мл в сравнении с 73,06 [66,72-79,94] нг/мл (р>0,05); и при III степени – 98,64 [95,84-101,44] нг/мл в сравнении с 87,88 [85,09-90,07] нг/мл (р<0,05) (рис. 3).
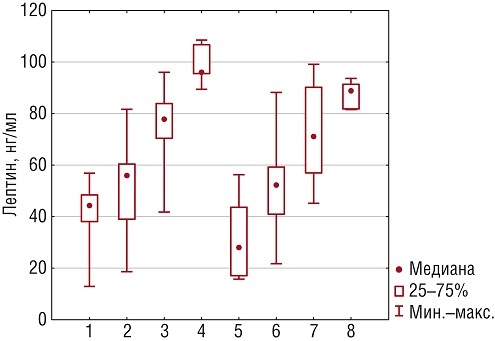
ис. 3. Содержание лептина в сыворотке крови беременных с ожирением андроидного и гиноидного типа, нг/мл 1 – подгруппа В.1.1 (ИМТ=25-29,9 кг/м2), андроидный тип ожирения (АТО); 2 – подгруппа В.2.1 (ИМТ=30-34,9 кг/м2), АТО; 3 – подгруппа В.3.1 (ИМТ=35-39,9 кг/м2), АТО; 4 – подгруппа В.4.1 (ИМТ >40 кг/м2), АТО; 5 – подгруппа В.1.2 (ИМТ=25-29,9 кг/м2), гиноидный тип ожирения (ГТО); 6 – подгруппа В.2.2 (ИМТ=30-34,9 кг/м2), ГТО; 7 – подгруппа В.3.2 (ИМТ=35-39,9 кг/м2), ГТО; 8 – подгруппа В.4.2 (ИМТ >40 кг/м2), ГТО.
Содержание лептиновых рецепторов в сыворотке крови беременных с ожирением находилось в обратной корреляции с содержанием лептина (r=+0,524; p=0,0004) (см. рис. 1, 2) составило в подгруппах следующие средние показатели: 11,29 [10,41-12,17] нг/мл у беременных с нормальной массой тела; 10,84 [9,74-11,95] нг/мл при избытке массы тела; 9,90 [9,14-10,66] при ожирении I степени; 7,89 [6,97-8,81] при ожирении II степени и 4,7 [4,15-5,25] при ожирении III степени. Обнаружены межгрупповые различия (pa–b1=0,871; pa–b2=0,124; pa–b3=0,0145; pa–b4=0,001), достоверно снижалось содержание лептиновых рецепторов в группе женщин со II и III степенью ожирения по сравнению с беременными с нормальной массой тела. Установлены групповые различия в содержании лептиновых рецепторов в сыворотке крови при делении каждой подгруппы беременных с лишней массой по типу ожирения, при андроидном типе этот показатель был ниже, чем при гиноидном (pb1.1-b1.2=0,338; pb2.1-b2.2=0,126; pb3.1-b3.2=0,026), достоверные изменения только в группе женщин с морбидным ожирением (III степень).
Все большую диагностическую ценность приобретает определение ИСЛ: отношение между уровнями лептина и растворимыми рецепторами лептина, умноженное на 100 [5]. Однако до сих пор отсутствуют данные о референсном диапазоне этого показателя, что ограничивает его использование. Выявлена прямая корреляция между ИМТ и ИСЛ, что косвенно позволяет сделать вывод о наличии лептинорезистентности у женщин с большой массой тела (r=+0,642; p=0,0001) (рис. 4).
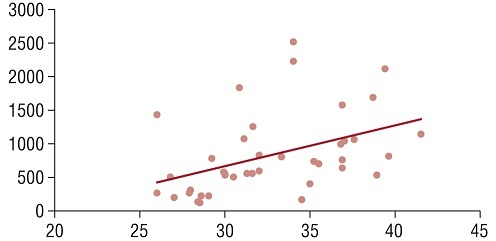
Рис. 4. Корреляционная взаимосвязь индекса массы тела (кг/м2) по оси Х и индекса свободного лептина (ед.) по оси Y
В группе беременных с избыточной массой тела и ожирением крупные плоды родились в 19,8% (25/126) случаев и только в 8,8% (3/34) у женщин с нормальной массой тела. Макросомия при расчете относительного риска развилась в 2 раза чаще у пациенток с ожирением, чем у женщин с нормальной массой тела, относительный риск (Relative Risk, RR) = 1,941 [доверительный интервал (ДИ) 0,62-6,05]. При делении пациенток по типу ожирения выявлено, что в группе с андроидным типом крупный плод сформировался у каждой четвертой женщины [25% (15/60)], при гиноидном типе – лишь у каждой десятой [10,6% (7/66)]. Риск макросомии при АТО в 2,7 раза выше, чем у женщин без ожирения, RR=2,736 (ДИ 0,84-8,84), а у женщин с гиноидным типом ожирения остается таким же, как и у женщин с нормальной массой тела, RR=1,167 (ДИ 0,32-4,23).
При проведении анализа взаимосвязи изучаемых предикторов возникновения макросомии (ИМТ, тип ожирения, содержание лептина, содержание растворимого рецептора лептина) было построено 12 уравнений, из которых выбрано уравнение с наиболее предсказательной ценностью. Пошаговый порядок (Step) включения отобранных предикторов (Variable) в уравнение с указанием процента верного предсказания на каждом шаге и коэффициентов регрессии отображен в табл. 2. В ней же можно проследить динамику предсказательной ценности предикторов и их совокупности при оценке уравнения логистической регрессии в целом. На первом шаге было включено ожирение (ИМТ >30 кг/м2), и этот предиктор дал сразу 82,2% верного предсказания. На втором шаге включен АТО, это увеличило процент до 92,9; и на последнем шаге уравнения включен ИСЛ >500 ед., и верное предсказание увеличилось до 96,5%.
Самый большой вклад в прогнозирование макросомии внес фактор ожирения (0,7979), далее – андроидный тип (0,7335) и ИСЛ >500 ед. (0,6033). Для оценки качества полученной модели выполнен ROC-анализ (receiver operating characteristic). Площадь под ROC-кривой составила 0,9289 (рис. 5), что подтверждает высокое качество данной модели для прогнозирования макросомии.
Таблица 2. Результаты пошаговой логистической регрессии
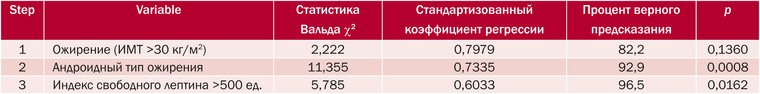
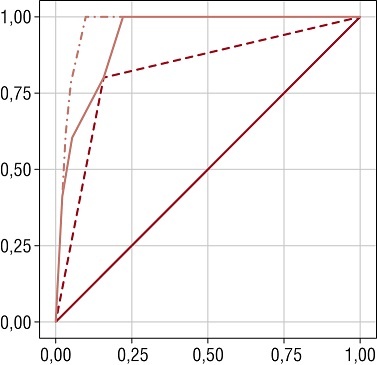
Рис. 5. ROC-кривая модели прогнозирования макросомии у беременных на основании регрессионного анализа Шаг 3 – сплошная кривая.
Обсуждение
При ожирении матери в 20-35% случаев рождается крупный плод при доношенной беременности (масса >4000 г), тогда как у женщин с нормальной массой риски не более 10% [6-8]. По нашим данным, частота макросомии в 2,5 раза чаще встречалась у женщин с лишней массой тела. Ранее было установлено, что у беременных при ожирении развивается дисбаланс адипокинов: лептин повышается, адипонектин снижается с увеличением массы тела [9]. При ожирении всегда развивается гиперлептинемия за счет гипертрофии адипоцитов. Еще более высокие концентрации циркулирующего лептина во время беременности формируются за счет дополнительного плацентарного синтеза лептина и высокого уровня половых стероидов во время гестации. При содержании лептина в сыворотке ≥30 нг/мл его уровень в мозговых структурах перестает расти, на фоне гиперлептинемии проницаемость гематоэнцефалического барьера для этого адипокина снижается [10]. У женщин с ожирением наблюдается снижение концентрации лептина в спинномозговой жидкости на фоне ее роста в сыворотке крови [11]. Данный феномен играет роль в развитии лептинорезистентности и ожирения. Перманентное повышение уровня лептина ухудшает состояние лептиновых рецепторов и уменьшает их общее количество. До сих пор не ясно, как эффективно оценивать чувствительность к лептину в клинических условиях. Можно предположить, что чувствительность к лептину напрямую связана с ожирением и объемом жировой ткани. Многие авторы [12-14] рассматривают гиперлептинемию как ключевой маркер лептинорезистентности, что увеличивает предрасположенность пациенток к алиментарному ожирению, которое способствует дальнейшему росту уровня лептина и усугублению лептинорезистентности, таким образом формируется порочный круг [15].
Для развития дисбаланса адипокинов имеет значение не только степень ожирения, но и особенность распределения жировой ткани в организме. При отложении жира в висцеральных жировых депо (АТО) нарушается физиологическая регуляция выработки инсулина, активируются атерогенные адипокины, что приводит к развитию инсулинорезистентности, атеросклероза и других метаболических нарушений [16]. ГТО более благоприятен для женского организма ввиду отсутствия развития коморбидной патологии и осложнений. В ряде работ [11, 16] продемонстрирована ассоциация между абдоминальным ожирением и высокой концентрацией лептина, что объясняется лептинорезистентностью. В нашем исследовании у беременных с андроидным типом морбидного ожирения показатель лептинемии оказался самым высоким – 98,64 [95,84-101,44] нг/мл, превышая норму в 6 раз, а уровень растворимых рецепторов лептина был самым низким – 4,6 [3,81-4,96] нг/мл.
Ранее нами были установлены значимые гестационные осложнения у женщин с АТО, что связано с гиперинсулинемией, эндотелиальной дисфункцией при таком распределении жировой ткани и ее патологической активностью [17-19]. Это позволило предположить патогенетическую значимость лептинорезистентности в формировании большого количества гестационных осложнений у женщин с АТО.
Ожирение матери часто способствует формированию проблем у плода. Основной причиной рождения крупного плода от матери с ожирением считают нарушения в углеводном и липидном обмене женщины, поступление большого количества питательных веществ при гиперкалорийной диете, что способствует ускорению пластических процессов в организме ребенка из-за анаболического влияния инсулина. Если беременность протекает на фоне ожирения, лептин еще более значимо повышается, что провоцирует, в свою очередь, гиперлептинемию у плода, гипергликемию, гиперинсулинемию и модулирует метаболический ответ нейронов гипоталамуса с развитием макросомии [20, 21]. Гиперлептинемия при ожирении матери оказывает влияние на стимуляцию синтеза соматотропина [21, 22].
Известно, что введение экзогенного лептина восстанавливает секрецию гормона роста за счет увеличения синтеза рилизинг-фактора гормона роста на уровне гипоталамуса. В передней доле гипофиза плода человека была выявлена матричная рибонуклеиновая кислота (мРНК) рецептора лептина, введение лептина в первичную культуру клеток гипофиза специфически стимулирует секрецию гормона роста без ущерба для других гормонов гипофиза [20]. Таким образом, закономерно предположить функциональную значимость гиперлептинемии как стимула секреции повышенных количеств соматотропина, вместе составляющих компенсаторно-адаптационную систему поддержания беременности [22, 23].
Нами установлено, что возникновение макросомии при АТО матери сопровождалось выраженной дисфункцией лептина, расчетный индекс свободного лептина превышал 500 ед. и составил в среднем 895,6 [643,2-2580,7] ед. ИСЛ может быть использован для прогнозирования рисков, связанных с осложнениями при ожирении, он характеризует низкую чувствительность тканей к лептину (лептинорезистентность) [5]. Логистический регрессионный анализ показал, что наиболее значимой совокупностью предикторов, связанных с формированием макросомии, являются ожирение ≥I степени (при ИМТ >30 кг/м2), АТО, расчетный ИСЛ >500 ед. Таким образом, полученные данные свидетельствуют о наличии патогенетической связи макросомии плода и АТО у матери, при дисбалансе адипокинов и формировании лептинорезистентности. Такие женщины должны быть отнесены в группу риска, для каждой из них врачом – акушером-гинекологом должен быть разработан персонифицированный план ведения беременности и родов с целью снижения акушерских и перинатальных осложнений.
Заключение
Разработан способ прогнозирования макросомии при ожирении у беременных. При значении ИСЛ >500 ед. у беременных с АТО прогнозируется формирование макросомии. Риск развития макросомии у беременных с АТО в 2,7 раза выше, чем у женщин с нормальной массой тела. Способ прогнозирования макросомии у беременных с ожирением может быть использован для стратификации риска осложнений для матери и плода.
Список литературы смотрите здесь.
Источник: Журнал “Акушерство и гинекология: новости, мнения, обучение”. 2021. Т. 10, № 1. С. 11-17.
