 Авторы: О.Д. Остроумова (1), И.В. Голобородова (2)
1) Российский геронтологический научно-клинический центр в структуре РНИМУ им. Н.И. Пирогова, Москва.
2) Московский государственный медико-стоматологический университет им. А.И. Евдокимова, Москва.
Авторы: О.Д. Остроумова (1), И.В. Голобородова (2)
1) Российский геронтологический научно-клинический центр в структуре РНИМУ им. Н.И. Пирогова, Москва.
2) Московский государственный медико-стоматологический университет им. А.И. Евдокимова, Москва.
Сердечная недостаточность (СН) – одна из основных причин заболеваемости и смертности во всем мире, в т.ч. и в РФ. СН также является одной из основных причин госпитализации пациентов, содействуя увеличению ее продолжительности и ухудшению прогноза после выписки, ложась тяжелым бременем как на пациентов, так и на систему здравоохранения в целом. Этиологическая структура СН включает не только многочисленные сердечно-сосудистые заболевания, но и сопутствующие состояния, способные привести к ее развитию. Действие лекарственных средств (ЛС) – одна из причин, приводящих к развитию или усугублению уже имеющейся СН, такая СН носит название «лекарственно-индуцированная». В настоящее время известны ЛС, способные приводить к развитию/усугублению СН, а также ЛС, которые лишь в отдельных случаях рассматриваются в качестве возможной причины развития лекарственно-индуцированной СН.
Одной из групп ЛС, способствующих развитию или прогрессированию СН, является группа сахароснижающих препаратов. Так, тиазолидиндионы увеличивают риск прогрессирования СН у пациентов с сахарным диабетом 2 типа (СД2), а инсулин, как и препараты сульфонилмочевины, обладают потенциальной способностью усугублять течение уже имеющейся СН. При этом метформин считается безопасным ЛС при лечении больных СД2 с СН. Ситаглиптин и линаглиптин – представители группы ингибиторов дипептидилпептидазы-4, также могут применяться пациентами с СД2 и СН в отличие от саксаглиптина, использование которого ассоциировано с развитием/прогрессированием СН.
Поскольку больные СД, изначально обладают повышенными сердечно-сосудистыми рисками, необходимость информированности о сердечно-сосудистой безопасности тех или иных групп сахароснижающих ЛС весьма актуальна. Понимание особенностей взаимосвязей тех или иных сахароснижающих препаратов с сердечно-сосудитыми рисками, в т.ч. с риском развития/прогрессирования СН, может оказать положительное влияние на эффективность лечения и клинические исходы для отдельных пациентов, а также внести вклад в снижение «бремени заболевания» в целом.
Актуальность
Сердечная недостаточность (СН) является одной из основных причин заболеваемости и смертности в мире [1, 2]. Распространенность СН составляет в среднем около 1–2% среди взрослого населения развитых стран мира, с возрастом увеличиваясь и превышая 10% у лиц старше 70 лет [1, 2].
В Российской Федерации СН диагностируется в среднем в 7–10% случаев [1]. Распространеность СН на территории России в последние 16 лет неуклонно увеличивалась ‒ с 4,9% в 1998 г. до 8,5% в 2014-м [1]. При этом абсолютное число пациентов, имеющих хроническую СН (ХСН), возросло более чем в 2 раза (с 7,18 до 12,35 млн человек), а число лиц с тяжелой СН (III–IV функциональных классов [ФК] по NYHA [New York Heart Association]) ‒ почти в 3 раза (с 1,76 до 4,5 млн человек) [1].
Тенденция к росту заболеваемости СН с увеличением возраста в России соответствует общемировой: за 18 лет средний возраст больных ХСН в РФ увеличился с 64±11,9 (1998) до 72,8±11,9 года (2016) [1].
СН – одна из наиболее распространенных причин госпитализации. Так, в связи с декомпенсацией СН в США ежегодно осуществляется около 5 млн госпитализаций, в Канаде – 106 тыс. [3, 4]. В России ХСН как основная причина госпитализации пациентов с сердечно-сосудистыми заболеваниями (ССЗ) регистрируется у 16,8% больных, при этом декомпенсация ХСН служит причиной госпитализации каждого второго из них (49%) [1].
В целом же диагноз ХСН фигурирует у 92% пациентов с ССЗ, госпитализированных в отделения кардиологического профиля [1].
СН оказывает значительное влияние на продолжительность пребывания пациентов в стационаре, составляющую в среднем 13 дней, а также на прогноз после выписки [3, 5]. Так, в течение первых 30 дней после выписки из стационара повторная госпитализация требуется 31% больных, в течение 90 дней ‒ еще 11%, а к 180-му дню ‒ еще 11% пациентов [1]. СН оказывает влияние и на госпитальную смертность: так, в условиях постоянного стационарного специализированного наблюдения и лечения частота летальных исходов среди больных с СН достигает 15% [3, 5]. С учетом изложенного высокий 6%-ный уровень общей смертности пациентов с ХСН, в 10 раз превышающий уровень в популяции (отношение шансов [OШ]=10,1; р<0,0001), представляется вполне объяснимым [1].
В клинических рекомендациях, регламентирующих диагностику, профилактику и лечение ХСН и острой декомпенсированной СН, сформулированных Обществом специалистов по сердечной недостаточности (ОССН), Российским кардиологическим обществом (РКО) и Российским научным медицинским обществом терапевтов (РНМОТ), СН трактуется как синдром, развивающийся в результате нарушения способности сердца к наполнению и/или опорожнению, протекающий в условиях нарушения баланса вазоконстрикторных и вазодилатирующих нейрогормональных систем, сопровождающийся неадекватной перфузией органов и тканей организма и проявляющийся комплексом симптомов (одышка, слабость, сердцебиение, повышенная утомляемостью и задержка жидкости в организме – отечный синдром) [1].
Этиологическая структура СН разнообразна и включает как ССЗ, так и сопутствующие состояния, способные приводить к ее развитию. Наиболее часто к развитию СН приводят артериальная гипертензия (АГ), ишемическая болезнь сердца (ИБС) и сахарный диабет (СД) [1, 2]. Так, в России на долю АГ в структуре причин СН приходится 95,5%, на долю ИБС – 69,7%, на долю СД – 15,9%; в США наиболее распространенной причиной СН считается ИБС, на долю которой приходится примерно 2/3 случая СН [1,2]. К другим причинам относят миокардиты, кардиомиопатиии, токсическое поражение миокарда различной этиологии, включая действие лекарственных средств (ЛС), обладающих способностью вызывать или усугублять течение СН, в последнем случае СН называют лекарственно-индуцированной.
К ЛС, способствующим развитию СН, относят большинство блокаторов кальциевых каналов (БКК; кроме дигидропиридиновых БКК III поколения и некоторых дигидропиридиновых БКК II поколения, например фелодипина), сахароснижающие препараты (ССП; некоторые ингибиторы фермента дипептидилпептидазы 4 [иДПП-4] и тиазолидиндионы [«глитазоны»] – пиоглитазон и росиглитазон), антиаритмические препараты (дизопирамид, дронедарон, лидокаин, лоркаинид, мексилетин, морацизин, пропафенон, токаинид, флекаинид, энкаинид), антрациклины (доксорубицин), противоопухолевые средства (бевацизумаб, инфликсимаб, лапатиниб, трастузумаб и др.), нестероидные противовоспалительные средства, селективные ингибиторы циклооксигеназы-2, некоторые β-адреноблокаторы [6]. Другие ЛС, которые были отмечены в отдельных случаях в качестве возможной причины развития лекарственно-индуцированной СН, представлены глюкокортикостероидами (преднизолон), агонистами дофаминовых рецепторов (каберголин, перголид, прамипексол, ропинирол), трициклическими антидепрессантами, антипсихотиками (клозапин), противоэпилептическими средствами (карбамазепин), противовирусными препаратами (зидовудин, амантадин), антибактериальными (ампициллин) и противогрибковыми ЛС (интраконазол), включая амфотерицин В, периферическими вазодилататорами (буфломедил, гидралазин, доксазозин), осмотическими диуретиками (маннитол и др.) [6].
Точная общая распространенность лекарственно-индуцированной СН неизвестна, а ее определение сопряжено с объективной трудностью дифференцирования СН, обусловленной ЛС, от многих других факторов, вызывающих этот синдром и, как правило, имеющихся у пациента. В настоящее время в литературе встречаются данные, характеризующие распространенность лекарственно-индуцированной СН относительно отдельных групп ЛС или отдельных представителей этих групп. Так, СН, ассоциированная с приемом антиаритмиков, встречается в 5–10% случаев; на СН, индуцированную с приемом БКК, приходится от 20,5 до 24% случаев, а на β-адреноблокаторы ‒ до 2%, СН, ассоциированная с использованием тех или иных противоопухолевых препаратов, встречается в 2–34% случаев [6].
Необходимо также отметить, что лекарственно-индуцированная СН у пациентов без ранее существовавшей дисфункции левого желудочка (ЛЖ) встречается крайне редко, в большинстве случаев наблюдается усугубление/обострение симптомов СН, обусловленное действием ЛС у лиц с уже установленной СН [6].
Одной из групп ЛС, способствующих развитию или прогрессированию/обострению уже имеющейся СН, является группа противодиабетических препаратов, что делает проблему лекарственно-индуцированной СН для лиц с СД весьма актуальной.
Мы уже упоминали, что СД является одной из наиболее распространенных причинных факторов СН. Распространенность СН среди пациентов с СД 2 типа (СД2) в возрасте до 65 лет значительно превышает аналогичный показатель в общей популяции (в 4 раза у мужчин и в 8 – у женщин) [7, 8]. Известно, что СН со сниженной фракцией выброса (ФВ) ассоциирована с более высокой вероятностью летального исхода и госпитализации больных, имеющих СД (по сравнению с лицами без СД). Пациенты с СД2 и СН характеризуются худшим долгосрочным прогнозом с повышенным риском прогрессирования СН (ОШ=1,17; 95% доверительный интервал [ДИ] – 1,04–1,32) и госпитализации по поводу СН (ОШ=1,19; 95% ДИ – 1,04–1,36); наличие СН удлиняет период стационарного лечения пациентов с СД [9].
Изложенное убедительно показывает необходимость информированности и учета потенциальной возможности ССП способствовать развитию или усугублять течение СН у лиц с СД, изначально характеризующихся повышенными сердечно-сосудистыми рисками. Необходимо, чтобы сахароснижающая терапия помимо достижения оптимального метаболического контроля оказывала как минимум нейтральное влияние на риски развития/декомпенсации СН и сердечно-сосудистых осложнений.
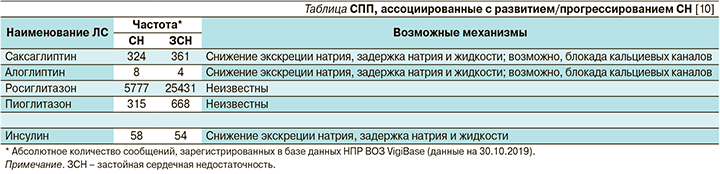
Перечень ССП, ассоциированных с развитием/прогрессированием СН, число случаев развития СН/застойной СН, ассоциированное с приемом того или иного СПП, и возможные механизмы представлены в таблице.
Далее будет рассмотрено влияние отдельных представителей различных групп ССП на развитие/прогрессирование СН.
Инсулин
К настоящему времени известно несколько проспективных клинических исследований, посвященных изучению влияния инсулинотерапии на сердечно-сосудитые события, включая СН, результаты которых имеют противоречивый характер.
В одном из первых подобных исследований G.L. Knatterud et al. [11] изучали влияние сахароснижающих ЛС на риск развития сердечно-сосудистых осложнений у пациентов с СД2. В результате изучения взаимосвязи между инсулинотерапией и риском макрососудистых осложнений выявлено не было. Схожие результаты были получены в британском проспективном исследовании (UK Prospective Diabetes Study Group, UKPDS), где также не было обнаружено связи между инсулинотерапией и макрососудистыми исходами (в т. ч. СН) у пациентов с впервые диагностированным СД2 [12].
В то же время результаты многоцентрового проспективного исследования, направленного на определение рисков и преимуществ интенсивной инсулинотерапии пожилых пациентов с СД2 (n=75) по сравнению с группой лиц, получающих стандартную терапию инсулином (n=78), свидетельствуют о значительном увеличении числа сердечно-сосудистых событий, в т.ч. СН, среди больных, получавших интенсивное лечение инсулином (32 против 20% в группе стандартной терапии) [13]. Однако последующая оценка влияния 2-летней интенсивной инсулинотерапии на функционирование ЛЖ показала отсутствие его влияния на систолическую или диастолическую функции [14].
В исследовании G.A. Nichols et al. [15] обнаружена большая распространенность СН среди пациентов с СД2, получающих инсулинотерапию, а также большая частота ее развития у больных без симптомов СН до начала терапии инсулином. Использовав множественную регрессионную модель, исследователи обнаружили статистически значимую взаимосвязь между инсулинотерапией и распространенностью уже имеющейся СН (OШ=1,47; 95% ДИ – 1,17–1,85), а также между инсулинотерапией и возникновением СН у пациентов без СН на момент начала лечения инсулином (OШ=1,66; 95% ДИ – 1,26–2,20). Авторы сделали заключение: использование инсулина является независимым фактором риска и предиктором развития СН. Однако они подчеркивают наблюдательный нерандомизированный характер данного исследования, что служит его ограничением, не позволяющим доказывать причинно-следственную связь между использованием инсулина и развитием ХСН.
S. Smooke et al. [16], обследовав 554 пациента без/с СД1 или СД2 и СН (ФВ ЛЖ – 24,6±7,4%), установили, что выживаемость в течение года больных с СН без СД (n=422) составила в среднем 89,7%, пациентов с СН и СД (n=89), принимавших пероральные ССП, – 85,8%, в группе больных СД и СН, получавших инсулин (n=43), – 62,1% (p<0,00001). Проведение мультифакторного анализа позволило авторам рассматривать использование инсулина как независимый предиктор смерти в группе больных СН (отношение рисков [ОР]=4,30; 95% ДИ – 1,69–10,94), тогда как использование пероральных ССП подобного влияния на смертность не оказывало (ОР=0,95; 95% ДИ – 0,31–2,93).
S.J. Pocock et al. [17], проанализировав данные 7601 пациента с ХСН, включенного в исследование CHARM (Candesartan in Heart Failure: Assessment of Reduction in Death and morbidity), выявили, что использование инсулина лицами с СД2 (9,3% всех пациентов в CHARM) оказывало негативное влияние на риск общей смертности (ОР=1,25; 95% ДИ – 1,03–1,51), а также риск сердечно-сосудистой смертности или частоту повторных госпитализаций по поводу СН (ОР=1,55; 95% ДИ – 1,29–1,86) по сравнению с пациентами, не использовавшими инсулин (19,1% всех пациентов CHARM).
Имеющиеся литературные данные позволяют говорить о том, что использование инсулина больными СД2 и СН, создает дополнительные риски в отношении развития/прогрессирования СН, что необходимо учитывать.
Препараты сульфонилмочевины (ПСМ)
Данные, свидетельствующие о возможности и характере влияния ПСМ на риск СН, весьма противоречивы.
Так, К.М. Pantalone et al. [18], изучив влияние пероральных противодиабетических ЛС (ПСМ, метформин и пиоглитазон) на сердечно-сосудистые события (ИБС, ЗСН и смертность) у 20450 лиц с СД2, обнаружили неблагоприятный профиль сердечно-сосудистой безопасности ПСМ по сравнению с другими пероральными ССП. Так, метформин был ассоциирован с более низким риском ЗСН (ОР=0,76; 95% ДИ – 0,64–0,91; р=0,003) и смерти (ОР=0,54; 95% ДИ – 0,46–0,64; р<0,001) по сравнению с ПСМ; пиоглитазон по сравнению с ПСМ, также ассоциировался с более низкой смертностью (ОР=0,59; 95% ДИ – 0,43–0,81; р<0,001).
Схожую цель преследовали I. Tzoulaki et al. [19], также изучавшие влияние пероральных ССП (ПСМ, метформин и тиазолидиндионы [ТЗД]) на сердечно-сосудистые события (инфаркт миокарда, ЗСН и смерть от всех причин) у 91 521 пациента с СД2. Результатом исследования также стал вывод о неблагоприятном профиле безопасности ПСМ, основанный на более высоком уровне смерти от всех причин и повышенном риске развития ЗСН при использовании ПСМ по сравнению с метформином.
А исследование J.W. Eriksson et al. [20] показало, что добавление ПСМ к метформину было ассоциировано с более высоким риском неблагоприятных сердечно-сосудистых событий и смерти от всех причин по сравнению с комбинацией метформин+иДПП-4 (ОР=1,17; 95% ДИ – 1,01–1,37; р=0,035 и ОР=1,25; 95% ДИ – 1,02–1,54; р=0,030 соответственно).
С другой стороны, результаты, опубликованные исследователями программ Prospective Diabetes Study (UKPDS) Group и A diabetes outcome progression trial (ADOPT), также не выявили влияния ПСМ на СН [21, 22].
Стратегия использования инсулина и ПСМ лицами с СД и высоким кардиометаболическим риском определена в клинических рекомендациях по СН экспертов ОССН, РКО и РНМОТ 2018 г. [1], согласно которым применение указанных ЛС больными СН возможно только при наличии прямых показаний к лечению СД – невозможности контролировать уровень глюкозы другими способами (класс рекомендаций IIb, уровень доказанности В).
Алгоритмы специализированной медицинской помощи больным СД (9-й выпуск, 2019) [23], сформулированные экспертами Российской ассоциации эндокринологов (РАЭ) и Национального медицинского исследовательского центра эндокринологии (НМИЦ эндокринологии), свидетельствуют о способности инсулина усугублять задержку жидкости с возможностью нарастания явлений ХСН (уровень достоверности доказательств [УДД] 3, уровень убедительности рекомендация [УУР] В). Вследствие потенциальной способности ПСМ усугублять течение ХСН использование данной группы ЛС пациентами с СД и ХСН должно осуществляться с осторожностью (УДД 1, УУР А).
Бигуаниды
Метформин – бигуанидный инсулиносенситайзер, известный ингибирующим действием на глюконеогенез в печени, а также способностью увеличивать чувствительность тканей к инсулину, повышать периферический захват глюкозы, окисление жирных кислот, при этом уменьшая всасывание глюкозы из желудочно-кишечного тракта.
Из-за того, что предшественником метформина был фенформин, продемонстрировавший сильную причинно-следственную связь с лактоацидозом, что послужило причиной отзыва последнего с фармакологического рынка в 1978 г., схожие опасения существовали и в отношении метформина.
Так, в 1996 г. Управление по контролю за пищевыми продуктами и лекарственными средствами США (Food and Drug Administration, FDA) сообщило о 47 случаях развития лактоацидоза у пациентов, принимавших метформин. При этом у 91% из них было ≥1 фактора риска лактоацидоза, 64% имели ССЗ, в т. ч. числе 38% – СН. ЗСН была добавлена в список противопоказаний к назначению метформина, в качестве которых традиционно выступала предрасположенность к лактоацидозу, формируемая в условиях почечной недостаточности, заболеваний печени и тяжелых заболеваний легких.
Однако в 2006 г. FDA удалило СН как абсолютное противопоказание к назначению метформина на основании полученных данных двух больших обсервационных исследований и клинических наблюдений, показавших, что риск развития лактоацидоза, ассоциированный с этим препаратом, минимален и не отличался от других ЛС, применяемых пациентами с СН.
В настоящее время доказана безопасность применения метформина на всех стадиях СН с сохраненной или стабильной умеренно сниженной почечной функцией. D.T. Eurich et al. [24] исследовали клинические исходы у лиц с СД2 и СН, сравнивая группу монотерапии метформином с группой монотерапии ПСМ и группой комбинированной терапии (метформин+ СМ). Было обнаружено, что монотерапия метформином ассоциировалась со снижением общей смертности по сравнению с группой ПСМ (ОР=0,70; 95% ДИ – 0,54–0,91) и группой комбинированной терапии (ОР=0,61; 95% ДИ – 0,52–0,72). Показатели общей смертности и госпитализации по всем причинам в группе терапии метформином также были ниже (ОР=0,83; 95% ДИ – 0,70–0,99 и ОР=0,86; 95% ДИ – 0,77–0,96 для групп ПСМ и комбинированной терапии соответственно).
В систематическом обзоре D.T. Eurich et al. [25] показали, что использование метформина в терапии пациентов с СД2 и СН было ассоциировано с уменьшением смертности (скорректированный риск=0,80; 95% ДИ – 0,74–0,87; р<0,001) по сравнению с группой контроля (в основном терапия ПСМ). Аналогичные результаты были зарегистрированы у пациентов с СН и хронической болезнью почек (объединенный скорректированный риск=0,8; 95% ДИ – 0,64–1,02; р=0,08). Также необходимо отметить, что метформин не был ассоциирован с повышенным риском лактоацидоза.
В 2016 г. FDA опубликовало заявление, согласно которому метформин противопоказан к назначению пациентам с СД и СН со сниженной функцией почек (скорость клубочковой фильтрации <30 мл/мин/1,73 м2) [26].
Клинические рекомендации по СН экспертов ОССН, РКО и РНМОТ 2018 г. [1] характеризуют метформин как препарат первого выбора лечения больных СД2 как без СН, которым проводится профилактика ХСН, так и пациентов с ХСН, в т.ч. при низкой ФВ ЛЖ и сочетании ХСН с нарушением функции почек (IIa, B). Эксперты РАЭ и НМИЦ эндокринологии в 9-м выпуске российских алгоритмов по СД [23] характеризуют метформин как безопасный препарат при лечении больных СД и ХСН с сохраненной ФВ, рекомендуя его как возможный препарат выбора пациентов с ХСН и нарушенной ФВ. Однако пациентам с тяжелой почечной и печеночной недостаточностью назначение метформина противопоказано из-за риска развития лактатацидоза (УДД 2, УУР А) [23].
Тиазолидиндионы
ТЗД (глитазоны) представляют собой группу препаратов, относящихся к классу сенситайзеров, т.е. ЛС, повышающих чувствительность периферических тканей к инсулину. Глитазоны достаточно широко используются в терапии пациентов с СД2 в составе комбинированной сахароснижающей терапии [23]. Однако известно, что представители данного класса ЛС обладают способностью задерживать жидкость, провоцируя проявление или усугубляя течение СН [6]. Так, W.H. Tang et al. [27], наблюдая в течение 2,5 лет 111 пациентов с ХСН и СД, выявили, что частота задержки жидкости у больных, принимавших ТЗД (пиоглитазон, росиглитазон, троглитазон) в составе монотерапии или в комбинации с инсулином (46% пациентов) составила 17%. Из них 26% пациентов были госпитализированы для лечения данного состояния, в т. ч. 11% с клинической картиной отека легких.
Механизмы, способствующие задержке жидкости с развитием отечного синдрома и СН у пациентов, получающих ТЗД, к настоящему времени изучены недостаточно. Считается, что прием глитазонов приводит к снижению экскреции натрия, задержке натрия и жидкости, увеличению объема циркулирующей крови с рос-том преднагрузки на миокард [6].
В многоцентровом рандомизированном двойном слепом исследовании S.E. Kahn et al. [22], посвященном изучению прогрессирования исходов СД2, 4360 пациентов были рандомизированы в 3 группы лечения: росиглитазоном (n=1456), метфомином (n=1454) и глибуридом (n=1441). Средняя продолжительность терапии составила 4,0 года в группах росиглитазона и метформина и 3,3 года – в группе глибурида. Было обнаружено, что в группе росиглитазона периферические отеки, отек легких и использование петлевых диуретиков регистрировались статистически значимо чаще (14,1%), чем в группах метформина (8,5%, р<0,001) и глибурида (7,2%, р<0,001). Сердечно-сосудистые события были зарегистрированы у 62 пациентов в группе росиглитазона, 58 – в группе метформина и у 41 – в группе глибурида. При этом в группе росиглитазона отмечалась более высокая частота развития СН. Так, ОР развития ХСН в группе росиглитазона по сравнению с группой метформина составило 1,22 (95% ДИ – 0,66–2,26; р=0,52), а ОР для группы росиглитазона по сравнению с группой глибурида – 2,20 (95% ДИ – 1,01–4,79; р=0,05).
В литературе опубликованы результаты ряда крупных исследований по изучению влияния глитазонов на СН, которые убедительно показали, что использование последних ассоциировалось как с усугублением уже существовавшей СН (ухудшение симптомов), так и с увеличением риска развития СН (новые случаи) [28–32]. Так, в исследование Н.С. Gerstein et al. [28], в котором изучалось профилактическое действие рамиприла и росиглитазона в отношении развития СД (The Diabetes Reduction Assessment with Ramipril and Rosiglitazone Medication, DREAM), были включены 5269 пациентов с повышенным уровнем глюкозы натощак и/или с нарушенной толерантностью к глюкозе, не имевших ССЗ (данное показание не зарегистрировано). Участники были распределены случайным образом в группы росиглитазона (n=2635) или плацебо (n=2634). В результате исследования было выявлено, что СН развилась у большего числа больных группы росиглитазона по сравнению с группой плацебо (0,5 против 0,1%; р=0,01), пациенты группы росиглитазона отличались большим риском развития СН (ОШ=7,03; 95% ДИ – 1,60–30,9; р=0,01) по сравнению с группой плацебо.
В многоцентровом проспективном открытом рандомизированном клиническом исследовании RECORD (Rosiglitazone Evaluated for Cardiac Outcomes and Regulation of Glycaemia in Diabetes) [29] 4447 пациентов с СД2 и ССЗ в анамнезе (инфаркт миокарда, инсульт, стенокардия, ХСН, транзиторная ишемическая атака) сравнивали 2 режима сахароснижающей терапии (росиглитазон+метформин/ПСМ и метформин+ПСМ). Промежуточный анализ спустя 3,75 года терапии показал достоверное увеличение риска развития СН у лиц, получавших росиглитазон (ОШ=2,15; 95% ДИ – 1,30–3,57).
Изучение влияния росиглитазона на динамику симптомов СН у лиц с СД2 осуществлено в исследовании H.J. Dargie et al. [30]. Применение пациентами с СД2 и СН I–II ФК по NYHA (ФВ ЛЖ ≤45%) росиглитазона (n=110) по сравнению с группой плацебо (n=104) в течение 52 недель было ассоциировано с увеличением смертности от всех причин (ОШ=1,5; 95% ДИ – 0,49–4,59), а также частоты госпитализаций по причине СН (ОР=1,30; 95% ДИ – 0,35–4,82).
Применение пиоглитазона (единственного препарата группы ТЗД, представленного в Российской Федерации в настоящее время) также ассоциировано с повышенной частотой развития и/или декомпенсации СН. Так, в проспективном рандомизированном двойном слепом исследовании PROactive (Prospective Pioglitazone Clinical Trial In Macrovascular Events) [31] 5238 пациентов с СД2 и признаками макрососудистых заболеваний (инфаркт миокарда, инсульт, реваскуляризация) изучали влияние пиоглитазона на макрососудистые исходы: пациенты были рандомизированы в группы пиоглитазона (n=2605) или плацебо (n=2633). В результате исследования было установлено, что прием пиоглитазона был ассоциирован с более высокой частотой развития СН (11 против 8% в группе плацебо; р<0,0001).
В 6-месячном рандомизированном двойном слепом многоцентровом исследовании T.D. Giles et al. [32], в котором приняли участие больные СД2 и СН II–III ФК по NYHA (ФВ ЛЖ ≤40%), сравнивали влияние пиоглитазона и глибурида на функцию ЛЖ. Комбинированная первичная конечная точка включала сердечно-сосудистую смерть, госпитализацию или посещение отделения неотложной помощи по причине СН. Было обнаружено, что пациенты, принимавшие пиоглитазон (n=262), первичной конечной точки (13%) достигали раньше и чаще, чем пациенты группы глибурида (8%; р=0,024). Госпитализация или посещение отделения неотложной помощи по причине СН произошло у 30 пациентов группы пиоглитазона и 15 ‒ глибурида.
Известен ряд мета-анализов, объединивших данные основных рандомизированных контролируемых и проспективных исследований, результаты которых также продемонстрировали способность ТЗД усугублять существующую СН и увеличивать риск ее развития [33–36].
Сравнение влияния различных ТЗД (росиглитазона и пиоглитазона) на риск развития серьезных сердечно-сосудистых событий было осуществлено в ретроспективном исследовании D.J. Graham et al. [37]. Анализ риска развития СН у 227 571 пациента, получавших ТЗД, показал, что больший риск был ассоциирован с росиглитазоном по сравнению с пиоглитазоном (ОШ=1,25; 95% ДИ – 1,16–1,34).
Результатом многочисленных исследований по оценке влияния ТЗД на риск развития и прогрессирования/обострения СН стали рекомендации по диабету, предиабету и ССЗ Европейского общества кардиологов (The European Society of Cardiology, ESC) в партнерстве с Европейской ассоциацией по изучению диабета (The European Association for the Study of Diabetes, EASD) [38], позиционирующих ТЗД (росиглитазон и пиоглитазон) как группу ЛС, ассоциированную с повышенным риском развития/прогрессирования СН у пациентов с СД2, не рекомендованную к использованию пациентами с СН или высоким риском ее развития (III, A). Эксперты ОССН, РКО и РНМОТ также не рекомендуют применения ТЗД для лечения СД2 у больных, имеющих высокий риск развития или клинически выраженную ХСН (III, A) [1]. Наконец, эксперты РАЭ и НМИЦ эндокринологии не рекомендуют использование ТЗД в отношении больных ХСН и СД2 (УДД 2, УУР А), что отражено в Алгоритмах специализированной медицинской помощи больным СД (9-й выпуск, 2019) [23].
Ингибиторы дипептидилпептидазы-4
В свете представленных выше данных фокус многих исследований, касающихся ССП, сместился в сторону сердечно-сосудистой безопасности этой группы ЛС: была инициирована масса рандомизированных контролируемых исследований. В поле пристального внимания и изучения попали в т.ч. и препараты группы иДПП-4. В настоящее время эта группа ССП, разработанных на основании современных представлений о физиологии инкретинов, широко используется в составе комбинированной сахароснижающей терапии при СД2 [23] и представлена в числе прочих саксаглиптином, алоглиптином, линаглиптином, вилдаглиптином и ситаглиптином.
Saxagliptin Assessment of Vascular Outcomes Recorded in Patients with Diabetes Mellitus —Thrombolysis in Myocardial Infarction 53 (SAVOR-TIMI 53) [39] – первое многоцентровое рандомизированное двойное слепое плацебо-контролируемое исследование препаратов группы иДПП-4, в нем оценивались эффективность и сердечно-сосудистая безопасность саксаглиптина для пациентов ≥40 лет с СД2 и ССЗ в анамнезе (n=12 959) или множественными факторами риска ССЗ (n=3 533). Средний срок наблюдения составил 2,1 года. Результаты исследования показали отсутствие значимых различий в группах саксаглиптина (n=8280) и плацебо (n=8212) как по основной комбинированной конечной первичной точке исследования (сердечно-сосудистая смертность, нефатальные инфаркт миокарда и ишемический инсульт; ОР=1,0; 95% ДИ – 0,89–1,12; р=0,99), так и по основной комбинированной конечной вторичной точке (сердечно-сосудистая смертность, нефатальные инфаркт миокарда и ишемический инсульт, госпитализации по поводу нестабильной стенокардии, коронарной реваскуляризации или СН; ОР=1,02; 95% ДИ – 0,94–1,11; р=0,66). Однако за период наблюдения было отмечено развитие 741 случая госпитализации по причине СН у 517 пациентов, при этом в группе саксаглиптина число госпитализаций было больше (289 случаев, 3,5%), чем в группе плацебо (228 случаев, 2,8%), а риск госпитализации по причине СН – выше (ОР=1,27; 95% ДИ – 1,07–1,51; р=0,007), особенно в первые 6 месяцев терапии.
Оценка взаимосвязи между базовыми клиническими характеристиками общей группы пациентов (вне зависимости от лечения) и риском госпитализации по поводу СН показала, что наибольшим риском обладали лица, имевшие предшествовавшую СН (ОР= 2,98; р<0,01), хроническое заболевание почек с СКФ ≤60 мл/мин/1,73 м2 (ОР=1,54; р<0,01) и/или исходный уровень NT-proBNP (предшественник мозгового натрийуретического пептида) >332 пг/мл (ОР=5,47; р<0,01) [40].
Дальнейший анализ результатов исследования был посвящен изучению клинических исходов для лиц с/без предшествовавшей СН [40]. Так, пациенты группы саксаглиптина, исходно имевшие СН, отличались несколько большим по сравнению с плацебо риском развития комбинированных первичной и вторичной конечных точек (ОР=1,13; р=0,32 и 1,06; р=0,5 соответственно), чем лица без СН, получавшие саксаглиптин (ОР=0,97; р=0,68 и 1,01; р=0,87), однако эти различия были статистически не значимы. Риск госпитализации по причине СН у больных группы саксаглиптина был статистически значимо выше в подгруппе пациентов с отсутствием СН на момент рандомизации (ОР=1,32; р=0,02) по сравнению с группой плацебо, а в подгруппе пациентов с наличием СН на момент включения в исследование определялась сходная тенденция (ОР=1,21; р=0,15).
Сердечно-сосудистую безопасность алоглиптина в рамках многоцентрового рандомизированного двойного слепого плацебо-контролируемого исследования Examination of Cardiovascular Outcomes with Alogliptin versus Standard of Care (EXAMINE) [41], посвященого изучению влияния алоглиптина на основные сердечно-сосудистые события у пациентов с СД2 (n=5 380), перенесших острый коронарный синдром в течение 15–90 дней до рандомизации, рассмотрели F. Zannad et al. Средний период наблюдения составил 18 месяцев. В результате было обнаружено увеличение частоты госпитализаций по поводу СН в группе алоглиптина (3,9%) по сравнению с группой плацебо (3,3%; ОР=1,19; 95% ДИ – 0,90–1,58; р=0,22). Однако сравнение подгрупп алоглиптина с/без исходно имеющейся СН с плацебо выявило больший риск госпитализации по причине СН у больных, не имевших СН на момент включения в исследование (ОР=1,76; р=0,026), тогда как у пациентов с СН в анамнезе увеличения риска выявлено не было (ОР=1,00; р=0,996).
Изучением безопасности иДПП-4 вилдаглиптина для пациентов с СД-2 и СН (I–III ФК по NYHA) со сниженной ФВ ЛЖ (< 40 мл) занимались, в частности, J.J.V. McMurray et al. [42]. Пациенты (n=254) были рандомизированы в группы вилдаглиптина (n=128) и плацебо (n=126). Наблюдение в течение 52 недель выявило, что по сравнению с плацебо вилдаглиптин не оказывал значительного влияния на ФВ ЛЖ, однако приводил к увеличению объема ЛЖ; причина и клиническое значение этого факта остаются неизвестными. В связи с этим исследователи заявили о необходимости дальнейших исследований в области безопасности иДПП-4 для пациентов с СН и систолической дисфункцией ЛЖ.
Ретроспективный мета-анализ G. McInnes et al. [43], объединивший данные пациентов 40 двойных слепых рандомизированных контролируемых исследований вилдаглиптина III и IV фаз (с проспективной оценкой сердечно-сосудистых характеристик) продолжительностью от 12 до 104 недель, был посвящен изучению сердечно-сосудистой безопасности этого препарата, в т.ч. и риску развития/прогрессирования СН у 17 446 пациентов с СД2.
В результате анализа было обнаружено, что у 41 (0,43%) пациента, принимавшего вилдаглиптин (n=9599), и у 32 (0,45%) пациентов контрольной группы (n=7847) были зарегистрированы случаи СН, ОР развития/прогрессирования СН в группах составил 1,08 (95% ДИ – 0,68–1,70). Был сделан вывод: использование вилдаглиптина не ассоциировано с повышенным риском развития/прогрессирования СН у пациентов с СД2.
Также необходимо отметить, что в отличие от саксаглиптина и алоглиптина отдельных проспективных исследований, направленных на изучение профиля сердечно-сосудистой безопасности вилдаглиптина, к настоящему времени выполнено не было.
Цель многоцентрового рандомизированного плацебо-контролируемого исследования The Cardiovascular and Renal Microvascular Outcome Study With Linagliptin (CARMELINA) [44] заключалась в оценке влияния линаглиптина на исходы ССЗ и заболеваний почек у пациентов с СД2 и высоким риском сердечно-сосудистых и почечных событий. Включенные в исследование пациенты были рандомизированы в группы линаглиптина (n=3 494) или плацебо (n=3485), которые были добавлены к обычной схеме ведения больных. Установлено, что у лиц с СД2, высоким сердечно-сосудистым и почечным риском линаглиптин по сравнению с плацебо не увеличивал сердечно-сосудистый риск в течение периода наблюдения (в среднем 2,2 года). В свете рассматриваемой проблемы важен тот факт, что время до первой госпитализации по поводу СН в группе линаглиптина было сопоставимо с аналогичным показателем в группе плацебо (ОР=0,90; 95% ДИ – 0,74–1,08; р=0,26). Сравнение подгрупп линаглиптина с/без исходной СН с плацебо не выявило отличий в риске госпитализации по причине СН (ОР=0,88; р=0,33 и ОР=0,92; р=0,56 соответственно) [45].
Влияние на сердечно-сосудистые события иДПП-4 ситаглиптина (Янувия) у пациентов с СД2 и ССЗ изучено в исследовании Trial Evaluating Cardiovascular Outcomes with Sitagliptin (TECOS) [46]. В этом рандомизированном двойном-слепом клиническом исследовании 14 671 пациент был рандомизирован в отношении 1:1 в группы ситаглиптина и плацебо. Средний период наблюдения составил 3,0 года. Анализ результатов исследования позволил прийти к следующему выводу: назначение ситаглиптина пациентам с СД2 и ССЗ не оказало влияния на частоту основных сердечно-сосудистых событий, а также не влияло на смертность от всех причин (ОР=1,01; 95% ДИ – 0,90–1,14; р=0,88), сердечно-сосудистую смертность (ОР=1,03; 95% ДИ – 0,89–1,19; р=0,71) или некардиоваскулярную смертность. Терапия ситаглиптином не была ассоциирована с повышенным риском госпитализаций по поводу СН (ОР=1,00; 95% ДИ – 0,83–1,20; р=0,98), а также с достижением комбинированной конечной точки – частота госпитализаций по поводу СН/сердечно-сосудистая смертность (ОР=1,02; 95% ДИ – 0,90–1,15; р=0,74). Полученные данные позволили исследователям сделать вывод о нейтральном действии ситаглиптина (Янувия) в отношении сердечно-сосудистых рисков и СН, а следовательно, о безопасности его использования пациентами с СД2 и наличием ССЗ.
Сравнение подгруппы пациентов, принимавших ситаглиптин и имевших СН до включения в исследование, и всех пациентов группы ситаглиптина с плацебо не выявило значимых различий во влиянии препарата как на риск госпитализации по причине СН (ОР=1,03; р=0,86 для подгруппы ситаглиптина с исходной СН; ОР=1,00; р=0,95 для всей группы ситаглиптина), так и на комбинированную конечную точку – частоту госпитализаций по поводу СН/сердечно-сосудистой смертности (ОР=0,96; р=0,71 для подгруппы ситаглиптина с исходной СН; ОР=1,02; р=0,81 для всей группы ситаглиптина) [47].
Вторичный анализ и сравнение подгрупп пациентов, госпитализированных по причине СН, выделенных из групп ситаглиптина (Янувия) (n=228 из 7 337 пациентов) и плацебо (n=229 из 7 337), показал незначительные различия в СН-ассоциированных исходах в зависимости от базовых характеристик подгрупп. Представители всех подгрупп (с/без исходной СН) в целом характеризовались низким риском госпитализации по причине СН, при этом пациенты с исходной СН I ФК по NYHA имели риск (ОР=1,08), сравнимый с таковым пациентов, не имевших СН исходно (ОР=0,96), еще большая тенденция к снижению риска госпитализации по причине СН была отмечена у больных исходной СН ≥II ФК по NYHA (ОР=0,82; р=0,12 для всех значений ОР) [47].
В мета-анализ D. Liu et al. [48] было включено четыре крупных рандомизированных контролируемых и три наблюдательных исследования больных СД2 (n=157 478), где 76 026 пациентам был назначен иДПП-4 (вилдаглиптин, ситаглиптин, саксаглиптин, алоглиптин, линаглиптин и омариглиптин – не зарегистрирован в Российской Федерации), а 81 452 пациентов были отнесены к контрольной группе. Анализ сердечно-сосудистых исходов показал, что в течение периода наблюдения от 52 до 152 недель показатели первичной конечной точки (сердечно-сосудистая смерть, нефатальный инсульт, нефатальный инфаркт миокарда) существенно не различались в группах с/без использования любого иДПП-4 (ОШ=0,95; 95% ДИ – 0,86–1,04; р=0,26). Существенных различий в группах не отмечалось также в отношении показателей смерти от всех причин (OШ=0,84; 95% ДИ – 0,59–1,18; р=0,31), госпитализаций по поводу сердечно-сосудистых осложнений (OШ=1,02; 95% ДИ – 0,96–1,09; р=0,45) и госпитализаций по поводу СН (OШ=1,05; 95% ДИ – 0,90–1,23; р=0,55).
Многочисленные исследования, посвященные изучению профиля сердечно-сосудистой безопасности иДПП-4, и их результаты легли в основу клинических рекомендаций, регламентирующих использование представителей данной группы, в т.ч. лицами с СД2 и ХСН. Так, эксперты РАЭ и НМИЦ эндокринологии в Алгоритмах специализированной медицинской помощи больным СД (9-й выпуск, 2019) [23] указывают, что иДПП-4 (за исключением саксаглиптина) не увеличивают риск сердечно-сосудистых событий и тяжесть ХСН (УДД 1, УУР А). В свою очередь клинические рекомендации по диабету, предиабету и ССЗ Европейского общества кардиологов (ESC) в партнерстве с Европейской ассоциацией по изучению диабета (EASD) [38] характеризуют иДПП-4 ситаглиптин и линаглиптин как ЛС, обладающие нейтральным эффектом в отношении риска госпитализации по причине СН, которые могут быть использованы для терапии пациентов с СД2 и СН (IIb, B). Ингибитор ДПП-4 саксаглиптин из-за ассоциации с высоким риском госпитализации по причине СН не рекомендован к использованию пациентами с СД2 и высоким риском развития СН, а также пациентами с СД и СН в анамнезе (III, B).
Эксперты ОССН, РКО и РНМОТ в клинических рекомендациях по СН 2018 г. [1] отдают предпочтение использованию у пациентов с СД2 (IIb, B) иДПП-4 ситаглиптину как препарату c нейтральным действием в отношении СН.
К сожалению, механизмы, с помощью которых иДПП-4 (саксаглиптин и алоглиптин) способствуют увеличению риска госпитализации по поводу СН, а также объясняющие различия между разными представителями этой группы ЛС в отношении данной конечной точки, в настоящее время неизвестны, возможно, что продолжающиеся исследования помогут ответить на этот вопрос. В качестве одного из возможных патофизиологических механизмов рассматривается роль ингибирования ДПП-4, участвующего в регуляции ряда пептидов, имеющих отношение к сердечно-сосудистой системе (глюкагоноподобный пептид-1 [glucagon-like peptide-1– GLP-1], желудочный ингибиторный полипептид [gastric inhibitory polypeptide – GIP], мозговой натрийуретический пептид [brain natriuretic peptide – BNP] и стромальный клеточный фактор-1 [stromal cell-derived factor-1 – SDF–1]), тем самым влияя не только на уровень гликемии, но и на уровень артериального давления, липиды крови и функциональное состояние сердечно-сосудистой системы [49, 50]. При этом различия в ассоциациях отдельных представителей группы с повышенным риском развития/прогрессирования СН могут быть связаны с отличиями на уровне молекулярной структуры ЛС (саксаглиптин – это созданный на основе β-аминокислоты пептидомиметический иДПП-4, тогда как алоглиптин представляет собой модифицированный пиримидиндион), с различными фармакологическими характеристиками, такими как разная селективность и мощность действия в отношении ДПП-4, продолжительность действия, особенности метаболизма и путей элиминации, что способно оказывать существенное воздействие на клиническое использование различных представителей группы.
Период полувыведения – один из показателей, характеризующих фармакологическую неоднородность группы. Если у одних иДПП-4 (алоглиптин, линаглиптин, ситаглиптин) он довольно продолжителен, обеспечивая стойкое ингибирование фермента при приеме 1 раз в сутки, то у других (саксаглиптин, вилдаглиптин) – более короткий. Однако ковалентный тип связи саксаглиптина и вилдаглиптина с ферментом (в отличие от нековалентного типа связи, характерного для алоглиптина, линаглиптина и ситаглиптина) обеспечивает более продолжительную по времени связь и соответственно малую кратность приема. Так, несмотря на то что период полувыведения саксаглиптина не превышает 5 часов, использование 1 раз в сутки возможно для данного ЛС.
К особенностям метаболизма и путей элиминации алоглиптина, ситаглиптина относится следующее: они практически не метаболизируются и выводятся почками преимущественно в неизмененном виде. В свою очередь саксаглиптин, метаболизирующийся в печени, образует активный метаболит с вполовину меньшей мощностью действия. То есть после приема саксаглиптина около 24% препарата циркулируют в интактном виде и около 36% – в виде значительно менее активного метаболита. В свою очередь вилдаглиптин, метаболизирующийся за счет цитохром-Р450 – независимого гидролиза и обладающий большей чувствительностью к гидролизу, лишь в 23% циркулирует в виде родительского препарата, а его метаболит вовсе фармакологически не активен. Окончательная элиминация саксаглиптина и вилдаглиптина происходит в почках с выведением как самого препарата, так и его метаболитов.
Экскреция с желчью – основной путь элиминации линаглиптина.
В терапевтических дозах препарат находится преимущественно в связанной с белком форме, что минимизирует его почечный клиренс.
Знание особенностей метаболизма и элиминации имеет значение при учете возможности лекарственных взаимодействий между иДПП-4 и другими ЛС, которые на практике минимальны и в большинстве случаев не требуют корректировки доз препаратов. Однако использование саксаглиптина с мощными ингибиторами CYP3A4/5 способно приводить к повышению концентрации иДПП-4, диктуя необходимость снижения дозы препарата. Совместное использование линаглиптина с индукторами CYP3A4 (рифампицин) способствует снижению концентрации линаглиптина с ожидаемым сохранением его клинической эффективности, которая, однако, будет проявляться не в полной мере.
Кроме того, различия в механизмах выведения отдельных представителей группы иДПП-4 влияют на особенности их практического использования. Так, достижения адекватного терапевтического действия иДПП-4 у пациентов с нарушенной функцией почек требует коррекции доз в той или иной степени представителей группы с преимущественной почечной элиминацией (ало-, сакса-, вилда- и ситаглиптин) в отличие от представителей группы с иным преимущественным путем выведения (линаглиптин). При этом необходимо отметить, что результаты крупномасштабных исследований по оценке безопасности использования иДПП-4 у пациентов с СД2 и заболеваниями почек, показали хорошую переносимость представителей группы у данной когорты пациентов.
Заключение
Современная стратегия лечения СД требует учета как эффективности, так и безопасности осуществляемой сахароснижающей терапии, при этом сердечно-сосудистая безопасность выступает одной из основополагающих целей данной терапии. Очевидно, что ряд ССП ассоциирован с высокими сердечно-сосудистыми рисками, включая риск развития/прогрессирования СН. Несомненно, информированность о потенциальной возможности развития СН при использовании тех или иных ССП поможет существенно расширить возможности практической медицины в сфере контроля за эволюцией СН, позволив в конечном счете влиять на сердечно-сосудистые риски и клинические исходы.
В настоящее время инсулин и ПСМ должны использоваться пациентами с СД2 и СН с осторожностью как препараты, потенциально способные усугублять течение уже имеющейся ХСН. ТЗД, увеличивая риск прогрессирования ХСН, также не рекомендованы к применению пациентами с СД2 и СН. Метформин считается безопасным ЛС при лечении больных СД2 и ХСН с сохраненной ФВ, а также может быть препаратом выбора терапии пациентов СД2 и ХСН с нарушенной ФВ. Ситаглиптин (Янувия) и линаглиптин не увеличивают риска госпитализаций по причине СН у больных СД2 и могут применяться у данной когорты пациентов.
Литература
1. Мареев В.Ю., Фомин И.В., Агеев Ф.Т. и др. Клинические рекомендации ОССН – РКО – РНМОТ. Сердечная недостаточность: хроническая (ХСН) и острая декомпенсированная (ОДСН). Диагностика, профилактика и лечение. Кардиология. 2018;58(S6):8–158. Doi:10.1808 /cardio.2475.
2. Ponikowski P., Voors A.A., Anker S.D., et al. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: the Task Force for the diagnosis and treatment of acute and chronic heartfailure of the European Society of Cardiology (ESC) Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur J Heart Fail. 2016;18:891–975. Doi:10.1093/eurheartj/ehw128.
3. Tsuyuki R.T., Shibata M.C., Nilsson C., et al. Contemporary burden of illness of congestive heart failure in Canada. Can J Cardiol. 2003;19:436–38.
4. DeFrances C., Cullen K., Kozak L. National Hospital Discharge Survey: 2005 annual summary with detailed diagnosis and procedure data. National Centre for Health Statistics. Vital Health Stat. 2007;13.
5. Fonarow G.C., Heywood J.T., Heidenreich P.A., et al. Temporal trends in clinical characteristics, treatments, and outcomes for heart failure hospitalizations, 2002 to 2004: findings from Acute Decompensated Heart Failure National Registry (ADHERE). Am Heart J. 2007;153:1021–28.
6. Hamarneh Y.N, Tsuyuki R.T. Heart Failure. In: Drug‐Induced Diseases: Prevention, Detection, and Management. 3rd ed. Tisdale JE, Miller DA, eds. Bethesda: American Society of Health‐System Pharmacists, 2018. P. 501–21.
7. Sarwar N., Gao P., Seshasai S.R., et al. Diabetes mellitus, fasting blood glucose concentration, and risk of vascular disease: a collaborative meta-analysis of 102 prospective studies. Lancet. 2010;375:2215–22. Doi:10.1016/S0140-6736(10)60484-9.
8. Kannel W.B., McGee D.L. Diabetes and cardiovascular disease: the Framingham study. JAMA. 1979;241:2035–38.
9. Greenberg B.H., Abraham W.T., Albert N.M., et al. Influence of diabetes on characteristics and outcomes in patients hospitalized with heart failure: a report from the Organized Program to Initiate Lifesaving Treatment in Hospitalized Patients with Heart Failure (OPTIMIZE-HF). Am Heart J. 2007;154:271–78. Doi:10.1016/j.ahj.2007.05.001.
10. База данных НПР ВОЗ VigiBase. URL: http://www.vigiaccess.org (Дата обращения:30.10.2019).
11. Knatterud G.L., Klimt C.R., Levin M.E., et al. Effects of hypoglycemic agents on vascular complications in patients with adult-onset diabetes. VII. Mortality and selected nonfatal events with insulin treatment. J Am Med Assoc.1978;240:37–42. Doi:10.1001/jama.1978.03290010041020.
12. UK Prospective Diabetes Study (UKPDS) Group. Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). Lancet. 1998;352(9131):837–53.
13. Abraira C., Colwell J.A., Nuttall F.Q., et al. Cardiovascular events and correlates in the Veterans Affairs Diabetes Feasibility Trial. Arch Int Med. 1997;157:181–88.
14. Pitale S.U., Abraira C., Emanuele N.V., et al. Two years of intensive glycemic control and left ventricular function in the Veterans Affairs Cooperative Study in Type 2 Diabetes Mellitus (VA CSDM).Diabetes Care. 2000;23:1316–20.
15. Nichols G.A., Hillier T.A., Erbey J.R., Brown J.B. Congestive heart failure in type 2 diabetes: prevalence, incidence, and risk factors. Diabetes Care. 2001;24(9):1614–19. Doi:10.2337/diacare.24.9.1614.
16. Smooke S., Horwich T.B., Fonarow G.C. Insulin treated diabetes is associated with a marked increase in mortality in patients with advanced heart failure. Am Heart J. 2005;149(1):168–74. Doi: 10.1016/j.ahj.2004.07.005.
17. Pocock S.J., Wang D., Pfeffer M.A., et al. Predictors of mortality and morbidity in patients with chronic heart failure. Eur Heart J. 2006;27:65–75. Doi: 10.1093/eurheartj/ehi555.
18. Pantalone K.M., Kattan M.W., Yu C., et al. The risk of developing coronary artery disease or congestive heart failure, and overall mortality, in type 2 diabetic patients receiving rosiglitazone, pioglitazone, metformin, or sulfonylureas: a retrospective analysis. Acta Diabetol. 2009;46:145–54.
19. Tzoulaki I., Molokhia M., Curcin V., et al. Risk of cardiovascular disease and all cause mortality among patients with type 2 diabetes prescribed oral antidiabetes drugs: retrospective cohort study using UK general practice research database. BMJ. 2009;339:b4731. Doi: 10.1136/bmj.b4731.
20. Eriksson J.W., Bodegard J., Nathanson D., et al. Sulphonylurea compared to DPP-4 inhibitors in combination with metformin carries increased risk of severe hypoglycemia, cardiovascular events, and allcause mortality. Diabetes Res Clin Pract. 2016;117:3947. Doi: 10.1016/j.diabres.2016.04.055.
21. UK Prospective Diabetes Study (UKPDS) Group. Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). Lancet. 1998;352:837–53.
22. Kahn S.E., Haffner S.M., Heise M.A., et al. ADOPT Study Group. Glycemic durability of rosiglitazone, metformin, or glyburide monotherapy. N Engl J Med. 2006;355(23): 2427–43.
23. Дедов И.И., Шестакова М.В., Майоров А.Ю. Алгоритмы специализированной медицинской помощи больным сахарным диабетом. 9-й выпуск. Сахарный диабет. 2019;22(1):1–211.
24. Eurich D.T., Majumdar S.R., McAlister F.A., et al. Improved clinical outcomes associated with metformin in patients with diabetes and heart failure. Diabetes Care. 2005;28:2345–51. Doi: 10.2337/diacare.28.10.2345.
25. Eurich D.T., McAlister F.A., Blackburn D.F., et al. Benefits and harms of antidiabetic agents in patients with diabetes and heart failure: systematic review. BMJ. 2007;335:497. Doi: 10.1136/bmj.39314.620174.80.
26. Page R.L., O’Bryant C.L., Cheng D., et al. Drugs That May Cause or Exacerbate Heart Failure. A Scientific Statement From the American Heart Association. Circulation. 2016;134:e32–e69. Doi: 10.1161/CIR.0000000000000426.
27. Tang W.H., Francis G.S., Hoogwerf B.J., et al. Fluid retention after initiation of thiazolidinedione therapy in diabetic patients with established chronic heart failure. J Am Coll Cardiol. 2003;41(8):1394–98.
28. DREAM (Diabetes REduction Assessment with ramipril and rosiglitazone Medication) Trial Investigators; Gerstein H.C., Yusuf S., Bosch J., et al. Effect of rosiglitazone on the frequency of diabetes in patients with impaired glucose tolerance or impaired fasting glucose: a randomized controlled trial. Lancet. 2006;368:1096–1105.
29. Home P.D., Pocock S.J., Beck-Nielsen H., et al. Rosiglitazone evaluated for cardiovascular outcomesan interim analysis. N Engl J Med. 2007;357:28–38.
30. Dargie H.J., Hildebrandt P.R., Riegger G.A., et al. A randomized, placebocontrolled trial assessing the effects of rosiglitazone on echocardiographic function and cardiac status in type 2 diabetic patients with New York Heart Association functional class I or II heart failure. J Am Coll Cardiol. 2007;49:1696–1704. Doi:10.1016/j.jacc.2006.10.077.
31. Lincoff A.M., Woski K., Nichols S.J., Nissen S.E. Pioglitazone and risk of cardiovascular events in patients with type 2 diabetes mellitus: a meta-analysis of randomized trials Pioglitazone and risk of cardiovascular events in patients with type 2 diabetes mellitus: a meta-analysis of randomized trials. J Am Med Assoc. 2007;298(10):1180–88. Doi:1180–1188.10.1001/jama.298.10.1180.
32. Giles T.D., Miller A.B., Elkayam U., et al. Pioglitazone and heart failure: results from a controlled study in patients with type 2 diabetes mellitus and systolic dysfunction. J Card Fail. 2008;14:445–52. Doi:10.1016/j.cardfail.2008.02.007.
33. Hernandez A.V., Usmani A., Rajamanickam A., Moheet A. Thiazolidinediones and risk of heart failure in patients with or at high risk of type 2 diabetes mellitus: a meta-analysis and meta-regression analysis of placebo-controlled randomized clinical trials. Am J Cardiovasc Drugs. 2011;11:115–28. Doi:10.2165/11587580-000000000-00000.
34. Filion K.B., Joseph L., Boivin J.F., et al. Thiazolidinediones and the risk of incident congestive heart failure among patients with type 2 diabetes mellitus. Pharmacoepidemiol Drug Saf. 2011;20:785–96. Doi:10.1002/pds.2165.
35. Loke Y.K., Kwok C.S., Singh S. Comparative cardiovascular effects of thiazolidinediones: systematic review and meta-analysis of observational studies. BMJ. 2011;342:d1309.
36. Lago R.M., Singh P.P., Nesto R.W. Congestive heart failure and cardiovascular death in patients with prediabetes and type 2 diabetes given thiazolidinediones: a meta-analysis of randomized clinical trials. Lancet. 2007;370:1129–36. Doi:10.1016/S0140-6736(07)61514-1.
37. Graham D.J., Ouellet-Hellstrom R., MaCurdy T.E.,et al. Risk of acute myocardial infarction, stroke, heart failure, and death in elderly Medicare patients treated with rosiglitazone or pioglitazone. JAMA. 2010;304:411–18. Doi:10.1001/jama.2010.920.
38. ESC Guidelines on diabetes, pre-diabetes, and cardiovascular diseases. Eur Heart J. 2019;00:1–69. Doi:10.1093/eurheartj/ehz486.
39. Scirica B.M., Bhatt D.L., Braunwald E., et al. SAVOR-TIMI 53 Steering Committee and Investigators. Saxagliptin and cardiovascular outcomes in patients with type 2 diabetes mellitus. N Engl J Med. 2013;369:1317–26. Doi: 10.1056/NEJMoa1307684.
40. Scirica B.M., Braunwald E., Raz I., et al. Heart Failure, Saxagliptin, and Diabetes Mellitus: Observations from the SAVOR-TIMI 53 Randomized Trial CLINICAL PERSPECTIVE. Circulation. 2014;130(18):1579–88. Doi:10.1161/circulationaha.114.010389.
41. Zannad F., Cannon C.P., Cushman W.C., et al. Heart failure and mortality outcomes in patients with type 2 diabetes taking alogliptin versus placebo in EXAMINE: a multicentre, randomised, double-blind trial. Lancet. 2015;385(9982):2067–76. Doi: 10.1016/s0140-6736(14)62225-x.
42. McMurray J.V., Ponikowski P., Bolli G.B., et al. VIVIDD Trial Committees and Investigators. Effects of vildagliptin on ventricular function in patients with type 2 diabetes mellitus and heart failure: a randomized placebo-controlled trial. JACC Heart Fail. 2018;6:817.
43. McInnes G., Evans M., Del Prato S., et al. Cardiovascular and heart failure safety profile of vildagliptin: a meta-analysis of 17 000 patients. Diabetes, Obesity and Metabolism. 2015;17(11):1085–92. Doi:10.1111/dom.12548.
44. Rosenstock J., Perkovic V., Johansen O.E., et al. CARMELINA Investigators. Effect of linagliptin vs placebo on major cardiovascular events in adults with type 2 diabetes and high cardiovascular and renal risk: the CARMELINA randomized clinical trial. JAMA. 2019;321:69–79. Doi: 10.1007/s40261-019-00770-z.
45. McGuire D.K., Alexander MHSc J.H., Johansen O.E., et al. Linagliptin Effects on Heart Failure and Related Outcomes in Individuals With Type 2 Diabetes Mellitus at High Cardiovascular and Renal Risk in CARMELINA. Circulation. 2018;139(3):351–61. Doi: 10.1161/CIRCULATIONAHA.118.038352.
46. Green J.B., Bethel M.A., Armstrong P.W., et al. TECOS Study Group. Effect of sitagliptin on cardiovascular outcomes in type 2 diabetes. N Engl J Med. 2015;373:232–42. Doi: 10.1056/NEJMoa1501352.
47. McGuire D.K., Van de Werf F., Armstrong, P.W.,et al. Association Between Sitagliptin Use and Heart Failure Hospitalization and Related Outcomes in Type 2 Diabetes Mellitus. JAMA Cardiology. 2016;1(2):126. Doi:10.1001/jamacardio.2016.0103.
48. Liu D., Jin B., Chen W., Yun P. Dipeptidyl peptidase 4 (DPP-4) inhibitors and cardiovascular outcomes in patients with type 2 diabetes mellitus (T2DM): a systematic review and meta-analysis. BMC Pharmacology and Toxicology. 2019;20(1):15. Doi:10.1186/s40360-019-0293-y.
49. Zhong J., Goud A., Rajagopalan S. Glycemia Lowering and Risk for Heart Failure. Circulation: Heart Failure. 2015;8(4):819–25. Doi:10.1161/circheartfailure.114.001967.
50. Лазарева Н.Б. Ингибиторы дипепетидилпептидазы-4: взгляд клинического фармаколога. Медицинский совет. 2016;19:114–21. Doi: 10.21518/2079-701X-2016-19-114-121.
