О.В. Васюкова*, П.Л. Окороков, Ю.В.
Касьянова, О.Б. Безлепкина
Национальный медицинский исследовательский центр
эндокринологии, Москва, Россия
Между человеком и окружающей средой постоянно происходит обмен веществами и энергией. В организм регулярно поступают микро- и макронутриенты, вода, кислород, элиминируются конечные продукты метаболизма во внешнюю среду. В клетках непрерывно протекают процессы расщепления органических веществ и синтеза необходимых нутриентов для построения и обновления структурных элементов клеток, тканей и органов, которые сопровождаются процессами высвобождения, поглощения и запасания энергии в виде макроэргических соединений. Взаимосвязь двух разнонаправленных процессов: анаболических (пластический обмен) и катаболических является основой динамического равновесия метаболизма, что обеспечивается сложной регуляцией на разных уровнях. Возраст, пол, расовая принадлежность, состояние здоровья, нутритивный статус, повседневная физическая активность, воздействие окружающей среды оказывают существенное влияние на состояние обмена веществ.
История изучения энергетического обмена человека началась в 1780-е гг., когда Антуан Лавуазье и Симон Пьер де Лаплас измерили потребление кислорода и выделение углекислого газа у людей и обнаружили, что оба показателя увеличиваются после еды и во время упражнений, хотя температура тела при этом не меняется [1]. Они сконструировали небольшой калориметр для морских свинок и показали прямую взаимосвязь между теплом, выделяемым животным, и дыхательной системой. Эти первые эксперименты были усовершенствованы Уилбуром Этуотером и его коллегами, которые создали калориметр, позволяющий обследовать людей, и показали, что организм человека соблюдает величайший закон термодинамики — закон сохранения энергии: количество тепла, продуцируемого индивидуумом, равно количеству тепла, выделяемому при окислении принятой им пищи [2].
Таким образом, энергетическое равновесие (так называемый нулевой энергетический баланс) достигается, когда потребление энергии, пригодной для метаболизма, соответствует количеству потраченной энергии. Cоответственно, «ненулевой» энергетический баланс предполагает равнонаправленное изменение метаболизма и веса, что впоследствии меняет расход энергии. Так, в случае положительного энергетического баланса базальный уровень метаболизма повышается соответственно увеличению веса вследствие роста мышечной массы для поддержания израсходованных жировых депо, и наоборот, отрицательный энергетический баланс вызывает снижение массы тела, при этом базовая скорость метаболизма также снижается. Предполагая, что потребление энергии останется неизменным после первоначального вмешательства, можно ожидать, что затраты энергии будут соответствовать потреблению энергии, а масса тела стабилизируется на новом заданном уровне [3].
Вместе с тем последние десятилетия новейшей истории пошатнули ранее известные аксиомы. Ожирение, захватившее всю планету, является следствием хронического энергетического дисбаланса, при котором потребление энергии постоянно превышает расходы, что приводит к накоплению избыточной энергии в виде белой жировой ткани. И несмотря на, казалось бы, простое решение — уменьшить потребление калорий (избегая определенной пищи) и увеличить затраты энергии (повышая физическую активность), результаты современных исследований демонстрируют крайне низкую эффективность данных мероприятий, свидетельствуя о том, что ожирение является проблемой гораздо более сложной, чем кажется на первый взгляд.
Кроме этого, следует признать, что современные фундаментальные научные исследования с использованием животных моделей и клеточных культур, позволившие понять молекулярные патогенетические механизмы, лежащие в основе развития метаболических нарушений и хронизации заболевания, не приблизили нас к пониманию практических стратегий управления избыточным набором массы тела и не дали эффективных клинических мер борьбы с эпидемией ожирения.
Нам еще предстоит изучить сложные взаимодействия между генетикой, физиологией и когнитивным поведением, которые регулируют энергетический гомеостаз. В сложившейся ситуации, когда генетика, биохимия не являются надежными предикторами траектории изменения массы тела, а также для оценки эффективности проводимых вмешательств, одним из быстроразвивающихся направлений персонификации терапии ожирения стало изучение энергетического обмена как некоего суммарного показателя взаимодействия различных факторов в организме отдельного человека. Суточный энергетический обмен человека (СЭО) состоит из трех основных компонентов: основной обмен, пищевой термогенез и затраты энергии на физическую активность.
Основной обмен (ОО, скорость метаболизма в состоянии покоя, «resting metabolic rate», RMR) составляет 55–70% суточных энергозатрат и характеризует расход энергии, необходимый для поддержания функционирования жизненно важных функций организма: дыхания, выделения, кровообращения и др. [4]. ОО включает затраты энергии во время сна и на поддержание бодрствования без физической активности (на долю последней приходится около 5% ОО с небольшими различиями в зависимости от расы, пола и веса). Наибольший вклад в формирование ОО (до 70%) вносит тощая масса.
Пищевой термогенез (диетиндуцированный термогенез) составляет не более 5–7% суточных энергозатрат и характеризует дополнительные затраты энергии организма на всасывание и утилизацию потребляемой пищи. Величина пищевого термогенеза зависит от качественного состава пищи: она максимальна при потреблении продуктов, богатых белком, и минимальна при приеме жирной пищи.
Энергозатраты, связанные с физической активностью, составляют 25–30% суточного энергетического обмена и характеризуют затраты энергии, необходимые для обеспечения структурированной (занятия спортом/ физкультурой) и повседневной двигательной активности.
В течение последних 20 лет активно расширяются возможности объективной оценки энергетических затрат человека, появляются новые методы и аппараты. Наиболее изученными являются методы прямой калориметрии (оценка теплопродукции) и непрямой, основанной на определении объема потребляемого кислорода и выделяемого углекислого газа, что, в свою очередь, также позволяет оценить пропорциональное соотношение участия углеводов и липидов в окислении.
Золотым стандартом измерения общих энергозатрат является метод двойной меченой воды (англ. «double labeled water», DLW), применение которого у людей берет начало с 1980-х гг. [5–8]. В ходе его проведения человек выпивает воду, содержащую тяжелые, меченые, нерадиоактивные формы водорода (дейтерий) и кислорода, которые постепенно выводятся из организма в течение дня (почками, с потом, выдыхаемым воздухом). Метод считается безопасным и используется во всех возрастных категориях, включая новорожденных. Забор биологических жидкостей (кровь, слюна или моча) проводят перед и после введения изотопа, затем в конце исследования через 1–3 нед. Вода, полученная из образцов, обогащенная этими двумя газами, измеряется спектрометрией изотопного соотношения. Поскольку дейтерий выводится из организма только с водой, а изотоп кислорода — с водой и выдыхаемым углекислым газом, скорость элиминации изотопа водорода является мерой потери жидкости организмом. Разница между кинетикой выведения двух изотопов позволяет оценить расход энергии. Метод, безусловно, трудоемкий и сложен для применения в рутинной клинической практике.
Результаты самого большого на сегодняшний день популяционного исследования с применением метода двойной меченой воды опубликованы в августе 2021 г. в журнале Science [9]. Эти уникальные данные, полученные Г. Понцером и соавт. при анализе энергетических затрат более чем у 6400 здоровых мужчин и женщин из 29 стран мира в возрасте от 8 дней до 95 лет, продемонстрировали изменения уровня метаболизма во время роста, развития и старения. Уровень основного обмена был скорректирован на безжировую («fat-free mass») массу тела, чтобы учесть различия композиционного состава тела, гендерные особенности, изменения в метаболическом статусе на протяжении жизни. Ожидаемо, общие энергозатраты увеличивались параллельно росту безжировой массы тела. Авторы выделили 4 основных периода значимых изменений энергетического обмена человека. Первый период — младенческий — от рождения до 1 года. Скорость обмена веществ (СЭО и ОО) у новорожденных соответствует уровню взрослого человека, к 1 году жизни быстро увеличивается и становится практически в два раза выше, чем у взрослых, достигая пика к 7 мес. Далее к 20 годам отмечается медленное снижение уровня метаболизма (причем у детей в возрасте от 10 до 15 лет не наблюдалось пубертатного увеличения уровня обмена), а в возрасте от 20 до 60 лет выходит на уровень плато и остается стабильным даже во время беременности и после родов. При многомерной регрессии в возрасте от 1 года до 20 лет у лиц мужского пола показатели обмена были более высокими, тогда как в старших группах пол не оказал заметного влияния на скорость снижения СЭО с возрастом. И наконец, у пожилых людей отмечается постепенное снижение уровня энергетического обмена, несмотря на отсутствие изменений в процентном содержании жировой ткани. Кроме того, данный период сопряжен с увеличением частоты хронических заболеваний (рис. 1).
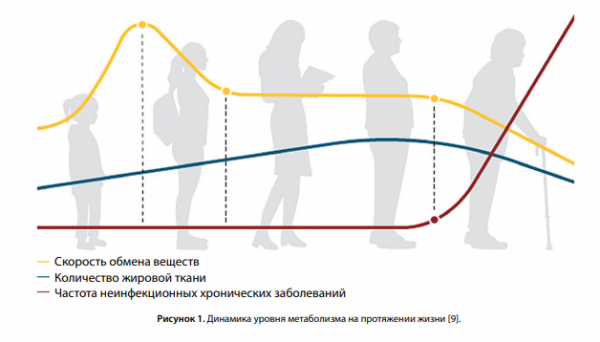
В последние годы появляются доказательства связи между изменениями митохондрий, доступностью питательных веществ и затратами энергии, что предполагает некоторую форму клеточной биоэнергетической адаптации. Если клетка испытывает состояние энергетического голода, ее митохондрии увеличивают соотношение аденозинтрифосфата (АТФ), вырабатываемого на единицу потребления питательных веществ, в то время как клетки с избытком питательных веществ увеличивают энергетические отходы в виде тепла за счет диссимиляции протонов из митохондрий [10]. Другими словами, мы адаптируемся к изменениям в энергетическом балансе, изменяя эффективность синтеза АТФ. Однако длительные нарушения (например, хронический положительный энергетический баланс при ожирении) могут привести к дисфункции митохондрий, характерной для метаболических заболеваний [11].
Изучая молекулярные аспекты процесса старения, П. Баласубраманян и соавт. в исследовании на животных отметили положительное влияние ограничения калорийности питания на состояния, связанные со старением человека, в первую очередь снижение риска ряда неинфекционных заболеваний — сердечно-сосудистых, опухолевых заболеваний, сахарного диабета, деменции, остеопороза, саркопении [12].
Анализ особенностей метаболического статуса в определенном возрастном промежутке имеет важное значение для персонификации рекомендаций по питанию и физической активности, фармакологической коррекции, а в перспективе, с учетом данных исследования Германа Понцера о том, что метаболическое старение, возможно, наступает не ранее 60 лет, — поиска предикторов для увеличения периода «метаболической молодости». В настоящее время также остается неясным, каким образом распределяются энерготраты у человека, как на них влияют возраст, окружающая среда, наследственность, образ жизни. Существуют две гипотезы. «Накопительная» модель предполагает, что человек имеет некоторый базовый уровень основного обмена, а физическая активность его увеличивает. «Ограничительная» модель, напротив, утверждает, что общий уровень затрат фиксирован, а в условиях физической активности изменяется только соотношение расхода энергии, которую организм тратит на те или иные виды своей жизнедеятельности.
Влияние физической активности и инфекционных заболеваний на метаболизм ребенка было исследовано группой ученых под руководством Германа Понцера в 2019 г. [13]. Авторы предположили, что именно во время активного роста закладываются основные характеристики обмена веществ. Они обследовали 44 ребенка (5–12 лет) из коренного индейского народа хиваро, насчитывающего не более 300 человек, образ жизни которых связан с ежедневными занятиями охотой, рыболовством, садоводством, практически отсутствием доступа к электроэнергии, водопроводу и медицине. Группу сравнения составили городские дети США и Великобритании. В результате дети хиваро почти в два раза больше проводили времени в активном состоянии, чем городские дети. Несмотря на это, у первых затраты на ежедневную физическую активность оказались почти в два раза меньше. Однако уровень ОО, измеренный методом непрямой респираторной калориметрии, оказался почти на 20% больше, что авторы связали с более высокой концентрацией иммуноглобулина G и более стойкой иммунной защитой в условиях высокого инфекционного риска. При этом значимых различий в количестве тощей массы между детьми не отмечалось. Суммарные ежедневные затраты, измеренные методом двойной меченой воды, различались несущественно (р=0,258). Таким образом, ученые подтвердили вторую, «ограничительную» модель энергозатрат. Эти данные подтверждают, что изменение рациона питания (количество получаемой энергии), а не физическая активность (расход энергии) является основным фактором, определяющим энергетический дисбаланс, лежащий в основе роста численности пациентов с ожирением. С другой стороны, в развивающихся странах повышенная физическая и иммунная активность может привести к снижению энергии, необходимой для роста, даже в условиях положительного энергетического баланса.
Наибольший интерес вызывает изучение особенностей энергетического обмена при различных формах ожирения, что необходимо для создания доказательного, персонализированного подхода к диетотерапии и повышения эффективности мероприятий, направленных на снижение веса. Непрямая респираторная калориметрия рекомендована Американской академией нутрициологии и диетологии и Американской академией педиатрии в качестве предпочтительного метода для оценки основного обмена при планировании диетотерапии у детей и подростков с ожирением [14, 15]. В работе С. Массарини и соавт. показано, что использование непрямой калориметрии в программах лечения ожирения приводит к большему снижению веса по сравнению традиционным планированием диетотерапии с использованием расчетных формул для оценки ОО [16].
Существуют особенности энергетического обмена при различных формах ожирения. Говоря о наиболее распространенной, конституционально-экзогенной форме детского ожирения следует отметить, что нормальные показатели интенсивности ОО определяются у 63,4% детей, снижение — у 25,8%, а повышение — у 10,8% [17]. Снижение скорости ОО рассматривается некоторыми авторами в качестве неблагоприятного фактора, способствующего прогрессированию ожирения [18, 19]. Согласно наиболее распространенной теории, недостаточное увеличение интенсивности энергетического обмена в покое и при физических нагрузках на фоне прибавки веса приводит к формированию положительного энергетического баланса даже в отсутствие нарушений в диете, что и способствует прогрессированию ожирения. Подобные нарушения могут быть обусловлены гипоталамической и гормональной дисрегуляцией, а также врожденными или приобретенными нарушениями митохондриального окисления [20].
Анализ литературы, посвященной изучению роли изменений энергетического обмена в прогрессировании ожирения у детей, показывает противоречивые результаты. В работе Дж. Родригеса и соавт. продемонстрировано снижение ОО с коррекцией на тощую массу у детей с ожирением по сравнению со сверстниками без избыточного веса [21]. По данным М. Гохенаделя и соавт., снижение основного обмена у детей в возрасте 10 лет ассоциировано с прогрессированием ожирения в дальнейшем [22]. Однако в проспективных исследованиях с длительностью наблюдения от 2 до 7 лет не доказано влияние скорости ОО на хронизацию ожирения у детей [23, 24]. Другие исследователи не находят взаимосвязи между интенсивностью ОО и последующим набором веса у взрослых и детей как с ожирением, так и без него [25–27], что указывает на необходимость проведения дальнейших проспективных исследований с целью уточнения влияния интенсивности ОО на развитие и течение ожирения в будущем.
Предполагалось, что повышение интенсивности ОО должно быть благоприятным фактором течения ожирения за счет формирования отрицательного энергетического баланса. Однако Д.Д. Кэмерон и соавт. продемонстрировали, что повышение ОО у подростков с ожирением ассоциировано с повышением потребления калорий и набором веса [28]. Таким образом, увеличение интенсивности ОО не следует рассматривать в качестве благоприятного прогностического фактора течения ожирения у детей и подростков.
Особой формой является морбидное тяжелое ожирение, характеризующееся крайне низкой эффективностью мероприятий по модификации образа жизни и диетотерапии. Изучение особенностей энергетического обмена у детей показало, что при морбидном ожирении отмечается более высокая интенсивность ОО по сравнению с группой «неморбидного» ожирения независимо от пола и количества тощей массы в организме [29]. Следует отметить, что при выраженном ожирении расчетные формулы значительно переоценивают уровень ОО, что может приводить к избыточному потреблению пищи и снижению эффективности похудения, поэтому использование непрямой калориметрии в данном случает является более предпочтительным [17].
Более редкой формой является гипоталамическое ожирение (ГО), связанное с наличием и лечением опухолей гипоталамуса и ствола мозга, лучевой терапией опухолей головного мозга и гемобластозов, травмой черепа или инсультом. Основной причиной развития ГО является повреждение структур гипоталамуса, участвующих в регуляции пищевого поведения. Важную роль в развитии ГО отводят дисфункции вегетативной нервной системы, выражающейся в снижении тонуса симпатической нервной системы, принимающей непосредственное участие в регуляции энергетического обмена в организме [30]. Многочисленные исследования демонстрируют, что одним из механизмов, объясняющих избыточную прибавку веса у детей с ГО, является снижение ОО [31–35]. По данным И. Бомера, и соавт. в группе детей после оперативного лечения краниофарингиомы выявлено значимое снижение ОО (1297 vs 1721 ккал; р<0,01) по сравнению с контрольной группой (43 ребенка с конституционально-экзогенным ожирением), сопоставимой с исследуемой группой по полу, возрасту и степени ожирения [31]. В работе M. Гуфтар Шейха и соавт. также определяется снижение основного обмена в группе из 18 детей с ГО [32]. Авторы отметили уменьшение двигательной активности в группе ГО при отсутствии полифагии и предположили, что снижение ОО и двигательной активности являются более значимыми факторами прибавки веса при ГО, чем количество потребляемой пищи. Среднее снижение ОО при ГО составляет 13–17%, однако у отдельных пациентов может достигать 33,4% [32, 33]. Синдромальные формы ожирения у детей встречаются при хромосомных нарушениях, болезнях геномного импринтинга, других генетических синдромах. Наиболее распространенной хромосомной патологией, ассоциированной с ожирением, является синдром Прадера–Вилли. В литературе активно обсуждается роль нарушений энергетического обмена в патогенезе ожирения при синдроме Прадера–Вилли [36]. Большинство исследований выявляют значимое снижение ОО — до 37% у пациентов с синдромом Прадера–Вилли по сравнению с группой простого (конституционально-экзогенного) ожирения, что в настоящее время связывают с меньшим количеством тощей массы у данных больных [36–39]. Имеющиеся также соматотропная недостаточность и гипогонадотропный гипогонадизм, характерные для данного синдрома, также вносят свой вклад в снижение количества тощей массы и могут потенцировать имеющиеся нарушения энергетического обмена.
Таким образом, для различных форм ожирения характерны особенности энергетического обмена, что является важной составляющей персонификации терапии ожирения.
ЗАКЛЮЧЕНИЕ
Энергетический обмен человека имеет ключевое значение для понимания как суточных потребностей в питании, так и расхода энергии при различных видах деятельности. Композиционный состав тела, вес, рост и физическая активность меняются на протяжении жизни, что затрудняет анализ факторов, определяющих расход энергии.
Ожирение — заболевание, являющееся следствием хронического энергетического дисбаланса, гетерогенно по своей структуре. Разные формы ожирения отличаются определенным вкладом генетических, гормональных, метаболических, внешне средовых факторов. И наряду с этим разные формы ожирения характеризуются особенностями энергетического обмена. Для эффективного лечения ожирения нужны точные измерения потребления и расхода энергии, а также изучение связанного с этим поведения, чтобы понять, как регулируется энергетический гомеостаз, а также для оценки проводимых мероприятий.
В настоящее время существует несколько методов, разработанных для измерения различных аспектов энергетического метаболизма, каждый из которых имеет свои плюсы и минусы. Современные исследования показали, что использование непрямой калориметрии в программах лечения ожирения приводит к большему снижению веса по сравнению с традиционным планированием диетотерапии с использованием расчетных формул для оценки.
Список литературы смотрите здесь.
