Е.В. Бирюкова
Н.М. Платонова
Московский государственный медико-стоматологический
университет им. А.И. Евдокимова
Национальный медицинский исследовательский центр эндокринологии
Введение
Заболевания щитовидной железы (ЩЖ) влияют на все обменные процессы. Не случайно их наличие ассоциируется с серьезными изменениями во многих системах организма, ухудшением прогноза и качества жизни пациентов [1, 2]. Именно поэтому крайне важно знать клинические проявления патологий щитовидной железы, принципы их диагностики и методы лечения.
Приходится констатировать, что до сих пор в отношении заболеваний ЩЖ существует терминологическая путаница. В литературе для их обозначения используются два термина – «тиреотоксикоз» и «гипертиреоз». Однако эти понятия не являются тождественными. В частности, гипертиреоз – одна из частых причин тиреотоксикоза.
Под гипертиреозом следует понимать состояние, обусловленное как избыточным синтезом, так и избыточной секрецией тиреоидных гормонов (тироксина (Т4) и трийодтиронина (Т3)). Его можно рассматривать как гиперфункцию ЩЖ, например при диффузном токсическом зобе (ДТЗ).
При тиреотоксикозе не всегда наблюдается гиперфункция ЩЖ. Данная патология может быть обусловлена воспалительными процессами в ЩЖ, сопровождающимися деструкцией фолликулов и выбросом готовых запасов тиреоидных гормонов. Такой вариант развивается при подостром (тиреоидит де Кервена), послеродовом, безболевом и цитокин-индуцированном тиреоидитах, тиреотоксической фазе хронического аутоиммунного тиреоидита, а также при амиодарон-индуцированном тиреотоксикозе 2 типа. Передозировка препаратами, содержащими тиреоидные гормоны (в частности, супрессивная терапия), приводит к развитию артифициальных форм тиреотоксикоза (табл. 1).

Диагностика тиреотоксикоза основывается на клинической симптоматике, повышении концентраций свободных Т4 и Т3 (св. Т4 и св. Т3) и неопределяемом уровне тиреотропного гормона (ТТГ). В случае низкого уровня ТТГ и повышения хотя бы одной из фракций тиреоидных гормонов устанавливается диагноз «манифестный тиреотоксикоз», если обе фракции находятся в пределах нормы – «субклинический тиреотоксикоз». Следующим этапом диагностики является поиск этиологического фактора – триггера заболевания. Дифференциальная диагностика тиреотоксикоза предполагает определение антител к рецепторам тиреотропного гормона (АТ-рТТГ). Из инструментальных методов наиболее простым и информативным считается ультразвуковое исследование (УЗИ), позволяющее с высокой точностью определить объем ЩЖ, эхогенность ее структуры, наличие узлов и особенности кровотока, а также сцинтиграфия ЩЖ с 131I или 99mТс, отражающая функциональную активность тиреоидной ткани [3, 4].
Болезнь Грейвса
Тиреотоксикоз является основным проявлением болезни Грейвса, известной так же, как ДТЗ.
Болезнь Грейвса представляет собой системное аутоиммунное заболевание, развивающееся вследствие выработки АТ-рТТГ (иммуноглобулина (Ig) G) и клинически проявляющееся поражением ЩЖ с развитием синдрома тиреотоксикоза в сочетании с экстратиреоидной патологией (офтальмопатией, претибиальной микседемой, акропатией, поражением сердечно-сосудистой системы и др.) [2, 5]. Патология чаще развивается у женщин, чем у мужчин. Так, соотношение женщин и мужчин с болезнью Грейвса варьируется от 5:1 до 10:1 [6].
Этиология и патогенез
Развитие болезни Грейвса связывают с врожденным дефектом специфических Т-лимфоцитов. Вследствие срыва иммунологической толерантности происходит активация В-лимфоцитов, продуцирующих тиреостимулирующие иммуноглобулины – АТ-рТТГ. Связывание стимулирующих антител с рецептором ТТГ приводит к его активации. Как следствие, повышается продукция гормонов тиреоцитами и развиваются клинические проявления тиреотоксикоза [7, 8]. В отличие от большинства других аутоиммунных заболеваний эндокринных желез (сахарного диабета 1 типа, гипокортицизма) при болезни Грейвса происходит не разрушение, а стимуляция органа-мишени (гипертиреоз). Основным секреторным продуктом ЩЖ остается Т4, однако нередко нарастает и соотношение Т3/Т4. По мере усиления продукции тиреоидных гормонов их свободные фракции увеличиваются [9, 10].
Наследуемое нарушение иммунологической толерантности может способствовать выживанию и пролиферации отдельных лимфоцитов, ответственных за аутоиммунную реакцию против тиреоцитов, а также секреции ими IgG в ответ на факторы внешней среды. Среди триггерных факторов обсуждается роль вирусной инфекции, стрессов, курения. В частности, эмоциональный стресс приводит к усилению секреции кортизола, при этом подавляется активность Т-лимфоцитов. В результате аутореактивные лимфоциты освобождаются от их супрессорного влияния и могут проявлять свою активность в полной мере. Речь, в частности, идет о синтезе и продукции тиреоидстимулирующих иммуноглобулинов. Курение повышает риск развития заболевания практически вдвое [11].
Нередко болезнь Грейвса ассоциируется с другой аутоиммунной патологией, например с пернициозной анемией, алопецией, витилиго, миастенией, идиопатической тромбоцитопенической пурпурой.
Симптомы тиреотоксикоза
При тиреотоксикозе происходят изменения практически всех видов обмена, однако наиболее выраженными являются нарушения жирового обмена. Это отражается на работе многих систем и органов, прежде всего сердечно-сосудистой, пищеварительной и других эндокринных желез помимо ЩЖ (табл. 2).

Симптомы заболевания развиваются и прогрессируют достаточно быстро [12].
Пациенты с тиреотоксикозом нередко наблюдаются врачами других специальностей – кардиологами, терапевтами, гастроэнтерологами и неврологами, к эндокринологам они попадают только при появлении развернутой клинической картины. Так, у лиц пожилого возраста симптомы заболевания часто расценивают как сердечно-сосудистую или онкологическую патологию.
Установлено, что избыток тиреоидных гормонов нарушает сопряжение процессов окисления и фосфорилирования на уровне тканевого дыхания. В результате увеличивается теплопродукция. Повышенная теплоотдача достигается за счет усиленного потоотделения, что выражается определенными клиническими симптомами со стороны кожи (становится мягкой, влажной и бархатистой). Поэтому у большинства пациентов с ДТЗ температура остается нормальной. Подкожно-жировая клетчатка прогрессивно уменьшается на всех участках тела в зависимости от тяжести тиреотоксикоза.
Ускоренный метаболизм сопряжен с повышенным потреблением кислорода различными органами и тканями, что достигается ускорением кровообращения.
Стойкая тахикардия, не зависящая от физической нагрузки, считается одним из главных симптомов тиреотоксикоза. Второй причиной тахикардии является непосредственное воздействие тироксина на сердечную мышцу [13].
Тиреотоксической тахикардии присущи следующие черты:
- укорочение диастол, вследствие чего усугубляется недостаток кислорода в миокарде;
- увеличение общего расхода энергии в единицу времени;
- повышение риска развития эктопических импульсов, что приводит к нарушению сердечного ритма и с течением времени – к сердечно-сосудистой недостаточности.
Чаще всего при ДТЗ развивается мерцание предсердий. Этот симптом настолько патогномоничен, что может стать основанием для обследования больного на предмет тиреотоксикоза.
Недостаточность кровообращения при тиреотоксикозе имеет ряд особенностей. Она развивается по правожелудочковому типу, сохраняются ускоренный кровоток и повышенный сердечный индекс. При тиреотоксикозе редко возникает инфаркт миокарда, что, очевидно, связано с меньшим риском развития атеросклероза и адаптацией миокарда к гипоксии. Увеличение размеров сердца отмечается только при появлении мерцательной аритмии и обусловлено прежде всего дилатацией желудочков.
Признаки гипертрофии левого желудочка на электрокардиограмме отмечаются у трети больных, однако носят функциональный характер (после устранения тиреотоксикоза патологические отклонения исчезают).
Классическим проявлением заболевания является нарушение ритма сердца – фибрилляция предсердий, причем частота аритмии увеличивается с возрастом. Фибрилляция предсердий сопровождается повышением риска тромбоэмболий [14].
Симптомы со стороны органов зрения многочисленны. К таковым относятся характерный пристальный испуганный взгляд с расширением глазных щелей, увеличенный блеск глаз, редкое мигание, симптом Грефе (при фиксации взгляда на медленно перемещающемся вниз предмете между верхним веком и радужной оболочкой остается белая полоска склеры) и др. Эти проявления, скорее всего, обусловлены повышенным тонусом симпатической нервной системы и исчезают при компенсации тиреотоксикоза.
Наиболее тяжелой патологией, осложняющей течение болезни Грейвса, является эндокринная офтальмопатия (инфильтративная орбитопатия). Это аутоиммунное органоспецифическое заболевание, протекающее с поражением ретробульбарной жировой и соединительной тканей, мышц орбит, зрительного нерва и периорбитальных тканей [15].
Воспалительная экссудация и инфильтрация ретробульбарной клетчатки, а также экстраокулярных мышц приводят к повышению внутриглазного давления с нарушением кровотока в тканях орбит и резкому увеличению объема тканей глазницы с развитием экзофтальма [16, 17]. Ретробульбарный отек обусловлен значительным увеличением продукции гликозаминогликанов фибробластами тканей орбит. Характерными признаками патологии являются светобоязнь, слезотечение, периорбитальные отеки, ощущение инородного тела в глазах, ретроорбитальная боль. К этим симптомам присоединяются диплопия, отечность конъюнктивы, снижение остроты зрения. Значительно ухудшают течение эндокринной офтальмопатии курение и плохо контролируемый тиреотоксикоз.
Избыток тиреоидных гормонов оказывает токсическое воздействие и на клетки печени. Они активируют протеолитические цитоплазмы, а также способствуют образованию SH-радикалов, что ведет к нарушению холестеринсинтезирующей, гликогенобразующей, дезинтоксикационной функции печени. Сначала это проявляется низким содержанием холестерина в крови, затем – нарушением углеводного обмена. По мере нарастания тяжести заболевания повышается уровень печеночных трансаминаз. При устранении тиреотоксикоза все нарушения устраняются [12].
Токсическое воздействие тиреоидных гормонов на центральную нервную систему реализуется за счет влияния на клетки и повышения их чувствительности к адреналину и норадреналину. Клиническими признаками тиреотоксической энцефалопатии служат головная боль, эмоциональная лабильность, быстрая психическая истощаемость, неспособность сосредоточиться, нарушение сна. На фоне лечения тиреостатиками все изменения исчезают. В некоторых случаях это может стать дифференциально-диагностическим признаком [18].
Мышечная слабость особенно проявляется при подъеме в гору или по лестнице, вставании с колен или поднятии тяжестей. После нормализации тиреоидного статуса мышечная сила восстанавливается довольно быстро, дольше – мышечная масса.
Вследствие бессонницы и мышечной слабости у таких пациентов нередко развивается чувство усталости.
У больных тиреотоксикозом также наблюдается нарушение кальциево-фосфорного обмена. Потеря кальция и фосфора с мочой значительно повышена относительно нормы. Однако их концентрация в сыворотке крови, как правило, находится в пределах нормы. Остеопороз чаще встречается у женщин пожилого возраста. Результаты многочисленных исследований свидетельствуют, что избыточное содержание тиреоидных гормонов оказывает катаболическое воздействие на костную ткань. Рентгенологические признаки напоминают климактерический остеопороз [19].
Репродуктивная система также испытывает негативное влияние избытка тиреоидных гормонов. У мужчин снижается либидо, иногда развивается гинекомастия. Для женщин характерны нарушения менструального цикла, вплоть до аменореи, возможно появление ановуляции.
У пациентов пожилого возраста зоб часто отсутствует или наблюдается небольшое увеличение размеров ЩЖ в сочетании с узловым зобом. Характерно мало- или олигосимптомное течение заболевания [18]. При атипичном течении может наблюдаться выраженная потеря массы тела с явлениями анорексии на фоне общей и прогрессирующей мышечной слабости, что вызывает подозрение на онкологическое заболевание. У пожилых пациентов часто преобладают сердечно-сосудистые нарушения. Поэтому, как отмечалось ранее, все больные с впервые выявленной необъяснимой сердечной недостаточностью или мерцательной аритмией должны быть обследованы на предмет тиреотоксикоза. Следует также помнить, что в пожилом возрасте метаболические проявления тиреотоксикоза могут быть стертыми, при этом в клинической картине часто преобладают апатия, вялость, депрессия, слабость (апатетический тиреотоксикоз), в других случаях – признаки проксимальной миопатии.
Диагностика и классификация
Диагноз болезни Грейвса, или ДТЗ, ставится на основании вышеизложенных клинических симптомов, высокого уровня тиреоидных гормонов (св. Т4, св. Т3) и низкого содержания ТТГ в крови. Повышенный титр АТ-рТТГ – маркера иммуногенного тиреотоксикоза служит доказательством, что причиной тиреотоксикоза является болезнь Грейвса. Сохранение такового на фоне лечения свидетельствует о высоком риске декомпенсации заболевания [3].
Название патологии «диффузный токсический зоб» подразумевает наличие зоба. Тем не менее в ряде случаев объем ЩЖ бывает не увеличен. Поэтому при установлении диагноза рекомендуется указывать объем ЩЖ в миллилитрах, тем более что ультразвуковая волюмометрия широко доступна в клинической практике.
Традиционно тиреотоксикоз классифицируют по степени тяжести (табл. 3).

Однако критерии оценки основаны на весьма вариабельных параметрах (частоте сердечных сокращений, снижении массы тела и т.д.). В связи с этим представляется более целесообразным выделять субклинический, манифестный и осложненный гипертиреоз (табл. 4).

На фоне лечения манифестного или осложненного гипертиреоза возможны декомпенсация, компенсация или рецидив. Эти состояния отражают эффективность проводимых лечебных мероприятий, поэтому должны фиксироваться в клиническом диагнозе.
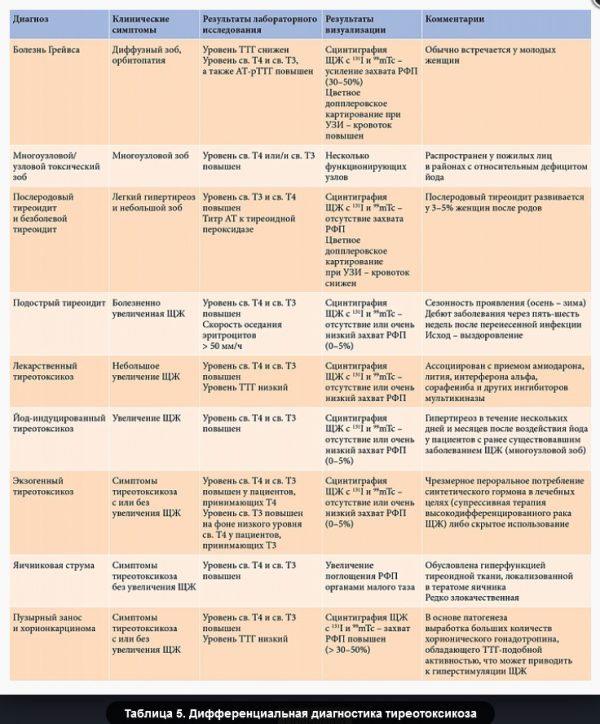
При проведении дифференциальной диагностики для определения причины тиреотоксикоза большое значение отводится УЗИ, а в ряде случаев сцинтиграфии ЩЖ (табл. 5). При болезни Грейвса наблюдается снижение эхогенности ткани ЩЖ диффузного характера, увеличение ее объема и усиление кровотока. Диффузное повышение захвата радиофармпрепарата (РФП) при проведении сцинтиграфии позволяет отличить болезнь Грейвса от других причин тиреотоксикоза. При функциональной автономии ЩЖ (токсическая аденома, многоузловой токсический зоб) выявляется горячий узел (или узлы) и пониженный захват РФП остальной тканью ЩЖ. Тиреотоксикоз, не связанный с гиперфункцией ЩЖ (при деструктивных тиреоидитах), характеризуется сниженным поглощением РФП [4].
УЗИ орбит, компьютерная томография и магнитно-резонансная томография могут использоваться для визуализации патологических изменений ретробульбарных тканей.
Методы лечения
Существует несколько методов лечения болезни Грейвса: применение тиреостатических средств (тионамиды), радиойодтерапия и хирургическое вмешательство. Каждый из них обладает рядом преимуществ и недостатков. Наиболее перспективным методом лечения считается радиойодтерапия.
Медикаментозная терапия
Независимо от избранного метода воздействия сначала для достижения эутиреоза проводится тиреостатическая терапия. С помощью тиреостатиков удается достичь ремиссии болезни Грейвса у 35–50% пациентов. Длительное консервативное лечение не имеет смысла при больших размерах зоба (объем ЩЖ > 35–40 мл), тяжелых осложнениях тиреотоксикоза, рецидиве тиреотоксикоза через 12–18 месяцев полноценной тиреостатической терапии [20, 21].
Тионамиды (тиамазол, пропилтиоурацил) блокируют синтез тиреоидных гормонов и купируют проявления тиреотоксикоза. Предполагают, что тиреостатики способны оказывать иммуносупрессивное действие (табл. 6).

На начальных этапах лечения тиреостатики назначают в максимальных дозах: 30–40 мг/сут тиамазола (1-метил-2-меркаптоимидазол) на два-три приема или 300 мг/сут пропилтиоурацила (6-пропил-2-тиоурацил) на три-четыре приема после еды. Продолжительность действия тиамазола достигает 40 часов, при этом его активность приблизительно в десять раз выше, чем у пропилтиоурацила. На фоне такой терапии через 4-6 недель у 90% пациентов с тиреотоксикозом средней тяжести удается достичь компенсации заболевания. Лабораторным признаком таковой служит нормализация уровня св. Т4 (уровень ТТГ еще долго может оставаться сниженным) [22]. С этого момента дозу тиреостатика постепенно снижают до поддерживающей (тиамазол 2,5–10,0 мг/сут, пропилтиоурацил 12,5–50,0 мг/сут). Консервативное лечение обычно продолжается от 12 до 24 месяцев. Чем длительнее тиреостатическая терапия, тем выше вероятность достичь устойчивой ремиссии. При наличии зобогенного эффекта и/или предпосылок к развитию медикаментозного гипотиреоза для поддержания эутиреоидного состояния рекомендуется комбинация тиреостатиков с L-тироксином (25–50 мкг/сут) [23].
Основным недостатком терапии тионамидами является развитие побочных эффектов. Незначительные побочные эффекты, такие как кожные проявления (крапивница, сыпь, зуд), артралгия, наблюдаются примерно у 5% пациентов и, как правило, только в течение первых нескольких недель терапии [24]. При возникновении незначительных кожных реакций возможно назначение антигистаминных препаратов. При наличии стойких умеренных и легких побочных эффектов тиреостатик необходимо отменить и назначить радиойодтерапию или хирургическое вмешательство. Если последние два метода лечения не показаны, возможен перевод на другое антитиреоидное средство [25].
При назначении тиреостатиков больных обязательно информируют о возможности возникновения агранулоцитоза (0,5–0,7% случаев). Для агранулоцитоза характерны симптомы инфекционного заболевания. При их появлении терапию прекращают.
В дополнение к антитиреоидным средствам применяются бета-блокаторы, глюкокортикостероиды, седативные средства и сердечные гликозиды, препараты калия (табл. 7).

Бета-блокаторы позволяют сократить период предоперационной подготовки за счет купирования симптомов со стороны сердечно-сосудистой системы, что достигается прямым воздействием на бета-рецепторы адреналина, а также воздействием на периферический обмен тиреоидных гормонов. Следует подчеркнуть, что для оценки адекватности дозы тиреостатиков нельзя ориентироваться на частоту пульса.
Пациентам с явным тиреотоксикозом бета-адреноблокаторы (Анаприлин 120 мг/сут на три-четыре приема или длительно действующие препараты, Атенолол 100 мг/сут однократно) целесообразно назначать до достижения медикаментозного эутиреоза, а зачастую и на более длительный срок. При тяжелом, длительном тиреотоксикозе и наличии симптомов недостаточности надпочечников показаны глюкокортикостероиды: преднизолон 10–15 мг/сут перорально или гидрокортизон 50–75 мг/сут внутримышечно [26]. Препараты данной группы следует отменять постепенно. Бета-блокаторы следует использовать с осторожностью у пациентов с бронхиальной астмой, застойной сердечной недостаточностью, брадиаритмией и феноменом Рейно. В качестве альтернативы им показаны блокаторы кальциевых каналов [27].
Хирургическое лечение
Хирургическое вмешательство было первым и основным методом радикального лечения болезни Грейвса [28]. С появлением в 1940-х и 1950-х гг. тиреостатической терапии и радиойодтерапии таковое рекомендуют менее 1% экспертов. Однако, по данным последних зарубежных исследований, хирургическое вмешательство вновь стало методом выбора при наличии показаний (против радиойодтерапии), особенно у пациентов с низким социально-экономическим статусом [29, 30]. В одних случаях оперативное вмешательство рекомендуют сразу после установления диагноза, в других – после консервативного лечения, иногда довольно длительного.
Абсолютными показаниями к хирургическому лечению при диффузном токсическом зобе являются [31, 32]:
- зоб больших размеров с признаками компрессии окружающих органов и анатомических структур, независимо от тяжести тиреотоксикоза;
- сочетание ДТЗ с неопластическими процессами в ЩЖ;
- тяжелая форма течения тиреотоксикоза с нарушениями сердечного ритма по типу мерцательной аритмии;
- непереносимость тиреостатиков;
- отсутствие стойкого эффекта от консервативной терапии в течение двух лет, рецидив заболевания.
Однако нередко возникают ситуации, которые можно расценивать как относительные показания к хирургическому лечению:
- отсутствие квалифицированной эндокринологической помощи по месту жительства пациента;
- социальные или бытовые условия, исключающие возможность регулярного приема препаратов.
Хирургическое лечение ДТЗ требует предоперационной подготовки больных. Ее основной целью является достижение эутиреоидного состояния.
В зависимости от тяжести тиреотоксикоза, объема ЩЖ, наличия сопутствующих заболеваний медикаментозная компенсация тиреотоксикоза достигается в различные сроки с использованием разных доз тиреостатиков. Важно помнить, что плохая компенсация тиреотоксикоза создает угрозу массивного поступления тиреоидных гормонов в кровоток во время операции и развития в раннем послеоперационном периоде тиреотоксического криза – состояния, при котором летальность достигает 60% [33].
Радиойодтерапия
В ряде случаев (непереносимость тиреостатиков, рецидив ДТЗ, противопоказания к оперативному лечению, связанные с тяжелыми соматическими заболеваниями) терапия радиоактивным йодом (131I) может рассматриваться как наиболее оптимальный метод лечения (табл. 8). Однако он имеет определенные ограничения. Его нельзя использовать при большом объеме ЩЖ и загрудинном расположении зоба. Лечение 131I противопоказано при беременности и грудном вскармливании. Гипотиреоз обычно развивается в течение 6–12 месяцев после введения. Кроме того, в некоторых ситуациях подготовка к радиойодтерапии требует медикаментозной компенсации тиреотоксикоза с помощью тиреостатиков. Последние отменяют за пять – семь дней до введения 131I [34–39].

Перед проведением терапии радиоактивным йодом лечение тиамазолом оправданно при наличии риска обострения тиреотоксикоза (то есть у тех пациентов, у которых симптоматика выражена или уровень св. Т4 превышает нормальный в два-три раза, у пациентов с сердечно-сосудистыми нарушениями, эндокринной офтальмопатией). Пациенты группы риска перед радиойодтерапией также должны получать бета-адреноблокаторы. Однако при агранулоцитозе, аллергической реакции на тиреостатик терапия радиоактивным йодом может быть назначена без предварительной подготовки.
В настоящее время большая часть пациентов с болезнью Грейвса, равно как и с другими формами токсического зоба, в качестве лечения получает именно радиойодтерапию. Это связано с тем, что метод эффективен, неинвазивен, относительно дешев, лишен тех осложнений, которые могут развиться во время операции на ЩЖ.
Целью радиойодтерапии является ликвидация тиреотоксикоза путем разрушения гиперфункционирующей ткани ЩЖ. При ДТЗ надлежащая активность 131I должна быть назначена однократно (10–15 мКи) с целью достижения у пациентов гипотиреоза. Последующее наблюдение включает определение уровня св. Т4 и св. Т3 с интервалом четыре – шесть недель. Если через шесть месяцев после радиойодтерапии тиреотоксикоз сохраняется, показано повторное лечение.
Заключение
Синдром тиреотоксикоза охватывает широкий спектр патологий, основной из которых является болезнь Грейвса. В настоящее время основными способами коррекции тиреотоксикоза являются лекарственная терапия, хирургическое вмешательство и терапия радиоактивным йодом. Глубокое понимание проблемы и владение современными диагностическими методами позволяют сформировать диагностический алгоритм, необходимый для применения персонифицированного подхода к ведению таких пациентов.
