В настоящее время в клинической практике все чаще приходится сталкиваться с проблемой сахарного диабета (СД) у беременных. Согласно данным экспертов Международной федерации диабета, 20,4 млн (15,8%) детей, родившихся в 2019 г., в период внутриутробного развития подвергались воздействию гипергликемии [1].
Сахарный диабет во время беременности ассоциируется с высоким риском развития осложнений не только у матери, но и у плода, в частности с диабетической фетопатией (ДФ).
Диабетическая фетопатия – заболевание плода, возникающее после 12 недель внутриутробной жизни и до начала родов вследствие сахарного диабета у матери [2]. Это симптомокомплекс фенотипических и метаболических нарушений, которые могут приводить к преждевременным родам, родовым травмам, нарушению адаптации новорожденного к условиям внеутробной жизни (респираторный дистресс-синдром, гипогликемия, гипокальциемия, тромбоцитопения и др.) [3, 4]. Рано сформировавшаяся ДФ ассоциируется с транзиторными метаболическими, а также стойкими морфологическими изменениями у новорожденного, которые приводят к нарушению работы разных органов и систем.
При гестационном сахарном диабете (ГСД) диабетическая фетопатия встречается в среднем у 25% новорожденных, с одинаковой частотой у мальчиков и девочек [2].
Клинический случай
Пациентка Р., 39 лет, поступила в родильный дом при городской клинической больнице № 29 им. Н.Э. Баумана (ГКБ № 29) на 40-й неделе беременности по направлению акушера-гинеколога женской консультации. Основание – повышение артериального давления (АД) до 140/90 мм рт. ст., выраженные отеки нижних конечностей и передней брюшной стенки.
При поступлении беременная предъявляла жалобы на головокружение, общую слабость, отеки нижних конечностей, одышку при физической активности.
Анамнез
Общий анамнез: отягощенная наследственность по эндокринным заболеваниям – СД 2 типа у отца и матери. Перенесенные заболевания: детские инфекции, ОРВИ, острый гайморит в 2010 г. Хронические заболевания: по словам пациентки, с 2017 г. эпизодическое повышение АД до 150/100 мм рт. ст. Однако у специалистов по поводу артериальной гипертензии не наблюдалась, терапию не получала. Аллергологический анамнез не отягощен.
Акушерско-гинекологический анамнез: менструации с 13 лет, установились сразу, умеренные, безболезненные, по четыре-пять дней, через 30 дней. Ведет половую жизнь с 20 лет, состоит в браке. Контрацепция барьерными методами. Первая беременность в 2018 г. закончилась самопроизвольным выкидышем на сроке 10–11 недель. Вторая беременность, настоящая, наступила самостоятельно.
Антропометрические показатели: рост – 162 см, до беременности вес – 111 кг, индекс массы тела (ИМТ) – 42,3 кг/м2, что соответствует морбидному ожирению.
По данным обменной карты, на восьмой неделе беременности в биохимическом анализе крови впервые выявлено повышение гликемии до 5,6 ммоль/л (во время беременности норма – до 5 ммоль/л), гликированный гемоглобин (HbA1c) – 6%, что соответствует гестационному сахарному диабету [5]. Со слов пациентки, к эндокринологу направлена не была. При повторном обследовании в женской консультации на 19-й неделе беременности в биохимическом анализе крови гликемия натощак – 5,1 ммоль/л. Консультацию эндокринолога не получала. На 28-й неделе гликемия натощак составила 7,8 ммоль/л, уровень HbA1c – 7%, что соответствует манифестному сахарному диабету. Данный диагноз устанавливается при гликемии натощак ≥ 7 ммоль/л, значениях HbA1c ≥ 6,5% [5].
Пациентка была направлена к эндокринологу в перинатальный центр ГКБ № 29, где диагностирован манифестный СД 2 типа. Даны рекомендации по диете с исключением легкоусвояемых углеводов, назначена инсулинотерапия. Однако рекомендации пациентка не выполняла, диету не соблюдала, инсулин не вводила. К эндокринологу в дальнейшем не обращалась.
Обследование и диагноз
При объективном обследовании в приемном отделении: состояние удовлетворительное, в сознании, общается адекватно. Зрение ясное, голова не болит. Положение активное, вес – 126 кг, прибавка массы тела за время беременности – 15 кг. Температура тела 36,5 ºС, частота дыхания – 18 в минуту, частота сердечных сокращений – 80 в минуту, АД – 132/70 мм рт. ст. Кожные покровы и видимые слизистые чистые, розовые, нормальной влажности, подкожно-жировая клетчатка выражена чрезмерно, отмечаются отеки голеней и стоп, передней брюшной стенки, пастозность лица. Молочные железы одинаковых размеров, округлой формы, при надавливании на соски отделяется молозиво. Щитовидная железа не увеличена. Язык влажный, чистый, живот увеличен в объеме за счет беременной матки. Стул регулярный, мочеиспускание свободное, безболезненное.
Акушерское обследование. Сроки родов по последней менструации (12.09.2019) – 19.06.2020 (39 недель 6 дней), по первому скринингу (10.12.2019, 13,2 недели) – 14.06.2020 (40 недель 4 дня), согласно данным женской консультации – 14.06.2020 (40 недель 4 дня).
При осмотре матка увеличена соответственно доношенной беременности. Высота дна – 46 см, окружность живота – 137 см. Размеры таза – 26–28–32–33 см. Матка при пальпации мягкая, легко возбудимая, безболезненная во всех отделах. Родовой деятельности нет. Положение плода продольное, предлежит головка плода, прижата ко входу в малый таз. Сердцебиение плода ясное, ритмичное, 140 ударов в минуту. Выделения из половых путей слизистые, в умеренном количестве, воды не подтекают.
Анализ мочи: протеинурия – 0,3 г/л, лейкоцитурия – 4–6 в поле зрения, эритроциты – 25–30 в поле зрения, глюкоза, кетоны – отсутствуют. Клинический анализ крови: лейкоцитоз 15,1 × 109/л, гемоглобин – 120 г/л, тромбоцитоз 373 × 109/л, формула – без изменений.
Микроскопия влагалищного мазка: лейкоциты – 40 в поле зрения, эпителий – немного, микрофлора смешанная.
Ультразвуковое исследование плода: масса – 4500–4600 г, бипариетальный размер – 94 мм (50‰), окружность живота – 404 мм (более 97‰, норма на сроке 40 недель 313–381 мм, менее 75‰ [5, 6]), толщина мягких тканей головы – 2,9 мм, шеи – 4 мм (увеличена), живота – 5,2 мм (норма до 5 мм [6]), размер печени – 50 мм, толщина межжелудочковой перегородки сердца – 8 мм (норма до 5 мм), толщина плаценты – 52 мм, плацента с гиперэхогенными включениями, индекс амниотической жидкости – 110 мм, головное предлежание, показатели маточно-плацентарного кровотока в норме.
Клинический диагноз: беременность 40 недель 4 дня. Головное предлежание, преэклампсия умеренной степени, манифестный сахарный диабет 2 типа, впервые выявленный. Плод крупный, диабетическая фетопатия, морбидное ожирение. Первые роды.
Родоразрешение и состояние новорожденного
С учетом диабетической фетопатии и крупных размеров плода у первородящей в 39 лет с преэклампсией принято решение о проведении кесарева сечения.
Произведено чревосечение по методу Джоэл – Кохана, кесарево сечение по методу Штарка. Через две минуты извлечен живой доношенный мальчик весом 4740 г с признаками диабетической фетопатии: лунообразное лицо, одутловатость, гипертрихоз ушных раковин, короткая шея, широкий плечевой пояс, выраженная пастозность мягких тканей, избыточность подкожно-жирового слоя. Оценка ребенка по шкале Апгар на первой минуте жизни – семь баллов, на пятой – восемь баллов, что соответствует легкой гипоксии [7]. Кровопотеря 400 мл.
При повторном осмотре неонатолога через 20 минут состояние новорожденного оценено как тяжелое из-за развития и нарастания дыхательной недостаточности, по шкале Даунса – шесть-семь баллов. Необходимо отметить, что дыхательная недостаточность, оцениваемая по шкале Даунса в три-четыре балла, соответствует легкой степени респираторного дистресс-синдрома, пять-шесть баллов – среднетяжелой, семь – десять баллов – тяжелой [8]. Тяжелая степень дыхательной недостаточности характерна для новорожденных от матери с сахарным диабетом в связи с длительным состоянием гиперинсулинемии плода и нарушением созревания легочного сурфактанта [2].
Вследствие тяжелого состояния ребенок поступил в отделение реанимации и интенсивной терапии (ОРИТ) из операционной в условиях транспортного кувеза на самостоятельном дыхании. Учитывая гипоксемию, налажена инсуффляция О2 в кувез.
При контроле гликемии новорожденного состояний гипогликемии не отмечалось, уровень глюкозы в течение дня – 4,5–4,5–7,4–3,6–4,1–4,4 ммоль/л, что соответствует норме.
При осмотре ребенка в ОРИТ: поза полуфлексии. Двигательная активность снижена, крик болезненный, средней силы. Мышечный тонус снижен, рефлексы ослаблены, нестойкие, что свидетельствует об угнетении центральной нервной системы на фоне хронической внутриутробной гипоксии. Зрачки OD = OS, фотореакция сохранена. Большой родничок 1 × 1 см, не выбухает, не пульсирует. Голова округлой формы. Кости черепа податливые. Судорог и апноэ при осмотре не обнаружено. Кожные покровы розовые, с акроцианозом, обычной влажности, теплые, с мацерацией ладоней и стоп, отмечается пастозность мягких тканей, избыточность подкожно-жирового слоя. Видимые слизистые оболочки розовые, чистые. Микроциркуляция снижена. Симптом бледного пятна в течение трех секунд. Аускультативно дыхание проводится во все отделы легких, ослабленное, выслушиваются единичные крепитирующие хрипы, частота дыхательных движений – 80 в минуту. Тоны сердца ритмичные, приглушены, шум не выслушивается, гемодинамика стабильная. Живот правильной формы, подвздут, мягкий, печень увеличена, выступает из-под края реберной дуги на 2,5 см.
Общий анализ крови: гемоглобин – 163 г/л, гематокрит – 48,6%, эритроциты – 4,54 × 109/л, тромбоциты – 112 × 1012/л, лейкоциты – 21,8 × 109/л (лейкоцитоз со сдвигом лейкоцитарной формулы до юных форм, тромбоцитопения).
Коагулограмма: гипокоагуляция: протромбиновое время – 18,4 с (норма 14,4–16,4 с), протромбиновый индекс – 40,5% (норма 50–95%), фибриноген – 1,6 г/л (норма 1,92–3,74 г/л), международное нормализованное отношение – 1,60 (норма 1,15–1,35), активированное частичное тромбопластиновое время – 45,4 с (норма 31,3–54,5 с), что является характерным проявлением метаболических нарушений при диабетической фетопатии.
Инструментальное обследование. При проведении нейросонографии подтверждены эхографические признаки гипоксически-ишемических изменений вещества головного мозга, связанных с внутриутробной гипоксией плода на фоне хронической гипергликемии у матери: дилатация левого бокового желудочка, кровоизлияние левого сосудистого сплетения, повышение эхогенности подкорковых структур и перивентрикулярной области. Скоростные и спектральные характеристики сосудов головного мозга: умеренная вазодилатация резистивных сосудов. Эхографические признаки скорости венозного оттока не изменены.
На эхокардиографии (ЭхоКГ) выявлены признаки диабетической кардиомиопатии с формированием стеноза выводного отдела: гипертрофия левого и правого желудочков со снижением сократительной способности сердца, уменьшение левого желудочка в объеме за счет выраженной гипертрофии (толщина межжелудочковой перегородки – 10 мм, умеренное сужение выводного отдела левого желудочка (фиброзное кольцо – 6,2 мм (рисунок)), открытый аортальный проток, открытое овальное окно, умеренное увеличение правых камер.
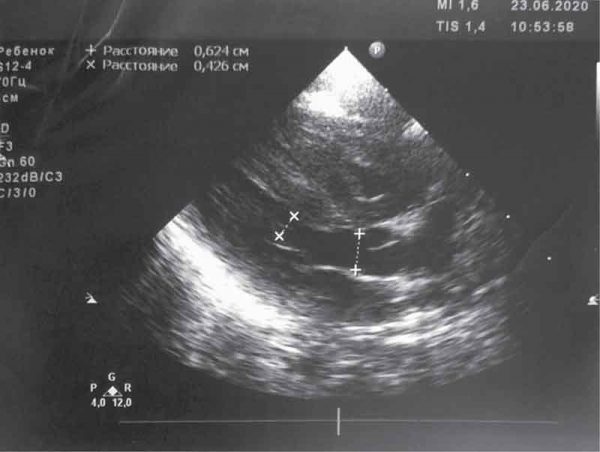
Рис. Умеренная обструкция выводного отдела левого желудочка
В динамике на ЭхоКГ выявлено нарастание гипертрофии левого и правого желудочков с обструкцией выводного отдела левого желудочка (градиент давления выводного отдела левого желудочка – 37 мм рт. ст.), умеренная обструкция выводного отдела правого желудочка, уменьшение левого и правого желудочков в объеме за счет выраженной гипертрофии. Сократительная способность желудочков снижена. Фракция выброса левого желудочка – 48%.
На рентгенограмме органов грудной клетки обнаружены признаки застойных явлений малого круга кровообращения, обусловленные кардиомиопатическими изменениями сердца, начальные проявления бронхопневмонии слева, связанные как с застойными явлениями, так и с реализацией внутриутробной инфекции у ребенка.
Таким образом, тяжесть состояния новорожденного была обусловлена дыхательной недостаточностью на фоне пневмонии, сердечно-сосудистой недостаточностью, связанной с развитием диабетической кардиомиопатии, а также неврологической симптоматикой – синдромом угнетения центральной нервной системы.
В ОРИТ получал инфузионную, респираторную, антигеморрагическую, антибактериальную терапию, кардиотоническую поддержку, Цитофлавин, дексаметазон. В возрасте шесть часов жизни, несмотря на лечение, отмечалась отрицательная динамика из-за нарастания дыхательной недостаточности (семь-восемь баллов по шкале Даунса) с выраженным тахипноэ до 100 дыхательных движений в минуту, неэффективности внешнего дыхания, нарастания гипоксии – 84–86% по данным прикроватного мониторинга SpO2. При санации из верхних дыхательных путей получена вязкая желто-зеленая слизь с примесью сукровицы.
При оценке показателей кислотно-щелочного состояния – тенденция к гиперкапнии, гипоксемия, в связи с чем ребенок был интубирован, переведен на искусственную вентиляцию легких в режиме SIMV: PIP 22, PEEP +5.0,VR 40, FiO2 50%, Tin 0,38, ДО 6,4 мл/кг. При санации из интубационной трубки получена слизь с примесью алой крови. Проводилась трансфузия свежезамороженной плазмы О(I) Rh+ из расчета 15 мл/кг. Подключена антигеморрагическая и гемостатическая терапия. В последующие часы на фоне проводимого лечения кровотечение купировалось, коагулограмма в пределах нормы.
В последующие часы состояние нестабильное с ухудшением из-за развития и нарастания сердечной недостаточности. Проводилась инотропная поддержка: допамин 20 мкг/кг/мин, адреналин 0,5 мкг/кг/мин.
В последующие дни состояние стабилизировалось и имело положительную динамику, инотропная терапия отменена на третий день, режимы искусственной вентиляции легких с редукцией.
Поскольку по данным ЭхоКГ отмечалось нарастание гипертрофии левого и правого желудочков с угрозой развития аортального стеноза, для дальнейшего обследования и лечения ребенка на шестой день жизни перевели в ОРИТ Морозовской детской городской клинической больницы с диагнозами: основной – врожденная пневмония, сопутствующий – диабетическая кардиомиопатия: гипертрофия левого и правого желудочков, церебральная депрессия. Осложнение – легочное кровотечение (купировано), дыхательная недостаточность семь-восемь баллов по шкале Даунса, сердечная недостаточность класса 2Б, кровоизлияние в сосудистое сплетение слева. Фон – синдром новорожденного от матери с гестационным диабетом. Риск внутриутробной инфекции.
За время нахождения в стационаре на фоне проводимого лечения отмечена положительная динамика, признаков аортального стеноза не выявлено (не сформирован), пациент в удовлетворительном состоянии выписан домой под наблюдение педиатра по месту жительства.
Обсуждение
Диабетическая фетопатия развивается при повышении уровня глюкозы и инсулина в крови плода из-за гипергликемии у матери. Патология может стать причиной перинатальных травм и постнатальной гибели новорожденного.
При СД происходит активный перенос глюкозы через плацентарный барьер. Повышение концентрации глюкозы усиливает выделение инсулина поджелудочной железой плода. Высокий уровень инсулина стимулирует анаболические механизмы в мышечной, жировой, соединительной тканях и определяет ускоренный рост плода. В результате развивается диабетическая фетопатия. Диабетическая фетопатия характеризуется сочетанием усиленного роста массы тела и некоторых органов с замедленным их функционированием. К наиболее частым признакам ДФ относятся пастозность мягких тканей, гепатомегалия, лунообразное лицо, короткая шея, избыточная масса, короткие конечности, гипертрихоз, одутловатость лица [9].
Различают два вида диабетической фетопатии: гипотрофическую и гипертрофическую.
При гипотрофической ДФ возможны антенатальная гибель плода, задержка внутриутробного развития по гипопластическому типу, пороки развития. При тяжелом материнском СД в сочетании с диабетической нефро- и ретинопатией бывает нарушен плацентарный кровоток с дальнейшим уменьшением роста плода. До 20-й недели беременности β-клетки плода не могут ответить на гипергликемию матери. Как следствие, эмбрион не контролирует ее и останавливается в росте. Гипогликемия может сопровождаться гибелью эмбриона, а гипергликемия – вызвать увеличение и повреждение β-клеток поджелудочной железы. После 20-й недели в ответ на гипергликемию матери возникает гиперплазия β-клеток у плода, что приводит к гиперинсулинемии, в печени, селезенке и фибробластах повышается синтез факторов роста (инсулиноподобного фактора роста 1 и 3), что в свою очередь приводит к увеличению клеточного роста и макросомии.
В отсутствие сосудистых осложнений СД при плохой компенсации сахарного диабета у беременных с гипергликемией возникает гипертрофическая ДФ. При этом макросомия сочетается с незрелостью ребенка и становится причиной родового травматизма. Она также сопровождается внутриутробной гипоксией и увеличением частоты кесарева сечения. У 25% новорожденных возникает асфиксия.
После родов у таких новорожденных выявляют нарушение ранней неонатальной адаптации. Хроническая внутриутробная гипоксия и асфиксия при рождении приводят к изменению функции центральной нервной системы, недостаточности легких, почек и других органов. Наиболее часто встречается перинатальное поражение центральной нервной системы. Возникающий при ДФ тромбогеморрагический синдром повышает риск развития гипоксически-ишемического поражения центральной нервной системы и дыхательных нарушений. У новорожденных выявляют метаболические и электролитные изменения, постнатальную гипогликемию в первые два часа после рождения, длительный метаболический ацидоз и тканевую гипоксию, гипокальциемию и гипомагниемию, нарушение метаболизма железа, гипопротеинемию, затяжную желтуху. Отмечается функциональная незрелость органов и систем, что приводит к отсутствию или снижению сосательного рефлекса, нарушению поведения в неонатальном периоде, нередко нарушение функции канальцев почек, возможно развитие острой почечной недостаточности.
Дыхательные нарушения при ДФ развиваются вследствие задержки структурного развития центральной нервной системы, созревания легочной ткани, легочной гипертензии. Причинами дыхательных расстройств у новорожденных от матерей с СД также являются заболевания сердца, аспирация мекония, инфекционные заболевания легких. Риск развития респираторного дистресс-синдрома у таких детей в 5,6 раза выше, чем в общей популяции [2].
Нарушения со стороны сердечно-сосудистой системы представлены сердечной недостаточностью, врожденными пороками сердца, кардиомиопатией (у 30% детей с ДФ), которая возникает при гипертрофии сердца с формированием субаортального стеноза и снижением сердечного выброса [2].
Клинические проявления диабетической кардиомиопатии, как правило, исчезают к концу первого месяца жизни, патологические морфологические изменения в сердце – в течение 6–12 месяцев, так как рост миокарда левого желудочка значительно опережает рост межжелудочковой перегородки [6], однако при сформировавшемся стенозе (пороке сердца) новорожденному может потребоваться оперативное лечение.
Основной причиной нарушения здоровья у детей первого года жизни признана патология центральной нервной системы различной степени тяжести. В последующем от 25 до 83% из них находятся под динамическим наблюдением невролога. Из соматической патологии у детей грудного возраста отмечаются патология желудочно-кишечного тракта, чаще обусловленная дисбактериозом и проявлениями рахита, сердечно-сосудистой системы (кардиопатия, задержка закрытия внутриутробных коммуникаций), дисплазия тазобедренных суставов, атопический дерматит. У них также высока частота инфекционных заболеваний, преимущественно вирусной этиологии [2].
Дети, рожденные от матерей с СД и ГСД, подвержены повышенному риску набора излишней массы тела или развития ожирения [9]. Так, ожирение первой и второй степени к концу первого года жизни наблюдается у 4,8% детей [2]. В данной популяции также высок риск нарушения толерантности к глюкозе и развития СД 2 типа в более позднем возрасте [10].
По данным анализа перинатальных исходов специализированного родильного дома при ГКБ № 29 за 2017–2019 гг., частота встречаемости ДФ при ГСД составляет 6,5%, при СД 1 типа – 44%, при СД 2 типа – 34,2% [11]. Однако при своевременном выявлении СД во время беременности в большинстве случаев удавалось избежать осложнений у новорожденных.
В описанном клиническом случае проявления диабетической фетопатии у новорожденного были очень выраженными. Отмечались не только фенотипические признаки фетопатии, но и признаки гипертрофии сердца, что привело к снижению сердечного выброса и выраженной сердечной недостаточности. Состояние новорожденного свидетельствовало о высоком риске формирования порока сердца.
С самого начала ведения беременности риск метаболических нарушений был высоким. Возраст пациентки – более 35 лет, она страдала морбидным ожирением, уровень гликемии натощак соответствовал гестационному сахарному диабету [5]. Однако беременной не была предложена специализированная диета с исключением легкоусвояемых углеводов, не проводился контроль гликемии в течение дня. С увеличением срока беременности набор массы тела продолжался. За данный период она увеличилась на 15 кг, что превышает допустимый предел, рекомендованный для женщин с ожирением, – 5–9 кг [12]. Это усугубило имеющуюся инсулинорезистентность, и при повторном обследовании на 28-й неделе показатели гликемии соответствовали манифестному сахарному диабету [5]. Отказ беременной от соблюдения диеты, предложенного лечения инсулином привел к формированию диабетической фетопатии у новорожденного, развитию гипертрофической кардиомиопатии с формированием субаортального стеноза и снижению сердечного выброса, развитию дыхательной, сердечной недостаточности, появлению выраженной неврологической симптоматики – синдрому угнетения центральной нервной системы [2, 11, 13]. Указанные изменения, а также реализация внутриутробной инфекции на фоне гипергликемии у матери привели к развитию пневмонии у новорожденного и необходимости лечения в условиях реанимации.
Выводы
Представленные данные позволяют сделать следующие выводы:
- гипергликемия при сахарном диабете у матери вызывает патологические изменения у плода и новорожденного;
- проведение перорального глюкозотолерантного теста и своевременная диагностика СД необходимы для каждой беременной независимо от имеющихся факторов риска;
- при выявлении сахарного диабета у беременной важно организовать наблюдение в специализированном учреждении, проводить тщательный контроль гликемии и постоянные консультации эндокринолога;
- адекватная терапия как прегестационного СД, так и гестационного – важнейший фактор, который позволяет свести к минимуму риск развития осложнений как у матери, так и у плода.
