Ученые выяснили, что инъекция фактора роста фибробластов 1, или FGF1, в гипоталамус инсулинорезистентных грызунов может быстро и надолго нормализовать уровень глюкозы в крови, а также подробно описали механизм его работы. Для этого ученые провели два исследования воздействия белка на мозг: в первом сравнили уровень экспрессии разных клеток гипоталамуса больных мышей, части из которых ввели FGF1, а во втором рассмотрели, как белок влияет на количество перинейрональных сетей в мозге крыс. Биологи обнаружили, что FGF1 воздействует на глиальные клетки мозга, усиливая сигнальную систему меланокортина: она играет важную роль в поддержании уровня сахара в крови. Статьи (1, 2) опубликованы в журналах Nature Metabolism и Nature Communications.
При диабете второго типа клетки недостаточно насыщаются глюкозой, из-за чего поджелудочная железа постоянно получает сигнал о нехватке гормона, в ответ на который она начинает интенсивно восполнять его запасы. В результате β-клетки, ответственные за секрецию инсулина, со временем истощаются и перестают производить достаточное его количество. Поэтому больным необходимо ежедневно принимать противодиабетические препараты, но, несмотря на их эффективность, они не обеспечивают надлежащего гликемического контроля для большинства пациентов.
В настоящее время лучшие методы лечения диабета второго типа заключаются в контроле уровня сахара в крови, но недавние исследования показывают, что мозг может стать альтернативной мишенью для терапии. Например, всего одной инъекции фактора роста фибробластов 1 (FGF1) в мозг мышей, страдающих диабетом второго типа, достаточно, чтобы восстановить нормальный уровень глюкозы в крови на несколько недель или даже месяцев. Но как именно FGF1 воздействует на мозг, было до недавнего времени было неизвестно.
Разобраться в этом вопросе решила команда ученых во главе с Майклом В. Шварцем (Michael W. Schwartz) из Вашингтонского университета в Сиэтле. Исследователи провели два эксперимента: в первом они изучили, как инъекция FGF1 влияет на экспрессию генов в различных типах клеток мозга, а во втором рассмотрели, какие структуры гипоталамуса помогают поддерживать ремиссию диабета. Именно гипоталамус — область мозга, отвечающая за регуляцию чувства голода, потребления энергии и, что важно, концентрацию сахара в крови — служил главным объектом изучения в обоих исследованиях.
Чтобы узнать, как клетки гипоталамуса реагируют на FGF1, команда хирургическим путем ввела белок в мозг мышей с диабетом второго типа, а затем наблюдала изменения в экспрессии генов разных клеток, сравнивая экспериментальную и контрольную группы мышей. Ученые проверяли утренний уровень глюкозы в крови у животных в течение пяти дней и показали, что у инъецированных FGF1 особей к пятому дню действительно нормализовался уровень сахара.
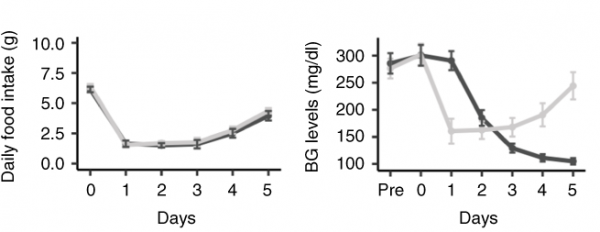
Изменения концентрации глюкозы в крови мышей на протяжении пяти дней Michael W. Schwartz / Nature Metabolism, 2020
На 1, 5 и 42 день после инъекции исследователи проводили эвтаназию и собирали клетки гипоталамуса. Чтобы оценить чувствительность различных клеток к инъекции FGF1, они проводили РНК-секвенирование трех типов: матричное РНК-секвенирование, моноядерное РНК-секвенирование и РНК-секвенирование единичных клеток. Результаты корректировали с учетом различий в потреблении пищи контрольных и экспериментальных животных: ученые сравнивали между собой тех мышей, которые получали одинаковое количество еды.
При анализе данных секвенирования, полученных в первый и пятый день, биологи заметили, что, глиальные клетки мозга мышей реагировали на FGF1 гораздо сильнее, чем нейроны. При этом танициты и эпендимальные клетки были наиболее чувствительны к FGF1 в первый день, тогда как астроциты и олигодендроциты стали более чувствительными на пятый.
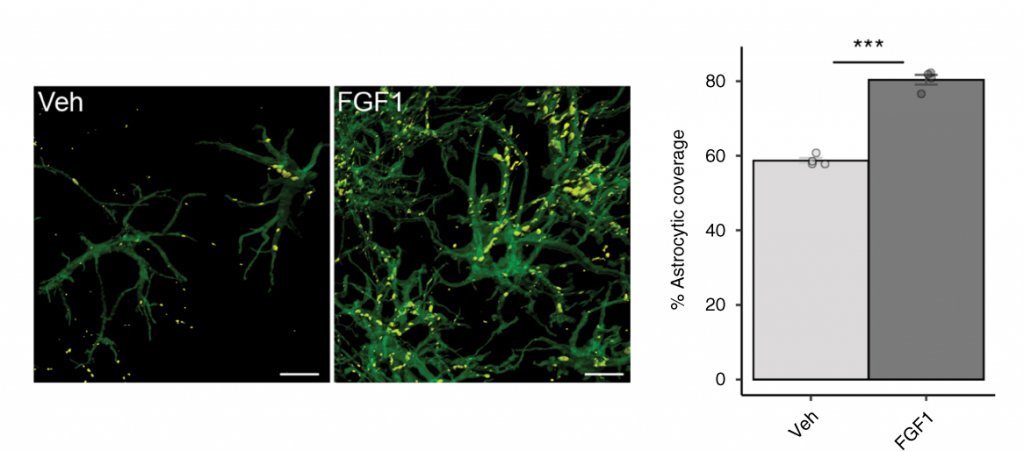
Межклеточные взаимодействия Agrp-нейронов и астроцитов у контрольной и экспериментальной групп Michael W. Schwartz / Nature Metabolism, 2020
Чтобы оценить влияние фактора роста фибробластов 1 на популяции нейронов через день после его инъекции, исследователи оценили количество генов, значительно различающихся по экспрессии у контрольной и экспериментальной групп. Оказалось, что нейроны, которые экспрессируют агути-подобный белок, или Agrp, наиболее подвержены влиянию FGF1 и что под его воздействием увеличивается количество межклеточных взаимодействий между ними и астроцитами. Одна из функций этих нейронов – эндогенное ингибирование передачи сигналов меланокортина – процесс, как было показано ранее, связанный с патогенезом диабета у грызунов и людей.
Сигнальная система меланокортина контролирует питание, массу тела и уровень сахара в крови грызунов и людей. Ученые обнаружили, что воздействие FGF1 на глиальные клетки обеспечивает беспрепятственную передачу сигналов в этой системе, что способствует противодиабетическому эффекту.
Чтобы узнать, какие структуры гипоталамуса связаны с корректной работой меланокортиновой системы, ученые исследовали перинейрональные сети, которые окружают нейроны и поддерживают их связи. Они представляют собой отдельный подтип внеклеточного матрикса и проникают во множество типов нейронов, включая нейроны, экспрессирующие агути-подобный белок.
Чтобы определить, различается ли количество и состав гипоталамических перинейрональных сетей у крыс с диабетом и контрольных животных с нормогликемией, ученые окрасили перинейрональные сети и сравнили его флуоресценцию в разных участках мозга подопытных грызунов. Команда обнаружила, что у крыс с диабетом в гипоталамусе меньше (p = 0,00036) перинейрональных сетей, чем у здоровых животных, причем этот эффект наблюдался только в областях, связанных с гомеостазом глюкозы.
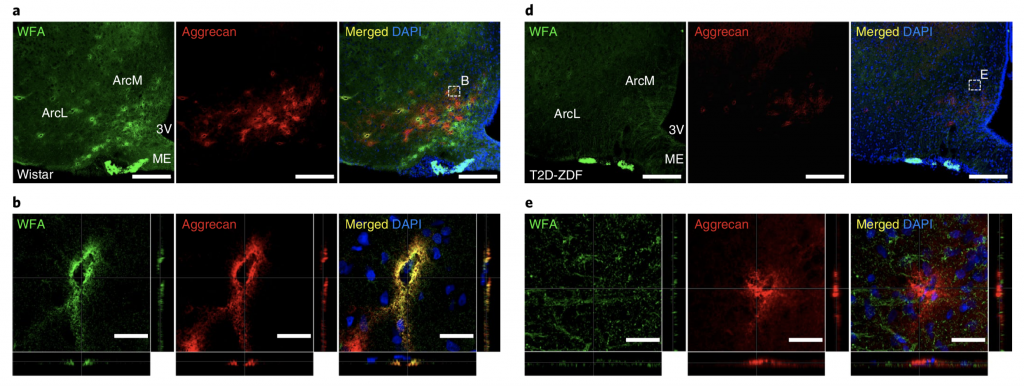
Разница во флуоресценции PNN больных (a, b) и здоровых (d, e) мышей Michael W. Schwartz / Nature Metabolism, 2020
Инъекция FGF1 в мозг подопытных крыс быстро восполнила дефицит перинейрональных сетей, и в гипоталамусе обработанных крыс возникли новые сети. Чтобы оценить влияние перинейрональных сетей на активность белка, исследователи удалили сети из мозга животных и обнаружили, что FGF1 сложнее справиться с диабетом.
Получается, что инъекция фактора роста фибробластов 1 в мозг грызунов воздействует на области гипоталамуса, задействованные в регуляции гомеостаза глюкозы и помогает восстановить ее уровень в крови у животных. Ученые выяснили, что белок воздействует на сигнальную систему меланокортина двумя способами. Во-первых он увеличивает степень покрытия мозга перинейрональными сетями, способствуя усилению активности нейронов, контролирующих активность меланокортиновой системы. А во-вторых предотвращает ингибирование этой системы Agrp нейронами с помощью регуляции экспрессии генов глиальных клеток мозга.
Чтобы окончательно понять механизм воздействия FGF1 на мозг, предстоит провести еще много исследований. Однако, такая терапия может в перспективе позволить достичь стойкой ремиссии диабета, а не просто ежедневного снижения уровня сахара в крови, как это делают современные методы лечения.
Поиск стратегий лечения сахарного диабета уже давно является одной из первостепенных задач здравоохранения. Недавно мы рассказывали о применении для этой цели стволовых клеток, а также обсуждали как можно бороться с почечной недостаточностью — частым осложнением пациентов, страдающих сахарным диабетом второго типа.
