Каннабис известен человечеству более 4 тысяч лет и используется в медицинских и рекреационных целях. Первый каннабиноид, каннабинол, был выделен в конце XIX века, а в конце XX века были открыты рецепторы каннабиноидов (СВ1 и СВ2) и сформировалось понятие об эндоканнабиноидной системе. Сегодня для медицинского применения разрешены два синтетических каннабиноида — дронабинол и набилон.
В разных частях мира постепенно легализуется марихуана. Исследователи узнают, что эндоканнабиноиды и их рецепторы задействованы почти в каждом физиологическом и патологическом процессе. Именно эта вездесущность эндоканнабиноидной системы чуть не поставила крест на применении ее антагонистов при ожирении. Эндоканнабиноидная система (ЭКС) организма человека в упрощенном виде состоит из эндоканнабиноидов, ферментов для их синтеза и распада, рецепторов эндоканнабиноидов СВ1 и СВ2.
Эндоканнабиноиды — это производные полиненасыщенных жирных кислот, которые образуются в клетке «по требованию» из фосфолипидов клеточной мембраны и действуют аутокринно или паракринно на каннабиноидные рецепторы. К наиболее изученным эндоканнабиноидам относятся анандамид (N-этаноламид арахидоновой кислоты, AEA) и глицероловый эфир арахидоновой кислоты, или 2-арахидоноилглицерол (2-AG).
Анандамид синтезируется из N-арахидоноилфосфатидилэтаноламина (NAPE) с помощью N-ацилтрансферазы и NAPE-PLD. Эти ферменты обнаруживаются в ЖКТ и ЦНС. 2-AG синтезируется из диацилглицерола при гидролизе его ДАГ-липазами альфа и бета. Есть и другие пути образования анандамида и 2-AG.
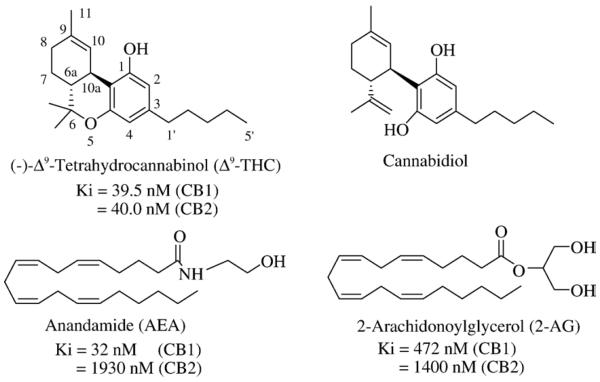
Рисунок 1 | Структурные формулы фитоканнабиноидов Δ9-тетрагидроканнабинола (Δ9-THC) и каннабидиола и эндоканнабиноидов анандамида (AEA) и 2-арахидоноилглицерола (2-AG). Ki показывает аффинность к рецепторам CB1 и CB2. Источник: Vemuri V. K., Janero D. R., Makriyannis A. Pharmacotherapeutic targeting of the endocannabinoid signaling system: drugs for obesity and the metabolic syndrome //Physiology & behavior. – 2008
Основные рецепторы эндоканнабиноидной системы — CB1 и CB2, с которыми помимо эндоканнабиноидов связываются фитоканнабиноиды (Δ9-тетрагидроканнабинол — основной компонент марихуаны, и каннабидиол) и синтетические каннабиноиды (набилон). Однако эндоканнабиноиды действуют и на другие типы рецепторов:
- CB1R: находятся в головном мозге, ответственны за антиноцицептивное действие, нарушения когнитивной функции и памяти. В основном это пресинаптические рецепторы в следующих структурах ЦНС: обонятельная луковица, кора больших полушарий, гипоталамус, гиппокамп, полосатое тело, мозжечок. Также находятся и на постсинаптических мембранах, астроцитах. В гораздо меньших количествах обнаруживаются в сердечной мышце, сосудах, ЖКТ, репродуктивных органах, мышцах, костях, коже. CB1R связаны с Gi и через каскад ПКА уменьшают выброс нейротрансмиттеров и снижают активность MAPK-пути. Некоторые CB1R связаны с Ca2+-каналами и Kir-каналами или стимулируют NOS.
- СB2R: находятся в основном на клетках иммунной системы и гемопоэтических клетках, а также на клетках периферических тканей: печени, эндокринной части поджелудочной железы, костях, нейронах и микроглии. Одной из их функций является подавление высвобождения цитокинов.
- Капсаициновый рецептор TPRV1: его несут первичные афференты и периваскулярные нейроны. Эффекты: местная вазодилатация, провоспалительное действие, кардиопротективное и антигипертензивное действие. Регулирует высвобождение субстанции Р и ген-кальцитонинового пептида (CGRP).
- PPARs, G-белок-связанный рецептор 55 (GPR55), никотиновые рецепторы, 5-HT3 и A2A аденозиновый рецепторы.
Аллостерически эндоканнабиноиды действуют на 5-HT2 рецепторы, 5-HT3 рецепторы, α1-адренорецепторы, M1 и M4 мускариновые рецепторы и AMPA GLUA1 и GLUA3 рецепторы глутамата.
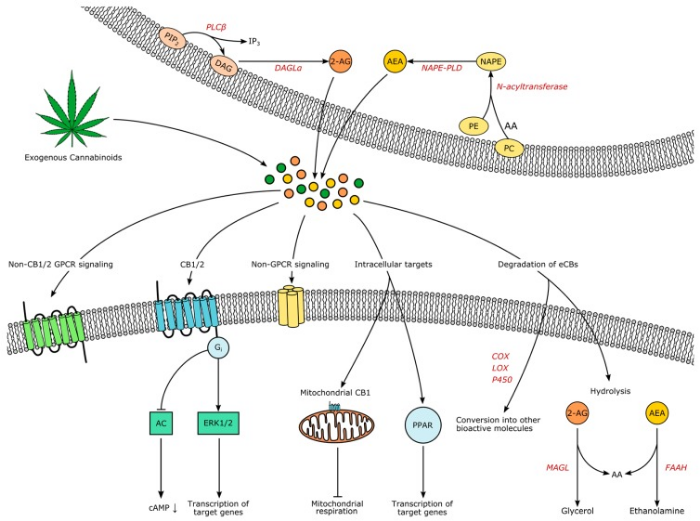
Рисунок 2 | Эндоканнабиноидная система. Источник: Horn H. et al. Endocannabinoids in Body Weight Control //Pharmaceuticals (Basel, Switzerland). – 2018
Связывание с вышеперечисленными рецепторами опосредует эффекты эндоканнабиноидов:
- анальгетический;
- спазмолитический;
- иммуносупрессивный;
- противовоспалительный;
- противоаллергический;
- седативный;
- нормотимический;
- орексигенный;
- противорвотный;
- снижение внутриглазного давления;
- бронходилатация;
- нейропротективный;
- противоопухолевый;
- антиоксидантный;
- тахикардия и сухость во рту.
Деградация анандамида и 2-AG происходит посредством обратного захвата эндоканнабиноидов клеткой и их гидролиза ферментами: анандамида — гидролазой амидов жирных кислот, 2-AG — моноацилглицерол-липазой.
2-AG также может окисляться циклооксигеназой-2 с образованием биологически активных глицериновых эфиров простагландинов.
ЭКС и ожирение
Гиперактивация эндоканнабиноидной системы может оказаться связующим звеном между ожирением и сопутствующими ему болезнями. Гиперактивация ЭКС обнаруживается как в гипоталамусе, так и в периферических тканях, включая печень и жировую ткань.
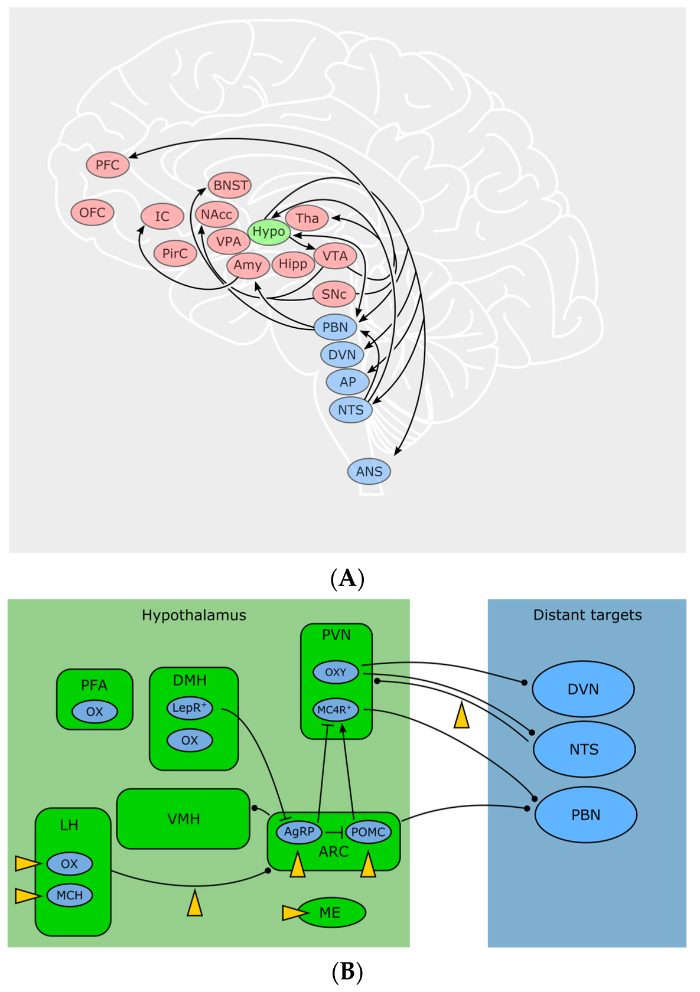
Рисунок 3 | ЭКС и питание А. Отвечающие за потребление пищи участки мозга, на которые влияет ЭКС. Голубой цвет: автономные участки, передающие сенсорные и висцеральные сигналы от периферии в ЦНС и обратно. Зеленый цвет: гипоталамус. Красный цвет: участки, отвечающие за мотивацию, принятие решений, эмоции, систему вознаграждения, добывание и выбор пищи. Расшифровка сокращений: PFC — префронтальная кора, OFC — орбитофронтальная кора, IC — островковая кора, PirC — пириформная кора, BNST — опорное ядро краевой полоски, NAc — прилежащее ядро, VPA — вентральный бледный шар, Amy — миндалевидное тело, Hypo — гипоталамус, Tha — таламус, Hipp — гиппокамп, VTA — вентральная область покрышки, SNc — черная субстанция, pars compacta, PBN — парабрахиальное ядро, DVN — дорсальное ядро вагуса, AP — area postrema, NTS — ядро одиночного пути, ANS — автономная нервная система. B. Клетки и взаимосвязи в контурах гипоталамуса и соединения с автономной нервной системой. Мишени ЭКС указаны желтыми стрелками. Расшифровка сокращений: PFA — перифорникальная область, LH — латеральный гипоталамус, DMH — дорсомедиальный гипоталамус, VMH — вентромедиальный гипоталамус, PVN — паравентрикулярное ядро, ARC — аркуатное ядро, ME — срединное возвышение, OX — орексин, MCH — меланинконцентрирующий гормон, LEPR — рецептор лептина, OXY — окситоцин, MCR4 — рецептор меланокортина 4 типа, DVN — дорсальное ядро вагуса, NTS — ядро одиночного пути, PBN — парабрахиальное ядро. Источник: Horn H. et al. Endocannabinoids in Body Weight Control //Pharmaceuticals (Basel, Switzerland). — 2018
В ЦНС эндоканнабиноиды выполняют функцию ретроградных нейромодуляторов, то есть ингибируют высвобождение возбуждающих и тормозящих нейротрансмиттеров через пресинаптические СВ1 рецепторы. Таким образом они модулируют нейрональную активность в том числе в частях мозга, ответственных за регуляцию энергетического баланса: гипоталамус, ствол, кортико-лимбическая система — прилежащее ядро (nucleus accumbens, NAc) и вентральная область покрышки (VTA).
Показано, что орексигенное или анорексигенное действие эндоканнабиноидов зависит от свойств нейрона, на котором расположены пресинаптические рецепторы СВ1. Однако орексигенное действие агонистов СВ1 рецепторов на организм в целом свидетельствует о преимущественном торможении глутаматергических синапсов. Эндоканнабиноиды информируют о мгновенных изменениях энергетического баланса, поскольку синтезируются «по необходимости». Их концентрация в структурах мозга возрастает при голодании и снижается, когда потребность в еде утоляется. Прямая инъекция AEA и 2-AG в гипоталамус или NAc крыс увеличивает потребление пищи и раствора сахарозы по СВ1R-зависимому механизму.
ЭКС регулирует аппетит по лептиновому пути в гипоталамусе. Лептин снижает потребление пищи, увеличивая высвобождение нейропептидов, уменьшающих аппетит, и подавляя выделение факторов, стимулирующих чувство голода. Снижение уровней лептина сопровождается повышением уровней эндоканнабиноидов в гипоталамусе. Лептин подавляет синтез эндоканнабиноидов, снижая внутриклеточный кальций, и подавляет СВ1-зависимую активацию нейронов, экспрессирующих меланин-концентрирующий гормон, в латеральном гипоталамусе. Однако действие лептина проявляется только при активации ЭКС, в ином случае (при нокаутировании гена СВ1 рецептора) лептин не снижает аппетит у мышей.
Существует антагонизм между лептином и глюкокортикоидами в регуляции синтеза эндоканнабиноидов в паравентрикулярном ядре (PVN). Глюкокортикоиды через мембранный рецептор запускают опосредованное эндоканнабиноидами быстрое торможение синаптического возбуждения в PVN, что позволяет быстро уменьшить секрецию гормонов гипоталамуса. Лептин блокирует запущенный глюкокортикоидами синтез эндоканнабиноидов.
ЭКС и грелин регулируют энергетический баланс сообща. Для действия грелина необходимо появление AMPK в PVN, что реализуется посредством активации СВ1 рецепторов. AEA стимулирует синтез и секрецию грелина в желудке крыс. У людей с нормальным весом потребление пищи ради удовольствия связано с повышением уровней грелина и 2-AG.
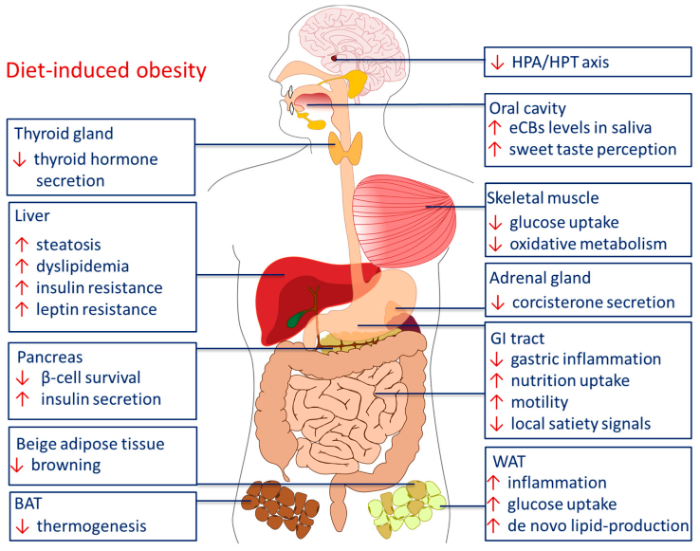
Рисунок 4 | Периферические эффекты ЭКС при алиментарном ожирении. BAT — бурая жировая ткань, HPA — гипоталамо-гипофизарно-надпочечниковая ось, HPT — гипоталамо-гипофизарно-тиреоидная ось, GI — желудочно-кишечный тракт, WAT — белая жировая ткань. Источник: Horn H. et al. Endocannabinoids in Body Weight Control //Pharmaceuticals (Basel, Switzerland). — 2018
Каннабиноиды усиливают чувство удовольствия от еды путем увеличения высвобождения дофамина в NAc. Вероятно, активация дофаминергических нейронов VTA опосредована действием эндоканнабиноидов на рецепторы СВ1 на глутаматергических терминалях, которые тормозят ГАМКергические нейроны, проецирующиеся от NAc к VTA, и тем самым растормаживают дофаминергические нейроны в VTA.
Вкусовые ощущения обрабатываются в парабрахиальном ядре (PBN) и ядре одиночного пути (NTS), где они интегрируются с сигналами от ЖКТ. Обработанная информация определяет объем поглощаемой пищи и интервалы между ее приемами. Стимулируя рецепторы СВ1 в PBN, эндоканнабиноиды увеличивают поглощение приятной на вкус пищи.
Увеличение поглощения пищи достигается за счет повышения концентрации эндоканнабиноидов, активации рецепторов СВ1 в терминалях аксонов обонятельной коры и торможения гранулярных клеток в обонятельной луковице, что повышает чувствительность к приятным запахам. Рецепторы эндоканнабиноидов колокализуются с рецепторами сладкого на сосочках языка и усиливают удовольствие от сладкой пищи.
Не существует доказательств того, что влияние эндоканнабиноидов на вкусовые ощущения и обоняние играет роль в патогенезе ожирения.
При ожирении также наблюдается:
- up-регуляция рецепторов СВ1. Интересно, что мыши, нокаутированные по рецептору СВ1, резистентны к алиментарному ожирению. У них повышена активность симпатической нервной системы, усилены окисление липидов и термогенез;
- повышение уровней эндоканнабиноидов в плазме и слюне.
Показано, что уровни эндоканнабиноидов в плазме повышены у пациентов с ожирением и диабетом 2-го типа и коррелируют со степенью инсулинорезистетности, индексом массы тела, окружностью талии и массой висцерального жира.
Предлагается использовать эти значения как маркеры распределения белого жира и инсулинорезистентности и для прогнозирования восприимчивости к терапии. Однако до клинического применения еще далеко: не стандартизированы методы выделения и измерения концентраций эндоканнабиноидов, не установлены референтные уровни и влияние возраста, пола и заболеваний на их значения.
Гиперактивация ЭКС проявляется изменением энергетического обмена в различных органах:
- активация рецепторов CB1 на изолированных адипоцитах мыши ведет к стимуляции синтазы жирных кислот и липопротеинлипазы и ингибированию AMPK. Увеличивается экспрессия генов адипоцитарной дифференцировки (PPAR), нарушается биогенез митохондрий;
- активация рецепторов СВ1 на гепатоцитах ведет к снижению фосфорилирования AMPK и ее активности. Усиливается экспрессия ацетил-КоА-карбоксилазы-1 (ACC1) и синтазы жирных кислот (FAS), увеличивается синтез жирных кислот de novo и развивается стеатоз печени. Происходит up-регуляция ингибирующего фосфорилирования субстрата рецептора инсулина (IRS) и ингибирующее дефосфорилирование активированной инсулином протеинкиназы В (PKB) с последующим запуском стресса эндоплазматического ретикулума. Показано, что в патогенезе стеатоза печени задействован рецептор СВ2;
- активация рецепторов CB1 в скелетной мышце подавляет окисление глюкозы и жирных кислот и биогенез митохондрий, снижает базальный и инсулин-зависимый транспорт глюкозы, снижает чувствительность ткани к инсулину по PI3-kinase/PKB и Raf-MEK1/2-ERK1/2 путям, что может приводить к резистентности к инсулину;
- активация CB1R на бета-клетках поджелудочной железы рекрутирует киназы фокальной адгезии (FAK), под действием которых цитоскелет перестраивается и происходит экзоцитоз везикул с инсулином, запускает апоптоз бета-клеток и способствует инфильтрации островков макрофагами и воспалению, из-за чего развивается диабет 2 типа.
Лечение ожирения снижением тонуса ЭКС
Для снижения активности ЭКС у пациентов с ожирением предлагаются следующие антагонисты ЭСК и модификации образа жизни:
- Неселективные блокаторы рецепторов CB1;
- Селективные блокаторы периферических рецепторов CB1 («Compound 2p», «Compound 10q»);
- Аллостерические антагонисты рецепторов CB1 (гемопрессин, прегненолон, ORG27569 и PSNCBAM-1);
- Нейтральные агонисты (AM4113, AM6545, JD5037, TM38837, NESS06SM);
- Агонисты рецепторов СВ2 (JWH-133, JWH-015);
- Неселективные агонисты СВ1 и СВ2 рецепторов (URB447);
- Модуляторы других рецепторов (TRPV1, GPR55);
- Ингибиторы ферментов синтеза эндоканнабиноидов;
- Диета с преобладанием омега-3 и омега-6 жирных кислот.
Первым блокатором CB1R, одобренным по результатам клинических испытаний для лечения ожирения, был римонабант (SR141716A). В Европе римонабант продавался с 2006 года под названием Acomplia. Его часто называют антагонистом CB1R, однако на самом деле он обратный агонист.
Данные мультинациональных клинических испытаний римонабанта при ожирении (Rimonabant in Obesity, RIO), а именно RIO-Lipids, RIO-Europe, RIONorth America и RIO-Diabetes свидетельствуют об эффективности римонабанта в снижении веса и уменьшении сердечно-сосудистых факторов риска. Последнее обусловлено нормализацией уровней адипонектина, ЛПВП, триглицеридов и HbA1c у пациентов с диабетом.
Рисунок 5 | Структурная формула римонабанта
Длительная терапия римонабантом приводила к восстановлению чувствительности клеток к инсулину, нормализовала размер жировых клеток и их распределение в теле, предотвращала отложения висцерального жира и уменьшала количество подкожного жира, снижала вес тела вне зависимости от сокращения потребления пищи.
Механизмы наблюдаемых эффектов пока не понятны, одним из них может быть увеличение экспрессии гена адипонектина в висцеральном жире и концентрации адипонектина в плазме при терапии римонабантом. Наблюдается увеличение активности рецепторов адипонектина 1 и 2 в печени. Гепатопротективное действие римонабанта проявляется также в увеличении окисления жиров в печени и уменьшении воспаления, что снижает накопление жира в печени.
Блокада рецепторов СВ1 на бета-клетках островков поджелудочной железы стимулировала их пролиферацию и увеличение размера клеток, снижала воспалительный ответ и приводила к нормализации уровней глюкозы и восстановлению чувствительности к инсулину. Фармакологическая блокада СВ1 эффективна только при гиперактивности ЭКС и гиперсекреции инсулина.
Блокада СВ1 рецепторов на белых адипоцитах in vitro стимулирует биогенез митохондрий через увеличение экспрессии эндотелиальной NOS, снижает синтез жирных кислот и накопление триглицеридов и индуцирует трансдифференцировку белого жира в бурый, характеризующийся увеличенной экспрессией разобщающего белка-1 (UCP-1), альфа-коактиватора PPAR-gamma (PGC-1) и активностью AMPK.
Блокада рецепторов СВ1 на бурых адипоцитах усиливает разобщенное дыхание. Однако in vivo показано, что ЭКС регулирует липогенез и липолиз в белой жировой ткани на уровне симпатической нервной системы, но не на тканевом уровне.
Гипофагический эффект римонабанта, достигаемый в течение часа, зависит от активности симпатической нервной системы и исчезает при введении бета-адреноблокаторов. При этом также исчезают и побочные неврологические и психиатрические эффекты — чувство страха, повышенная тревожность.
Acomplia ушел с европейских рынков в 2008 году, поскольку вызывал суицидальное поведение, депрессию, судороги и стал причиной пяти смертельных случаев в Великобритании. Клинические исследования других антагонистов СВ1 рецепторов (таранабант, суринабант, ибипинабант) были прекращены на 2–3 фазе в 2008–2012 годах.
Фокус исследований сместился в сторону блокаторов периферических CB1R, аллостерических ингибиторов, нейтральных агонистов, ингибиторов синтеза эндоканнабиноидов, стимуляторов их деградации, модуляторов других рецепторов и ограничений в диете. Ни одно из возможных лекарств пока не было исследовано на людях, хотя все они показали некоторую эффективность на животных моделях ожирения.
Диета с повышенным содержанием жиров увеличивает содержание анандамида в печени мышей, тогда как аналогичная диета с высоким содержанием омега-3 жирных кислот (содержащихся в рыбьем жире) снижает содержание 2-AG в головном мозге поросят. У крыс, потребляющих в пищу большое количество линолевой кислоты («западная диета»), содержание 2-AG и анандамида в тонком кишечнике повышено.
Однако в клинических исследованиях одинаковые по содержанию калорий диеты с низким и высоким содержанием жиров не привели к изменению концентраций эндоканнабиноидов в плазме. Диета, обогащенная полиненасыщенными жирными кислотами, не привела к снижению веса у пациентов с ожирением, но у пациентов с гиперхолестеринемией улучшила липидный профиль.
Источники:
1. Katchan V., David P., Shoenfeld Y. Cannabinoids and autoimmune diseases: A systematic review //Autoimmunity reviews. – 2016. – Т. 15. – №. 6. – С. 513-528.
2. Gatta-Cherifi B., Cota D. New insights on the role of the endocannabinoid system in the regulation of energy balance //International journal of obesity. – 2016. – Т. 40. – №. 2.
3. Richey J. M., Woolcott O. Re-visiting the Endocannabinoid System and Its Therapeutic Potential in Obesity and Associated Diseases //Current diabetes reports. – 2017. – Т. 17. – №. 10. – С. 99.
4. Yao B., Mackie K. Endocannabinoid receptor pharmacology //Behavioral Neurobiology of the Endocannabinoid System. – Springer, Berlin, Heidelberg, 2009. – С. 37-63.
